Paciente mujer de 44 años, valorada por primera vez en endocrinología por hiperglucemia (glucemia plasmática al azar de 580mg/dL y hemoglobina glucosilada del 10,3%) acompañada de pérdida de peso, clínica cardinal y astenia intensa. Ante la presencia de clínica de insulinopenia se inició insulinización en régimen bolo-basal. Dos semanas después, la paciente comenzó a presentar lesiones cutáneas tipo placas eritemato-descamativas en miembros superiores e inferiores, de crecimiento progresivo, coalescentes y con una distribución parcheada. Las lesiones evolucionaron a lo largo de los días hacia la regresión y el aclaramiento central de éstas. Junto a ésto, se objetivó la presencia de otras lesiones eritematosas y costrosas periorificiales (perinasales, peribucales y perianales), glositis grave, distrofia ungueal, alopecia progresiva y blefaritis. La paciente presentó además un deterioro importante de su estado general y anímico con pérdida de peso progresiva e intensa anorexia, motivo por el que fue ingresada para completar estudio.
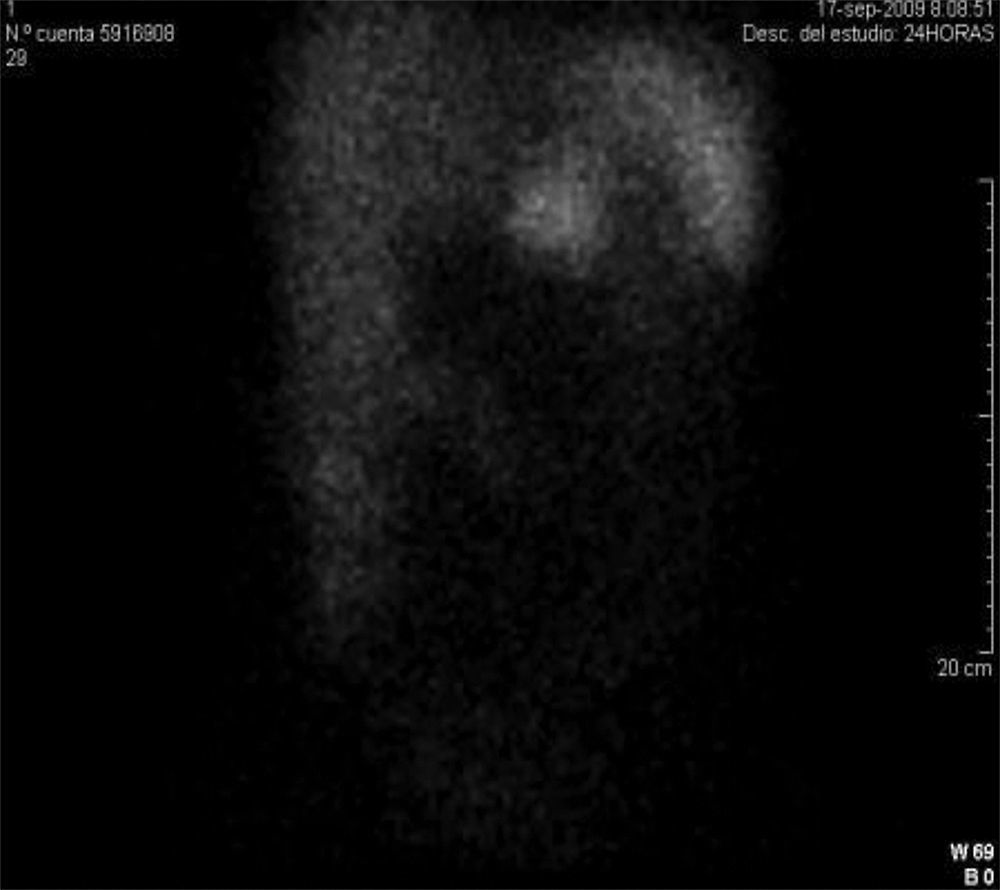
Las primeras determinaciones analíticas reflejaron anemia normocítica y normocrómica (hemoglobina 10g/dL), hipoproteinemia con hipoalbuminemia (proteínas totales 5,6g/dL [Valor normal (VN): 6,5-8g/dL] y albúmina 2,9g/dL [VN: 3,5-5-3g/dL]) y descenso del zinc plasmático (46,9μg/dL; VN: 70-120μg/dL). Se le realizó una biopsia de tejido vulvar, que fue informada como fragmento de piel con pústula neutrofílica con paraqueratosis focal, acantosis e infiltrado inflamatorio mixto perivascular, sugestiva de eritema necrolítico migratorio (ENM). Ante la existencia de estas lesiones junto a la presencia de diabetes mellitus y el cuadro constitucional se procedió a la determinación de glucagón y cromogranina A. Los niveles de glucagón fueron elevados en dos determinaciones (510 y 655 pg/mL; VN: 59-177 pg/mL), así como los de cromogranina A (798,8 ng/mL, VN: 19,4-98,1 ng/mL). Con la sospecha clínica y bioquímica de glucagonoma se procedió a la realización de pruebas de imagen para la localización de la lesión. En estas pruebas (por orden cronológico fueron: tomografía axial computerizada [TAC] helicoidal abdominal, colangiorresonancia y ecoendoscopia) no se visualizaron a nivel pancreático ni en otras localizaciones la existencia de lesiones tumorales. Ante la ausencia de localización de la lesión se realizó una gammagrafía con 111In-DTPA-D-Phe-octreótido (Octreoscan®) que mostró un gran foco de hipercaptación del trazador en línea media del epigastrio correspondiente con el área anatómica pancreática, además de otro acúmulo del radiofármaco de menor intensidad situado en el reborde hepático (fig. 1).
Se inició tratamiento con octreótide 50μg diarios por vía subcutánea cada 12 horas durante dos semanas y posteriormente cada 8 horas. La tolerancia a este tratamiento fue buena y tras el inicio de éste, la paciente mejoró clínicamente con práctica desaparición de las lesiones cutáneas y con un descenso marcado de los requerimientos insulínicos.
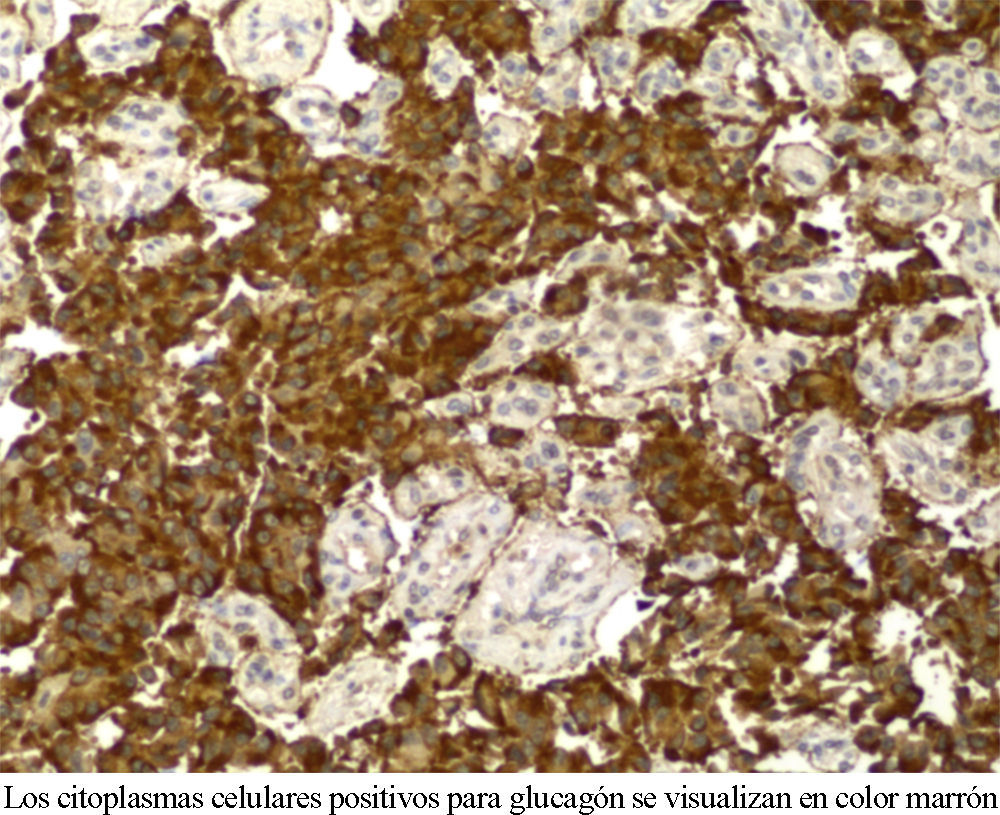
Con el diagnóstico de glucagonoma pancreático fue intervenida la paciente. La exploración intraoperatoria confirmó la existencia de una gran lesión que afectaba al cuerpo y la cola del páncreas. Se efectuó una pancreatectomía corporocaudal laparoscópica y se exploró mediante ecografía intraoperatoria la superficie hepática sin visualizarse lesiones. La pieza quirúrgica pesó 46 gramos y tuvo unas dimensiones de 8,5×4,5cm. El estudio anatomopatológico reveló un parénquima desestructurado con múltiples nódulos confluentes. Al microscopio óptico se observó necrosis, invasiones vasculares múltiples e infiltración de tejidos blandos peripancreáticos y de los márgenes de resección. La tinción inmunohistoquímica fue positiva para marcadores de diferenciación neuroendocrina como la cromogranina y CD56, y para glucagón como marcador hormonal específico. El índice Ki-67 fue del 5-10%. El diagnóstico anatomo-patológico fue de tumor endocrino multifocal e histológicamente maligno compatible con glucagonoma (fig. 2).
Tras la intervención se retiró el tratamiento con octreótida, desaparecieron las lesiones cutáneas y mucosas por completo y no fue preciso la administración de insulina. Las pruebas complementarias efectuadas tras la intervención reflejaron la desaparición del foco de hipercaptación del trazador que estaba localizado en la línea media del epigastrio, sin observarse otras captaciones patológicas (Octreoscan®). La resonancia magnética de abdomen tras la cirugía no mostró la existencia de lesiones sugestivas de metástasis o signos de recidiva locorregional.
Los niveles de cromogranina A tras la intervención descendieron, aunque persistieron elevados (577 ng/mL), y se normalizaron los de glucagón (71 pg/mL). Se solicitó el estudio genético para descartar que el glucagonoma se encuentre el contexto de una neoplasia endocrina múltiple tipo 1 (MEN 1).
El glucagonoma es un tumor raro originado en las células alfa pancreáticas. Se estima que su incidencia se sitúa en torno a 1/20.000.000 millones de habitantes, representado aproximadamente el 7% del total de los tumores neuroendocrinos pancreáticos (TNEP)1. Aparece con mayor frecuencia en la quinta década de la vida y no se han encontrado claras diferencias en cuanto al sexo. La mayoría de los glucagonomas son esporádicos, sólo el 3-5% de los casos están asociados a MEN 12.
Las manifestaciones clínicas de esta enfermedad suelen estar englobadas en el denominado síndrome glucagonoma que se caracteriza por la presencia de ENM, diabetes mellitus, pérdida de peso, diarreas, glositis, queilitis, síntomas neuropsiquiátricos y cuadros tromboembólicos. La síntomas clínicos de presentación son variables, si bien en las dos series más amplias publicadas, los más prevalentes fueron el desarrollo de lesiones dérmicas tipo eritema necrolítico migratorio (50-70%), diabetes mellitus (40-75%) y pérdida de peso (70%). Las alteraciones bioquímicas características de este síndrome comprenden además de la hiperglucagonemia y la hiperglucemia, hipoproteinemia y anemia normocítica-normocrómica1,3.
El desarrollo de diabetes mellitus en esta enfermedad está principalmente relacionado con el exceso de liberación de glucagón y la concentración relativa de insulina/glucagón a favor de este último, lo que condiciona su efecto glucogenolítico y neoglucogénico. Otros factores que participan en el desarrollo de diabetes son la existencia de lesiones pancreáticas de gran tamaño y las metástasis hepáticas3. El diagnóstico de diabetes mellitus es previo al del glucagonoma en el 20-50% de los casos1,3 y, se ha comunicado que la mediana de tiempo entre la aparición de la diabetes y el ENM es hasta de cuatro años3.
El ENM es la lesión característica del glucagonoma aunque no es patognomónico de éste. Su patogenia no está totalmente esclarecida y en su fisiopatología se ha implicado la hiperglucagonemia, el catabolismo proteico, el déficit de aminoácidos y de zinc, y otras anomalías metabólicas que acontecen en la enfermedad4. Se caracteriza por presentarse como placas o pápulas eritmatosas que afectan a la cara, periné y extremidades. Este mismo proceso afecta también a las membranas mucosas resultando en glositis, queilitis angular, estomatitis y blefaritis. Estas lesiones suelen aparecer de forma cíclica y tienden a crecer, coalescer, formándose posteriormente un aclaramiento central dejando al final una hiperpigmentación residual5. La biopsia de estas lesiones se caracteriza por presentar necrólisis superficial de la epidermis con separación de las capas superficiales con queratinocitos vacuolados e infiltración perivascular de linfocitos e histocitos2,5.
Los glucagonomas son habitualmente tumores de tamaño grande al diagnóstico y hasta en un 80% de los casos existen metástasis hepáticas al diagnóstico, siendo otros lugares frecuentes de metástasis los ganglios linfáticos regionales y los huesos1. Se localizan con mayor frecuencia en la cola del páncreas, son generalmente sólidos, circunscritos y encapsulados. La localización de la lesión suele ser fácil por su tamaño con pruebas de imagen como la TAC o la resonancia nuclear magnética. En este caso la localización de la lesión sólo fue posible mediante gammagrafía con Octreoscán®, a pesar de comprobarse en la intervención que el tamaño de la lesión era grande. En diferentes series, en el 95-100% de los pacientes con glucagonoma la gammagrafía con 111In-octreótide fue positiva1,6. La ecoendoscopia tampoco permitió la localización de la lesión. En grupos altamente experimentados en esta técnica la sensibilidad en la detección de lesiones pancreáticas es alta, ya estén localizadas en cabeza, cuerpo o cola, pudiendo identificar la existencia de lesiones intrapancreáticas en el 90% de los casos, incluso siendo éstas subcentimétricas7.
La resección primaria del tumor, en ausencia de metástasis, es el tratamiento de elección con intención curativa. Como en el caso descrito, las resecciones curativas suelen ir acompañadas de la resolución de la hiperglucagonemia y del ENM.
Los análogos de somatostatina han sido empleados pre-intervención o post-intervención. Su uso se asocia, como en este caso, con regresión del ENM y descenso de los requerimientos de insulina3 y con supresión importante de glucagón2. Su utilización como tratamiento post-operatorio en enfermedad metastásica puede reducir la progresión de la enfermedad8.
Los regímenes quimioterápicos que incluyen interferón alfa, estreptozotocina, doxorubicina y 5-fluoracilo han conseguido respuestas dispares; en algunas series la respuesta bioquímica o radiológica se ha conseguido hasta en el 50% de los casos1 y la regresión parcial radiológica en un tercio de ellos1,3. En casos de enfermedad metastásica, con fracaso previo del tratamiento quimioterápico, el tratamiento con everolimus ha demostrado ser eficaz en la estabilización de la enfermedad9.
La supervivencia está condicionada por la presencia de metástasis a distancia, la edad y el grado histológico10. En dos de las series más amplias publicadas, la supervivencia media en casos de enfermedad metastásica al diagnóstico fue de 4,9 años3 y la supervivencia global a 5 años del 76%1.