Recientemente varios trabajos han relacionado la disfunción tiroidea autoinmune con la diabetes gestacional (DG). El hipotético nexo de unión sería el desarrollo de la homeostasis proinflamatoria. Por ello nos propusimos estudiar si la presencia de anticuerpos antitiroideos se relaciona con la aparición de DG.
Material y métodosSe estudiaron retrospectivamente 56 gestantes con valores de TSH ≥2,5μU/ml en el primer trimestre. Se midieron anticuerpos antitiroideos y se realizó la prueba de O'Sullivan. Para el diagnóstico de DG se llevó a cabo una sobrecarga oral de glucosa (100g) y se siguieron los criterios recomendados por el Grupo Español de Diabetes y Embarazo.
ResultadosSe constató anticuerpos antitiroideos elevados en 21 (37,50%) mujeres. Se diagnosticó DG en 15 (26,79%) pacientes, de las que 6 (10,71%) tenían anticuerpos positivos y 9 (16,07%) tenían anticuerpos negativos. Los datos fueron analizados mediante regresión logística exacta por LogXact-8 Cytel, no encontrándose diferencias significativas entre las pacientes diagnosticadas de DG con anticuerpos antitiroideos positivos y con autoinmunidad negativa (OR=1,15 [IC 95%=0,28-4,51]; p=1,00).
ConclusionesLa presencia de autoinmunidad tiroidea en mujeres con TSH por encima de los valores recomendados al inicio de la gestación no se asocia con el desarrollo de DG. No obstante, la prevalencia de DG en estas pacientes es superior a la documentada en la población general española, lo que sugiere la necesidad de un seguimiento más estrecho en gestantes con TSH≥2,5μU/ml.
Some recent studies have related autoimmune thyroid dysfunction and gestational diabetes (GD). The common factor for both conditions could be the existence of pro-inflammatory homeostasis. The study objective was therefore to assess whether the presence of antithyroid antibodies is related to the occurrence of GD.
Material and methodsFifty-six pregnant women with serum TSH levels≥2.5 mU/mL during the first trimester were retrospectively studied. Antithyroid antibodies were measured, and an O'Sullivan test was performed. GD was diagnosed based on the criteria of the Spanish Group on Diabetes and Pregnancy.
ResultsPositive antithyroid antibodies were found in 21 (37.50%) women. GD was diagnosed in 15 patients, 6 of whom (10.71%) had positive antibodies, while 9 (16.07%) had negative antibodies. Data were analyzed using exact logistic regression by LogXact-8 Cytel; no statistically significant differences were found between GD patients with positive and negative autoimmunity (OR=1.15 [95%CI=0.28-4.51]; P=1.00).
ConclusionsThe presence of thyroid autoimmunity in women with TSH above the recommended values at the beginning of pregnancy is not associated to development of GD. However, GD prevalence was higher in these patients as compared to the Spanish general population, suggesting the need for closer monitoring in pregnant women with TSH levels≥2.5mU/mL.
La diabetes gestacional (DG) se define como cualquier grado de intolerancia a los hidratos de carbono diagnosticada por primera vez durante el embarazo1. Se ha documentado una prevalencia DG que abarca una horquilla entre el 1 y 14%1,2: en nuestro medio la prevalencia de DG se sitúa en torno al 10%3–6.
En la mayoría de las pacientes se estima que la DG es causada por la disfunción de las células β, siendo el mecanismo subyacente el incremento de resistencia a la insulina sin que exista una disminución de su secreción7. Algunos trabajos han documentado una alta prevalencia de anticuerpos antitiroideos elevados en situaciones donde predomina un fondo de resistencia insulínica, tales como en gestantes con DG8, pacientes con diabetes mellitus tipo 29 o en el síndrome del ovario poliquístico10. En consecuencia, se especula que la presencia de autoinmunidad tiroidea podría ser un factor de riesgo para la aparición de diabetes. El nexo de unión entre el trastorno autoinmune y la insulinorresistencia podría encontrarse en los fenómenos inflamatorios asociados a ambos cuadros. Así, por ejemplo, la concentración sérica de citoquinas se encuentra elevada tanto en pacientes con autoinmunidad tiroidea11 como en los cuadros de insulinorresistencia12. Del mismo modo se ha descrito que los pacientes con hipotiroidismo subclínico de origen autoinmune exhiben aumento de la proteína C-reactiva, que no se modifica con el estado de la función tiroidea13. Esta característica puede ser paralela al incremento de la proteína C-reactiva descrito en sujetos prediabéticos con autoinmunidad contra las células de los islotes pancreáticos14. Adicionalmente la presencia de marcadores inflamatorios ha sido relacionada con la diabetes mellitus en mujeres gestantes15,16, y finalmente la disfunción tiroidea también se ha asociado con la resistencia a la insulina17–19.
Debido a esa posible conexión entre la disfunción tiroidea autoinmune y la resistencia a la insulina nos propusimos analizar la posible asociación entre la presencia de autoinmunidad en mujeres gestantes con hipotiroidismo y su relación con la DG en nuestro medio.
Material y métodosPoblaciónSe evaluaron restrospectivamente un total de 56 mujeres (edad: 32,89±4,16 años; media±DE) remitidas a nuestro departamento durante el período comprendido entre el año 2008 y el 2012 por presentar al inicio de la gestación una cifra de TSH ≥2,5μU/ml, según las recomendaciones de la Asociación Americana de Tiroides (ATA)20. En todas las pacientes se registró la edad (años), el índice de masa corporal (IMC) pregestacional (kg/m2) y antecedentes familiares de diabetes mellitus. Se excluyeron aquellas pacientes con antecedentes personales de alteración del metabolismo hidrocarbonado y con diagnóstico previo de disfunción tiroidea.
A todas las pacientes se les realizó determinación de tirotropina (TSH) y anticuerpos antitiroideos: anti-peroxidasa (anti-TPO) y anti-tiroglobulina (anti-TG) durante el primer trimestre de la gestación. Tras el diagnóstico de hipotiroidismo todas las gestantes fueron tratadas con L-tiroxina, realizando seguimiento evolutivo de la función tiroidea mediante analítica con frecuencia mensual hasta el parto. La determinación de los anticuerpos generalmente se llevó a cabo entre 1 y 4 semanas después del diagnóstico de hipotiroidismo, una vez iniciado el tratamiento con suplementos de L-tiroxina.
En la semana 24-28 de gestación, siguiendo el protocolo habitual, se realizó la prueba de cribado de diabetes gestacional (test de O'Sullivan) a todas las pacientes. Se consideró positivo cuando el valor de glucemia era mayor de 140mg/dl 1h después de la administración de 50g de glucosa vía oral. A estas pacientes se les completó el estudio mediante una sobrecarga oral con 100g de glucosa tras permanecer 12h en ayunas. El diagnóstico de DG se realizó siguiendo los criterios del 3.er workshop, tal y como recomienda el Grupo Español de Diabetes y Embarazo21.
Se consideró como grupo control a aquellas pacientes con valor de TSH≥2,5μU/ml en las que el diagnóstico de DG fue negativo.
MétodosLa medición de TSH se realizó por inmunoanálisis de electroquimioluminiscencia (Modular Analytics E170; Roche); VR: 0,38-4,7μU/ml. Durante el primer trimestre de la gestación se ha considerado como patológico un valor ≥2,5μU/ml. Los anticuerpos anti-TPO se determinaron por ELISA (QUANTA Lite®); VR<29 UI/ml y los anticuerpos anti-TG por inmunoanálisis de quimioluminiscencia (Access® 2 Immunoassay System; Beckman Coulter); VR<4 UI/ml. Las concentraciones de glucosa se obtuvieron mediante una reacción de glucosa oxidasa (UniCel DxC 800; Beckman Coulter).
Estudio estadísticoSe trata de una muestra de conveniencia en la que se incluyeron todas las pacientes que reunían los criterios establecidos, sin llevar a cabo un cálculo previo del tamaño muestral.
Se realizó un análisis mediante la prueba de «t» de Student para la comparación de medias de variables cuantitativas entre el grupo de DG y el grupo control, verificando la normalidad de la distribución mediante los test de Kolmogorov-Smirnov y Shapiro-Wilk. Las frecuencias de variables cualitativas fueron comparadas por el test de la Chi cuadrado de Pearson o por el test exacto de Fisher cuando una de las frecuencias absolutas era menor de 5. Se calculó la fuerza de la asociación de los factores de riesgo (anticuerpos antitiroideos) con el desarrollo de DG mediante la estimación de la odds ratio (OR) y los intervalos de confianza del 95% (IC 95%) mediante un análisis de regresión logística exacta utilizando el programa LogXact-8 Cytel. En todos los casos se consideraron significativos aquellos grados de confianza superiores al 95% (p<0,05). Los datos se muestran como frecuencias absolutas (n) o relativas (%), y medias con su desviación estándar (DE).
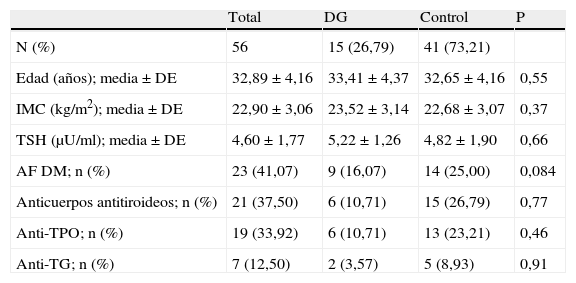
ResultadosEn el momento del diagnóstico de hipotiroidismo (TSH ≥2,5μU/mL) durante el primer trimestre de embarazo el valor medio de TSH fue de 4,60±1,77μU/ml. Se encontró presencia de autoinmunidad antitiroidea en 21 pacientes (37,50%). En 19 pacientes (33,92%) se encontraron anticuerpos anti-TPO, mientras que en 7 (12,50%) se hallaron anticuerpos anti-TG. En 5 mujeres (8,93%) estuvieron presentes ambos anticuerpos.
Del total de la muestra 21 mujeres (37,50%) tuvieron una prueba de O'Sullivan positiva, de las cuales 15 (26,79%) fueron diagnosticadas finalmente de DG. No se encontraron diferencias estadísticamente significativas en lo referente a la edad, índice de masa corporal, título de anticuerpos o cifra de TSH al inicio del embarazo, así como en la presencia de antecedentes familiares de diabetes mellitus entre el grupo de gestantes diagnosticadas de DG frente al grupo control (tabla 1).
Características demográficas de las pacientes con y sin diabetes gestacional al inicio del embarazo
| Total | DG | Control | P | |
| N (%) | 56 | 15 (26,79) | 41 (73,21) | |
| Edad (años); media±DE | 32,89±4,16 | 33,41±4,37 | 32,65±4,16 | 0,55 |
| IMC (kg/m2); media±DE | 22,90±3,06 | 23,52±3,14 | 22,68±3,07 | 0,37 |
| TSH (μU/ml); media±DE | 4,60±1,77 | 5,22±1,26 | 4,82±1,90 | 0,66 |
| AF DM; n (%) | 23 (41,07) | 9 (16,07) | 14 (25,00) | 0,084 |
| Anticuerpos antitiroideos; n (%) | 21 (37,50) | 6 (10,71) | 15 (26,79) | 0,77 |
| Anti-TPO; n (%) | 19 (33,92) | 6 (10,71) | 13 (23,21) | 0,46 |
| Anti-TG; n (%) | 7 (12,50) | 2 (3,57) | 5 (8,93) | 0,91 |
AF DM: antecedentes familiares de diabetes mellitus; Anti-TG: anticuerpos anti-tiroglobulina; Anti-TPO: anticuerpos anti-peroxidasa tiroidea; IMC: índice de masa corporal.
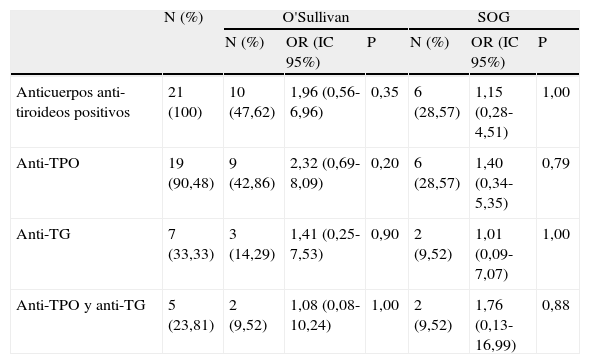
Se estudió el posible efecto de la autoinmunidad tiroidea (en pacientes con TSH por encima del objetivo al inicio del embarazo) y el desarrollo de DG. Entre las 21 pacientes con autoinmunidad antitiroidea positiva, 10 (47,62%) presentaron test O'Sullivan positivo, de las que finalmente 6 (28,57%) fueron diagnosticadas de DG. De las 35 gestantes con autoinmunidad negativa 11 (31,43%) presentaron test O'Sullivan positivo, entre las cuales 9 (25,71%) fueron diagnosticadas de DG. De acuerdo con los resultados de autoinmunidad, las pacientes se subdividieron en 3 grupos según el tipo de anticuerpos con el objeto de analizar el riesgo de desarrollar DG según el anticuerpo que se encontraba elevado. El análisis de regresión logística no encontró diferencias significativas entre las pacientes diagnosticadas de DG con positividad para anticuerpos anti-TPO, anti-TG o ambos respecto a las gestantes con autoinmunidad negativa (tabla 2).
Prevalencia y riesgo de presentar test de O'Sullivan positivo y diabetes gestacional en presencia de autoinmunidad tiroidea, clasificado por el tipo de anticuerpos antitiroideos
| N (%) | O'Sullivan | SOG | |||||
| N (%) | OR (IC 95%) | P | N (%) | OR (IC 95%) | P | ||
| Anticuerpos anti-tiroideos positivos | 21 (100) | 10 (47,62) | 1,96 (0,56-6,96) | 0,35 | 6 (28,57) | 1,15 (0,28-4,51) | 1,00 |
| Anti-TPO | 19 (90,48) | 9 (42,86) | 2,32 (0,69-8,09) | 0,20 | 6 (28,57) | 1,40 (0,34-5,35) | 0,79 |
| Anti-TG | 7 (33,33) | 3 (14,29) | 1,41 (0,25-7,53) | 0,90 | 2 (9,52) | 1,01 (0,09-7,07) | 1,00 |
| Anti-TPO y anti-TG | 5 (23,81) | 2 (9,52) | 1,08 (0,08-10,24) | 1,00 | 2 (9,52) | 1,76 (0,13-16,99) | 0,88 |
Anti-TG: anticuerpos anti-tiroglobulina; Anti-TPO: anticuerpos anti-peroxidasa tiroidea; IC 95%: intervalo de confianza al 95%; OR: odds ratio; SOG: sobrecarga oral de glucosa.
Los datos fueron obtenidos mediante regresión logística exacta por el programa LogXact-8 Cytel.
El presente estudio revela una alta prevalencia de DG en la población gestante con valor de TSH por encima del rango óptimo según recomendaciones de la ATA20. Sin embargo, en nuestra serie, no se ha observado una relación entre DG y autoinmunidad tiroidea en el embarazo.
Como se ha indicado, la hipótesis del presente estudio fue analizar si la existencia de autoinmunidad tiroidea en pacientes con TSH por encima del rango de referencia en el inicio del embarazo pudiera aumentar el riesgo de desarrollar DG. Esta suposición se basaba en las evidencias que vinculan la inflamación tanto con la resistencia insulínica7 como con la autoinmunidad tiroidea11. De este modo, un estudio demostró la reducción de la tolerancia a la glucosa y la tendencia a incrementar la concentración circulante de insulina en ayunas al final del embarazo en mujeres con anticuerpos tiroideos y que posteriormente sufrieron tiroiditis posparto, no siendo atribuible a la autoinmunidad de células de los islotes22. Sin embargo, hasta la fecha, la bibliografía en referencia a este aspecto es limitada, existiendo controversia en los resultados23–28.
En nuestra población de mujeres embarazadas, controladas durante el transcurso de su gestación por presentar un valor de TSH por encima del objetivo establecido al inicio del embarazo (objetivo <2,5μU/ml), no hemos identificado un incremento de la prevalencia de DG en aquellas mujeres con anticuerpos anti-TPO y/o anti-TG positivos. Sin embargo, la prevalencia de DG en nuestra muestra es claramente superior a la documentada en la población general española, que se sitúa en torno al 10%3–6.
Al estudiar factores identificados como predictores independientes de GD (como son la edad, el IMC y los antecedentes familiares de diabetes mellitus)29,30 en nuestra serie, no encontramos diferencias significativas entre las gestantes diagnosticadas de DG y el grupo control. Tampoco observamos diferencias en lo que concierne al valor de TSH al inicio del embarazo o al título de anticuerpos antitiroideos entre ambos grupos. No obstante, cabe destacar que las gestantes diagnosticadas de DG muestran una media de TSH superior al grupo control, dato que podría investigarse en estudios de mayor amplitud. Asimismo, destaca una mayor prevalencia de anticuerpos anti-TPO respecto a los anti-TG, con mayor porcentaje de DG en este grupo, a pesar de no encontrarse significación estadística en el análisis de regresión, posiblemente por el pequeño tamaño muestral del que disponemos. Estos resultados son similares a los publicados previamente24.
Como limitaciones en nuestro estudio reconocemos que hemos llevado a cabo un estudio retrospectivo y que el tamaño de la muestra es limitado. Además reconocemos que hubiese sido de interés el análisis de anticuerpos antidescarboxilasa del ácido glutámico-65 (GAD-65), así como disponer de un grupo control de gestantes con TSH dentro del objetivo establecido durante el embarazo (<2,5μU/ml). No obstante, hay que tener en cuenta que se trata de un estudio retrospectivo llevado a cabo con pacientes en la práctica clínica diaria, en la que no se evalúan rutinariamente anticuerpos antitiroideos en ausencia de disfunción tiroidea o antecedentes relevantes que justificaran su análisis.
En conclusión, la presencia de autoinmunidad tiroidea en pacientes con cifras de TSH por encima del rango deseado al inicio de la gestación no predice el desarrollo de DG. No obstante, la prevalencia de DG en nuestra muestra es superior a la documentada en la población general española, lo que sugiere la necesidad de un seguimiento más estrecho en gestantes con TSH≥2,5μU/ml.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.