El propósito de este estudio es el de considerar si en España la actuación de los especialistas ante el nódulo tiroideo y carcinoma diferenciado de tiroides está de acuerdo con la guía norteamericana y el consenso europeo.
Material y métodosEstudio transversal con un cuestionario que constaba de preguntas que fueron facilitadas a los endocrinológos clínicos expertos en cáncer de tiroides y a algunos miembros de los servicios de medicina nuclear de toda España.
ResultadosSe obtuvieron 177 respuestas, el 85% de los encuestados; de ellas el 74% procedían de endocrinólogos y el 26% de especialistas en medicina nuclear; el 82% de las respuestas procedían de hospitales de tercer nivel, el 10% de segundo nivel y el resto de centros privados. La mayoría de los encuestados valora el nódulo tiroideo con ecografía y practica el estudio citológico. La mayoría también dispone de un grupo quirúrgico experto en cirugía tiroidea y practican la tirodectomía total o casi total en los cánceres de tamaño superior a 10 mm, así como la disección ganglionar orientada por compartimentos. Menos 43 (24%), practican la disección profiláctica de los ganglios del compatimento central. En 81 (45%) respuestas se sigue practicando el rastreo corporal total con I131 o I123 previo al tratamiento con I131. En la mayoría de los casos se sigue al paciente basándose en la ecografía cervical y en la tiroglobulina; sin embargo 101 (57%) de los encuestados siguen realizando el rastreo corporal total en el seguimiento.
ConclusiónLa actitud que siguen nuestros especialistas está bastante de acuerdo con la guía americana y consenso europeo, si bien difiere en el rastreo corporal total con I131 previo al tratamiento ablativo así como el seguimiento basado también en el rastreo corporal total con I131.
The aim of this study was to assess the approaches of specialists in Spain to patients with thyroid nodules and differentiated thyroid carcinoma and to compare them with the American guideline and European consensus.
Material and methodsWe performed a cross-sectional study based on a questionnaire addressed to clinical endocrinologists specialized in thyroid cancer and specialists in nuclear medicine throughout Spain.
ResultsA total of 177 questionnaires were completed, representing an overall response rate of 85%; 74% of responses were from endocrinologists and 24% from physicians active in nuclear medicine; 82% of respondents worked in third-level hospitals, 10% in second level hospitals and the remainder in private practice. Most used ultrasonography and cytology to assess thyroid nodules and collaborated with a group of surgeons expert in thyroid surgery. The majority preferred total or subtotal thyroidectomy in tumors with a diameter of 1 cm or more, and systematic lymph node dissection. Only 43 (24%) preferred prophylactic central lymph node dissection. Eighty-one respondents (45%) would still use whole body scan with 131I or 123I before 131I ablation. Follow-up was based on cervical echography and thyroglobulin determination; however, 101 (57%) respondents continued to use diagnostic whole body scan in the follow-up.
ConclusionThe approaches of the respondents were mainly in accordance with the guideline and consensus, although some variations were found, especially in the use of whole body scan with 131I before ablation and in follow-up.
Desde hace años se viene planteando la necesidad de proponer una aproximación racional ante el nódulo tiroideo y el cáncer diferenciado de tiroides (CDT), así como para el seguimiento de este último; de estas inquietudes han surgido numerosas guías y consensos en diferentes países de las que fue pionera la guía británica publicada inicialmente en 20021,2 y que supuso un estándar aplicable a la mayoría de pacientes afectos de CDT3,4. En nuestro país igualmente se propuso una guía siguiendo las bases y todas las evidencias de que entonces se disponía5.
El CDT es la neoplasia endocrina más frecuente, con un espectro de malignidad muy variable, de forma que mientras la mayoría de los CDT, papilar y folicular, tienen un pronóstico excelente con tasas de supervivencia de casi el 90% a los 20 años, hay un pequeño grupo de los mismos, con mal pronóstico y que no responden a la terapia convencional6. Las opciones de tratamiento actuales son la resección quirúrgica de la enfermedad local o de las metástasis, el tratamiento con I131 y la supresión de la TSH con T4 exógena; la radioterapia tiene un efecto moderado en el cáncer avanzado y hay pocos estudios que hayan demostrado el de la quimioterapia7. Recientemente se han incorporado varias técnicas y avances para el diagnóstico y seguimiento del CDT como el empleo de la TSH humana recombinante (TSHhr), la ecografía cervical, la citología tras punción aspiración aguja fina de los nódulos tiroideos así como la experiencia acumulada a largo de los últimos años. Todo ello ha llevado a la publicación de la guía de la American Thyroid Association8 que recientemente ha sido revisada9 y a la del consenso europeo por parte de European Thyroid Association y el Cancer Research Network10.
El propósito de este artículo es el de considerar si en la actualidad en España la actuación de los especialistas ante el nódulo tiroideo y CDT así como su seguimiento está de acuerdo con la guía norteamericana y el consenso europeo.
Material y métodosEl estudio es transversal y para ello se elaboró un cuestionario dentro del Grupo de Trabajo de Cáncer de Tiroides de la Sociedad Española de Endocrinología y Nutrición que constaba de una serie de preguntas que fueron facilitadas de forma directa seleccionando a los endocrinológos clínicos expertos en cáncer de tiroides y a algunos miembros de los servicios de medicina nuclear de toda España, implicados también en el tratamiento y seguimiento del CDT; el cuestionario constaba de una serie de preguntas sobre la conducta a seguir ante el nódulo tiroideo y su diagnóstico, actitud ante el CDT, tratamiento y seguimiento del mismo siguiendo el guión de lo que se define y estructura en el consenso europeo10 de las cuales las más relevantes están en la tabla 1 y el cuestionario entero en el anexo 1; también se recogieron datos demográficos y de situación laboral de los encuestados.
Preguntas más importantes del cuestionario
| Valoración inicial de los nódulos tiroideos |
|
| Estadificación preoperatoria |
|
| Tratamiento quirúrgico |
|
| Estadificación postoperatoria |
|
| Ablación con I131 |
|
| Supresión de la TSH |
|
| Seguimiento |
|
TSHhr: TSH humana recombinante.
Se obtuvieron 177 respuestas, el 85% de los encuestados; de ellas el 74% procedían de endocrinólogos y el 26% especialistas en medicina nuclear; el 82% de las respuestas procedían de hospitales de tercer nivel, el 10% de segundo nivel y el resto de centros privados.
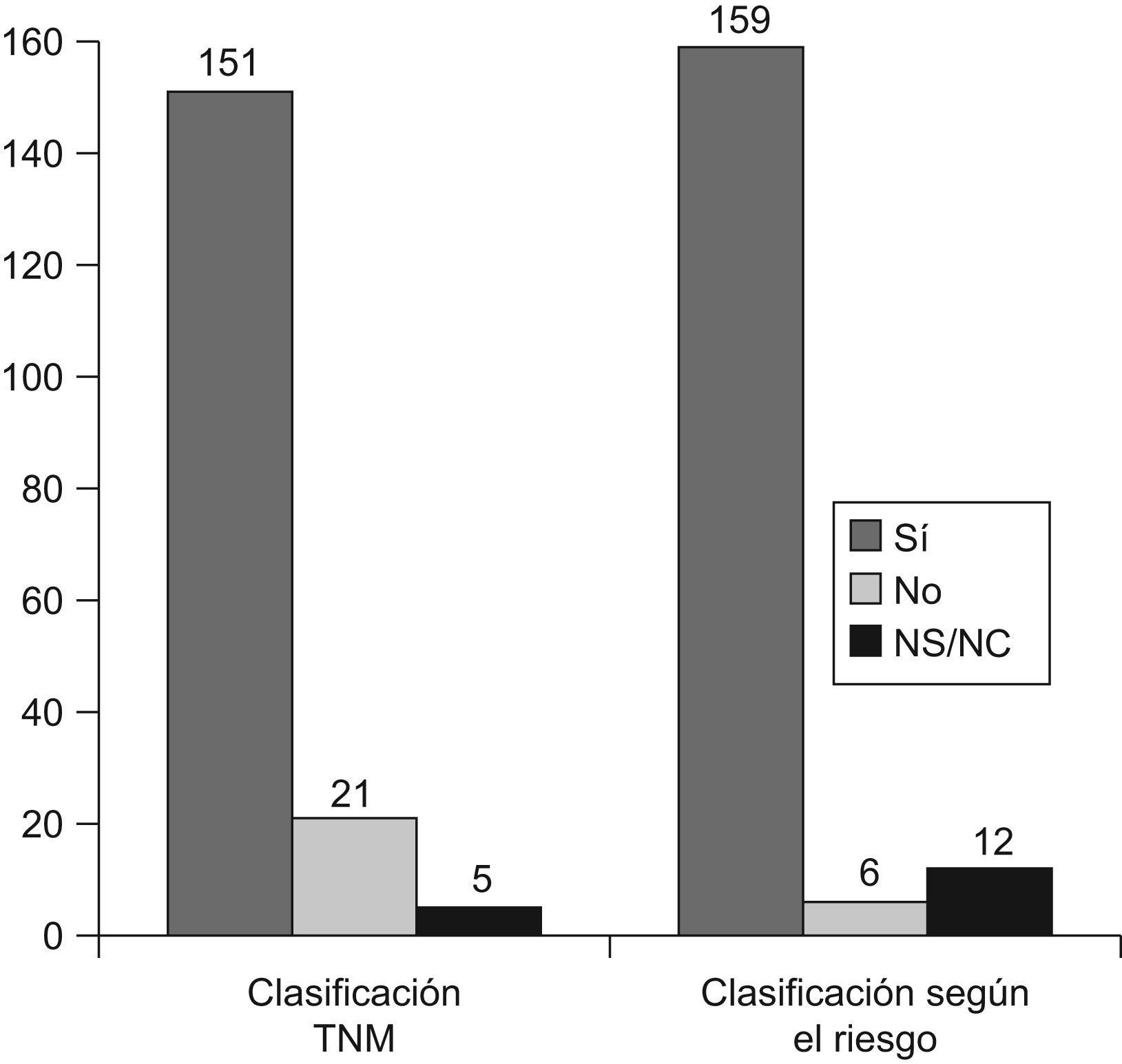
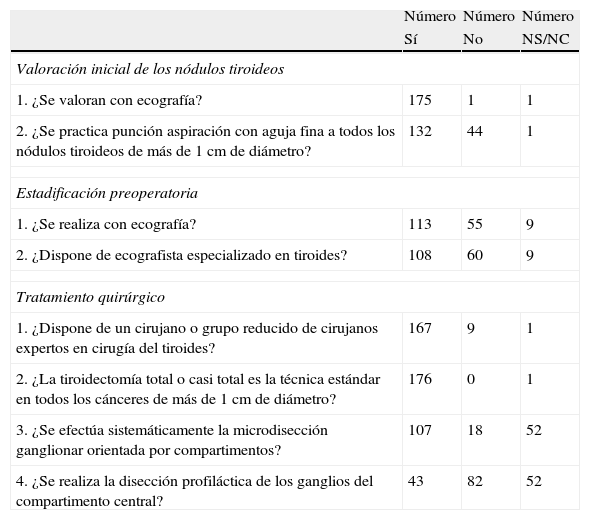
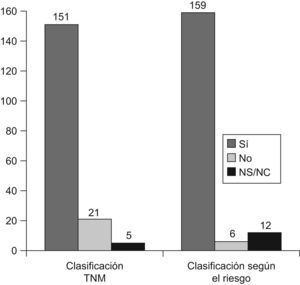
Cabe resaltar que la mayoría de los encuestados valora el nódulo tiroideo con ecografía así como también practica la punción aspiración con aguja fina para el estudio citológico. La estadificación preoperatoria también se hace basándose en la ecografía y la mayoría dispone de ecografista o ecografistas especializados en tiroides. De los encuestados, la mayoría también dispone de un grupo quirúrgico reducido que todos son expertos en cirugía tiroidea; en la mayoría de los casos se practica la tirodectomía total o casi total en los cánceres de tamaño superior a 10mm, así como la disección ganglionar orientada por compartimentos. De los encuestados, menos practican la disección profiláctica de los ganglios del compartimento central 43 (24%) (tabla 2). En la mayoría de casos los pacientes se clasifican de acuerdo con la escala pTNM (6.a edición) (fig. 1) y se catalogan por el riesgo.
Actitud ante el nódulo y cáncer de tiroides
| Número | Número | Número | |
| Sí | No | NS/NC | |
| Valoración inicial de los nódulos tiroideos | |||
| 1. ¿Se valoran con ecografía? | 175 | 1 | 1 |
| 2. ¿Se practica punción aspiración con aguja fina a todos los nódulos tiroideos de más de 1 cm de diámetro? | 132 | 44 | 1 |
| Estadificación preoperatoria | |||
| 1. ¿Se realiza con ecografía? | 113 | 55 | 9 |
| 2. ¿Dispone de ecografista especializado en tiroides? | 108 | 60 | 9 |
| Tratamiento quirúrgico | |||
| 1. ¿Dispone de un cirujano o grupo reducido de cirujanos expertos en cirugía del tiroides? | 167 | 9 | 1 |
| 2. ¿La tiroidectomía total o casi total es la técnica estándar en todos los cánceres de más de 1 cm de diámetro? | 176 | 0 | 1 |
| 3. ¿Se efectúa sistemáticamente la microdisección ganglionar orientada por compartimentos? | 107 | 18 | 52 |
| 4. ¿Se realiza la disección profiláctica de los ganglios del compartimento central? | 43 | 82 | 52 |
En 81 (45%) respuestas, se sigue practicando el rastreo corporal total con I131 o I123 previo al tratamiento con I131. En la mayoría de los casos se sigue al paciente basándose en la ecografía cervical y en la tiroglobulina sérica basal o estimulada con TSHhr y se basan en ambas exploraciones para definir la ablación completa del CDT. Sin embargo, 101 (57%) de los encuestados siguen realizando el rastreo corporal total en el seguimiento tras retirada de T4 o tras estímulo con TSHhr. La mayoría afirma que si la tiroglobulina fuese elevada o aumentase durante el seguimiento, trataría al paciente con una dosis terapéutica de I131 (tabla 3).
Estadificación y seguimiento del cáncer de tiroides
| Número | Número | Número | |
| Sí | No | NS/NC | |
| Estadificación postoperatoria | |||
| 1. ¿Se clasifican los casos de acuerdo con la escala pTNM (6.a edición)? | 151 | 21 | 5 |
| 2. ¿Se catalogan los casos en: muy bajo riesgo, bajo riesgo y alto riesgo? | 159 | 6 | 12 |
| Ablación con I131 | |||
| 1. ¿Se hace rastreo diagnóstico previo al tratamiento con I131? o con I123? | 81 | 96 | 0 |
| Supresión de la TSH | |||
| 1. ¿En los casos considerados curados se desciende la dosis de l-T4 al año o 2 años para conseguir que la TSH basal sea de 0,5–1mU/l? | 144 | 22 | 11 |
| Seguimiento | |||
| 1. ¿Se hace usando la ecografía? | 167 | 6 | 4 |
| 2. ¿Se hace también basado en las concentraciones de tiroglobulina basal y/o estimulada? | 175 | 1 | 1 |
| 3. ¿Se sigue al paciente con rastreo corporal total diagnóstico tras retirada de T4 o tras estímulo con TSHhr? | 101 | 59 | 17 |
| 4. ¿Se considera que la definición actual de la ablación completa es la concentración de tiroglobulina indetectable por método inmunométrico y sin anticuerpos antitiroglobulina tras estímulo con TSHhr y ecografía cervical normal? | 167 | 9 | 1 |
| 5. ¿Si la concentración de tiroglobulina fuese detectable por encima del cut off institucional o bien aumentase durante el seguimiento basalmente o tras estímulo con TSHhr se administra una dosis terapéutica de I131 con rastreo corporal total posterior? | 149 | 22 | 6 |
TSHhr: TSH humana recombinante.
El presente estudio transversal, sobre la conducta a seguir que siguen los especialistas en España en el nódulo tiroideo y en el CDT, pretende recoger y reflejar la situación actual respecto a las recomendaciones de la guía americana8,9 y el consenso europeo10 conocidos desde 2006; ambos están basados en un gran número de evidencias que además surgen del desarrollo y aproximación recientes basados en la ecografía tiroidea, la citología tiroidea y el uso de la TSHrh11.
Las características profesionales de la muestra obtenida refleja la distribución que hay en nuestro país en cuanto a los profesionales que tratan el nódulo tiroido y sobre todo el CDT; la mayoría son endocrinólogos, seguido de un número menor de especialistas en medicina nuclear, sin que haya ningún oncólogo en la misma. Por otra parte es una enfermedad cuyo tratamiento y seguimiento es hospitalario y en la mayoría de los casos en hospitales de tercer nivel al igual que ocurre en otros países12.
En la encuesta se exploran áreas de consenso, otras más convencionales o conocidas así como algunas controvertidas debido a la tradición que se ha seguido en determinadas conductas, como el predominio que ha tenido en este tema durante muchos años el uso y la aplicación terapéuticos y de seguimiento de los isotopos radioactivos; también es un motivo de controversia el tratamiento quirúrgico, su indicación, extensión y algún tipo de cirugía profiláctica.
La mayoría de los encuestados están de acuerdo en que tanto la aproximación diagnóstica al nódulo tiroideo como su estadificación se realizan mediante ecografía y citología tras punción con aguja fina del tiroides y que además un buen número de ellos dispone de un ecografista especializado en tiroides.
En cuanto a las controversias en relación con la cirugía, la mayoría dispone de un cirujano o grupo reducido de cirujanos que habitualmente intervienen el nódulo o CDT; también la mayoría proponen la tiroidecotomía total o casi total como técnica quirúrgica estándar en los nódulos sospechosos de más de 10 mm de diámetro y efectúa la microdisección ganglionar orientada por compartimentos, siguiendo por lo tanto las directrices americanas y europeas8–10. En cuanto a la disección profiláctica de los ganglios del compartimento central, la actitud es de cautela y la mayoría no la efectúa. Esta actitud es congruente con la recomendación de la European Thyroid Association10, que indica que los beneficios de la disección profiláctica de dicho compartimento en ausencia de evidencia de invasión ganglionar pre o intraoperatoria, son dudosos con el consiguiente aumento de morbilidad10,13,14. En este sentido la revisión reciente de la guía americana se decanta y recomienda que la disección terapéutica deberá llevarse a cabo en los pacientes con adenopatías centrales o laterales para extirpar mejor la enfermedad. La disección profiláctica deberá llevarse a cabo solo en pacientes con carcinoma papilar sin adenopatías centrales y que estén en estadio T3 o T4. Para los T1 y T2 la indicación sería la no disección si no presentasen adenopatías, así como para la mayoría de los foliculares9.
La mayor parte clasifican los casos de acuerdo con la escala pTNM (6.a edición)15 recomendándose además el considerar la edad también en todo tipo de tumores como factor pronóstico y los clasifica por grupos de riesgo; esta clasificación, que se utiliza además para los registros hospitalarios del cáncer así como en los estudios epidemiológicos, identifica a la mayoría de los pacientes con bajo riesgo de mortalidad, del 70 al 85%, en los cuales el tratamiento sería menos intensivo que es resto que tienen más riesgo y que se beneficiarían de un tratamiento más agresivo16.
En relación con el tratamiento ablativo con I131, 81(45%) de los encuestados frente a 96 (55%) siguen realizando el rastreo diagnóstico previo al tratamiento con I131; puede realizarse tras retirada o sin T4 o tras estímulo con TSHhr; actualmente la tendencia es a evitar los rastreos pretratamiento ya que por una parte no sirven para decidir la ablación y por otra producen stunning, es decir la reducción de la capacidad de captación de I131 que ocurre sobretodo con dosis del isótopo de mayor actividad, entre 5 y 10mCi de I131. Solo tendría sentido el efectuarlo y con poca actividad radioactiva, cuando se desconociese la extensión de la tiroidectomía que constase en el informe quirúrgico o por el estudio local con ecografía8–10.
El tratamiento supresor con T4 a largo plazo, constituye también uno de los grandes cambios introducidos por la guía y el consenso; hay estudios que muestran una asociación entre la supresión de la TSH y la menor frecuencia de recidivas17,18 si bien el grado de supresión recomendable aún se desconoce. También hay que considerar los efectos secundarios que dicha supresión prolongada puede llevar a cabo19–21. Las recomendaciones actuales son que si la enfermedad fuese persistente se debería suprimir la TSH por debajo de 0,1mU/l de forma indefinida; en aquellos pacientes con riesgo elevado deberían mantener la TSH entre 0,1 y 0,5mU/l, durante 5–10 años y los que están libres de enfermedad se debería mantener la TSH en los límites bajos de la normalidad, una vez que así se haya determinado. En este sentido la mayoría de los encuestados aceptan esta práctica.
El seguimiento del CDT se lleva acabo usando la ecografía cervical y la tiroglobulina basal y/o estimulada en la mayoría de los casos, tal como se recomienda en la guía y en el protocolo y basados en numerosas evidencias aportadas hasta la actualidad8,9,10,22–27; sin embargo, 59 (34%) de los encuestados siguen realizando el rastreo corporal total tras retirada de la T4 o tras estímulo con TSHhr. A pesar de ello, la mayoría considera que la definición actual de ablación completa es la concentración de tiroglobulina indetectable por método inmunométrico y sin anticuerpos antitiroglobulina tras estímulo con TSHhr y ecografía cervical normal.
También la mayoría administra una dosis terapéutica de I131 con rastreo corporal total posterior si la concentración de tiroglobulina fuese detectable por encima del cut off institucional o bien aumentase durante el seguimiento basalmente o tras estímulo con TSHhr.
Las limitaciones del estudio vienen dadas porque no disponemos de un auténtico registro de CDT en España ni tampoco de todos los especialistas que de forma preferente se dedican a su tratamiento y seguimiento. Por otra parte, el número de facultativos que tratan el CDT puede ser mayor debido a que trabajen en centros hospitalarios de menor nivel o centros privados y que sean menos conocidos para nosotros. Todo lo cual conlleva un sesgo importante ya que no todos ellos presumiblemente sigan la misma conducta y nosotros nos hemos dirigido a los de centros más reconocidos, los cuales a su vez serán más conscientes de los cambios introducidos y de las nuevas orientaciones. También puede estar artefactada la encuesta porque los que contestan son los más activos y que han participado en más foros, debates, etc. y son más conscientes de los cambios introducidos.
Aún con todas las limitaciones que presenta la encuesta y sus resultados, la actitud que siguen nuestros especialistas en la conducta ante el nódulo tiroideo y el CDT está bastante de acuerdo con la guía americana y consenso europeo de 20068–10, si bien difiere en algunos aspectos, especialmente en lo que al rastreo corporal total con I131 previo al tratamiento ablativo así como el seguimiento basado también en el rastreo corporal total con I131.
El Grupo de Cáncer de Tiroides de la Sociedad Española de Endocrinología está formado por: Cristina Álvarez, Elías Álvarez, Emma Anda, Amparo Calleja, Sergio Donnay, Demetria Drigopoulous, José Manuel Gómez, Álvaro Larrad, Luis López-Penabad, Anna Maria Lucas, Edelmiro Ménendez, Pablo Moreno, Elena Navarro, Vicente Pereg, Begoña Pérez, Franco Sánchez-Franco, Javier Santamaría, Carlos Zafón.
Los autores agradecen la inestimable colaboración en el estudio de la empresa Genzyme, especialmente a Antonio Gracia y a Sylvia Plaza.
Ver tabla A1.
Cuestionario completo
| Valoración inicial de los nódulos tiroideos |
|
| Estadificación preoperatoria |
|
| Tratamiento quirúrgico |
|
| Estadificación postoperatoria |
|
| Ablación con I131 |
|
| Supresión de la TSH |
|
| Seguimiento |
|
| Futuro |
| 1. ¿Considera que fármacos antiangiogénicos o con otras propiedades, pueden ser de futuro en el cáncer diferenciado avanzado de tiroides? |
| Datos demográficos del encuestado |
|