Se ha descrito la existencia de deficiencia de vitamina D tanto en la población general como en un gran número de enfermedades. Sin embargo, se han publicado pocos estudios realizados en población joven y sana en España. Teóricamente no debería encontrarse deficiencia de vitamina D entre los estudiantes de Medicina de la Universidad de Las Palmas de Gran Canaria, porque disponen de todos los medios para evitarla.
ObjetivoEstimar la prevalencia de deficiencia de vitamina D en una población de estudiantes de Medicina de ambos sexos de la Universidad de Las Palmas de Gran Canaria.
MétodoSe estudiaron 103 alumnos de Medicina de ambos sexos de la Universidad de Las Palmas de Gran Canaria. A todos se les realizó un cuestionario y una exploración física. Se determinó la vitamina D 25-hidroxicolecalciferol (25-HCC), la hormona paratiroidea, varios marcadores bioquímicos de remodelado óseo y un estudio bioquímico general. Se estimó la densidad mineral ósea por absorciometría radiológica dual en la columna lumbar y en la extremidad proximal del fémur. Asimismo, se midieron los parámetros ultrasonográficos en el calcáneo.
ResultadosSólo el 38,8% de los estudiantes de Medicina (el 42,1% de los varones y el 44,9% de las mujeres) presentaron niveles de 25-HCC superiores a 30 ng/dl tal y como se recomienda en la actualidad. Se observó deficiencia de vitamina D (menos de 20 ng/ml) en el 32,6% de los alumnos e insuficiencia (menos de 30 ng/ml) en el 28,6% de los estudiantes de Medicina de la Universidad de Las Palmas de Gran Canaria.
ConclusionesAunque los estudiantes de Medicina de las Isla Canarias disponen de las condiciones ideales para tener unos niveles óptimos de vitamina D, casi dos tercios de ellos tienen valores de 25-HCC inferiores a 30 ng/ml.
Vitamin D deficiency has been described in many diseases and indeed in the general population. However fewer reports have been published in young and healthy people. Vitamin D deficiency should not be found in medical students of the Canary Islands, because they have all the resources to avoid it.
ObjectiveTo estimate the prevalence of vitamin D deficiency in a population of medical students of both gender from the University of Las Palmas de Gran Canaria.
Methods103 medical students of both genders from the University of Las Palmas de Gran Canaria. They completed a questionnaire and a physical examination. Vitamin D (25- hydroxycholecalciferol [25-HCC]), parathyroid hormone, biochemical markers of bone remodeling and a general biochemical study were performed. Bone mineral density was assessed by dual energy X-ray absorptiometry at the lumbar spine and the proximal femur. Quantitative ultrasounds parameters were measured at the calcaneus.
ResultsOnly 38.8% of the students of Medicine (42.1% of males and 44.9% of females) have 25-HCC values higher than 30 ng/dl as widely recommended nowadays. Vitamin D deficiency (< 20 ng/ml) is observed in 32.6% and vitamin D insufficiency (< 30 ng/ml) in 28.6% of the students of Medicine in Las Palmas de Gran Canaria.
ConclusionAlthough they have optimal conditions for having good levels of vitamin D, near two thirds of the medical students in the Canaries have low values of vitamin D.
La vitamina D ha dejado de considerarse un micronutriente esencial para ser considerada en la actualidad como una hormona involucrada en un complejo sistema endocrino que regula la homeostasis mineral, protege la integridad del esqueleto y modula el crecimiento y la diferenciación celular en una variedad amplia de tejidos1. La deficiencia de vitamina D se ha descrito en muchas enfermedades2,3 y ha sido propuesta como un factor de riesgo para la osteoporosis4,5, las fracturas por fragilidad6,7 y las caídas8,9. Dado que la vitamina D se sintetiza sobre todo en la piel con la exposición a la luz solar y como esta capacidad disminuye con la edad10, la deficiencia de vitamina D habitualmente ha sido descrita en las personas de edad avanzada, aunque existen algunas publicaciones que describen esta deficiencia en poblaciones sanas, con escasa exposición solar3,11.
La hipovitaminosis D no debería ser prevalente en los alumnos de Medicina de la Universidad de Las Palmas de Gran Canaria dado que: a) se trata de una población joven y sana, b) tienen conocimientos sobre la fisiología de la vitamina D y de sus requerimientos diarios y c) por el soleado clima de Gran Canaria, con muchas horas de sol y escasa pluviosidad durante todo el año. Sin embargo, por otra parte, los estudiantes pasan una buena cantidad de horas diarias dentro de edificios, ya sea en los hospitales o estudiando. Por ello, ya se ha descrito que el 32% de los estudiantes, médicos residentes y de plantilla de un hospital de Boston tenían deficiencia de vitamina D, pese a que bebían al menos un vaso de leche al día, tomaban polivitamínicos diariamente y comían salmón al menos una vez por semana12.
Por ello, hemos realizado el presente estudio en una población de alumnos de Medicina de la Universidad de Las Palmas de Gran Canaria, con el objeto de estimar en ellos la posible prevalencia de hipovitaminosis D.
Material y métodoPara la realización de este estudio hemos utilizado a 103 estudiantes de Medicina de ambos sexos de la Universidad de Las Palmas de Gran Canaria, con una edad media de 22 años. Todos eran de raza blanca y habían nacido y vivido en Gran Canaria. Se les informó de los objetivos del estudio y todos dieron su consentimiento escrito para participar.
Cuestionario general sobre osteoporosis. A todos los alumnos que participaron en el estudio se les realizó un cuestionario en el que se recogió información sobre su estado de salud, estilos de vida, hábitos nutricionales, consumo de fármacos e historia reproductiva relacionados con la osteoporosis13.
Cuestionario específico. Además del cuestionario anterior, los alumnos completaron un cuestionario de 28 preguntas, dirigido a conocer posibles factores con influencia sobre los niveles de vitamina D, como el estado de salud general, la actividad diaria, la realización semanal de ejercicio, así como la exposición semanal al sol.
En el cuestionario se incluían también preguntas sobre el consumo diario, semanal o mensual de los alimentos que contienen vitamina D, como los productos lácteos, el zumo de naranja fortificado, los cereales, pescado, huevos y aceite de hígado de bacalao, así como los suplementos nutricionales y los polivitamínicos.
También se les preguntó sobre el número de horas que pasaban a la semana fuera de casa sin factor de protección solar, el número de partes del cuerpo expuestas al sol, así como las actividades deportivas que practicaban al exterior y las horas a la semana que pasaban en la playa. En todos los casos se les preguntó por el uso de protección solar en estas actividades.
A todos los alumnos se les realizó una exploración física completa. Se obtuvo la talla y el peso y a partir de ellos se calculó el índice de masa corporal (IMC) de cada sujeto. Se obtuvo sangre tras 12 h de ayuno y fue inmediatamente congelada a –80°C. Los parámetros bioquímicos fueron medidos por métodos estandarizados.
Los niveles séricos de vitamina D se midieron por inmunoquimioluminiscencia, según el método de Nichols (Nichols Institute Diagnostics, San Clemente, CA). Este método tiene un coeficiente de variación intraensayo del 3,0-4,5% e interensayo del 7,1-10,0%. Los valores dados por el laboratorio como normales oscilan entre 10 y 68 ng/ml.
Las concentraciones de parathormona (PTH) sérica para la molécula intacta se determinaron por inmunoquimioluminiscencia, según el método de Nichols Advantage. El rango de normalidad en los adultos oscila entre los 6 y los 40 pg/ml, con un coeficiente de variación interensayo del 7,0-9,2%. Los propéptidos de la fracción amino-terminal del colágeno tipo I y los beta crosslaps en sangre fueron medidos por técnicas previamente descritas14,15. Los restantes parámetros bioquímicos fueron determinados por técnicas colorimétricas.
Densidad mineral óseaLa masa ósea fue medida por absorciometría radiológica dual (DXA) tanto en la columna lumbar (L2-L4) como en la extremidad proximal del fémur, con un densitómetro Hologic Discovery, (Hologic Inc. Waltham, EE.UU.). La precisión es del 0,75-0,16%. Las mediciones fueron realizadas por el mismo operador, por lo que no existe variación interobservador. Los valores Z y T-Score se calcularon a partir de los valores publicados como normales para la población canaria16.
Parámetros ultrasonográficos en el calcáneoA todos los participantes en el estudio se les realizó una estimación de los ultrasonidos en el calcáneo. Se utilizó un ultrasonógrafo Sahara (Hologic®, Bedford, MA). El sistema consta de dos transductores montados coaxialmente sobre un monitor. Un transductor actúa como emisor y el otro como receptor. Los transductores se ajustan al calcáneo por medio de unas almohadillas sobre las que se aplica un gel oleoso. Los parámetros ultrasonográficos que mide el Sahara son la atenuación ultrasónica de banda ancha o broadband ultrasound attenuation (BUA) y la velocidad de sonido o speed of sound (SOS). La combinación de la BUA y la SOS permite obtener un nuevo parámetro, llamado índice de consistencia o Quantitative Ultrasound Index (QUI), por medio de la fórmula: QUI = 0,41*(BUA + SOS) – 571. Los valores de Z y T-Score se calcularon a partir de los valores previamente descritos como normales para la población española17.
Análisis estadísticoLas variables categóricas fueron resumidas como porcentajes y las continuas como medias y desviación típica, cuando los datos seguían una distribución normal o por medianas con sus rangos intercuartiles cuando no lo hacían. Los porcentajes fueron comparados utilizando la prueba de la chi-cuadrado, las medias fueron comparadas por medio de la prueba de la t de Student y las medianas por la prueba de Wilcoxon.
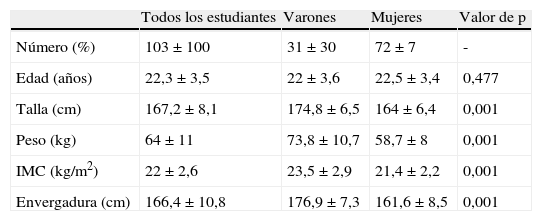
ResultadosLa tabla 1 muestra las características basales de la población estudiada. El 70% de los estudiantes era mujer. La edad media fue similar en ambos grupos. Los varones tenían más talla y peso que las mujeres; por ello el IMC fue también mayor en los varones.
Características basales de la población estudiada, media±desviación estándar
| Todos los estudiantes | Varones | Mujeres | Valor de p | |
| Número (%) | 103±100 | 31±30 | 72±7 | - |
| Edad (años) | 22,3±3,5 | 22±3,6 | 22,5±3,4 | 0,477 |
| Talla (cm) | 167,2±8,1 | 174,8±6,5 | 164±6,4 | 0,001 |
| Peso (kg) | 64±11 | 73,8±10,7 | 58,7±8 | 0,001 |
| IMC (kg/m2) | 22±2,6 | 23,5±2,9 | 21,4±2,2 | 0,001 |
| Envergadura (cm) | 166,4±10,8 | 176,9±7,3 | 161,6±8,5 | 0,001 |
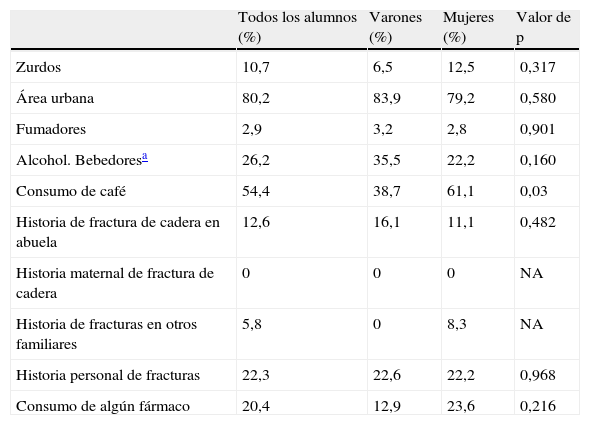
En la tabla 2 se recoge la distribución de algunos estilos de vida y factores de riesgo para la osteoporosis, así como los datos sobre los antecedentes médicos. El 10,7% de los estudiantes era zurdo; el 6,5% de los varones y el 12,5% de las mujeres, sin diferencias estadísticamente significativas en su prevalencia. La mayor parte de los estudiantes vivía en un área urbana, sin diferencias estadísticamente significativas entre áreas. La mayor parte de los alumnos no fumaba (p = 0,901). Entre los que consumían alcohol (el 26,2% de los alumnos) el 35,5% correspondía a varones y el 22,2% a mujeres. Por otra parte, de los que consumían café, la mayoría eran mujeres, siendo esta diferencia estadísticamente significativa.
Distribución de algunos estilos de vida, factores de riesgo para la osteoporosis y antecedentes personales y familiares
| Todos los alumnos (%) | Varones (%) | Mujeres (%) | Valor de p | |
| Zurdos | 10,7 | 6,5 | 12,5 | 0,317 |
| Área urbana | 80,2 | 83,9 | 79,2 | 0,580 |
| Fumadores | 2,9 | 3,2 | 2,8 | 0,901 |
| Alcohol. Bebedoresa | 26,2 | 35,5 | 22,2 | 0,160 |
| Consumo de café | 54,4 | 38,7 | 61,1 | 0,03 |
| Historia de fractura de cadera en abuela | 12,6 | 16,1 | 11,1 | 0,482 |
| Historia maternal de fractura de cadera | 0 | 0 | 0 | NA |
| Historia de fracturas en otros familiares | 5,8 | 0 | 8,3 | NA |
| Historia personal de fracturas | 22,3 | 22,6 | 22,2 | 0,968 |
| Consumo de algún fármaco | 20,4 | 12,9 | 23,6 | 0,216 |
NA: no analizado.
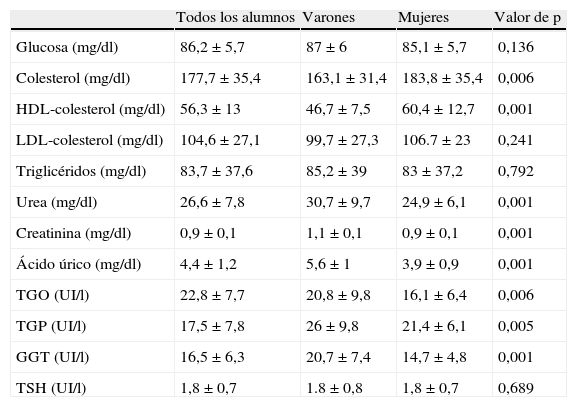
La tabla 3 muestra los lípidos, la función renal y hepática, la TSH y algunos otros resultados bioquímicos. Todos estos parámetros se encontraban dentro de los límites de la normalidad.
Parámetros bioquímicos, lípidos, función renal y hepática y TSH
| Todos los alumnos | Varones | Mujeres | Valor de p | |
| Glucosa (mg/dl) | 86,2±5,7 | 87±6 | 85,1±5,7 | 0,136 |
| Colesterol (mg/dl) | 177,7±35,4 | 163,1±31,4 | 183,8±35,4 | 0,006 |
| HDL-colesterol (mg/dl) | 56,3±13 | 46,7±7,5 | 60,4±12,7 | 0,001 |
| LDL-colesterol (mg/dl) | 104,6±27,1 | 99,7±27,3 | 106.7±23 | 0,241 |
| Triglicéridos (mg/dl) | 83,7±37,6 | 85,2±39 | 83±37,2 | 0,792 |
| Urea (mg/dl) | 26,6±7,8 | 30,7±9,7 | 24,9±6,1 | 0,001 |
| Creatinina (mg/dl) | 0,9±0,1 | 1,1±0,1 | 0,9±0,1 | 0,001 |
| Ácido úrico (mg/dl) | 4,4±1,2 | 5,6±1 | 3,9±0,9 | 0,001 |
| TGO (UI/l) | 22,8±7,7 | 20,8±9,8 | 16,1±6,4 | 0,006 |
| TGP (UI/l) | 17,5±7,8 | 26±9,8 | 21,4±6,1 | 0,005 |
| GGT (UI/l) | 16,5±6,3 | 20,7±7,4 | 14,7±4,8 | 0,001 |
| TSH (UI/l) | 1,8±0,7 | 1.8±0,8 | 1,8±0,7 | 0,689 |
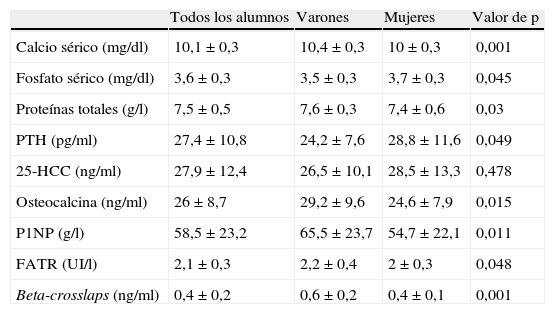
La tabla 4 muestra los parámetros analíticos relacionados con el metabolismo mineral: PTH, 25-hidroxivitamina D y los marcadores bioquímicos de remodelado óseo. Los valores medios de 25-HCC fueron de 27,9 ± 12,4 ng/ml; varones: 26,5 ± 10,1 ng/ml y mujeres: 28,5 ± 13,3 ng/ml, p = 0,478). Los restantes parámetros medidos mostraron unos valores dentro del rango normal obtenido descrito en nuestro laboratorio.
Parámetros de metabolismo mineral y remodelado óseo
| Todos los alumnos | Varones | Mujeres | Valor de p | |
| Calcio sérico (mg/dl) | 10,1±0,3 | 10,4±0,3 | 10±0,3 | 0,001 |
| Fosfato sérico (mg/dl) | 3,6±0,3 | 3,5±0,3 | 3,7±0,3 | 0,045 |
| Proteínas totales (g/l) | 7,5±0,5 | 7,6±0,3 | 7,4±0,6 | 0,03 |
| PTH (pg/ml) | 27,4±10,8 | 24,2±7,6 | 28,8±11,6 | 0,049 |
| 25-HCC (ng/ml) | 27,9±12,4 | 26,5±10,1 | 28,5±13,3 | 0,478 |
| Osteocalcina (ng/ml) | 26±8,7 | 29,2±9,6 | 24,6±7,9 | 0,015 |
| P1NP (g/l) | 58,5±23,2 | 65,5±23,7 | 54,7±22,1 | 0,011 |
| FATR (UI/l) | 2,1±0,3 | 2,2±0,4 | 2±0,3 | 0,048 |
| Beta-crosslaps (ng/ml) | 0,4±0,2 | 0,6±0,2 | 0,4±0,1 | 0,001 |
25-HCC: 25-hidroxivitamina D; FATR: fosfatasa ácida tartrato-resistente; P1NP: propéptido aminoterminal del colageno tipo I
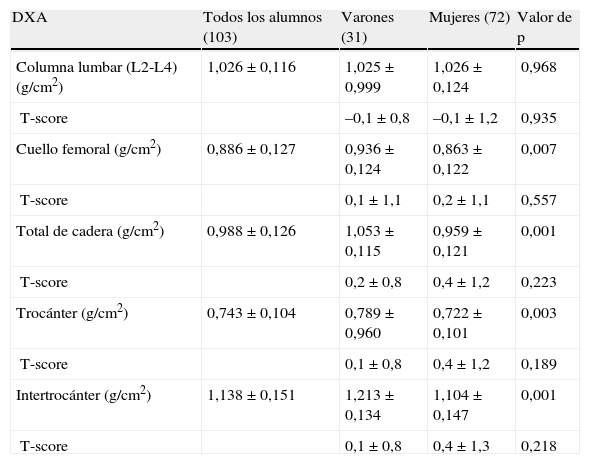
La tabla 5 muestra los valores de DMO determinados tanto en la columna lumbar (L2-L4) como en la extremidad proximal del fémur. No se apreciaron diferencias estadísticamente significativas entre hombres y mujeres en la columna lumbar, pero en la extremidad proximal del fémur los varones mostraron unos valores densitométricos que fueron estadísticamente superiores en todos los lugares anatómicos de la extremidad proximal del fémur.
Valores de densidad mineral ósea, medidos en la columna lumbar (L2-L4) y en la extremidad proximal del fémur
| DXA | Todos los alumnos (103) | Varones (31) | Mujeres (72) | Valor de p |
| Columna lumbar (L2-L4) (g/cm2) | 1,026±0,116 | 1,025±0,999 | 1,026±0,124 | 0,968 |
| T-score | –0,1±0,8 | –0,1±1,2 | 0,935 | |
| Cuello femoral (g/cm2) | 0,886±0,127 | 0,936±0,124 | 0,863±0,122 | 0,007 |
| T-score | 0,1±1,1 | 0,2±1,1 | 0,557 | |
| Total de cadera (g/cm2) | 0,988±0,126 | 1,053±0,115 | 0,959±0,121 | 0,001 |
| T-score | 0,2±0,8 | 0,4±1,2 | 0,223 | |
| Trocánter (g/cm2) | 0,743±0,104 | 0,789±0,960 | 0,722±0,101 | 0,003 |
| T-score | 0,1±0,8 | 0,4±1,2 | 0,189 | |
| Intertrocánter (g/cm2) | 1,138±0,151 | 1,213±0,134 | 1,104±0,147 | 0,001 |
| T-score | 0,1±0,8 | 0,4±1,3 | 0,218 |
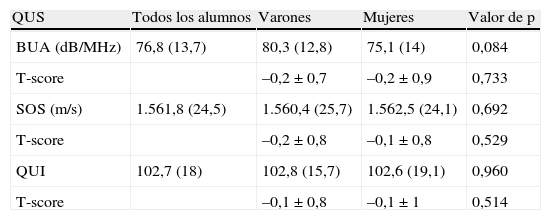
La tabla 6 muestra los parámetros ultrasonográficos medidos en el calcáneo. No se observaron diferencias estadísticamente significativas entre ambos sexos en ninguno de los parámetros estudiados: BUA, SOS y QUI.
Valores de ultrasonidos medidos en el calcáneo
| QUS | Todos los alumnos | Varones | Mujeres | Valor de p |
| BUA (dB/MHz) | 76,8 (13,7) | 80,3 (12,8) | 75,1 (14) | 0,084 |
| T-score | –0,2±0,7 | –0,2±0,9 | 0,733 | |
| SOS (m/s) | 1.561,8 (24,5) | 1.560,4 (25,7) | 1.562,5 (24,1) | 0,692 |
| T-score | –0,2±0,8 | –0,1±0,8 | 0,529 | |
| QUI | 102,7 (18) | 102,8 (15,7) | 102,6 (19,1) | 0,960 |
| T-score | –0,1±0,8 | –0,1±1 | 0,514 |
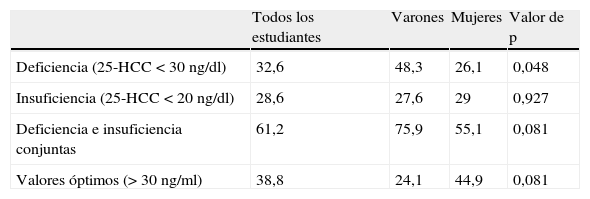
Finalmente, en la tabla 7 se muestra la prevalencia de insuficiencia y deficiencia de vitamina D en la población estudiada. El 48,3% de los varones y el 26,1% de las mujeres mostraron unos niveles de 25-HCC por debajo de 30 ng/ml y el 27,6% de los varones y el 29% de las mujeres presentaron unos niveles de 25-HCC inferiores a 20 ng/ml. Valorados conjuntamente, el 75,9% de los varones y el 55,1% de las mujeres presentaron insuficiencia o deficiencia de vitamina D y sólo el 24,1% de los varones y el 44,9% de las mujeres mostraron unos valores de 25-HCC superiores a 30 ng/ml.
Prevalencia de insuficiencia y deficiencia de vitamina D (%)
| Todos los estudiantes | Varones | Mujeres | Valor de p | |
| Deficiencia (25-HCC < 30 ng/dl) | 32,6 | 48,3 | 26,1 | 0,048 |
| Insuficiencia (25-HCC < 20 ng/dl) | 28,6 | 27,6 | 29 | 0,927 |
| Deficiencia e insuficiencia conjuntas | 61,2 | 75,9 | 55,1 | 0,081 |
| Valores óptimos (> 30 ng/ml) | 38,8 | 24,1 | 44,9 | 0,081 |
En condiciones normales, la vitamina D es sintetizada por la piel, que convierte el 7-dihidrocolesterol en previtamina D3, que es rápidamente convertida en vitamina D3. La vitamina D de la piel y la dieta es metabolizada en el hígado a 25-HCC que es el metabolito utilizado para valorar el estado de vitamina D en el organismo18,19.
Aunque no existe un consenso sobre cuáles son los niveles óptimos de 25-HCC, hoy en día se acepta la clasificación de deficiencia de vitamina D cuando los valores de 25-HCC son inferiores a 20 ng/ml20 e insuficiencia cuando las cifras de 25-HCC están por debajo de 30 ng/ml3,21.
Las personas que viven cerca del Ecuador, expuestas a la luz solar sin protección, habitualmente tienen unos niveles altos de 25-HCC, por encima de 30 ng/ml3. Sin embargo, incluso en las áreas más soleadas, la deficiencia de vitamina D es un hallazgo común, dado que es práctica habitual esconder la piel del sol. En estudios realizados en Arabia Saudí, Emiratos Árabes Unidos, Australia, India y Líbano, entre el 30 y el 50% de los niños y adultos tienen unos niveles de 25-HCC por debajo de 20 ng/ml22–25.
La deficiencia de vitamina D está considerada como una verdadera pandemia. Su principal causa es la falta de concienciación de que la exposición al sol es la principal fuente de vitamina D para la mayor parte de los seres humanos11 y entre las posibles consecuencias de su déficit se encuentran: osteoporosis, osteomalacia, algunas enfermedades autoinmunes, enfermedades cardiovasculares, enfermedades infecciosas y algunas formas de cáncer3,4,11.
Sorprendentemente, la deficiencia de vitamina D se encuentra de manera habitual en países que tienen abundante luz solar, como por ejemplo India o Emiratos Árabes. Esta paradoja puede explicarse por la existencia de una escasa actividad fuera de casa en las áreas urbanas26, la presencia de una piel oscura, la utilización de ropa que limita la exposición de la piel al sol27, una dieta pobre en calcio que condicionaría una deficiencia de calcio secundaria27,28 o la contaminación ambiental29.
Este mismo fenómeno se produce en España, un país que dispone de un gran número de horas de sol durante todo el año, pero que presenta elevadas tasas de hipovitaminosis D, tanto entre la población sana30, como entre los pacientes que sufren diferentes enfermedades31,32.
Las Islas Canarias están situadas geográficamente cerca de África, entre 27° 37’ y 29° 25’ de latitud Norte y 13° 20’ y 18° 10’ de longitud Oeste, y constituyen el territorio más meridional de España. Este estudio ha sido realizado en estudiantes de Medicina, sanos y jóvenes, con conocimientos de la fisiología de la vitamina D y de la necesidad de exposición solar para su síntesis.
Existen pocos estudios publicados sobre los niveles de vitamina D en las Islas Canarias. En un trabajo realizado en ancianos institucionalizados, los niveles de 25-HCC fueron de 20 ng/ml33. Por otra parte, comparando nuestros resultados con los publicados en poblaciones que podrían ser similares (jóvenes y sanos), un estudio efectuado en Hawai, en jóvenes surferos, mostró también una elevada prevalencia de insuficiencia de vitamina D. Los valores medios de 25-HCC fueron de 31,6 ng/ml, pero estableciendo el punto de corte en 30 ng/ml, hasta el 51% de esta población mostró niveles bajos de vitamina D34, cifras similares a las nuestras.
Hemos encontrado en la literatura algunos estudios realizados en médicos y estudiantes de Medicina. Así, en España se estudiaron los niveles de 25-HCC en un grupo de 116 médicos internos residentes (MIR) en el examen médico que se les realizó al comenzar sus residencias. Los valores medios de 25-HCC obtenidos fueron de 24,5 ± 6,9 ng/ml y hasta el 83,6% de estos médicos presentó valores de 25-HCC inferiores a 30 ng/ml35. En otro estudio efectuado en 35 MIR de Medicina Interna, el 51,4% de ellos mostró unos niveles de 25-HCC inferiores a 20 ng/ml35. En nuestro estudio, el 28,6% de los estudiantes tenía unos niveles de 25-HCC inferiores a 20 ng/ml, que es el valor que establece la presencia de deficiencia, y el 32,6% mostró que los valores obtenidos de este metabolito fueron inferiores a 30 ng/dl, que es el límite que establece la insuficiencia de vitamina D. No obtuvimos diferencias estadísticamente significativas entre los valores de vitamina D y tampoco en la prevalencia de insuficiencia y deficiencia de vitamina D entre ambos sexos.
Comparando los resultados obtenidos en la tabla 1, observamos que los varones tienen mayor talla y peso, y consecuentemente mayor IMC que las mujeres, siendo ambos grupos de edades similares, lo cual es un hecho sobradamente conocido y que creemos que no precisa comentario. Tampoco observamos diferencias estadísticamente significativas en la distribución de algunos estilos de vida, factores de riesgo para la osteoporosis y antecedentes personales y familiares, que se muestra en la tabla 2, con la excepción de un mayor consumo de café por parte de las mujeres sobre los varones. Si bien existen estudios publicados que sugieren una relación negativa entre el consumo de cafeína y los valores de DMO36, consideramos que en lo referente al nivel de vitamina D no existe tal relación. En cuanto a la distribución de los estilos de vida, la población estudiada era homogénea. Los resultados obtenidos en las tablas 3 y 4, en las que se recogen los valores bioquímicos generales (función renal, hepática, lípidos, glucosa, etc.), marcadores bioquímicos de remodelado óseo, las hormonas calciotropas (PTH, osteocalcina, FATR, PINP y beta-crosslaps), muestran diferencias estadísticamente significativas, pero sin relevancia clínica, puesto que los valores obtenidos en ambos grupos se encuentran dentro de los valores normales para cada uno de los parámetros analíticos, lo que creemos que nos permite establecer la normalidad de la población estudiada y la ausencia de patología que pudiera de alguna manera interferir en los resultados. Queremos dar el mismo significado a los resultados obtenidos sobre DMO, tanto por DXA como por ultrasonidos y que se muestran en las tablas 5 y 6.
En conclusión, presentamos en este estudio la existencia de una elevada prevalencia de hipovitaminosis D entre unos alumnos de Medicina, pese a que tienen conocimientos sobre la fisiología y necesidades de vitamina D y disponen de un elevado número de horas de sol, lo que nos hace plantearnos tres preguntas: primera, ¿de qué sirve disponer de las horas solares suficientes para sintetizar vitamina D si éstas no se aprovechan? Segunda, con nuestros actuales estilos de vida, con largos períodos en los interiores de los edificios, y con nuestra vestimenta occidental, ¿estamos en condiciones de sintetizar toda la vitamina D que necesitamos? Y por último, de acuerdo con lo anterior, ¿no sería necesaria la suplementación de algunos alimentos con vitamina D? Son preguntas que se responderán con más estudios sobre este campo.