INTRODUCCIÓN
Una vez se sospecha por los datos clínicos la presencia de acromegalia se debe proceder a la realización de diferentes pruebas que confirman su presencia. El diagnóstico de acromegalia se establece por la demostración de una secreción aumentada y autónoma de hormona de crecimiento (GH), para posteriormente confirmar, mediante técnicas de imagen, la presencia de un adenoma de hipófisis.
GH SÉRICA BASAL
La determinación aislada, al azar, de GH en el suero no es útil para el diagnóstico de acromegalia. En individuos sanos, las concentraciones séricas de GH se hallan al menos durante el 50% del día por debajo de 1 ng/ml y con frecuencia son incluso prácticamente indetectables (< 0, 1 ng/ml en ensayos ultrasensibles)1,2. Sin embargo, la secreción episódica de GH hace imposible la diferenciación entre sujetos sanos y con acromegalia3. En individuos normales, el ejercicio físico o incluso un aumento de secreción espontánea, sobre todo nocturno, pueden dar lugar a concentraciones de GH sérica por encima de 30 ng/ml4. La secreción de GH se encuentra influida por numerosos factores: ejercicio, estrés, sueño, ayuno, etc.; además, su vida media es de tan sólo unos 15 min4. En sujetos con acromegalia, la secreción también es episódica, aunque el número de pulsos durante el día está aumentado y las concentraciones entre ellos no disminuyen a valores indetectables5. Las concentraciones séricas de GH pueden oscilar desde 1 ng/ml hasta valores > 100 ng/ml6. En la acromegalia, aunque las concentracones de GH pueden hallarse en el rango normal, los pacientes se encuentran expuestos a concentraciones aumentadas de GH sérica de forma crónica5. Esta elevación mantenida de las concentraciones de GH es posiblemente la causa de gran parte de los signos y los síntomas de la acromegalia6.
Las concentraciones de GH sérica, además, pueden hallarse elevadas en la diabetes mellitus mal controlada, la hepatopatía o la malnutrición. Kaltsas et al7 calcularon la media de 5 determinaciones de GH sérica en pacientes con acromegalia y comprobaron que, aunque se correlacionaba con una determinación aislada al azar de GH, había amplias variaciones de un individuo a otro.
Los criterios de consenso sobre el diagnóstico de acromegalia establecidos en el año 2000 señalan que unas concentraciones séricas de GH basales o al azar < 0,4 ng/ml y de factor de crecimiento similar a la insulina tipo I (IGF-I) normales ajustadas a la edad y el sexo excluyen el diagnóstico8.
Pese al escaso o nulo valor de la determinación de GH al azar para el diagnóstico de acromegalia, puede ser de utilidad, por ejemplo, en pacientes con diabetes mellitus en los que la práctica de una sobrecarga oral de glucosa (SOG) no es aconsejable.
IGF-I SÉRICA
La producción del IGF-I se halla regulada por la GH. Muchos de los efectos endocrinos y paracrinos de la GH se producen a través de la acción de IGF-I9. La producción y la actividad de IGF-I se halla regulada también por una variedad de otros factores, tales como la insulina, el estado nutricional y las proteínas específicas de transporte de IGF-I (IGFBP)5,9,10. La generación de aproximadamente el 75-85% de IGF-I circulante resulta de la acción de GH sobre los receptores hepáticos9. Otros lugares de producción de IGF-I son el riñón, el tracto gastrointestinal, el músculo, el cartílago y la hipófisis9. La secreción de IGF-I, a diferencia de la GH, no es episódica5. Tan sólo un 1% de IGF-I circula de forma libre en la sangre; el resto se halla unido a las IGFBP9-11. Se han caracterizado 6 proteínas transportadoras, aunque circula unida principalmente a IGFBP-39. Esta proteína, junto con el IGF-I y otra proteína, la subunidad ácido-sensible (ALS), circulan formando un complejo ternario que se ensambla en la circulación posthepática9. Ambas proteínas se hallan bajo control de la GH9-11. La ALS se expresa en los hepatocitos, mientras que la IGFBP-3 se produce en las células epiteliales de los sinusoides hepáticos9-11. De igual forma, la GH actúa de forma directa sobre muchos otros tejidos, como el corazón, el hueso, el cartílago y el cerebro, y otros órganos donde también genera la producción de IGF-I y actúa de forma paracrina y autocrina como factor de crecimiento local5,9-11.
En la última década, el IGF-I sérico se ha convertido en el principal marcador de la actividad de la acromegalia y en la actualidad su determinación aislada es el parámetro de más utilidad en el diagnóstico de acromegalia6. Aunque para el diagnóstico de esta entidad su determinación se complementa con la realización de la prueba de frenación de GH después de la SOG, para muchos autores es una prueba ideal de cribado ante la sospecha de acromegalia. Se halla elevada en prácticamente la totalidad de los pacientes con acromegalia, salvo si hay procesos intercurrentes graves. Debido a su unión a proteínas de transporte, tiene una larga vida media (alrededor de 16-20 h) y refleja la acción tisular de la GH, aunque puede haber normalidad de IGF-I junto con alteraciones en la dinámica de GH5,9-11. A diferencia de la GH, las concentraciones séricas de IGF-I no fluctúan y se considera que son un reflejo de la secreción integrada de GH no influida como ésta por la ingesta, el ejercicio, el sueño, etc.9-11. El IGF-I se halla relacionada con la actividad de la enfermedad, de forma que la concentración sérica se correlaciona con diferentes parámetros clínicos, como el grosor del tejido subcutáneo del talón, y con la glucemia basal y tras la SOG12. Igualmente, en la acromegalia hay una correlación entre la concentración sérica media de GH a lo largo de 24 h y los valores séricos de IGF-I13.
En individuos normales, las concentraciones séricas de IGF-I son máximas durante la pubertad y descienden de forma paulatina con la edad. Para la interpretación de las concentraciones séricas de IGF-I es preciso disponer de los valores de referencia ajustados a la edad y el sexo propios de cada laboratorio, ya que los valores pueden diferir de forma muy importante de un laboratorio a otro9. Las diferencias en la determinación de IGF-I se exponen en la tabla 1. Los factores que influyen en la determinación de IGF-I derivan, en primer lugar, del tipo de ensayo utilizado (competitivo o tipo sándwich), así como del marcador utilizado (125I, enzimoinunoanálisis, luminiscencia) y de las variaciones intraensayo e interensayo. Anteriormente se cuantificaba el IGF-I total, sin extracción con inmunoanálisis convencionales (radioinmunoanálisis competitivo [RIA o IRMA] con anticuerpos frente a IGF-I). Ante un pH neutro, las IGFBP se unen rápidamente y con alta afinidad a IGF-I y pueden interferir en su determinación. En la década de los noventa se desarrollaron nuevos análisis para medir el IGF-I9. Se realizaba un primer paso con ácido (pH: 3) que permitía la rápida disociación del IGF-I de los complejos con las proteínas de unión. La adición posterior de etanol precipitaba las proteínas de alto peso molecular y los complejos proteínicos. Algunos de estos análisis, sin embargo, no conseguían una separación completa y dejaban unas proteínas de unión remanentes en el sobrenadante. Las IGFBP residuales (especialmente IGFBP-1 y 4) podían unirse al IGF-I e interferir en el siguiente paso de unión con el anticuerpo. En la actualidad, tras la separación con ácido de las IGFBP se añade IGF-2 en exceso a la muestra de plasma extraído. Las altas concentraciones de IGF-2 saturan las IGFBP y dan lugar a que prácticamente todas las proteínas de unión precipiten y desplacen el IGF-I de cualquier unión a las proteínas. De esta forma se consigue la total recuperación de IGF-I antes de añadir el anticuerpo. Este método exige un anticuerpo anti-IGF-I altamente específico, con escasa o nula reacción cruzada con el IGF-2. En el proceso siguiente, dado que ya hay IGF-2 en exceso, quedan moléculas de IGF-2 no unidas a proteínas en el sobrenadante9. Pese a estas mejoras, persiste una gran variabilidad intramétodo debida a los diversos métodos y a la especificidad del epítopo de los anticuerpos usados. Clemmons et al14 hallaron una variabilidad de hasta el 37% en las muestras de los mismos pacientes en diferentes días cuando utilizaban el mismo análisis. Además de estos problemas metodológicos, otras situaciones pueden interferir en las concentraciones de IGF-I circulantes, como el ayuno, el estado nutricional, el embarazo, la enfermedad intercurrente, la hepatopatía o la enfermedad renal9-11,14.
En la acromegalia, el aumento de las concentraciones séricas de IGF-I es con frecuencia mucho mayor que el valor de GH sérico como consecuencia de la gran fluctuación de la secreción de GH; además, la GH no sólo estimula la secreción de IGF-I, sino también la de IGFBP-3. Ante concentraciones séricas de GH muy elevadas, los valores séricos de IGF-I alcanzan un plateau12,13.
La producción de IGF-I se encuentra influida por diferentes factores que conviene tener presentes para la correcta interpretación de sus concentraciones séricas9-11,15-17:
1. Edad. Hay un pico en la pubertad con una progresiva disminución con la edad. Se produce una disminución cercana al 10-15% en su concentración en cada década. La amplia variación de las concentraciones séricas de IGF-I en los diferentes estudios se debe, además de a los diferentes métodos empleados para su determinación, a la inclusión de grupos de individuos con distintas edades18.
2. Hormonas sexuales. Se observan diferencias en las concentraciones séricas de IGF-I en función del sexo. Para un valor dado de GH se encuentran unos valores de IGF-I superiores en varones respecto a mujeres19. Como es sabido, las mujeres sanas secretan mayores cantidades de GH para conseguir valores similares de IGF-I19. Asimismo, los estrógenos orales disminuyen las concentraciones séricas de IGF-I y las mujeres posmenopáusicas tienen valores séricos de IGF-I significativamente inferiores a los de las premenopáusicas. Por el contrario, la administración de testosterona puede aumentar las concentraciones séricas de IGF-I.
3. Enfermedades intercurrentes. La gravedad de la enfermedad hepática se correlaciona negativamente con las concentraciones séricas de IGF-I. De igual forma, el alcoholismo da lugar a una disminución de la producción de IGF-I y su biodisponibilidad. En la insuficiencia renal, aunque no hay una disminución significativa de los valores de IGF-I, sí se produce una acumulacion de sus proteínas de transporte, especialmente IGFBP-3, con lo que se reduce la actividad biológica de IGF-I20.
GH SÉRICA DESPUÉS DE LA SOBRECARGA ORAL DE GLUCOSA
Clásicamente, constituye la prueba que confirma el diagnóstico de acromegalia. La administración de 75 g de glucosa da lugar a la supresión, dentro de las 2 h posteriores, de los valores séricos de GH por debajo de 1 ng/ml en individuos sanos, alcanzando con frecuencia valores indetectables. En pacientes con acromegalia ocurre una ausencia de supresión por debajo de dichos valores y a menudo hay incluso una respuesta paradójica, con un incremento de las concentraciones séricas de GH. La práctica de esta prueba no es obligada si los datos clínicos se acompañan de concentraciones séricas elevadas de IGF-I, estableciéndose de forma inequívoca el diagnóstico de acromegalia.
Con los métodos de radioinmunoanálisis clásicos, las concentraciones séricas de GH tras la administración de 75 g de glucosa eran < 2 ng/ml; sin embargo, en los últimos años, con el advenimiento de los nuevos ensayos inmunorradiométricos de GH con anticuerpos monoclonales para GH mucho más sensibles, se consideran normales valores < 1 ng/ml8. Incluso con ensayos de quimioluminiscencia mucho más sensibles que detectan concentraciones de GH sérica tan bajas como 0,002 ng/ml, el umbral se ha ido reduciendo hasta preconizar incluso un nadir < 0, 17 ng/ml (tabla 2). En la actualidad, numerosos autores postulan un punto de corte de 0,25 ng/ml; los valores por debajo de esta cifra junto con concentraciones séricas de IGF-I excluyen el diagnóstico de acromegalia21,22.
En estudios recientes se indica que, ocasionalmente, pacientes con valores de GH tan bajos como 0,037 ng/ml pueden presentar signos y síntomas de acromegalia y valores séricos elevados de IGF-I21. Es previsible que, en los próximos años, los criterios diagnósticos de acromegalia sean de nuevo redefindos23.
Pese a que esta prueba virtualmente confirma el diagnóstico de acromegalia, algunas situaciones clínicas, como la insuficiencia renal crónica, la hepatopatía, la desnutrición, la diabetes mellitus, la adicción a la heroína o incluso la etapa adolescente (debido a los picos puberales de GH) pueden dar lugar a falsos positivos.
A efectos prácticos, un valor de GH sérica < 1 ng/ml prácticamente excluye el diagnóstico de acromegalia. Sin embargo, varios autores han descrito a pacientes con acromegalia activa, concentraciones séricas de IGF-I elevadas y valores de GH por debajo de 1 ng/ml (tras SOG)21,24. Estos autores consideran que, en estos pacientes, unas concentraciones séricas de GH disminuidas dan lugar a una activación de los receptores de GH con valores séricos elevados de IGF-I y datos clínicos de exceso de GH21.
SECRECIÓN INTEGRADA DE GH SÉRICA DURANTE 24 H
Se efectúa una extracción de sangre para determinación de GH cada 10-20 min durante 24 h. Permite distinguir con claridad entre sujetos normales y afectados de acromegalia. Las concentraciones séricas integradas < 2,5 ng/ml excluyen la presencia de acromegalia8. La prueba es compleja y laboriosa, y en la práctica no se recomienda.
OTROS MARCADORES DE LA ACCIÓN DE GH
Las concentraciones séricas de IGFBP-3 se correlacionan con los valores séricos de IGF-I, por lo que algunos autores han preconizado su determinación, tanto para el diagnóstico como para el seguimiento de pacientes con acromegalia. Como es sabido, IGFBP-3 es mejor marcador bioquímico de la deficiencia de GH en la infancia que IGF-I. Sin embargo, en edades más tardías, IGFBP-3 tiene una utilidad mucho más limitada que el IGF-I en los trastornos de la GH, ya que hay un solapamiento entre los pacientes con acromegalia y los individuos normales25. La determinación de ASL podría sustituir a la determinación de IGF-I, pero en la actualidad se dispone de pocos ensayos que cuantifiquen esta proteína y no se ha demostrado de forma convincente su superioridad sobre la determinación de IGF-I.
GH sérica después de hormona liberadora de tirotropina (TRH)
La administración intravenosa de 200-500 µg de TRH no produce respuesta de GH en los individuos normales. Sin embargo, en el 50-80% de los pacientes con acromegalia hay una respuesta paradójica con un incremento a los 20-30 min de más del 50% del valor basal. En la actualidad, esta prueba se considera obsoleta y no añade más información a las otras pruebas efectuadas para el diagnóstico de acromegalia5.
DETERMINACIÓN DE LA HORMONA LIBERADORA DE GH SÉRICA (GH-RH)
Aproximadamente, en menos del 0,5% de los casos la acromegalia se produce por un tumor productor de hormona liberadora de GH (GH-RH). Se debe determinar la concentración sérica de esta hormona en los casos en los que tras el establecimiento del diagnóstico de acromegalia no se demuestra la presencia de un tumor en la hipófisis, o bien la histología de la hipófisis revela la presencia de una hiperplasia de células somatotropas. Junto con su determinación se deberán efectuar otras pruebas de localización del posible tumor (tomografía computarizada de tórax y abdomen, etc.), habitualmente tumor carcinoide de pulmón o de páncreas productor de GH-RH5,6.
DIAGNÓSTICO MORFOLÓGICO
Tras establecer el diagnóstico bioquímico de acromegalia, la resonancia magnética (RM) de la región hipotálamo-hipofisaria permite detectar y caracterizar un tumor hipofisario productor de GH, que aparece en el 95% de los casos. Con esta técnica se pueden detectar tumores incluso de 2 mm de diámetro. En alrededor del 75% de los casos el tumor es una macroadenoma (¾ 10 mm) y con frecuencia hay extensión paraselar o supraselar. En ocasiones el paciente presenta una silla turca parcialmente vacía y el tumor adopta una forma laminar en el fondo selar. La resonancia magnética (RM) es útil, igualmente, en la valoración de la compresión quiasmática, la invasión del seno cavernoso y la extensión del crecimiento extraselar.
Aunque los adenomas somatotropos captan el análogo de la somatostatina 111In-pentreóctrido, no se aconseja la práctica de la gammagrafía, ya que no añade más información a la aportada por la RM26,27.
La secreción ectópica de GH-RH aparece en el 0,5% de los casos de acromegalia. El marcador más útil es la determinación de GH-RH en el suero. La RM hipofisaria aparece normal, aumentada de tamaño o, en ocasiones, simula la presencia de un adenoma. La concentración sérica de GH-RH se determinará en las situaciones en las que no haya una imagen tumoral hipofisaria, y en el estado postoperatorio, si el examen histológico hipofisario muestra una hiperplasia de células somatotropas.
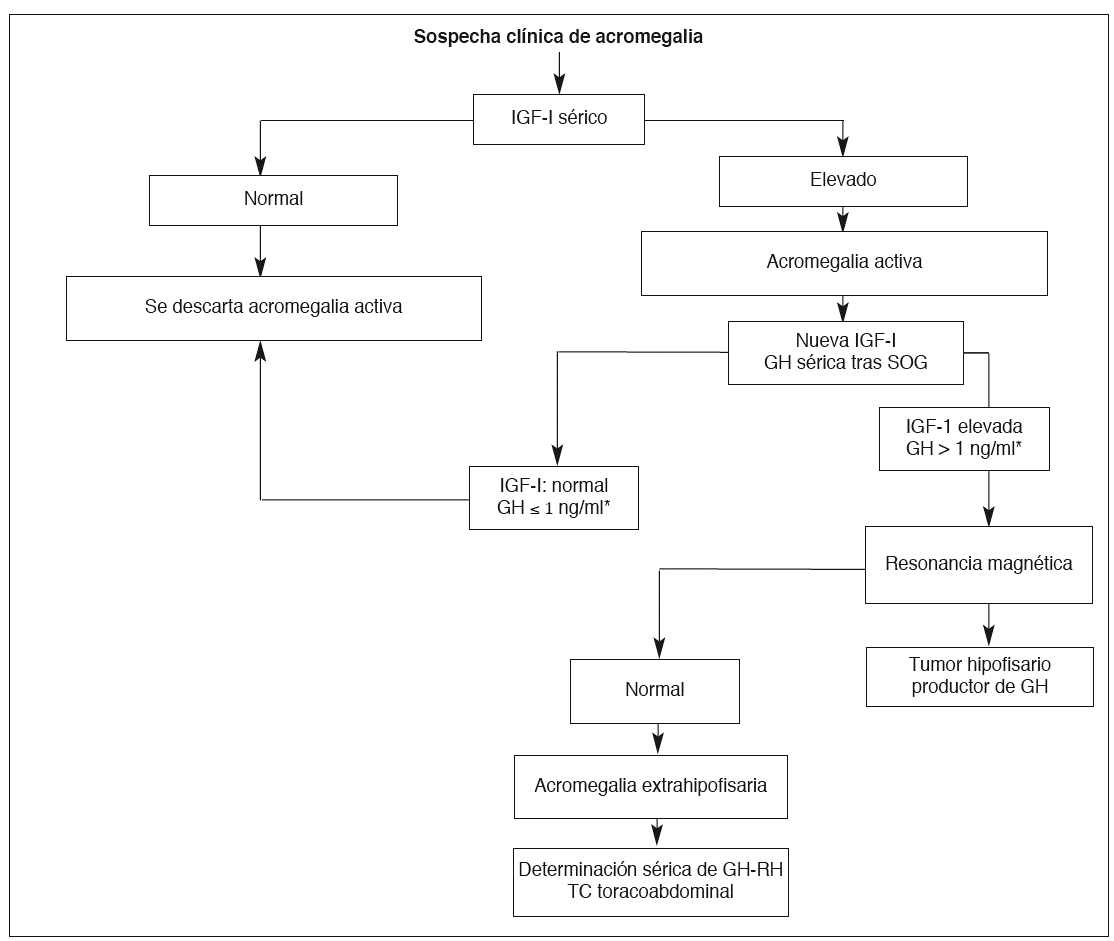
En la figura 1 se describe el algoritmo diagnóstico de la acromegalia ante la sospecha clínica28.
Fig. 1. Algoritmo diagnóstico de la acromegalia. SOG: sobrecarga oral de glucosa; TC: tomografía computarizada. *Con métodos inmunorradiométricos o de quimioluminiscencia. (Modificada de Lucas et al28.)