Evaluar si el hipotiroidismo subclínico se acompaña de elevaciones de las concentraciones de colesterol y triglicéridos en pacientes con diabetes tipo 2.
Pacientes y métodosDe un total de 1.112 pacientes diabéticos sometidos a cribado de disfunción tiroidea (determinación de tirotropina), seleccionamos un grupo de 325 pacientes eutiroideos y otro de 29 pacientes con hipotiroidismo subclínico. Ningún paciente presentaba dislipidemia conocida o tratamiento hipolipidemiante.
ResultadosLos pacientes con hipotiroidismo subclínico presentaron unas concentraciones séricas de colesterol (4,88±0,74mmol/l), colesterol-HDL (1,37±0,34mmol/l), colesterol-LDL (2,94±0,58mmol/l) y triglicéridos (1,05 [0,88-1,41] mmol/l) que no difirieron significativamente de las encontradas en los pacientes eutiroideos (4,79±0,83, 1,33±0,36, 2,87±0,76 y 1,11 [0,81-1,43] mmol/l, respectivamente). El análisis de regresión múltiple no mostró una asociación entre los valores de TSH y las concentraciones de lípidos séricos.
ConclusiónEstos resultados evidencian que, en nuestra población, no existen diferencias en las concentraciones de colesterol y triglicéridos entre los pacientes diabéticos tipo 2 con función tiroidea normal o disminuida.
To assess whether subclinical hypothyroidism is associated to elevations in serum cholesterol and triglyceride levels in patients with type 2 diabetes.
Patients and methodsFrom a total population of 1,112 patients with type 2 diabetes screened for thyroid dysfunction (thyrotropin measurement), a group of 325 patients with normal thyroid function and another group of 29 patients with subclinical hypothyroidism were selected. No patient had known dyslipidemia or was taking lipid lowering medication.
ResultsPatients with subclinical hypothyroidism had serum levels of total cholesterol (4.88±0.74mmol/L), HDL cholesterol (1.37±0.34mmol/L), LDL cholesterol (2.94±0.58mmol/L), and triglycerides (1.05 [0.88-1.41] mmol/L) that did not significantly differ from those found in euthyroid patients (4.79±0.83, 1.33±0.36, 2.87±0.76, and 1.11 [0.81-1.43] mmol/L, respectively). Multiple regression analysis showed no association between TSH and serum lipid levels.
ConclusionThese results suggest that, in our population, there are no significant differences in serum cholesterol and triglyceride levels between diabetic patients with normal and reduced thyroid function.
La elevación de la concentración de tirotropina (TSH) sérica, en presencia de concentraciones normales de hormonas tiroideas circulantes, define la situación de insuficiencia tiroidea leve conocida como hipotiroidismo subclínico1. La prevalencia de este trastorno hormonal es elevada en la población general, especialmente en mujeres de edad avanzada2. Recientemente hemos demostrado que los pacientes con diabetes tipo 2 de nuestro medio presentan un riesgo incrementado de hipotiroidismo en ambos sexos3, y un riesgo incrementado de hipertiroidismo subclínico en mujeres4.
Aunque el hipotiroidismo franco se acompaña de una elevación del colesterol sérico5, la asociación entre hipotiroidismo subclínico y dislipidemia es controvertida6. Algunos autores han descrito un aumento de las concentraciones de colesterol ligado a lipoproteínas de densidad baja (LDL)7,8, lo que estaría en relación con un posible incremento del riesgo cardiovascular en pacientes con hipotiroidismo subclínico. Sin embargo, otros estudios han mostrado diferencias no significativas en las concentraciones de lípidos entre sujetos eutiroideos y pacientes con hipotiroidismo subclínico9,10.
El hipotiroidismo subclínico y la dislipidemia son 2 factores que pueden actuar sinérgicamente en la elevación del riesgo cardiovascular de los pacientes con diabetes tipo 2. Por ello tiene interés analizar si la presencia de hipotiroidismo subclínico se acompaña de alteraciones relevantes del perfil lipídico. Nuestro objetivo ha sido evaluar si el hipotiroidismo ligero detectado en un programa de cribado de disfunción tiroidea se acompaña de elevaciones de las concentraciones de colesterol y triglicéridos en pacientes con diabetes tipo 2. Para ello hemos comparado los valores lipídicos en pacientes diabéticos hipotiroideos con los observados en pacientes diabéticos sin el diagnóstico previo de hiperlipidemia y con función tiroidea normal.
Pacientes y métodosDiseño del estudioSe diseñó un estudio transversal que incluyó todos los pacientes eutiroideos e hipotiroideos hallados en un programa de cribado de función tiroidea desarrollado durante 2004-2010 en nuestro centro3,4. Todos los pacientes habían sido diagnosticados de diabetes tipo 2 según los criterios de la American Diabetes Association11, y se estudiaron de forma ambulatoria. Se excluyeron pacientes con enfermedad aguda reciente y en tratamiento con fármacos con capacidad de alterar la función tiroidea. El estudio fue aprobado por el Comité Ético local, y los pacientes dieron su consentimiento informado antes de la extracción sanguínea.
Se registraron datos demográficos y antropométricos, duración de la diabetes, presencia de bocio, hipertensión arterial, hiperlipidemia, complicaciones microvasculares y macrovasculares de la diabetes, tratamiento antidiabético utilizado (dieta, antidiabéticos orales, insulina), así como datos analíticos (glucosa, colesterol, triglicéridos y hemoglobina A1c). En todos los pacientes sin enfermedad tiroidea previamente conocida se determinó la concentración sérica de TSH. Cuando era superior a 5mU/l se midió también la concentración de T4 libre. El estado autoinmune se evaluó mediante la cuantificación de los niveles de anticuerpos antiperoxidasa tiroidea y antitiroglobulina. Se consideró que la autoinmunidad tiroidea era negativa cuando ambos autoanticuerpos eran negativos, y positiva cuando uno de los 2 lo era.
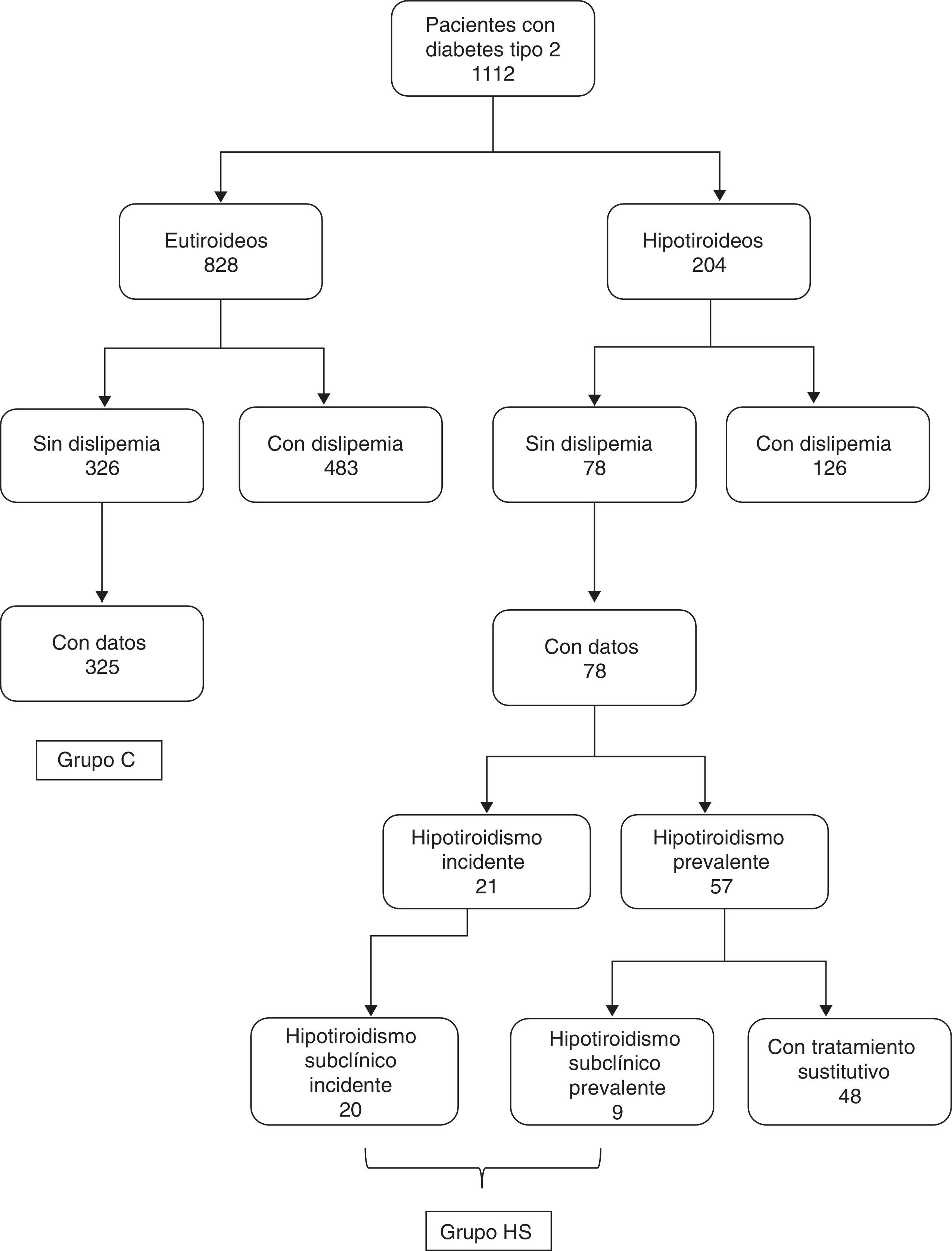
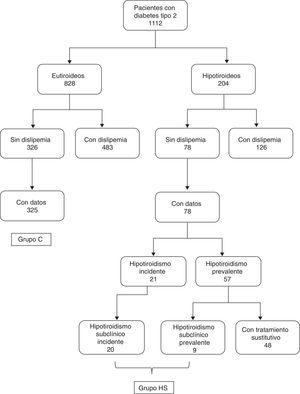
PacientesDe los 1.112 pacientes estudiados, había 828 eutiroideos y 204 hipotiroideos3 (fig. 1). El hipotiroidismo subclínico se definió por la presencia de una concentración de TSH superior a 5mU/l con T4 libre normal, mientras que el hipotiroidismo franco requería la presencia de un valor de TSH superior a 5mU/l junto con T4 libre inferior a 9pmol/l.
En el grupo de 828 diabéticos eutiroideos, 483 pacientes presentaban el diagnóstico previo de hiperlipidemia, mientras que 326 pacientes no tenían hiperlipidemia previamente conocida (en 19 pacientes carecíamos de información sobre el diagnóstico de hiperlipidemia previa). Los datos de perfil lipídico (al menos colesterol y triglicéridos) estaban disponibles en 325 de los 326 pacientes sin hiperlipidemia. El grupo control (grupo C) estaba formado por estos 325 pacientes (164 hombres y 161 mujeres, con una edad media de 65,2±13,4 años).
En el grupo de 204 pacientes diabéticos hipotiroideos había 126 con el diagnóstico previo de hiperlipidemia y 78 sin este diagnóstico. En este último grupo había 57 pacientes con hipotiroidismo prevalente (con un tiempo de evolución de la enfermedad de 5 [3-12,8] años) y 21 con hipotiroidismo incidente (detectado en el cribado). De estos 21 pacientes hipotiroideos, uno presentaba hipotiroidismo franco, y los 20 restantes, hipotiroidismo subclínico. En el grupo de 57 pacientes con hipotiroidismo prevalente, 48 seguían tratamiento con levotiroxina y 9 no tomaban tratamiento sustitutivo por presentar hipotiroidismo subclínico ligero. Dado que el objetivo primario de nuestro estudio era analizar las diferencias entre pacientes eutiroideos y pacientes con hipotiroidismo subclínico, comparamos los datos del grupo C (pacientes controles eutiroideos) con los del grupo de pacientes con hipotiroidismo subclínico, ya fuera este incidente o prevalente. Este último (grupo HS) estaba formado por los 20 pacientes con hipotiroidismo subclínico incidente y los 9 con hipotiroidismo subclínico prevalente sin tratamiento (fig. 1).
Determinaciones analíticasPara las determinaciones analíticas se obtuvieron muestras sanguíneas en situación basal entre las 08:00 y las 09:00 horas. Las concentraciones de TSH y de T4 libre se cuantificaron mediante un ensayo inmunoquimioluminiscente comercial (Immulite®, Diagnostic Products Corporation, Los Ángeles, CA, EE. UU.). La sensibilidad del ensayo de TSH fue de 0,004mU/l. Los coeficientes de variación intraensayo e interensayo fueron menores del 10%. Los valores normales de TSH fueron 0,4-5,0mU/l.
La cuantificación de glucosa, colesterol total, colesterol unido a lipoproteínas de densidad alta (HDL) y triglicéridos se llevó a cabo mediante un analizador multicanal Architect ci8200 (Abbot Diagnostics, Berkshire, Reino Unido). La concentración de colesterol-LDL se calculó mediante la fórmula de Friedewald [colesterol-LDL=colesterol total−colesterol-HDL−(triglicéridos/5)], siempre y cuando estuviera disponible la concentración de colesterol-HDL y el paciente tuviera una concentración de triglicéridos inferior a 4,52mmol/l. La hemoglobina A1c se determinó mediante cromatografía líquida de alta resolución (Diamat, Bio-Rad, Viena, Austria) empleando un autoanalizador Merk-Hitachi modelo L9100. Los anticuerpos antiperoxidasa tiroidea y antitiroglobulina se cuantificaron mediante un inmunoanálisis quimioluminiscente (Immulite® Thyroid Autoantibodies, Siemens Medical Solutions Diagnostic Ltd., Llanberis, Gwynedd, Reino Unido). Se consideró positivo un título superior a 100U/ml para los anticuerpos antiperoxidasa tiroidea y a 340U/ml para los antitiroglobulina.
Análisis estadísticoLos resultados se expresan como media±desviación típica para variables normales y como mediana (recorrido intercuartílico) para las no paramétricas. El ajuste a una distribución normal se comprobó mediante la prueba de Kolmogorov. Las variables cualitativas se describen como proporciones o porcentajes. Para la comparación de medias entre los 2 grupos de pacientes se empleó el test de la t de Student para datos normales y el de Mann-Whitney para variables no paramétricas. Para comparar proporciones utilizamos la prueba de chi-cuadrado y la prueba exacta de Fisher. Para analizar la relación entre los valores de función tiroidea y el perfil lipídico en diferentes grupos de pacientes se utilizó el análisis de regresión simple y múltiple. Todas las pruebas estadísticas fueron bilaterales, y las diferencias se consideraron significativas cuando p<0,05.
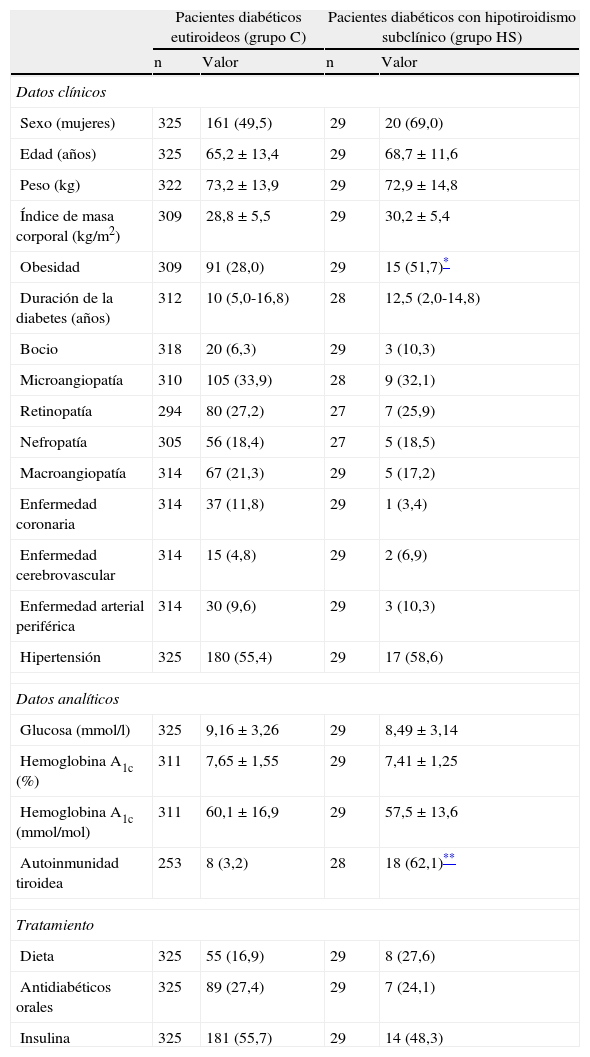
ResultadosPerfil lipídico en pacientes con hipotiroidismo subclínicoNo encontramos diferencias significativas entre el grupo C y el grupo HS en lo que se refiere a edad, duración de la diabetes, presencia de bocio, complicaciones crónicas de la diabetes o valores de glucosa basal y hemoglobina A1c. El tratamiento antidiabético empleado era también similar entre ambos grupos. Los pacientes con hipotiroidismo subclínico presentaban una mayor proporción de personas obesas. La autoinmunidad tiroidea positiva era también más frecuente entre los pacientes hipotiroideos (tabla 1).
Características clínicas y analíticas de los pacientes diabéticos eutiroideos y de los pacientes diabéticos con hipotiroidismo subclínico (incidente y prevalente)
| Pacientes diabéticos eutiroideos (grupo C) | Pacientes diabéticos con hipotiroidismo subclínico (grupo HS) | |||
| n | Valor | n | Valor | |
| Datos clínicos | ||||
| Sexo (mujeres) | 325 | 161 (49,5) | 29 | 20 (69,0) |
| Edad (años) | 325 | 65,2±13,4 | 29 | 68,7±11,6 |
| Peso (kg) | 322 | 73,2±13,9 | 29 | 72,9±14,8 |
| Índice de masa corporal (kg/m2) | 309 | 28,8±5,5 | 29 | 30,2±5,4 |
| Obesidad | 309 | 91 (28,0) | 29 | 15 (51,7)* |
| Duración de la diabetes (años) | 312 | 10 (5,0-16,8) | 28 | 12,5 (2,0-14,8) |
| Bocio | 318 | 20 (6,3) | 29 | 3 (10,3) |
| Microangiopatía | 310 | 105 (33,9) | 28 | 9 (32,1) |
| Retinopatía | 294 | 80 (27,2) | 27 | 7 (25,9) |
| Nefropatía | 305 | 56 (18,4) | 27 | 5 (18,5) |
| Macroangiopatía | 314 | 67 (21,3) | 29 | 5 (17,2) |
| Enfermedad coronaria | 314 | 37 (11,8) | 29 | 1 (3,4) |
| Enfermedad cerebrovascular | 314 | 15 (4,8) | 29 | 2 (6,9) |
| Enfermedad arterial periférica | 314 | 30 (9,6) | 29 | 3 (10,3) |
| Hipertensión | 325 | 180 (55,4) | 29 | 17 (58,6) |
| Datos analíticos | ||||
| Glucosa (mmol/l) | 325 | 9,16±3,26 | 29 | 8,49±3,14 |
| Hemoglobina A1c (%) | 311 | 7,65±1,55 | 29 | 7,41±1,25 |
| Hemoglobina A1c (mmol/mol) | 311 | 60,1±16,9 | 29 | 57,5±13,6 |
| Autoinmunidad tiroidea | 253 | 8 (3,2) | 28 | 18 (62,1)** |
| Tratamiento | ||||
| Dieta | 325 | 55 (16,9) | 29 | 8 (27,6) |
| Antidiabéticos orales | 325 | 89 (27,4) | 29 | 7 (24,1) |
| Insulina | 325 | 181 (55,7) | 29 | 14 (48,3) |
Los datos representan el número de pacientes (porcentaje), la media±desviación típica para datos normales, y la mediana (recorrido intercuartílico) para datos no paramétricos. El número de pacientes empleado para calcular el valor de medias, medianas y porcentajes se indica mediante n.
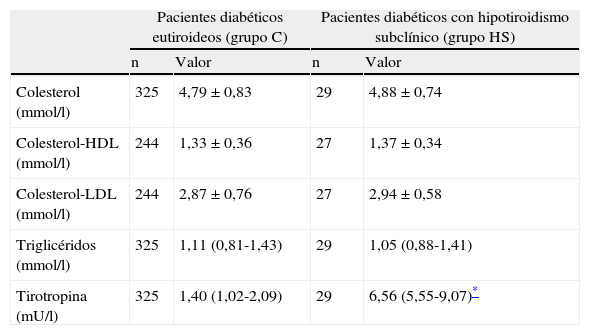
Los pacientes con hipotiroidismo subclínico presentaron unas concentraciones séricas de colesterol, colesterol-HDL, colesterol-LDL y triglicéridos que no difirieron significativamente de las encontradas en los pacientes eutiroideos (tabla 2). Cuando se analizaron los valores lipídicos en los subgrupos de pacientes con hipotiroidismo subclínico incidente y prevalente, así como en los subgrupos de mujeres y de pacientes con obesidad, tampoco se encontraron diferencias significativas con respecto a los valores de pacientes eutiroideos (datos no mostrados).
Perfil lipídico y valores de tirotropina en pacientes diabéticos con hipotiroidismo subclínico en comparación con pacientes diabéticos eutiroideos
| Pacientes diabéticos eutiroideos (grupo C) | Pacientes diabéticos con hipotiroidismo subclínico (grupo HS) | |||
| n | Valor | n | Valor | |
| Colesterol (mmol/l) | 325 | 4,79±0,83 | 29 | 4,88±0,74 |
| Colesterol-HDL (mmol/l) | 244 | 1,33±0,36 | 27 | 1,37±0,34 |
| Colesterol-LDL (mmol/l) | 244 | 2,87±0,76 | 27 | 2,94±0,58 |
| Triglicéridos (mmol/l) | 325 | 1,11 (0,81-1,43) | 29 | 1,05 (0,88-1,41) |
| Tirotropina (mU/l) | 325 | 1,40 (1,02-2,09) | 29 | 6,56 (5,55-9,07)* |
Datos expresados como media±desviación típica o mediana (recorrido intercuartílico). El número de pacientes empleado para calcular estos valores en cada grupo se indica mediante n.
En el análisis de regresión simple no hubo correlación lineal de los valores de TSH y T4 libre con las concentraciones lipídicas en los pacientes con hipotiroidismo subclínico. En los pacientes eutiroideos encontramos una correlación significativa entre la concentración de TSH y la de triglicéridos (rho=0,165; p=0,003).
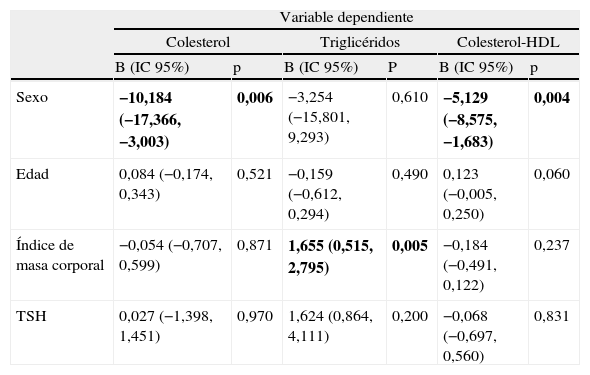
Se realizó un análisis de regresión múltiple para estudiar si existía asociación entre la función tiroidea, representada por la concentración de TSH, y los lípidos plasmáticos en el conjunto de pacientes diabéticos estudiados. Cuando se consideraron como variables independientes la edad, el sexo, el índice de masa corporal y la TSH, se encontró una asociación significativa entre el sexo y el colesterol total y el colesterol-HDL, así como entre el índice de masa corporal y los triglicéridos, pero no se encontró asociación entre TSH y los valores de lípidos séricos (tabla 3). En un segundo modelo en el que el valor de TSH se sustituyó por el grupo al que pertenecía el paciente (grupo C o grupo HS), los resultados fueron muy similares (datos no mostrados).
Análisis de regresión múltiple para estudiar la relación entre los lípidos plasmáticos y la concentración de tirotropina en los pacientes diabéticos estudiados
| Variable dependiente | ||||||
| Colesterol | Triglicéridos | Colesterol-HDL | ||||
| B (IC 95%) | p | B (IC 95%) | P | B (IC 95%) | p | |
| Sexo | −10,184 (−17,366, −3,003) | 0,006 | −3,254 (−15,801, 9,293) | 0,610 | −5,129 (−8,575, −1,683) | 0,004 |
| Edad | 0,084 (−0,174, 0,343) | 0,521 | −0,159 (−0,612, 0,294) | 0,490 | 0,123 (−0,005, 0,250) | 0,060 |
| Índice de masa corporal | −0,054 (−0,707, 0,599) | 0,871 | 1,655 (0,515, 2,795) | 0,005 | −0,184 (−0,491, 0,122) | 0,237 |
| TSH | 0,027 (−1,398, 1,451) | 0,970 | 1,624 (0,864, 4,111) | 0,200 | −0,068 (−0,697, 0,560) | 0,831 |
Los valores estadísticamente significativos aparecen resaltados en negrita.
El desarrollo de un programa de cribado de disfunción tiroidea en nuestra población con diabetes tipo 2 nos ha brindado la oportunidad de comparar un grupo de 29 diabéticos con hipotiroidismo subclínico no tratado con un amplio grupo de diabéticos eutiroideos extraídos de la misma población. Nuestros resultados muestran que las concentraciones de colesterol y triglicéridos en los pacientes diabéticos hipotiroideos no difieren de forma significativa de los mismos valores hallados en diabéticos con función tiroidea normal. En ambos grupos se excluyeron los pacientes que tenían diagnóstico previo de dislipidemia y que, por tanto, seguían un tratamiento para esta alteración metabólica.
Algunos estudios poblacionales recientes han mostrado elevaciones de colesterol total y colesterol-LDL, generalmente modestas, en pacientes con hipotiroidismo subclínico en comparación con eutiroideos12–14, mientras que otros solo encuentran elevación de cifras lipídicas en mujeres15. Nuestros resultados son coherentes con un amplio grupo de estudios que han mostrado diferencias no significativas en las concentraciones de lípidos entre sujetos eutiroideos y pacientes con hipotiroidismo subclínico, extraídos de la población general9,10,16–18. Un estudio observacional, específicamente dirigido al estudio del perfil lipídico de pacientes hipotiroideos y que incluyó 4.886 sujetos eutiroideos y 1.055 con hipotiroidismo subclínico, no encontró diferencias significativas entre ambos grupos en las concentraciones de colesterol total, colesterol-LDL, colesterol-HDL y triglicéridos19. Un análisis en profundidad de los datos procedentes de más de 8.000 sujetos evaluados en el Third National Health and Nutritional Examination Survey mostró que el hipotiroidismo subclínico en la población general americana no se relacionaba con elevaciones de colesterol total, colesterol-LDL o triglicéridos, ni con descensos de colesterol-HDL20.
Así como en la literatura abundan estudios de alta calidad en población general, no hemos encontrado estudios amplios que comparen los valores lipídicos en pacientes diabéticos con hipotiroidismo subclínico y normofunción tiroidea. Wang et al.21 encontraron que la prevalencia de cifras elevadas de colesterol total y colesterol-LDL, o reducidas de colesterol-HDL, fue superior en mujeres diabéticas que presentaban hipotiroidismo subclínico en comparación con las eutiroideas, pero este estudio seleccionó solo mujeres mayores con dislipidemia mal controlada. En un estudio previo, realizado en una cohorte de pacientes distinta de la que ahora hemos estudiado, encontramos que la presencia de disfunción tiroidea no se relacionó con las complicaciones de la diabetes, incluida la hiperlipidemia22.
Un estudio reciente ha encontrado una correlación positiva entre TSH y concentraciones lipídicas en una cohorte de pacientes con diversos grados de disfunción tiroidea, si bien los datos indican que una ligera elevación de TSH solo ejerce una influencia marginal en el perfil lipídico23. Nuestro análisis de regresión no mostró relación entre los valores de TSH y las concentraciones de lípidos séricos en los pacientes diabéticos hipotiroideos. Sin embargo, sí hallamos una correlación lineal positiva entre TSH y triglicéridos en la muestra de sujetos eutiroideos. Esta correlación, posiblemente dependiente del índice de masa corporal, no se apreció en el análisis de regresión múltiple. Un hallazgo similar fue observado en las mujeres del estudio de Tromsø, un análisis epidemiológico de 5.143 sujetos de la población general15.
Los mecanismos que relacionan la función tiroidea con las concentraciones lipídicas en diabéticos son complejos. Algunos estudios evidencian que las conocidas asociaciones entre dislipidemia e hipotiroidismo franco podrían incluso ser válidas en sujetos con TSH dentro del intervalo de referencia24,25. Chubb et al.24 demostraron asociaciones significativas entre TSH y lípidos séricos en mujeres eutiroideas con diabetes tipo 2 que estaban presentes en pacientes con resistencia a la insulina, pero ausentes en aquellos con mayor sensibilidad a la insulina. Incluso en diabéticos tipo 1 se ha demostrado recientemente que la TSH se asocia al colesterol-LDL solo en los pacientes con menor sensibilidad a la insulina26. Es decir, la interacción entre la función tiroidea y la resistencia a la insulina podría desempeñar un papel importante en la génesis de la dislipidemia diabética.
Nuestro trabajo tiene las limitaciones propias de un estudio de cribado que no fue inicialmente diseñado para la valoración de las concentraciones lipídicas en pacientes con disfunción tiroidea. Por esta razón, en algunos pacientes no disponíamos de la concentración de colesterol-HDL. La muestra de 29 pacientes con hipotiroidismo subclínico puede parecer pequeña a priori. Sin embargo, en el momento actual, no parece sencillo conseguir de forma prospectiva una muestra amplia de pacientes diabéticos tipo 2 libres de tratamiento con hipolipidemiantes y que presenten disfunción tiroidea ligera sin tratamiento sustitutivo, junto con otra muestra comparable de diabéticos eutiroideos. Aunque nuestro análisis no puede tener el mismo valor que un análisis prospectivo, permite soslayar las grandes dificultades de este último. La muestra de 325 pacientes eutiroideos que nos sirvió de grupo control no difirió significativamente de la muestra estudiada más que en una mayor proporción de personas obesas. No obstante, el análisis por subgrupos también mostró la ausencia de diferencias significativas en los valores de colesterol y triglicéridos en obesos. En nuestro estudio no se pudo estimar la resistencia a la insulina de los pacientes diabéticos, por lo que no pueden analizarse los efectos de la sensibilidad a la insulina sobre las relaciones entre función tiroidea y lípidos séricos.
El significado clínico de la discreta elevación de colesterol y triglicéridos que puede presentarse en el momento del diagnóstico de un hipotiroidismo ligero en un paciente diabético es incierto. En primer lugar, porque el hipotiroidismo subclínico puede revertir espontáneamente27. Y, en segundo lugar, porque no se ha demostrado que el tratamiento sustitutivo con levotiroxina mejore el perfil lipídico de forma relevante en pacientes con hipotiroidismo subclínico. Distintos estudios de intervención han mostrado que el tratamiento con levotiroxina no origina ningún cambio significativo de los lípidos séricos en pacientes con hipotiroidismo subclínico28,29. Algunos otros han mostrado una reducción del colesterol total y colesterol-LDL tras tratamiento con tiroxina7,8, pero estas reducciones son más marcadas en pacientes con valores elevados de colesterol y en pacientes con hipotiroidismo franco inadecuadamente sustituido. Un metaanálisis de 13 estudios de intervención ha mostrado que el tratamiento con sustitutivo con levotiroxina produjo una reducción del colesterol proporcional a la gravedad del hipotiroidismo y a la elevación de los lípidos séricos30.
En conclusión, nuestros resultados muestran que, en nuestra población, no existen diferencias en las concentraciones de colesterol y triglicéridos entre los pacientes diabéticos tipo 2 con función tiroidea normal o disminuida. Tampoco se encontró correlación entre los valores de TSH y las concentraciones lipídicas en los pacientes diabéticos. Estos resultados no apoyarían la instauración de tratamiento sustitutivo precoz con levotiroxina en los diabéticos con hipotiroidismo ligero para la prevención de la dislipidemia diabética. Esta conclusión solo podrá obtenerse de forma fiable con adecuados estudios clínicos prospectivos en un número suficientemente amplio de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con este artículo.