La acidosis metabólica hiperclorémica es una complicación de las derivaciones urinarias que utilizan ileon o colon, y su prevalencia oscila entre el 25% y 46% de los casos, dependiendo de la técnica utilizada y de la función renal del paciente. Es una consecuencia del intercambio hidroelectrolítico entre la mucosa intestinal y la orina, siendo su mecanismo principal la absorción del amonio y cloruro de la orina. A largo plazo la acidosis metabólica crónica puede conllevar una alteración del metabolismo óseo y producir osteomalacia, por lo que la monitorización del pH, cloro, bicarbonato y metabolismo fosfocálcico es fundamental para un diagnóstico y tratamiento precoz.
Hyperchloremic metabolic acidosis is a complication of urinary diversion using ileum or colon. Its prevalence ranges from 25% and 46% depending on the procedure used and renal function of the patient. It is a consequence of intestinal fluid and electrolyte exchange between intestinal mucosa and urine. The main mechanism is absorption of ammonium and chloride from urine. Long-term chronic metabolic acidosis in these patients may lead to impaired bone metabolism and osteomalacia. Regular monitoring of pH, chlorine, bicarbonate, and calcium-phosphorus metabolism is therefore essential for early diagnosis and treatment.
La principal indicación de las derivaciones urinarias es la cistectomía radical por cáncer de vejiga. Las reconstrucciones urinarias pueden utilizar distintos segmentos del tracto gastrointestinal, siendo los más frecuentemente usados aquellos procedentes de ileon y colon. El estómago y el intestino proximal solo se utilizan cuando no está disponible el resto de la mucosa intestinal, como por ejemplo en algunos casos de enfermedad inflamatoria intestinal, intestino corto o antecedentes de radiación pélvica. Estos segmentos se usan para sustituir a la vejiga, ya sea como un conducto para drenar la orina a la pared abdominal, un estoma urinario, o una reconstrucción para formar una neovejiga, es decir, con derivación a la uretra nativa.
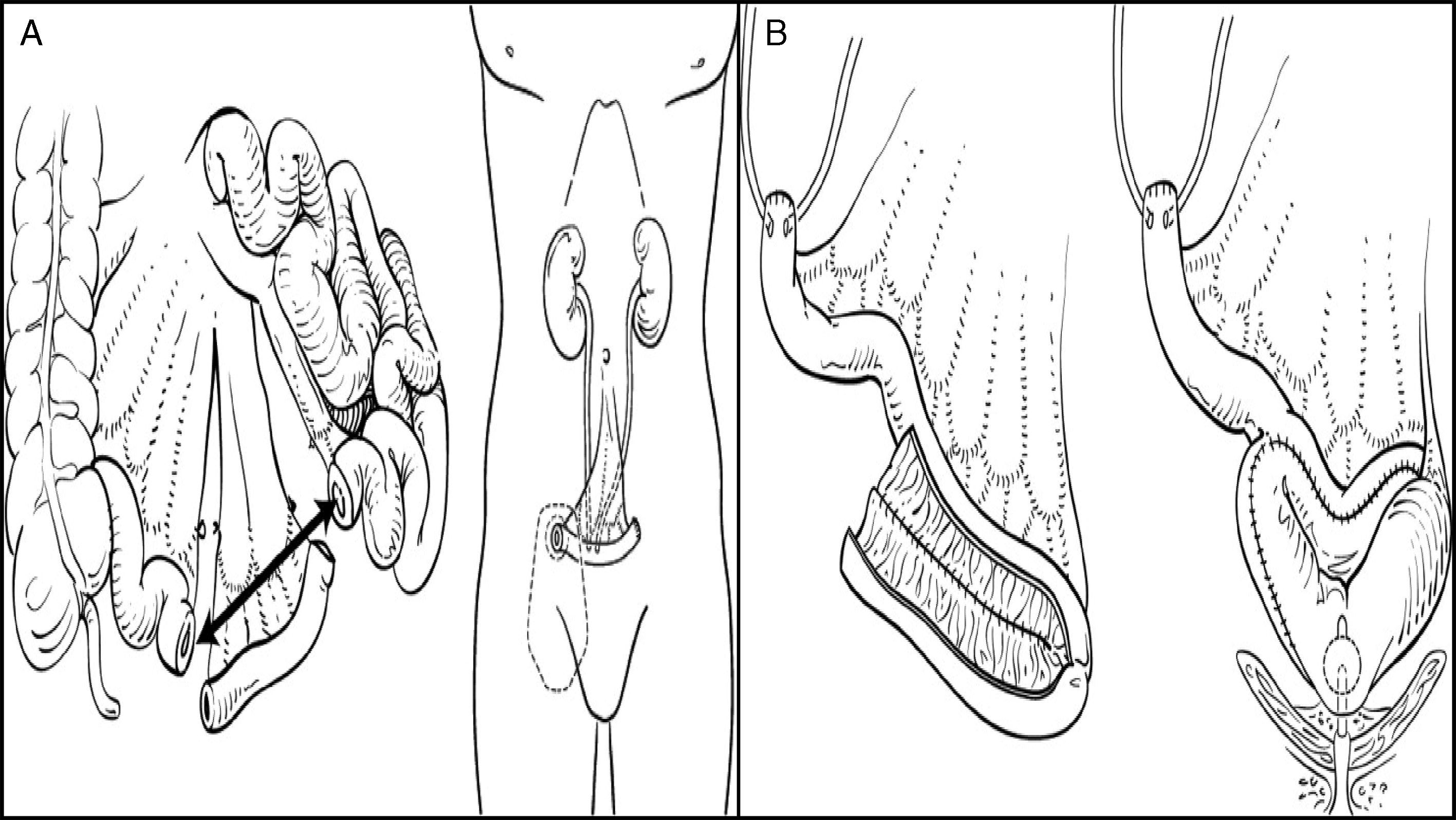
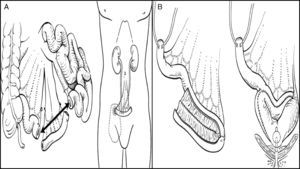
Las derivaciones urinarias se pueden dividir en 2 grupos, las heterotópicas y las ortotópicas, en función de la vía de salida de la orina. En las heterotópicas la orina saldrá por un conducto diferente de la uretra (piel, recto, etc.); a su vez, estas derivaciones pueden ser continentes o incontinentes. La derivación más utilizada es la ureteroileostomía tipo Bricker, en la que se crea un conducto ileal: en un extremo se abocarán los uréteres, mientras que el otro extremo se llevará a la piel para construir un estoma. En las derivaciones ortotópicas se realiza la sustitución vesical respetando la vía excretora natural, es decir la uretra; se crea una neovejiga, donde se almacena la orina, que se elimina de forma voluntaria y controlada (fig. 1).
A. Conducto ileal. B. Neovejiga ileal ortotópica.
Tomado de: Parekh y Donat.1
La mucosa intestinal difiere de la urinaria en su carácter semipermeable y metabólicamente activo, de forma que al ponerse en contacto con la orina, mediante distintos mecanismos de transporte y difusión de electrolitos, pueden producirse alteraciones metabólicas.
Se estima que la incidencia de trastornos hidroelectrolíticos puede estar comprendida entre el 21-48%, según las distintas series de casos comunicadas2-5.
Las complicaciones derivadas de la propia resección intestinal son muy escasas, debido al uso de segmentos intestinales cortos, siendo muy rara la malabsorción con resecciones ileales menores de 60cm6, aunque el déficit de vitamina B12 puede aparecer a largo plazo hasta en el 21% de los pacientes7. Es decir, el riesgo de aparición de estos trastornos hidroelectrolíticos depende más bien de la técnica utilizada, que determina en gran medida el tamaño de la superficie y el tiempo de contacto de la orina con la mucosa intestinal8.
Conceptos generales de fisiopatogeniaCada segmento intestinal (estómago, yeyuno, ileon y colon) se diferencia fisiológicamente en el tipo de transporte de solutos, produciéndose distintas alteraciones en función del segmento y la longitud utilizados (tabla 1). Además, también hay que tener en cuenta que la capacidad absortiva del segmento intestinal disminuye con el tiempo, objetivándose áreas de atrofia en la mucosa como mecanismo de defensa frente a la distinta osmolaridad, pH y concentración de solutos de la orina6.
Alteraciones hidroelectrolíticas en pacientes con derivaciones urinarias según el segmento intestinal utilizado
| Síndrome | Segmento | Síntomas | Otros |
|---|---|---|---|
| Alcalosis metabólica severa | Gástrico | Letargia, debilidad, arritmias, convulsiones, insuficiencia respiratoria, | Aumento de aldosterona, hipopotasemia, hipocloremia |
| Acidosis metabólica hipoclorémica, hipopotasemia | Yeyuno | Letargia, náuseas, vómitos, deshidratación, debilidad muscular | Aumento de renina y angiotensina |
| Acidosis metabólica hiperclorémica | Ileon, colon | Fatiga, anorexia, letargia, debilidad | Hipopotasemia, hipocalcemia |
Adaptada de: Douglas y MacDougal.9
Por un lado, a nivel intestinal existe un transporte transcelular de iones y solutos, que se realiza mediante proteínas transmembrana y gradientes electroquímicos, cotransportadores y canales de intercambio. El transporte de sodio (Na+) e hidrogeniones (H+) se realiza de forma transcelular mediante la bomba Na+/K+/ATPasa y el intercambiador de Na+/H+ en la membrana luminal del intestino delgado y grueso. Este proceso permite mantener una concentración intracelular baja de sodio estableciendo el gradiente electroquímico necesario para el transporte de solutos. Este mecanismo promueve la absorción de Na+ en la luz intestinal en contra del gradiente de concentración que existe entre esta y el plasma, con la secreción subsiguiente de H+en la luz. La eficiencia con la que se absorbe el Na+ aumenta distalmente10. Sin embargo, el transporte de potasio en el intestino es pasivo, siguiendo el gradiente de concentración, por lo que su absorción depende de su concentración luminal.
Por otro lado, existe un transporte paracelular de agua e iones a favor de un gradiente electroquímico y de concentración, que es más importante a nivel proximal. Es decir, la mucosa intestinal es más permeable a nivel proximal (estómago, duodeno y yeyuno) que distal (ileon y colon). Si se utilizan segmentos proximales, y dependiendo de la osmolaridad de la orina, se puede producir un movimiento rápido de agua y solutos a través de la mucosa debido al gradiente osmótico, con pérdida resultante de Na+y cloro e hipovolemia10.
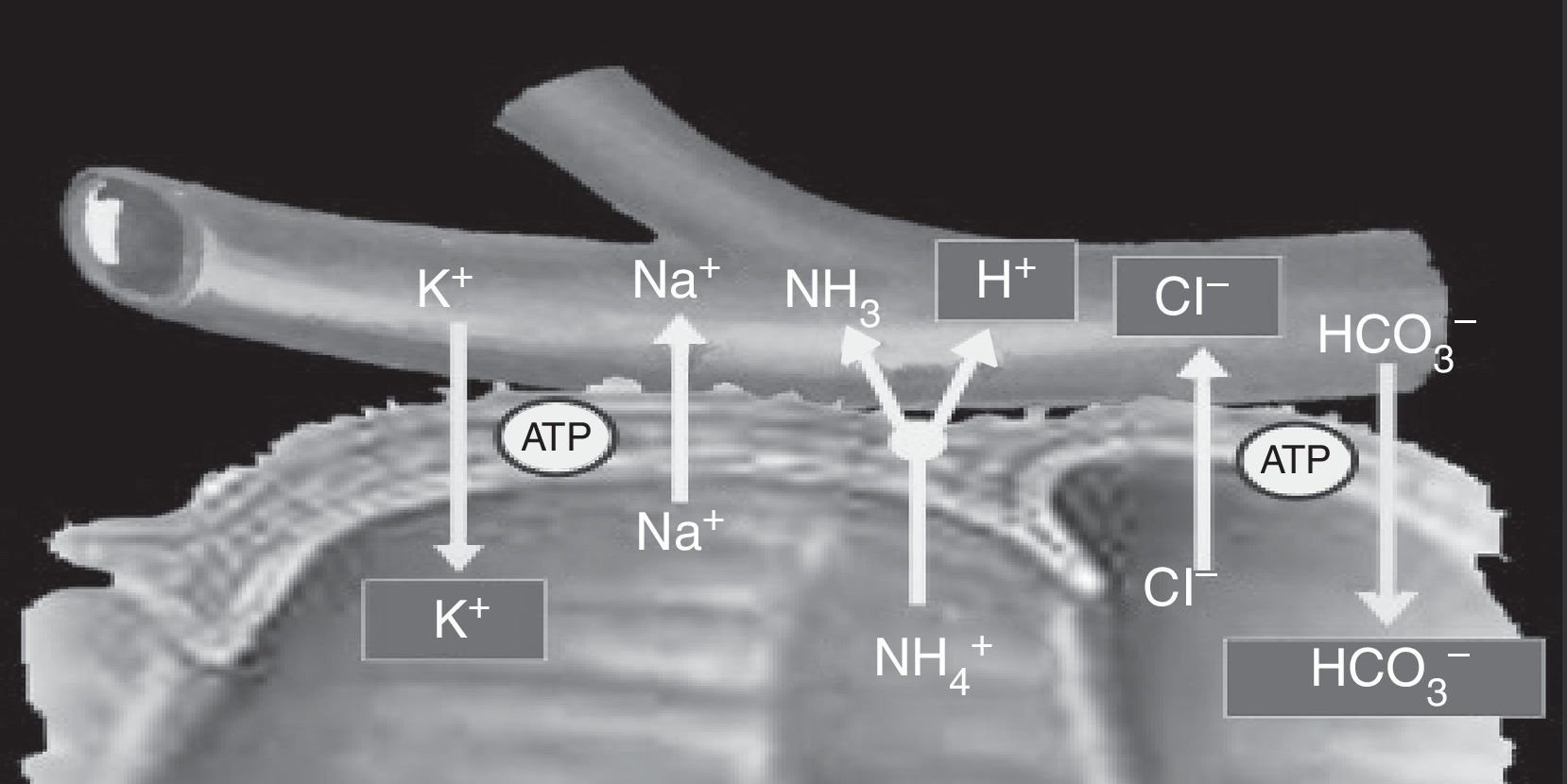
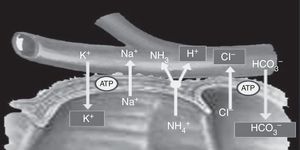
Las células localizadas en el colon e intestino distal tienen un canal intercambiador de aniones, que reabsorbe cloruro (Cl−) y secreta bicarbonato (HCO3−), y tiene la capacidad de absorber el amonio (NH4+) de la orina; el yeyuno no posee esta capacidad. Debido a estas diferencias en la capacidad de transporte, las alteraciones metabólicas que puedan aparecer en estos pacientes dependerán del segmento intestinal utilizado, además de las características químicas de la orina (osmolaridad, pH y concentración de solutos), del tiempo de contacto de la mucosa con la orina y de la presencia de insuficiencia renal6. La absorción de NH4+ por parte de la mucosa intestinal es el mecanismo principal de la acidosis metabólica que aparece en los pacientes con derivaciones urinarias. Este proceso de absorción de NH4+ está acoplado con el intercambio de HCO3− y Cl−. Además, la absorción de NH4+ puede producirse a través de los canales de potasio (K+), produciéndose una pérdida de HCO3− y K+8,11 (fig. 2).
El amonio y cloruro se reabsorben. El intercambio de amonio por un protón está acoplado con el intercambio de bicarbonato por el cloruro; por lo tanto, se pierde bicarbonato y un poco de potasio.
Tomado de Stein et al.7.
Cuando se utiliza la mucosa gástrica se produce una pérdida continua de H+ desde la mucosa gástrica, desarrollándose una alcalosis metabólica hipopotasémica e hipocloremia. Teniendo en cuenta que normalmente la orina tiene niveles bajos de Na+, Cl− y HCO3− un alto contenido de K+ y una elevada osmolaridad en relación con el plasma sanguíneo, el uso de yeyuno en estas derivaciones determina una depleción de volumen circulante eficaz, debido a una pérdida de sal y agua a través de la mucosa intestinal; en consecuencia, se produce hiponatremia, hipocloremia, hiperpotasemia y alcalosis metabólica por deshidratación, y finalmente acidosis metabólica secundaria a hipoperfusión e hipovolemia6,10,12. Además, cuanto más proximal es el segmento yeyunal utilizado, más severa será la complicación metabólica12.
En relación con el uso del ileon y colon la principal complicación es la acidosis metabólica hiperclorémica debida a la reabsorción de NH4+ y a la secreción de HCO3−. Algunos casos solo desarrollan hipercloremia sin acidosis significativa13. Se han descrito otras alteraciones como hipopotasemia, hipomagnesemia, hipocalcemia, hiperamonemia y elevación de la creatinina y la urea en sangre. En la literatura hay comunicados casos aislados de parálisis muscular secundaria a acidosis hipopotasémica en relación con ureterosigmoidostomías14-16.
La proporción de acidosis metabólica en el caso de las derivaciones continentes y neovejigas es del 26 y el 45% respectivamente, y hasta un 4% de los casos requieren hospitalización para su tratamiento4. Esta proporción desciende al 10-15% en el caso de los conductos ileales17,18. Además, la incidencia de acidosis metabólica posquirúrgica también depende de la longitud de ileon utilizado, como antes hemos señalado, siendo más frecuente con segmentos mayores de 40cm19. En las ureterosigmoidostomías las alteraciones metabólicas pueden llegar a aparecer en el 100% de los casos5.
Osteomalacia y enfermedad ósea asociadas a los trastornos hidroelectrolíticos por derivaciones urinariasEl tratamiento de la acidosis metabólica consiste en la administración oral de bicarbonato y debe hacerse de forma temprana para prevenir el desarrollo de osteomalacia. La acidosis crónica promueve la activación de los osteoclastos y la resorción ósea, y altera la hidroxilación de la 25-hidroxi-vitamina D (25[OH]D) o calcifediol a nivel renal, favoreciendo la hipercalciuria e hipermagnesuria, promoviendo un balance negativo de calcio y fósforo, e impidiendo, por tanto, una adecuada mineralización ósea20. Por otro lado, la acidosis metabólica induce un aumento del catabolismo proteico, lo que favorece un balance negativo de nitrógeno y una disminución de la síntesis de albúmina, que pueden contribuir al desarrollo de enfermedad ósea21. Además, los pacientes con enfermedad renal preexistente tienen un riesgo mayor de acidosis metabólica y alteración en la hidroxilación de la vitamina D, por lo que son un grupo propenso a desarrollar enfermedad ósea. Este aspecto es importante de valorar, puesto que con el tiempo hasta el 72% de los pacientes intervenidos de una cistectomía radical pueden tener deterioro de su función renal. La edad avanzada, la hipertensión arterial, la hidronefrosis postoperatoria y la estenosis de la anastomosis de la unión ureteroentérica son factores de riesgo para este deterioro22.
La osteomalacia puede aparecer entre 2 y 4 años después de la intervención, si bien hay casos descritos hasta 35 años después20,23. Los pacientes con osteomalacia tras derivación urinaria mediante ileon o colon suelen tener niveles séricos elevados de Cl− y déficit de HCO3−. La fosfatasa alcalina plasmática (FAL) puede estar aumentada debido al incremento del recambio óseo, con niveles de calcio y fósforo habitualmente normales (o en el límite bajo de la normalidad); en la mayoría de los casos la hormona paratiroidea (PTH) y la 1,25 (OH)-vitamina D se mantienen dentro de la normalidad20,23-25. La enfermedad ósea también puede estar presente en ausencia de acidosis metabólica severa, debido a que la presencia de alteraciones en los niveles de fosfato, sulfato y HCO3− que promueven la hipercalciuria y dificultan la mineralización ósea10,26. En los pacientes con osteomalacia se deberían corregir en primer lugar las alteraciones del equilibrio ácido-base; si no existe una mejoría, el tratamiento se debería completar con suplementos de calcio y vitamina D27.
El seguimiento a largo plazo de estos pacientes puede ser complicado debido a que las alteraciones óseas pueden ser subclínicas o asintomáticas. La densitometría ósea (DMO) no es capaz de detectar cambios sutiles, de modo que en ocasiones la única forma de confirmar el diagnóstico es mediante la histología ósea27.
Algunos autores han estudiado la utilidad de algunos marcadores de remodelación ósea en el diagnóstico y seguimiento. Hay que tener en cuenta que en muchos de estos estudios se han excluido a las mujeres por el efecto de la menopausia sobre el hueso20,28-30.
Koch et al. compararon una serie de pacientes intervenidos de mielomeningocele y derivación urinaria, con otros tratados mediante cateterización intermitente, al cabo de 23 y 17 años de la intervención, respectivamente. Observaron que ambos grupos tenían una DMO disminuida. Sin embargo, en el grupo de derivación urinaria existía una mayor incidencia de complicaciones en procedimientos ortopédicos (fracturas intraoperatorias y no consolidaciones) y un aumento de la necesidad de cirugía de la columna para la corrección de desviaciones en la curvatura espinal. No hubo diferencias entre ambos grupos respecto a la incidencia de fracturas. Por todo ello, concluyen que las derivaciones urinarias tienen efectos deletéreos en la salud ósea31.
Gianini et al. estudiaron una serie de 25 varones con una neovejiga ileal, con un seguimiento comprendido entre 29 y 75 meses, y observaron niveles incrementados de FAL, así como una menor DMO. Por otro lado, cuando ajustaron las variables metabólicas según el tiempo transcurrido desde la intervención, los sujetos intervenidos más recientemente tenían un menor pH sérico y unos niveles más elevados de hidroxiprolina en orina. Estos resultados llevan a los autores a argumentar que el tiempo de evolución desde la intervención es importante, puesto que las alteraciones metabólicas producidas por la mucosa intestinal disminuyen progresivamente debido a la atrofia progresiva de la mucosa intestinal que está en contacto con la orina. Además, la DMO fue menor en 2 de los 4 lugares anatómicos analizados en el grupo de estudio, objetivándose una disminución significativa en el cuello femoral y en la zona del triángulo de Ward, pero no en la columna lumbar y en la región intertrocantérica femoral. Los autores no analizaron si estos cambios metabólicos y en la DMO se asociaban a un aumento de riesgo de fracturas20.
Fujisawa et al. objetivaron, en una serie de 33 varones con una neovejiga, y un seguimiento desde la intervención entre 4 y 114 meses, que los marcadores óseos telopéptido C-terminal de colágeno tipo i en orina y deoxipiridinolina sérica se correlacionaban negativamente con el pH sérico. Además, el Z-score lumbar (L2-L4) se correlacionó significativamente con los niveles de telopéptidos N-terminal y de deoxipiridinolina28. Kawakita et al. estudiaron una serie de 46 pacientes con derivaciones urinarias y encontraron que aquellos pacientes con acidosis metabólica tenían una menor DMO y niveles mayores de enlaces cruzados de piridinio en orina respecto a aquellos con un estado ácido-base normal30. Sevin et al. encontraron una menor DMO en aquellos pacientes con una neovejiga ileal, pero no en el grupo con reservorio colónico25.
Sin embargo, otros autores no han objetivado cambios significativos en el metabolismo óseo en estos casos29,32,33. Davidsson et al. analizaron la histología ósea de 20 pacientes con derivación urinaria tipo conducto ileal y de 19 pacientes con un reservorio urinario continente formado a partir de un segmento cecal. El estudio histológico no reveló defectos en la mineralización ósea o aumento de la resorción ósea, pero objetivaron un volumen de hueso trabecular mayor en el grupo del reservorio y una tasa de aposición mineral disminuida en ambos grupos. Los autores concluyeron que existía una disminución del recambio óseo en estos pacientes32. El grupo de Campanello et al. tampoco objetivó, en sujetos con reservorio ileal y conducto tipo Bricker valorados 2-17 años después de la intervención, cambios significativos respecto a controles en la DMO ni en los parámetros bioquímicos de vitamina D, PTH, FAL, calcio y osteocalcina29.
Ninguno de los estudios mencionados previamente ha establecido un mayor riesgo de fracturas óseas en pacientes con derivaciones urinarias. Recientemente, Gupta et al. analizaron una cohorte de 50.520 pacientes con cáncer de vejiga; 4.878 de ellos habían sido intervenidos de cistectomía radical y derivación urinaria, y presentaban un aumento del riesgo de fractura del 21%, sobre todo en pacientes con historia previa de enfermedad renal y más jóvenes34.
Por otra parte, en 1992, Wagstaff y Mundy describieron que la enfermedad ósea relacionada con las derivaciones urinarias, y como consecuencia de la acidosis metabólica, podía producir retraso del crecimiento y desarrollo en niños35,36. Sin embargo, hay que tener en cuenta que no es una consecuencia única específica de las derivaciones urinarias o enterocistoplastias. Gerharz et al. (2002), después de analizar una serie de 123 niños con una enterocistoplastia, hallaron un trastorno del crecimiento clínicamente relevante en 4 casos; en ninguno de ellos, y tras una completa evaluación endocrinológica, se consideró que la enterocistoplastia fuera un factor causal. Estos autores defienden que el trastorno del crecimiento se debe a un fenómeno multifactoral no específico más que a una consecuencia directa de la cirugía. De todos modos, y con carácter general, se recomienda monitorizar el crecimiento en estos niños, puesto que el deterioro de la función renal sí puede alterar los mecanismos de compensación de las alteraciones metabólicas que son consecuencia de la enterocistoplastia, y afectar potencialmente al crecimiento37.
ConclusionesEn las derivaciones urinarias, las alteraciones metabólicas (y óseas) dependen en gran medida del tiempo transcurrido desde la intervención, de la técnica quirúrgica, del segmento gastrointestinal utilizado y de la longitud del mismo.
La complicación metabólica más prevalente en las derivaciones urinarias es la acidosis metabólica hiperclorémica, y puede aparecer tanto a corto como a largo plazo, por lo que es necesario realizar en estos pacientes un seguimiento prolongado para un diagnóstico y tratamiento precoz de estas complicaciones, con especial atención en aquellos pacientes con enfermedad renal crónica.
Aunque los estudios hasta ahora publicados son heterogéneos, (muestras pequeñas, distintas técnicas quirúrgicas y periodos de seguimiento variables), la mayoría de los autores postulan que la corrección de la acidosis puede prevenir y normalizar las alteraciones en la masa ósea. Por este motivo, en el seguimiento de estos pacientes es imprescindible la realización periódica de DMO, gasometría venosa y parámetros del metabolismo fosfocálcico38. Se requieren estudios prospectivos de series más numerosas para determinar los efectos a largo plazo de las derivaciones urinarias en el metabolismo óseo.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses que pueda ser percibido como perjudicial para la imparcialidad de la investigación publicada.