La acromegalia es una enfermedad caracterizada por hipersecreción de hormona de crecimiento (GH) que en la mayoría de los casos se debe a producción de GH por un adenoma hipofisario (más del 95%). Raramente está causada por tumores hipotalámicos o ectópicos1,2 y hasta en un 20–30% de los casos podemos encontrar co-secreción de prolactina (PRL)2. Las alteraciones en el metabolismo de la glucosa son una característica común de la acromegalia y su gravedad se correlaciona con las concentraciones de GH3–5. La intolerancia a la glucosa afecta a un 30–50% mientras que la diabetes mellitus (DM) puede verse en un 10–30% de los pacientes acromegálicos3–6.
La exposición a GH induce resistencia a insulina (RI) con incremento tanto de la gluconeogénesis hepática como periférica, así como, disminución de captación de glucosa a nivel periférico5,7. Estos efectos son en gran medida secundarios a la estimulación de la lipólisis inducida por GH y a la competición de sustratos glucosa/ácidos grasos. El incremento de la oxidación de los ácidos grasos inhibe la recaptación de glucosa estimulada por insulina a nivel muscular7. La hiperprolactinemia también es causa de alteraciones en el metabolismo glucídico conduciendo a RI, entre los mecanismos sugeridos están la disminución de receptores de insulina y/o defectos a nivel posreceptor, así como, la disminución de adiponectina8.
La cetoacidosis diabética, secundaria a un déficit relativo o absoluto de insulina y a un exceso de hormonas contrarreguladoras, es infrecuente y una característica rara de la acromegalia, hasta ahora se han documentado unos diez casos de cetoacidosis diabética como primera manifestación4,5,9, no existiendo en la literatura ningún caso de tumor hipofisario mixto secretor de GH y PRL. Presentamos el primer caso descrito de cetoacidosis como primera manifestación de una paciente con adenoma mixto productor de GH y PRL.
Mujer de 54 años, previamente sana con antecedentes maternos de DM tipo 2, que fue atendida en el servicio de urgencias por presentar bajo nivel de conciencia y deterioro del estado general. En las semanas previas la paciente había presentado un cuadro de poliuria, polidipsia y polifagia.
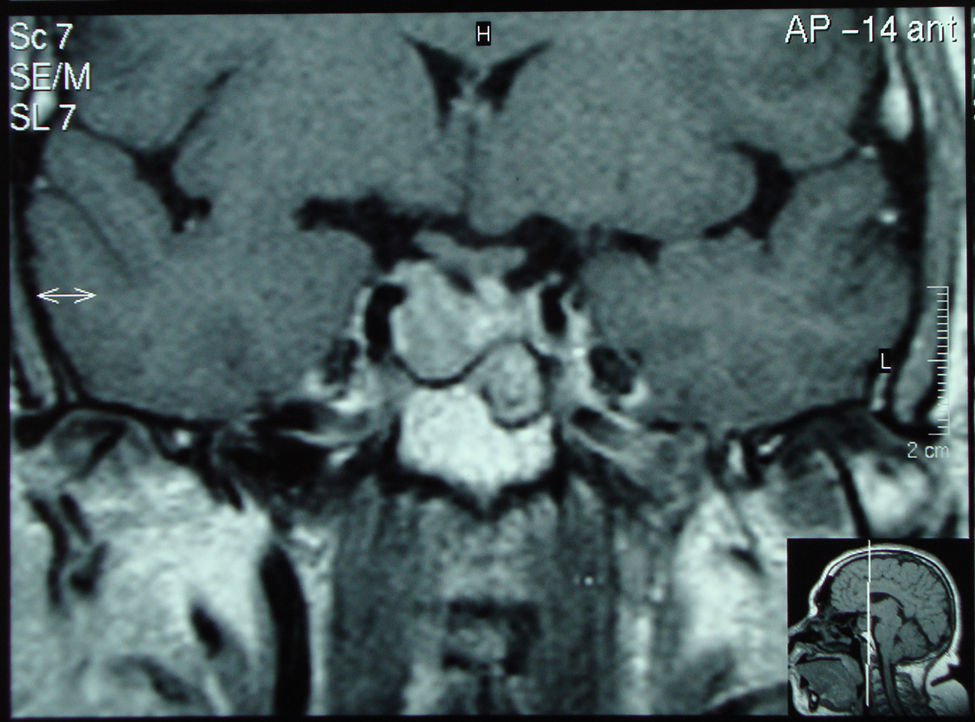
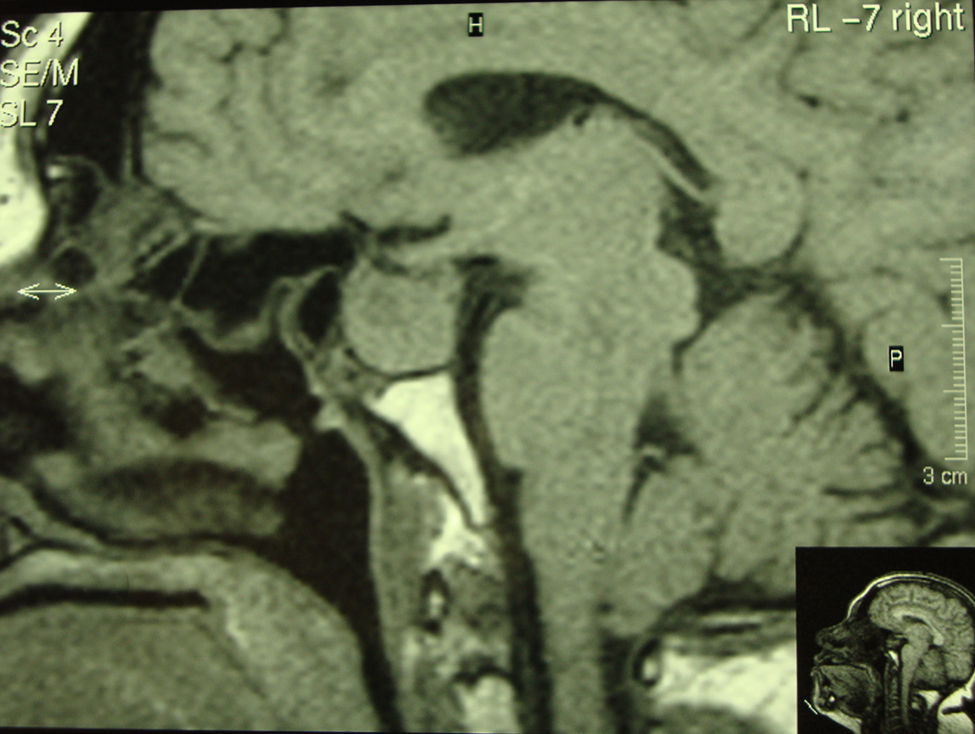
A su llegada a urgencias se objetiva cuadro de cetoacidosis diabética con glucemia venosa de 1.437mg/dl, creatinina 1,94mg/dl, pH 6,96, bicarbonato 3,4mEq/l y beta hidroxibutirato en sangre de 4,8mmol/l, iniciando tratamiento con sueroterapia e insulina intravenosa, descartándose causas intercurrentes de cetoacidosis. Tras su ingreso en planta se inició tratamiento con insulina subcutánea, inicialmente pauta bolo-basal, requiriendo en la evolución solamente basal (glargina) con aumento progresivo de la dosis hasta conseguir buen control metabólico (40 unidades/día). Durante el interrogatorio la paciente refería aumento del tamaño de partes blandas de varios años de evolución con aumento del número de calzado, sudoración intensa y antecedentes de cirugía de síndrome de túnel del carpo bilateral. A la exploración presentaba obesidad de predominio abdominal (índice de masa corporal [IMC] 31kg/m2), aspecto acromegálico con aumento llamativo de partes blandas en manos y pies, prognatismo, engrosamiento de labio inferior, macroglosia y sudoración en manos sin galactorrea. Analíticamente se objetivó: hemoglobina glucosilada (Hb1Ac) 13,3%, GH basal 81,1ng/ml, factor de crecimiento insulínico tipo 1 (IGF-1) 502ng/ml (normal 87–238ng/ml), PRL 57,2ng/ml, péptido C basal 1,4ng/ml, péptido C tras estímulo con glucagón 4,5ng/ml, anticuerpos anti-IA2 y anti-GAD negativos, folitropina (FSH) 0,21mUI/ml, lutropina (LH)<0,07mUI/ml, estradiol 11pg/ml, tirotropina (TSH) 2,206uUI/ml, test de Nuvacthen® (tetracosáctido) para cortisol (basal y 60min) 17,7 y 21,4μg/dl y corticotropina (ACTH) plasmática 79,80pg/ml. Se realizó resonáncia magnética (RMN) craneal (figs. 1 y 2) en la que se objetivó macroadenoma hipofisario de 24×22×18mm de diámetro con invasión de seno cavernoso derecho englobando carótida interna y extensión suprasellar contactando y desplazando cranealmente el quiasma óptico. Como tratamiento de elección se decidió realizar intervención quirúrgica (transesfenoidal y endoscópica), llevándose a cabo sin complicaciones. La anatomía patológica fue informada como adenoma de hipófisis secretor de PRL con inmunotinción focal para GH. Tras la cirugía, se instauró tratamiento con análogos de somatostatina (SS) depot (60mg/28d) ante la persistencia de hipersecreción de GH (GH 14,4ng/ml e IGF-1 1176ng/ml). En el seguimiento inmediato (2 meses tras cirugía) se objetivó GH de 15,6ng/ml, IGF-1 de 976ng/ml y PRL de 82,3ng/ml aumentándose la dosis de análogo a 120mg/28d. En la RMN de control postoperatoria (6 meses después) se describe persistencia de adenoma hipofisario de 2,5cm en lado derecho de silla con infiltración de seno cavernoso y englobando carótida, por lo que se decidió administrar radioterapia holocraneal (RT) y suspender el análogo de somatostatina. Tras la RT se reinstauró el análogo y se reevalúó la función hormonal hipofisaria (2 meses después de RT) objetivandose concentraciones séricas de IGF-1 431ng/ml, PRL 118ng/ml, TSH 0,182uUI/ml, tiroxina no unida a proteína (T4L) 0,64ng/dl (previamente dentro del rango de normalidad), FSH 0,16mUI/ml, LH<0,07mUI/ml, ACTH 35,40pg/ml y respuesta del cortisol al test de Nuvacthen® (basal y 60min): 14,9 y 27,8μg/ml. Presentando la paciente tras cirugía, RT y tratamiento con análogos: persistencia de secreción de GH y PRL, hipogonadismo hipogonadotropo, hipotiroidismo central y ausencia de otros déficits hipofisarios. Se inició tratamiento con levotiroxina (25 mg/día) y agonistas dopaminérgicos ante las concentraciones elevadas de PRL (cabergolina 2mg/semana). En la actualidad, a los 6 meses de finalizar la RT, la paciente ha mejorado clínicamente y presenta un mejor control de la función hormonal (GH de 1,68ng/ml, IGF-1 de 267ng/ml, y PRL de 36,9ng/ml), está correctamente sustituida del hipotiroidismo y sin cambios radiológicos significativos. Desde el punto de vista metabólico presenta, así mismo, un buen control de la DM tipo 2 (Hb1Ac 6%) continuando el tratamiento con insulina glargina.
La cetoacidosis diabética es un raro e infrecuente hallazgo como primera manifestación de la acromegalia, ocurre cuando los efectos de las hormonas contrarreguladoras exceden a los de la insulina9. El efecto de GH en el metabolismo de la glucosa es complejo6, de manera que el exceso de GH e IGF-1 induce RI directamente en hígado, tejido adiposo y músculo, resultando en un aumento de la neoglucogénesis y disminución de captación de glucosa mediada por insulina a nivel periférico (músculo y tejido adiposo), conllevando a hiperglucemia. Los mecanismos patogénicos descritos de RI en la acromegalia son defectos a nivel posreceptor (disminución de la autofosforilación del substrato 1 del receptor de insulina [IRS-1] y de transportadores de glucosa [sobre todo del trasportador de glucosa tipo 4 {GLUT-4}]). Estos defectos suelen ser reversibles tras la normalización de las concentraciones de GH e IGF-12.
Por otro lado, el papel de la GH en la cetoacidosis no es bien conocido. Además de un déficit de insulina (absoluto o relativo), se ha visto que un factor determinante es la existencia de RI a nivel periférico. Cabe destacar, además, en este caso la presencia de hiperprolactinemia y, por tanto, incremento de RI8. La hiperglucagonemia existente es otro factor involucrado en su desarrollo ya que reduce la fructosa 2,6 bifosfato hepática, inhibiendo la gluconeogénesis e induciendo cetogénesis hepática. Como consecuencia de esto, el balance global de las acciones de GH y glucagón descritas son claros determinantes en el desarrollo de la cetoacidosis en estos pacientes3,6. Comentar también el papel de la glucolipotoxicidad sobre la secreción de insulina, la combinación de un exceso de ácidos grasos (lipólisis) y de glucosa (neoglucogénesis) secundarios al efecto de GH conduce a una disminución de secreción de insulina, a alteraciones en la expresión de su gen y a muerte de las células beta por apoptosis, lo cual, también puede contribuir al desarrollo de la misma10.
Entre los posibles factores que se han implicado en el desarrollo de cetoacidosis destacan: edad mayor de 40 años, duración de enfermedad superior a 6 años, antecedentes familiares de diabetes, obesidad, hipertensión, sexo femenino con hirsutismo, concentraciones séricas de GH >25ng/ml, hiperprolactinemia y macroadenoma, siendo los más significativamente asociados la hipertensión y los antecedentes familiares11. Nuestra paciente reunía la mayoría de los factores citados destacando las concentraciones elevadas de GH y PRL.
En la acromegalia la cirugía transesfenoidal es el tratamiento de elección en la mayoría de los pacientes, aunque solo en el 70–80% de los pacientes con microadenomas y en menos del 50% con macroadenomas se normalizan las concentraciones de IGF-1 y GH4. Por lo tanto, muchos pacientes tienen evidencia de enfermedad persistente y requieren tratamiento adicional siendo éste el caso de nuestra paciente (irradiación y tratamiento farmacológico con análogos de SS).
Es de destacar que el tratamiento con análogos de SS al disminuir GH e IGF-1 (y por tanto la RI) pueden producir mejoría en el metabolismo hidrocarbonado. No obstante, al inhibir la secreción de insulina y glucagón el efecto global sobre el metabolismo hidrocarbonado es difícil de valorar. De manera que los datos derivados de trabajos experimentales de los análogos sobre el metabolismo glucídico parecen apuntar a un deterioro en la función de la célula beta y, por tanto, un daño en la homeostasis de la glucosa7.
Inicialmente las concentraciones elevadas de PRL fueron etiquetadas como secundarias a compresión de tallo hipofisario por un macroadenoma. Fue en la anatomía patológica donde se etiquetó de adenoma secretor de PRL. Hubiera sido interesante haber realizado determinación de la misma tras dilución para descartar un «efecto gancho» dado las concentraciones «escasamente» elevadas en un macroadenoma secretor tanto de GH como de PRL.
En nuestro caso, existe la peculiaridad de ser el primer caso descrito de tumor mixto de GH y PRL, por lo que además fue tratada con agonistas dopaminérgicos objetivando una reducción tanto de las concentraciones de PRL como de GH e IGF-1. Estos fármacos mejoran la RI inducida por la hiperprolactinemia y, por lo tanto, el control glucémico8.
En resumen, describimos el primer caso de cetoacidosis diabética como primera manifestación de un tumor mixto productor de GH y PRL. Tras las medidas terapéuticas citadas la paciente ha presentado tanto una mejoría clínica como analítica con disminución de las concentraciones de GH, IGF-1 y PRL contribuyendo a una mejoría del control metabólico (Hb1Ac 6%).