El sistema nervioso autónomo parasimpático tiene el control de la función tiroidea mediante la activación de receptores muscarínicos en las células foliculares. Se han identificado diversos subtipos farmacológicos y moleculares de receptores muscarínicos (M1, M2, M3, M4, M5) tanto en el sistema nervioso central (SNC) como en los tejidos periféricos, pero hay controversia acerca de su caracterización en las células tiroideas.
Material y métodosCultivos celulares de células epiteliales tiroideas indiferenciadas de ratas Fisher (FRT). Estudios de unión de receptores a radioligando: cinéticas de asociación, cinéticas de disociación y competiciones entre diversos fármacos antagonistas selectivos muscarínicos; se utiliza, como radioligando, 3H-N-metil-escopolamina (3HNMS).
ResultadosSe observa que hay receptores específicos muscarínicos en la membrana plasmática de las células FRT con una constante de disociación en equilibrio (Kd) de 0,44nmol. El orden de afinidades de los diferentes antagonistas muscarínicos encontrado en membranas epiteliales de células FRT mediante el ajuste de los datos para un modelo de un solo sitio de unión fue: diciclomina > hexahidrosiladifenidol (HHSD) = 4-difenilacetoxi-N-metilpiperidina metiodida (4-DAMP) > pirenzepina > himbacina = 11-[[2-[(dietil-amino)metil]-1-piperidinil]acetil]-5,11-dihidro-6H-pirido(414)benzodiacepina (AF-DX 116).
ConclusionesLos resultados obtenidos en este estudio indican que hay sitios de unión para 3H-NMS que se corresponden con los receptores muscarínicos localizados en células FRT. Los resultados obtenidos en los experimentos de competición indican que el receptor presente en esta localización se corresponde con el subtipo M3.
The parasympathetic autonomous nervous system exerts control over thyroid function by activation of the muscarinic receptors in follicular cells. Various pharmacological and molecular subtypes of muscarinic receptors (M1, M2, M3, M4, M5) have been identified in central nervous system and peripheral tissues. Controversy surrounds receptor characterization in thyroid cells.
Materials and methodsUndifferentiated Fisher rat thyroid epithelial cells (FRT) were cultured. Association and dissociation kinetics assays and antagonist competition studies of the binding of 3H-N-methylscopolamine (3H-NMS) to muscarinic receptors were performed to demonstrate the presence of muscarinic receptors.
ResultsSpecific muscarinic receptors in the plasma membrane of FRT cells were observed with an equilibrium dissociation constant (Kd) of 0.44nmol. The order of affinities obtained fitting the data to one binding site model in competition experiments with the muscarinic receptor antagonist was: dicyclomine > hexahydrosiladifenidol (HHSD) = 4-diphenylacetoxy-N-methylpiperidine methiodide (4-DAMP) > pirenzepine > himbacine = 11-[[2-[(diethylamino)methyl]- 1-piperidinyl]acetyl]-5,11-dihydro-6H-pyrido (414)benzodiazepine (AF-DX 116).
ConclusionsThe results obtained indicate the existence of specific 3H-NMS muscarinic binding sites located in the plasma membrane of FRT cells. The results obtained in competition experiments suggest that the receptors present in FRT cells belong to the M3 subtype.
Hay evidencia de que el sistema nervioso vegetativo (simpático y parasimpático) controla la función tiroidea en el ser humano mediante inervación colinérgica y adrenérgica en las células foliculares1. Adicionalmente, se ha demostrado el acúmulo de guanosinmonofosfato cíclico (GMPc) en el tejido tiroideo humano en respuesta a agentes colinérgicos que es inhibido selectivamente por la atropina, antagonista del receptor muscarínico, pero no por la d-tubocurarina, antagonista del receptor nicotínico2. Estos resultados apoyan la idea de un papel del sistema nervioso colinérgico en la regulación de la función tiroidea.
Los receptores colinérgicos muscarínicos se encuentran en diversas localizaciones en el organismo humano. Además de su amplia distribución en el sistema nervioso central (SNC), donde median funciones relacionadas con procesos de memoria y aprendizaje, también se encuentran en tejidos periféricos.
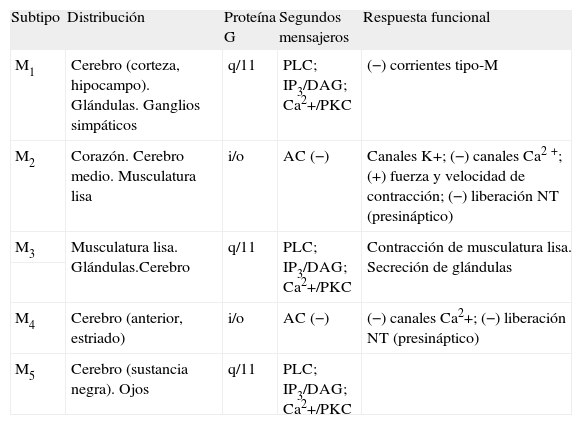
En la actualidad, se han identificado 5 subtipos de receptores muscarínicos (M1, M2, M3, M4 y M5). Previamente a la descripción molecular de los 5 subtipos, 3 de ellos (M1, M2 y M3) se definieron mediante estudios de unión y técnicas farmacológicas clásicas3-5. La distribución y la localización de los subtipos de receptores muscarínicos se han estudiado ampliamente en las últimas dos décadas. En la tabla 1 se resume la principal distribución y las principales funciones de los diferentes subtipos. Así, en el organismo humano, además de presentar una amplia distribución en el sistema nervioso central, se encuentran en tejidos periféricos, como el corazón, las glándulas endocrinas y exocrinas, la fibra muscular lisa digestiva y vascular o la placenta, entre otros.
Resumen de la distribución, el acoplamiento a proteínas G y las principales respuestas funcionales de los diferentes subtipos de receptor muscarínico
| Subtipo | Distribución | Proteína G | Segundos mensajeros | Respuesta funcional |
| M1 | Cerebro (corteza, hipocampo). Glándulas. Ganglios simpáticos | q/11 | PLC; IP3/DAG; Ca2+/PKC | (−) corrientes tipo-M |
| M2 | Corazón. Cerebro medio. Musculatura lisa | i/o | AC (−) | Canales K+; (−) canales Ca2+; (+) fuerza y velocidad de contracción; (−) liberación NT (presináptico) |
| M3 | Musculatura lisa. Glándulas.Cerebro | q/11 | PLC; IP3/DAG; Ca2+/PKC | Contracción de musculatura lisa. Secreción de glándulas |
| M4 | Cerebro (anterior, estriado) | i/o | AC (−) | (−) canales Ca2+; (−) liberación NT (presináptico) |
| M5 | Cerebro (sustancia negra). Ojos | q/11 | PLC; IP3/DAG; Ca2+/PKC |
AC: adenilatociclasa; DAG: diacilglicerol; IP3: inositol 1,4,5-trifosfato; PKC: proteincinasa C; PLC: fosfolipasa C; NT: neurotrasmisor. Los signos – y + indican inhibición y activación respectivamente. Adaptada de Caulfield et al, 1998.
El subtipo M1, que en farmacología se caracteriza por presentar alta afinidad para el antagonista pirenzepina, es el subtipo receptorial predominante en el cerebro anterior, principalmente en el córtex cerebral, el hipocampo y el estriado6.
El subtipo M2 está localizado preferentemente en corazón y cerebelo y muestra alta afinidad para el antagonista 11 [[2[(dietil-amino)metil] -1 -piperidinil] acetil] -5,11 -dihidro-6H-pirido(414)benzodiacepina (AF-DX 116), además de estar alostéricamente regulado por compuestos del tipo de la gallamina.
El subtipo M3 farmacológicamente se caracteriza por presentar alta afinidad para los antagonistas 4-difenilacetoxi-N-metilpiperidina metiodida (4-DAMP) y hexahidrosiladifenidol (HHSD). Además de estar ampliamente distribuido por el SNC, en la periferia participa en numerosas funciones fisiológicas; unas de sus principales localizaciones son la musculatura lisa y las glándulas exocrinas7-10.
El subtipo M4 se encuentra preferentemente en cerebro anterior6. Diferentes trabajos11,12 indican un papel de regulación en los receptores dopaminérgicos D1 relacionados con las funciones estriatales y la actividad locomotora. En la zona periférica, se ha localizado en pulmón de conejo, corazón de pollo y médula adrenal bovina13.
Finalmente, se han encontrado bajas densidades del subtipo M5 tanto en tejido neuronal (sustancia negra y núcleo accumbens), con un posible papel modulador en la liberación de dopamina en cerebro medio y su relación con los efectos de recompensa de las drogas de abuso14, como en endotelio vascular cerebral y periférico. A pesar de que se ha identificado una gran diversidad de efectos bioquímicos, fisiológicos y en el comportamiento relacionados con la neurotransmisión colinérgica muscarínica en el cerebro, la identidad de los subtipos moleculares causales de funciones específicas en otros tejidos implicados en numerosas situaciones patológicas permanece poco clara.
En el presente trabajo nos planteamos como objetivo poner de manifiesto la existencia de receptores muscarínicos en la membrana plasmática de células epiteliales no diferenciadas y polarizadas tiroideas de ratas Fisher (FRT) y realizar la caracterización farmacológica de los subtipos de receptores muscarínicos presentes en ellas.
MATERIAL Y MÉTODOSSe han utilizado células epiteliales tiroideas indiferenciadas (Fisher rat thyroid) cultivadas en medio Ham F12 modificado por Coon, suplementado con el 5% de suero bovino, gentamicina (50μg/ml) y anfotericina B (0,25μg/ml). Las células se mantuvieron en incubador a 37°C en una atmósfera con el 95% de aire y el 5% de CO2.
Para la caracterización de los receptores colinérgicos muscarínicos presentes en la membrana plasmática de células FRT se llevó a cabo estudios de unión de receptores a radioligando: cinéticas de asociación, cinéticas de disociación y competiciones entre diversos fármacos antagonistas muscarínicos. El radioligando empleado fue 3H-N-metil-escopolamina (3H-NMS), antagonista no selectivo que no discrimina entre los diferentes subtipos de receptores muscarínicos. Los fármacos antagonistas muscarínicos utilizados en los estudios de competición fueron los siguientes: pirenzepina, AFDX 116, himbacina, 4-DAMP, diciclomina y HHSD. Los datos se analizaron con el programa iterativo LIGAND, modificado por Mc Pherson15. Los coeficientes de Hill (nH) se obtuvieron ajustando los datos de los experimentos de unión a una ecuación logística de 4 parámetros con el programa de gráficos GraphPad Prism (v. 2.01). Las proteínas se midieron con el método de Lowry et al16, empleando albúmina bobina (BSA) como estándar.
RESULTADOSLos experimentos cinéticos realizados sobre la unión del radioligando a los receptores muscarínicos presentes en las preparaciones de membrana plasmática de células FRT muestran que la unión del radioligando 3H-NMS fue dependiente de temperatura, tiempo y concentración.
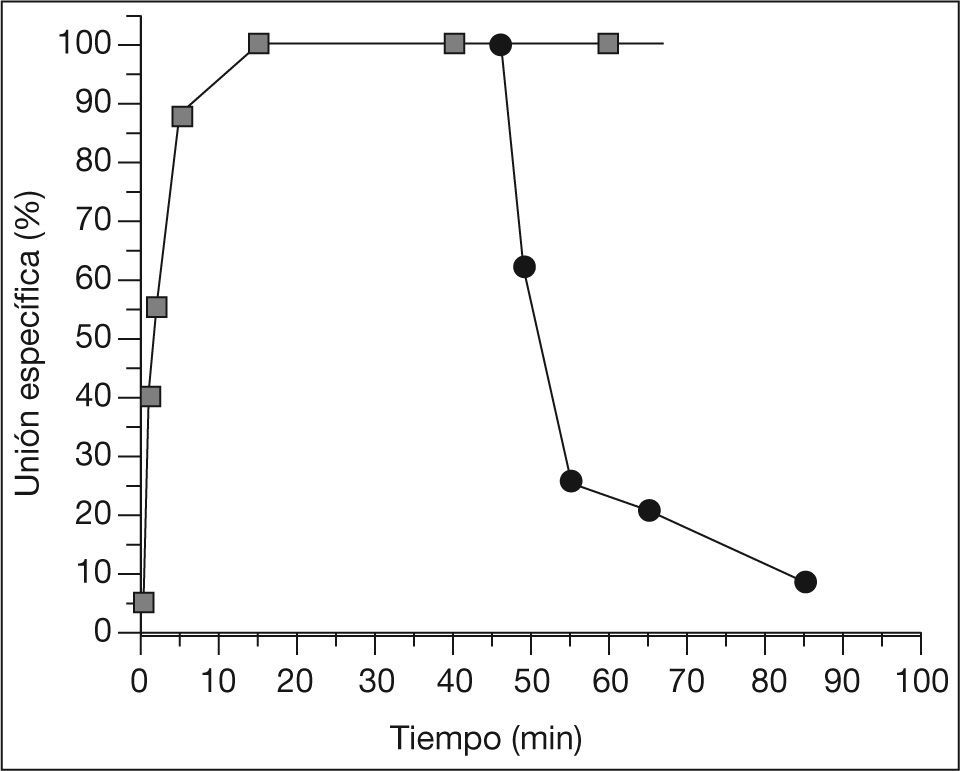
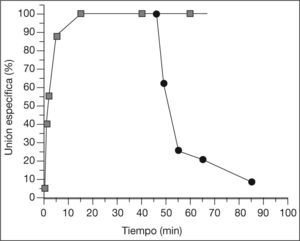
En todos los casos, independientemente de la concentración de 3H-NMS, la unión del radioligando al receptor aumentó progresivamente con el tiempo de incubación hasta alcanzar una unión estable a los 15min (fig. 1), unión que luego se mantuvo estable hasta los 90min, el tiempo máximo estudiado. La constante de disociación en situación de equilibrio (Kd), determinada a partir del cociente entre las constantes de velocidad de disociación (Koff) y de asociación (Kon) para este radioligando, fue de 0,44nmol (tabla 2).
Valores de las constantes de velocidad de asociación y disociación y constante de disociación en estado de equilibrio del ligando por su receptor
| Kon (M−1m−1) | 5,23 E+8 |
| Koff (m−1) | 0,232 |
| Kd = Koff/ Kon (nmol) | 0,44 |
Kd: constante de disociación en situación de equilibrio; Koff: constante de velocidad de disociación; Kon: constante de velocidad de asociación.
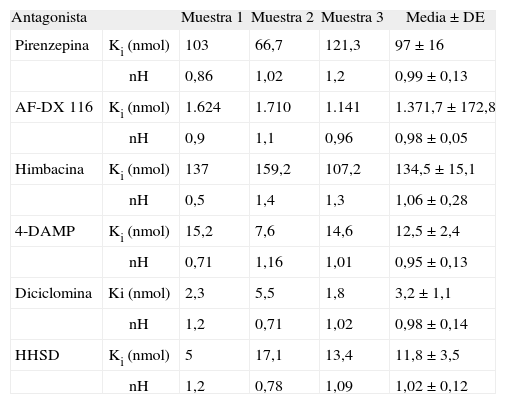
En la tabla 3 se muestran los resultados comparativos de los experimentos de competición de la unión de 3H-NMS frente a los distintos fármacos antagonistas muscarínicos utilizados: pirenzepina, AF-DX 116, himbacina, 4-DAMP, diciclomina y HHSD. Los resultados ponen de manifiesto claras diferencias en términos de afinidad entre estos antagonistas. Así, la potencia de inhibición de la unión del 3H-NMS para los fármacos antagonistas utilizados fue: diciclomina > HHSD = 4-DAMP > pirenzepina > himbacina = AFDX 116. El coeficiente de Hill (nH) fue, en todos los casos, cercano a la unidad, y el análisis de los datos, con el programa LIGAND, mostró que nuestros datos experimentales se ajustaban a un modelo de un solo sitio de unión, y fue imposible realizar un ajuste de estos datos a un modelo de dos sitios de unión.
Resultados de los experimentos y valores medios de los estudios de competición de la unión de 3H-N-metil-escopolamina (3H-NMS) frente a diversos antagonistas selectivos de los receptores muscarínicos
| Antagonista | Muestra 1 | Muestra 2 | Muestra 3 | Media ± DE | |
| Pirenzepina | Ki (nmol) | 103 | 66,7 | 121,3 | 97 ± 16 |
| nH | 0,86 | 1,02 | 1,2 | 0,99 ± 0,13 | |
| AF-DX 116 | Ki (nmol) | 1.624 | 1.710 | 1.141 | 1.371,7 ± 172,8 |
| nH | 0,9 | 1,1 | 0,96 | 0,98 ± 0,05 | |
| Himbacina | Ki (nmol) | 137 | 159,2 | 107,2 | 134,5 ± 15,1 |
| nH | 0,5 | 1,4 | 1,3 | 1,06 ± 0,28 | |
| 4-DAMP | Ki (nmol) | 15,2 | 7,6 | 14,6 | 12,5 ± 2,4 |
| nH | 0,71 | 1,16 | 1,01 | 0,95 ± 0,13 | |
| Diciclomina | Ki (nmol) | 2,3 | 5,5 | 1,8 | 3,2 ± 1,1 |
| nH | 1,2 | 0,71 | 1,02 | 0,98 ± 0,14 | |
| HHSD | Ki (nmol) | 5 | 17,1 | 13,4 | 11,8 ± 3,5 |
| nH | 1,2 | 0,78 | 1,09 | 1,02 ± 0,12 | |
AF-DX 116: 11-[[2-[(dietil-amino)metil]-1-piperidinil]acetil]-5,11-dihidro-6H-pirido(414)benzodiacepina; 4-DAMP: 4-difenilacetoxi-N-metilpiperidina metiodida; HHSD: hexahidrosiladifenidol; Ki: constante de inhibición; nH: coeficientes de Hill.
En cultivos primarios de células tiroideas y en células epiteliales diferenciadas de tiroides FRTL-5 la estimulación con carbacol produce importantes cambios metabólicos y funcionales que afectan, de forma directa, a la formación de hormonas tiroideas17-23, lo que indica que hay receptores muscarínicos en la glándula tiroides. Sin embargo, la naturaleza y los subtipos de receptores expresados en estas células permanecen, por el momento, poco claros. Mientras que algunos estudios indican que hay una sola población de sitios de unión en la membrana plasmática de los tirocitos, los efectuados en preparaciones de membrana plasmática de células FRTL-5 apuntan a dos lugares posibles de unión de alta y baja afinidad para la 3H-NMS, y proponen que hay dos subtipos de receptores muscarínicos según la inhibición de diferentes rutas de señalización intracelular; uno sensible a la pirenzepina, antagonista de los receptores de subtipo M1, implicado en la activación de la fosfolipasa A2 (PLA2), y otro insensible a la pirenzepina, relacionado con la disminución de la actividad fosfolipasa C (PLC)24,25.
De acuerdo con el objetivo planteado, hemos efectuado una caracterización de los receptores muscarínicos presentes en células epiteliales tiroideas no diferenciadas FRT. Los resultados obtenidos indican que hay sitios de unión específicos y saturables para el ligando muscarínico 3H-NMS, y la unión del radioligando es dependiente de tiempo, temperatura y concentración en la membrana plasmática de células tiroideas FRT.
La constante de disociación en situación de equilibrio (Kd) guarda una estrecha correlación con los valores de Kd obtenidos en varias preparaciones de tejidos26-28 y en diferentes líneas celulares que expresan los distintos subtipos de receptores muscarínicos29. Además, el número de receptores por miligramo de proteína que pueden ser marcados con 3H-NMS en la membrana plasmática de células tiroideas FRT es comparable con el encontrado en otros tejidos humanos, como la glándula submandibular y en membranas de placenta humana a término30. Estos hallazgos muestran, inequívocamente, que hay receptores colinérgicos muscarínicos en la membrana plasmática de células epiteliales tiroideas FRT con una población única y muy homogénea de sitios de unión para 3H-NMS, en contra de otros trabajos25.
Una vez demostrado que hay receptores muscarínicos en las preparaciones de membrana plasmática de células FRT, nos planteamos estudiar las características de la unión de diversos antagonistas selectivos en estos receptores con el fin de clarificar qué subtipo en concreto es el localizado en células epiteliales tiroideas. Para ello, realizamos experimentos de competición de la unión de 3H-NMS frente a antagonistas que muestran cierta selectividad por determinados subtipos.
La constante de inhibición (Ki) obtenida en nuestros experimentos sobre preparaciones de membrana plasmática de células tiroideas FRT con pirenzepina, un antagonista selectivo para el subtipo M1 pero que también muestra cierta selectividad por el subtipo M3, fue más parecida a los valores de Ki de este antagonista sobre el subtipo M3 que para el subtipo M1 cuando se estudia sobre tejidos de mamíferos31,32, y más parecida a los valores encontrados para el subtipo M3 que para el subtipo M1 cuando se estudia en células transfectadas que expresan sólo este subtipo de receptor colinérgico29,33. Estos hallazgos, en términos de alta afinidad para la pirenzepina, fueron concordantes con los obtenidos cuando utilizamos como competidor otro antagonista selectivo, el AF-DX 116, un fármaco que muestra selectividad por el receptor subtipo M2 y, en menor proporción, por el subtipo M4 y que mostró baja afinidad para los receptores localizados en la membrana plasmática de células tiroideas epiteliales FRT. Los valores de Ki para este antagonista fueron muy similares a los encontrados33 en líneas celulares transfectadas que expresaban solamente el receptor subtipo M3. La existencia de una población homogénea de subtipos de receptores colinérgicos se mantiene por el coeficiente de Hill obtenido en los experimentos de competición con los antagonistas pirenzepina y AF-DX 116. Dado que estos dos antagonistas son selectivos para el subtipo M1 y M2 respectivamente, si la población de receptores presentes en membranas plasmáticas de células FRT no correspondiese a un solo subtipo, necesariamente deberíamos encontrar un coeficiente de Hill inferior a la unidad, cosa que no ocurrió en nuestro estudio.
Para confirmar la presencia de receptores subtipo M3 en membrana plasmática de células tiroideas FRT, realizamos nuevos experimentos de competición de la unión del antagonista no selectivo 3H-NMS frente a los antagonistas HHSD, 4-DAMP, himbacina y diciclomina. En membrana plasmática de células tiroideas FRT, el HHSD, un antagonista moderadamente selectivo para el subtipo M3, mostró valores de Ki más cercanos a los encontrados para los receptores subtipo M3 que para los de subtipo M1 cuando se expresan en líneas celulares transfectadas con un solo subtipo de receptor33. Además, los valores de Ki determinados para el 4-DAMP en las mismas membranas estuvieron más cercanos a los valores encontrados26 para el subtipo M3 que para el Mp mientras que la himbacina y la diciclomina29 mostraron valores de Ki similares a los determinados en líneas celulares que expresan el receptor subtipo M3. En todos los casos, los coeficientes de Hill obtenidos fueron cercanos a la unidad, lo que confirma que la unión de todos estos antagonistas se estaba realizando sobre una población homogénea y única de subtipos de receptores muscarínicos.
Del análisis pormenorizado de los resultados, podemos destacar que la información obtenida con el antagonista pirenzepina indica la exclusión del receptor subtipo M1 como el receptor expresado en células tiroideas FRT. Los resultados derivados de nuestros experimentos con AF-DX 116 también excluyen a los receptores subtipo M2 y M4 como los receptores expresados en células no diferenciadas FRT; este hecho también es congruente con los resultados obtenidos con los antagonistas himbacina y diciclomina. Además, los resultados de los experimentos con 4-DAMP y HHSD apuntan al receptor subtipo M3 como el receptor presente en células epiteliales no diferenciadas tiroideas FRT. Todos estos resultados apoyan la propuesta de que el receptor muscarínico presente en células epiteliales no diferenciadas tiroideas FRT pertenece al subtipo M3.
A pesar de estos claros resultados, son necesarios nuevos estudios que evalúen el papel de la activación de los receptores muscarínicos en condiciones fisiológicas y en diferentes situaciones de enfermedad, así como el posible papel modulador de la manipulación farmacológica de dichos receptores en condiciones de hipofunción o hiperfunción tiroidea.
Las células FRT fueron generosamente donadas por el Prof. Dr. Bruno de Jeso del Centro di Endocrinología ed Oncologia Sperimentale G. Salvatore, CNR (Italia).