Aunque el carcinoma diferenciado de tiroides, papilar o folicular, tiene habitualmente un buen pronóstico, existe un porcentaje de casos que presentan un comportamiento más agresivo con recurrencias locales y metastatización, ya sea en el momento del diagnostico (en menos de un 5% de los casos) ya en el seguimiento. A pesar de que existen diferentes sistemas de evaluación del pronóstico del carcinoma diferenciado de tiroides, basados especialmente en datos clínicos y patológicos, no hay en la actualidad un criterio válido que permita definir un tratamiento diferencial entre los pacientes con carcinomas de bajo riesgo y aquellos con carcinomas más agresivos. La identificación de los pacientes de riesgo en el momento del diagnóstico sería clave para desarrollar nuevas estrategias terapéuticas y mejorar el seguimiento, siendo en este sentido los biomarcadores moleculares una herramienta de gran valor.
Although papillary or follicular well-differentiated thyroid carcinoma usually has a good prognosis, a proportion of well-differentiated thyroid carcinomasshow a more aggressive behavior with local recurrence and metastases, either at diagnosis (in less than 5% of cases) or over time. Although there are several scoring systems to assess prognosis of well-differentiated thyroid carcinoma, mainly based on clinical and pathological data, there is currently no valid criterion to define an adequate, differential treatment for patients with low risk carcinomas as compared to those with more aggressive tumors. Identification of patients with a high risk at the time of diagnosis would be essential to develop new therapeutic strategies and to improve follow-up, and molecular biomarkers could be a highly useful tool for this purpose.
El carcinoma diferenciado de tiroides constituye la neoplasia endocrina más frecuente con una incidencia creciente en los últimos años1,2. Más del 90% se origina en la célula folicular, clasificándose en carcinoma bien diferenciado (CDT) que incluye las variantes papilar (CPT) y folicular (CFT), y carcinoma indiferenciado o anaplásico (CAT), constituyendo este último una de las neoplasias más agresivas, con una supervivencia media de 5 meses desde el diagnóstico, sobreviviendo únicamente un 20% de los pacientes al año del diagnóstico3.
La mayoría de los tumores bien diferenciados tienen un curso clínico favorable con supervivencias próximas al 90% a los 10 años del diagnóstico4–6. Sin embargo, existe un porcentaje de casos que presentan un comportamiento más agresivo con recurrencias locales y metastatización ya sea en el momento del diagnostico (en menos de un 5% de los casos) o en el seguimiento, habiéndose estimado que alrededor de un 10-15% de los pacientes con carcinoma diferenciado desarrollará una metástasis local o a distancia7,8. La supervivencia descrita a los 10 años de la aparición de una metástasis cervical oscila entre el 49-68%, siendo responsables de un tercio de las muertes relacionadas con la enfermedad. Las metástasis a distancia se localizan en pulmón (50%), hueso (25%) pulmón y hueso (20%) y otras localizaciones (5%). La supervivencia tras el diagnóstico de una metástasis a distancia se reduce al 25-42%9.
El tratamiento del carcinoma diferenciado de tiroides de bajo riesgo no ha variado de manera sustancial en las ultimas décadas y se basa en el tratamiento quirúrgico, la ablación con I131 y el tratamiento supresor con levotiroxina10, aunque con una tendencia cada vez mayor a basar tanto las recomendaciones de tratamiento como de seguimiento en una evaluación individualizada del riesgo7,11. En este sentido la evaluación de pacientes de alto riesgo en el momento del diagnostico sería clave para establecer el tratamiento más adecuado. La mayoría de los sistemas de evaluación se basan en datos clínicos y patológicos, habiéndose identificado diferentes factores de riesgo como la edad al diagnóstico, el sexo, el tamaño, la presencia de metástasis y el tratamiento inicial aplicado6,12,13.
La tasa de respuesta al tratamiento convencional es elevada, con una supervivencia global superior al 75%; sin embargo, los pacientes que sufren procesos de desdiferenciación (carcinoma pobremente diferenciado [CPDT]) con enfermedad yodorrefractaria (presencia de al menos una lesión no captante o con progresión en el año siguiente al tratamiento con I131) presentan una supervivencia media tras el diagnóstico de metástasis a distancia de 3 a 6 años, y aunque el crecimiento es lento, la mayoría de las metástasis progresan, por lo que son pacientes candidatos a otras modalidades terapéuticas14, siendo uno de los objetivos principales de los clínicos diferenciar este subgrupo del CDT de buen pronóstico.
Por ello resulta fundamental conocer el proceso de desdiferenciación o transformación anaplásica de estos tumores. En los últimos años se ha alcanzado un mayor conocimiento acerca de los biomarcadores moleculares relacionados con el este proceso, y por tanto con el pronóstico y la supervivencia, lo que está permitiendo establecer nuevas dianas terapéuticas.
Biomarcadores: definiciónEn términos médicos, cuando se habla de biomarcador se está haciendo referencia a aquellos parámetros biológicos que puedan ser medidos o detectados y que a su vez puedan ser correlacionados con un proceso patológico. No obstante, para que estos parámetros puedan ser considerados como un verdaderos biomarcadores deben cumplir una serie de criterios, los cuales fueron descritos por Herberman en 1977, tales como: 1) su medición debe ser simple, reproducible y fácilmente disponible; 2) deben discriminar entre la normalidad y el proceso patológico; 3) deben tener una gran sensibilidad y especificidad; y finalmente, 4) deben ser capaces de monitorizar los procesos recurrentes de la enfermedad15.
Durante los últimos años el desarrollo de nuevas tecnologías aplicadas al conocimiento molecular de las enfermedades ha contribuido de manera significativa a la identificación de nuevos biomarcadores, denominados biomarcadores moleculares. Estos nuevos biomarcadores han sido sin duda de una gran relevancia, ya que nos han permitido profundizar en el conocimiento de la etiopatogenia de muchas enfermedades identificando, al menos parcialmente, los mecanismos moleculares implicados, especialmente en los procesos neoplásicos, y han proporcionado una información valiosa tanto a nivel diagnóstico y pronóstico como terapéutico. Sin embargo, la existencia de numerosos factores, no solo genéticos o epigenéticos, sino también ambientales, que de forma directa o indirecta están implicados en el inicio tumoral y en su progresión metastásica, hace que en muchas ocasiones la elección de estos nuevos biomarcadores sea compleja, lo que constituye una de sus limitaciones más importantes en la práctica clínica. Existen diferentes tipos de biomarcadores en enfermedad tumoral tiroidea que se revisan a continuación.
Marcadores serológicosEn el caso de los tumores tiroideos de estirpe epitelial uno de los primeros biomarcadores tejido-específico utilizado fue la tiroglobulina (TG), glucoproteína producida por las células foliculares del órgano. Sin embargo, a pesar de que este marcador sérico es útil para evaluar la presencia de tumor residual o metastático en pacientes que han sido sometidos a tiroidectomía total, numerosos estudios apuntan a su nula eficacia en la detección de poblaciones de alto riesgo para el desarrollo de este tipo de tumor16. Por otra parte, los ensayos de TG pueden a su vez no ser fiables en aquellos pacientes que están sometidos a terapias supresoras con levotiroxina, y en pacientes que desarrollan algunos tipos de dolencias benignas: tiroiditis, tirotoxicosis, adenomas tiroideos, o situaciones como la deficiencia en yodo. En estos últimos casos es frecuente poder observar falsos positivos debido a un aumento de la TG sérica17.
Marcadores genómicos y transcriptómicosEs bien conocido que el proceso de la carcinogénesis es el resultado de una acumulación aleatoria de aberraciones genéticas y epigenéticas en los tejidos, habiéndose descrito al menos un 10-20% de cambios de expresión génica en las células tumorales. Estas alteraciones están directamente producidas por alteraciones en el ADN de las células, siendo las que contribuyen de manera significativa al proceso de oncogénesis en prácticamente todos los cánceres humanos18,19. Inicialmente los primeros estudios se centraron en la identificación y posterior análisis de tan solo uno o varios genes implicados en el inicio, desarrollo y metástasis de los tumores. Así, en el caso de la glándula tiroidea y ante las discrepancias observadas por diferentes autores en la detección de las determinaciones de la TG sérica en los pacientes, una de las primeras elecciones propuestas fue la detección del transcrito de la TG en la sangre de estos pacientes como alternativa a su detección proteica. Sin embargo los resultados obtenidos demostraron una gran variabilidad, no pudiéndose observar diferencias de expresión entre los individuos controles utilizados en los estudios frente a los individuos afectos de enfermedad17,20–22. Otro marcador propuesto fue la detección de la presencia del transcrito del receptor de la hormona estimulante del tiroides (TSH). Este receptor actúa como principal regulador, a través de la TSH, del proceso de diferenciación y división de las células foliculares tiroideas, no así en células foliculares patológicas, que son insensibles o resistentes a dicha estimulación. Sin embargo, a pesar de que diferentes estudios de expresión génica demostraron una modificación parcial o total de la misma en los carcinomas diferenciados de tiroides, los resultados no fueron concluyentes, ya que tanto la TG como la TSH por si solas no permitían discriminar entre los diferentes gados de malignidad de los tumores ni su progresión a tumores más agresivos23–25.
A continuación pasamos a describir los hallazgos más relevantes en cuanto a expresión de marcadores genómicos y transcriptómicos según las características histológicas de los tumores
Tumores bien diferenciados: carcinoma diferenciado de tiroides variante papilar y variante folicularUnas de las primeras alteraciones descritas son las mutaciones en los oncogenes de la familia RAS que afectan tanto al GTP en los codones 12, 13 como al dominio GTPasa del codón 61 de la proteína, con una prevalencia similar en tumores benignos y malignos; algunos autores encuentran estas mutaciones en aproximadamente un 50% de los CFT analizados, lo que puede sugerir su implicación en alteraciones tempranas asociadas en el proceso de transformación de las células foliculares tiroideas26,27.
El proto-oncogén RET localizado en el cromosoma 10q112 ha sido descrito en un 50% de los CPT diagnosticados, denominándose RET/PTC. Las formas activas del proto-oncogén RET son consecuencia de reordenamientos y fusiones oncogénicas del dominio tirosina cinasa del gen RET con el 5 ‘de dominio de diferentes genes, observándose distintas variantes (RET/PTC1, -2,–3, -4 y -5)28. Sin embargo, a pesar de existir estudios que identifican RET/PTC como un buen marcador genético en los CPT, otros trabajos identifican dichas mutaciones en nódulos benignos29,30
También se ha estudiado la tirosina cinasa, que puede ser activada de forma inadecuada en los CPT. Sin embargo, el mecanismo molecular es desconocido y no existen validaciones en tumores benignos31.
Factores angiogénicos como, por ejemplo, VEGF (vascular endotelial growth factor), han sido identificados en los tirocitos del CDT, correlacionándose su expresión con el grado de desdiferenciación tumoral, por lo que se ha propuesto como un marcador de mal pronóstico implicado en procesos de metástasis en el CPT32,33. Otro factor de crecimiento implicado en la tumorogénesis es el EGF (epidermal growth factor), que además de promocionar la proliferación celular en el tiroides, actúa inhibiendo funciones tiroideas específicas como el transporte de yodo, su organificación, y la síntesis de peroxidasa y TG. Es decir, promueve la proliferación de la célula tiroidea, pero no su diferenciación. Por último, el TGFalfa (tumor growth factor alpha), interacciona con el EGF receptor (EGF-R), y contribuye junto con el EGF al estímulo proliferativo celular. Sin embargo, la expresión en el núcleo tanto de EGF como de su receptor (EGF-R) es detectada no solo en el CFT sino también en la enfermedad de Graves y en adenomas34.
No ha sido hasta la secuenciación masiva del genoma humano y los avances tecnológicos posteriores aplicados, como por ejemplo las técnicas de arrays y/o microarrays, cuando se han podido identificar nuevas dianas moleculares implicadas en procesos claves de la regulación celular (vías de señalización, factores de transcripción, alteraciones en las moléculas de adhesión como indicadores de agresividad tumoral) y perfiles moleculares específicos (también llamadas firmas genéticas) asociadas a una variedad de patrones clínicos. Los avances realizados en la búsqueda de estos perfiles genéticos específicos han sido importantes para poder diferenciar en muchos casos el comportamiento biológico entre entidades estrechamente relacionadas entre ellas, que sin tener patrones histológicos diferenciales, clínicamente presentaban importantes diferencias en la evolución de la enfermedad. En el caso del tiroides, los análisis llevados a cabo entre los adenomas foliculares o tumores benignos frente a carcinomas, permitieron identificar una serie de alteraciones genéticas diferenciales tales como la distinta expresión del gen galectina-3, diferencias en la actividad telomerásica y la detección de la translocación del gen PAX8/PPARγ entre otras. Sin embargo ninguno de estos marcadores presentaba suficiente fiabilidad para poder diferenciar con seguridad entre tumores benignos y malignos en muestras citológicas35,36.
Paralelamente, estas nuevas estrategias diagnósticas se aplicaron en el estudio del CPT37–40. Así, en el año 2001, uno de los primeros estudios en los que se aplicaban las técnicas de array en estos tipos de tumores fue el descrito por Huang et al., donde los autores fueron capaces de identificar 220 genes diferencialmente expresados; Sin embargo, algunos ellos no pudieron ser validados posteriormente en una nueva cohorte de CPT, lo que constituye un punto crítico del estudio41.
Estudios posteriores realizados por Giordano et al. en 2005 identificaron una firma genética asociada a mutaciones en los genes BRAF, RAS y RET/PTC en CPT; el estudio de la misma permitía diferenciar tumores de estirpe epitelial que presentaban distintos patrones histológicos (patrón clásico papilar y sus diferentes variantes), constituyendo así el primer trabajo que identifica patrones de expresión génica y su correlación mutacional. Esto permite no solo predecir el posible éxito de la terapia aplicada, sino contemplar nuevas dianas celulares que permitan diseñar nuevas estrategias terapéuticas42. Así, mutaciones en el gen RAS fueron detectadas por Capella et al. en diferentes tipos de lesiones tiroideas, incluyendo CAT, confirmando su papel en la tumorogénesis, aunque no se pudo determinar su relación con el pronóstico43. Posteriormente la detección de hipermetilacion del promotor de PTEN, especialmente en tumores foliculares, fue indicativa de su posible papel durante el inicio o evolución del tumor44.
A partir de este momento el número de trabajos dirigidos a la identificación de nuevos marcadores y firmas genéticas que pudieran ser aplicados en la clínica se incrementó, aumentando también el tamaño de las series estudiadas. Estudios recientes con un importante número de pacientes (n=1.168) confirmaban que mutaciones en gen BRAFv600E eran relevantes en el CPT y estaba asociado a una mayor aumento en la recurrencia, mortalidad y pérdida de la capacidad de captación de 131I, pudiéndose utilizar como biomarcador para este tipo de tumores. Sin embargo, tenía poco poder pronóstico en tumores esporádicos que no presentaban la mutación, por lo que su utilidad como prueba diagnóstica y pronóstica no era concluyente45,46.Un trabajo reciente analiza la relación de la presencia de la mutación BRAFT1799A como indicador de recidiva o persistencia del CPT, sin que pueda concluirse que la presencia de la misma confiera un peor pronóstico47.
Metanálisis realizados por Griffith et al., basados en 21 trabajos publicados, los cuales utilizaban la misma tecnología de Affimetrix, identificaron, que de los 1.785 genes diferencialmente expresados, solo 39 fueron los más significativos, destacando 12 genes candidatos, 6 de los cuales ya habían sido descritos anteriormente (MET, TFF, SERPINA!, TIMP1, FN1 y TPO) y 6 de ellos eran genes candidatos (TGFA, QPCT, CRABP1, FCGBP, EPS8 y PROS1), identificados por primera vez en tiroides que podían representar junto con los anteriores una herramienta diagnóstica válida en el entorno clínico48.
Tumores desdiferenciados y anaplásicos (carcinoma indiferenciado o anaplásico y carcinoma pobremente diferenciado)Carcinoma indiferenciado o anaplásicoExisten pocos estudios de expresión génica en tumores más agresivos cuya etiología sigue siendo muy discutida, no habiéndose identificado todavía ningún agente específico clave para el desarrollo de los mismos (se ha sugerido, por ejemplo, un papel de la TSH y/o la irradiación externa en la promoción del desarrollo de estos tumores)49.
Existe correlación entre la frecuencia de la pérdida de heterocigosidad y el pronóstico del carcinoma del tiroides. Se ha observado que es superior en el CAT respecto a CPT y CFT, donde encontramos una pérdida de heterocigosidad en 19p hasta en el 36% de los casos26. También se ha observado que con frecuencia existen pérdidas localizadas en el brazo corto del cromosoma 16, lo que indicaría la probable ausencia de un gen supresor en esta localización. Esta observación se ve avalada por el hecho de que se ha visto que líneas celulares de CAT presentan frecuentemente pérdidas de 16p con respecto a líneas celulares de carcinoma diferenciado, lo que sugiere la existencia de algún gen en esta localización que puede asociarse a la transformación desde carcinoma bien diferenciado a indiferenciado50.
Por otro lado, estudios de microarrays en estos tumores han identificado grupos de genes relacionados con diferentes vías de señalización entre los que cabe destacar factores de trascripción, mitosis, proliferación y diferenciación celular, apoptosis, moléculas de adhesión celular, citoesqueleto etc.45,46,51–53, sin haber encontrado ninguna firma genética consistente. Se han identificado, al igual que en tumores diferenciados, mutaciones en el gen RAS y en BRAF, lo que hace hipotetizar que podrían ser los primeros pasos en el proceso de desdiferenciación y que a su vez permitan la adquisición de nuevas mutaciones (mutaciones tardías) entre las que se incluyen las identificadas en los genes: TP53, catenina (cadherina proteína asociada), beta 1, y PIK3CA; sugiriéndose que todas estas mutaciones acumuladas en este tipo de tumores contribuyeran a la conducta extremadamente agresiva de los mismos. Por el contrario, reordenamientos del gen RET/PTC identificados en la infancia y en CPT posradiación o la proteína de fusión PAX8/PPARG detectada en el CFT no se identifican en los carcinomas mal diferenciados o en los tumores anaplásicos54. De esta transformación posmaligna asociada a mutaciones genéticas surge el concepto de «transformación anaplásica», concepto interesante pero controvertido55.
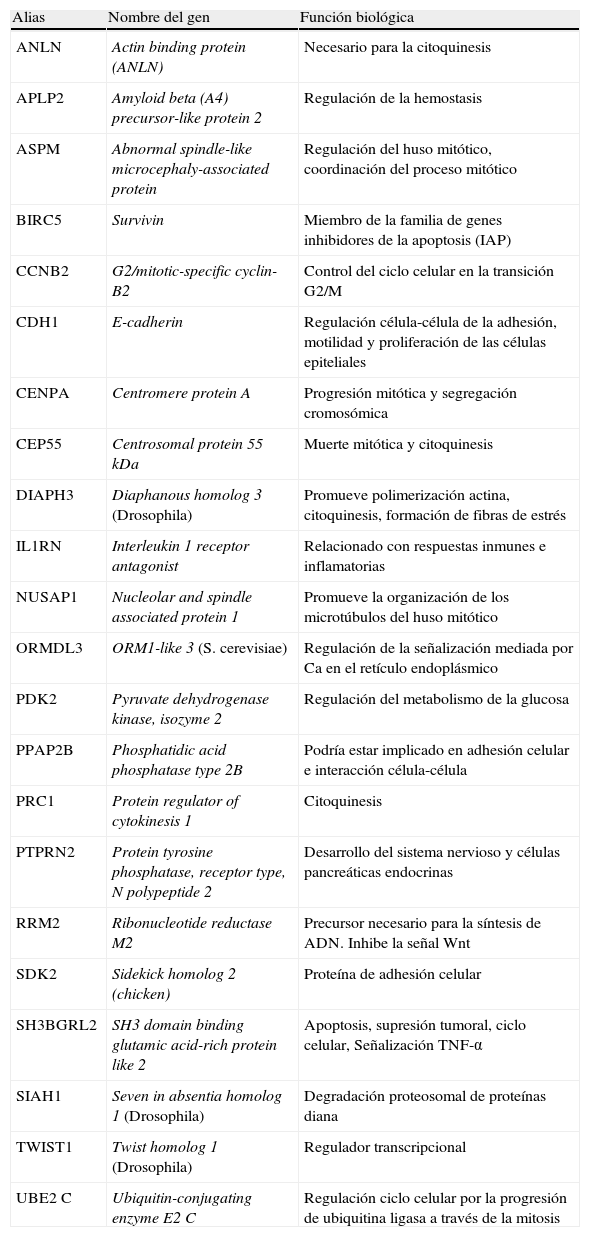
Carcinoma pobremente diferenciadoLos CPDT, reconocidos en el año 2004 por la Organización Mundial de la Salud como entidad patológica propia, presentan desde un punto de vista molecular una expresión diferencial respecto al resto de los tumores descritos. Así, en el año 2008 nuestro grupo56 estudió este tipo de tumores (n=6) y comparó la expresión diferencial de los mismos respecto a los tumores CAT (n=6) y un grupo de tumores bien diferenciados (n=31). Este trabajo identificó 1.031 genes diferenciales, implicados en distintas vías de señalización celular: MAPKinasas, genes implicados en la regulación del ciclo celular, adhesión celular, citoesqueleto y las vías de TGFβ. De entre todos estos genes, 23 de ellos conformaban una firma genética que confiere mal pronóstico (tabla 1), firma que está siendo validada en una nueva cohorte de pacientes. En la actualidad se han analizado 22 de los 23 genes identificados mediante tecnología de arrays de baja densidad en un total de 19 tumores bien diferenciados en el momento del diagnóstico, 7 de los cuales son CFT y 12 CPT. Los datos analizados identifican grupos de genes diferenciales entre los 2 tipos de tumores, de manera que en CPT se identifican: PTPRN2, TWIST1, ANLN, PRC1, RRM2 y en CFT encontramos a APLP2, PPAP2B, SIAH1 y CEP5548. El siguiente paso consistirá en analizar de forma prospectiva la diferente expresión de estos grupos de genes entre tumores que sufren un proceso de desdiferenciación durante la evolución y los que no57.
Firma genética identificada por Montero et al., que está siendo analizada en una nueva cohorte de pacientes
| Alias | Nombre del gen | Función biológica |
| ANLN | Actin binding protein (ANLN) | Necesario para la citoquinesis |
| APLP2 | Amyloid beta (A4) precursor-like protein 2 | Regulación de la hemostasis |
| ASPM | Abnormal spindle-like microcephaly-associated protein | Regulación del huso mitótico, coordinación del proceso mitótico |
| BIRC5 | Survivin | Miembro de la familia de genes inhibidores de la apoptosis (IAP) |
| CCNB2 | G2/mitotic-specific cyclin-B2 | Control del ciclo celular en la transición G2/M |
| CDH1 | E-cadherin | Regulación célula-célula de la adhesión, motilidad y proliferación de las células epiteliales |
| CENPA | Centromere protein A | Progresión mitótica y segregación cromosómica |
| CEP55 | Centrosomal protein 55kDa | Muerte mitótica y citoquinesis |
| DIAPH3 | Diaphanous homolog 3 (Drosophila) | Promueve polimerización actina, citoquinesis, formación de fibras de estrés |
| IL1RN | Interleukin 1 receptor antagonist | Relacionado con respuestas inmunes e inflamatorias |
| NUSAP1 | Nucleolar and spindle associated protein 1 | Promueve la organización de los microtúbulos del huso mitótico |
| ORMDL3 | ORM1-like 3 (S. cerevisiae) | Regulación de la señalización mediada por Ca en el retículo endoplásmico |
| PDK2 | Pyruvate dehydrogenase kinase, isozyme 2 | Regulación del metabolismo de la glucosa |
| PPAP2B | Phosphatidic acid phosphatase type 2B | Podría estar implicado en adhesión celular e interacción célula-célula |
| PRC1 | Protein regulator of cytokinesis 1 | Citoquinesis |
| PTPRN2 | Protein tyrosine phosphatase, receptor type, N polypeptide 2 | Desarrollo del sistema nervioso y células pancreáticas endocrinas |
| RRM2 | Ribonucleotide reductase M2 | Precursor necesario para la síntesis de ADN. Inhibe la señal Wnt |
| SDK2 | Sidekick homolog 2 (chicken) | Proteína de adhesión celular |
| SH3BGRL2 | SH3 domain binding glutamic acid-rich protein like 2 | Apoptosis, supresión tumoral, ciclo celular, Señalización TNF-α |
| SIAH1 | Seven in absentia homolog 1 (Drosophila) | Degradación proteosomal de proteínas diana |
| TWIST1 | Twist homolog 1 (Drosophila) | Regulador transcripcional |
| UBE2C | Ubiquitin-conjugating enzyme E2C | Regulación ciclo celular por la progresión de ubiquitina ligasa a través de la mitosis |
Fuente: Montero-Conde et al.56.
El carcinoma de tiroides es la neoplasia más común del sistema endocrino, suponiendo un 2% del total de cánceres en la especie humana con incidencia creciente en las ultimas 3 décadas (a razón de un 3% anual) sobre todo a expensas de microcarcinomas papilares1. El 90% se originan en la célula folicular y la mayoría se consideran bien diferenciados con un excelente pronóstico. El CDT tiene habitualmente un curso indolente con una supervivencia media a 10 años cercana al 90%. Sin embargo, el CAT provoca el 50% de las muertes relacionadas con el cáncer de tiroides, con una supervivencia media de 6 meses3,58 y algunos pacientes con CDT tienen un pronóstico desfavorable fundamentalmente en relación con procesos de desdiferenciación. El conocimiento de distintos procesos implicados en la carcinogénesis y en los procesos de desdiferenciación permitiría una mejor comprensión de la enfermedad y la posibilidad de aplicar terapias dirigidas. Además, la posibilidad de reconocer firmas genéticas de mal pronóstico entre todos los biomarcadores identificados constituiría una herramienta de gran valor diagnóstico y pronóstico, que nos ayudaría a una mejor estratificación del riesgo, lo que sería de gran utilidad para aplicar estrategias terapéuticas adecuadas así como para desarrollar nuevas alternativas farmacológicas. En este sentido, la posibilidad de disponer de un modelo animal de carcinoma indiferenciado/anaplásico sería de gran utilidad a la hora de investigar in vivo el mecanismo biológico de estos tumores. A su vez permitiría testar nuevas alternativas terapéuticas, como la aplicación de nanopartículas dirigidas contra la célula tumoral, capaces de liberar fármacos, así como el uso de terapias génicas mediante la utilización de células portadoras de genes suicida. Este trabajo está siendo llevado a cabo en la actualidad por nuestro grupo en colaboración con otras instituciones, enmarcadas dentro del proyecto intramural del CIBER-BBN (Cell-Nano-Thyroid [webside caber-bbn.es]).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.