El estado nutricional es un indicador pronóstico en la fibrosis quística (CF). La prevención del deterioro nutricional y de la pérdida de peso son objetivos clínicos principales, ya que están asociados con empeoramiento de la función pulmonar y aumento de la mortalidad.
ObjetivoIdentificar si existe una relación entre los parámetros clínicos de nutrición, y sus cambios relativos, con la función pulmonar (FEV1%) en una cohorte de pacientes adolescentes y adultos con CF.
MétodosAnalizamos de forma retrospectiva una serie de 64 pacientes mayores de 14años. Se recogieron datos del peso, talla e IMC, suplementos nutricionales, y la función pulmonar en fase de estabilidad tanto en el año de realización del primer test de sobrecarga oral de glucosa (OGTT) patológico como en el año previo. Se determinaron los cambios relativos de peso e IMC, y su relación con FEV1%, mediante regresión lineal y ANOVA, así como la influencia del género y la diabetes.
ResultadosLa media de edad de la serie fue de 26,8años (28 mujeres y 36 varones). El 26,7% tenían una tolerancia normal a la glucosa (TGN) y el 18,3% tenían diabetes sin alteración de la glucosa en ayunas (CFRD sin FPG). La media del IMC fue de 20,32, con un peso medio de 53,53kg. El 32,8% tenían un IMC<18,5 y tan solo el 4,7% presentaban sobrepeso. De forma global, un cambio relativo de peso positivo (≥6%) se asociaba con un incremento del FEV1% (9,31%) respecto a los que presentaban una mayor pérdida de peso, de al menos un 2%, los cuales tenían una caída del FEV1 del 12,09%. Los pacientes con CFRD sin FPG presentaban peor función pulmonar si mostraban una pérdida relativa de peso superior al 2%, en comparación con TGN.
ConclusionesEn los pacientes con CF, la ganancia relativa de peso tiene una asociación positiva con el FEV1%, mientras que una pérdida ≥2% tiene una repercusión significativa negativa en la función pulmonar.
Nutritional status is a prognostic factor in cystic fibrosis. Prevention of nutritional impairment and weigh loss are major clinical objectives because they are associated with worsening of lung function and increased mortality.
ObjectiveTo identify a potential relationship of clinical nutrition parameters, and their relative changes, with lung function (FEV1%) in a cohort of adolescent and adult patients with CF.
MethodsA retrospective analysis of 64 patients older than 14years. Weight, height, BMI, and lung function data were collected at a period of disease stability, both in the year of the first abnormal oral glucose tolerance test (OGTT) and in the previous year. Relative changes in weight and BMI, and their relationship with FEV1%, were determined by linear regression and ANOVA tests; influence of gender and diabetes was also assessed.
ResultsMean age of the series (28 females and 36 males) was 26.8years. Normal glucose tolerance (NGT) was found in 26.7%, while 18.3% had diabetes without impaired fasting glucose (CFRD without FPG). Mean BMI was 20.32, with a mean weight of 53.53kg; 32.8% had BMI<18.5, and only 4.7% were overweight. Overall, a positive relative change in weight (≥6%) was associated with an increase in FEV1% (9.31%), as compared to those with a greater weight loss (at least 2%), who had a 12.09% fall in FEV1. Patients with CFRD without FPG had poorer lung function if they had a negative relative change in weight by at least 2% as compared to NGT.
ConclusionsIn patients with CF, a relative weight gain is positively associated to FEV1%, while a relative weight loss of at least 2% has a significant negative impact on lung function.
La fibrosis quística (CF) produce un aumento del gasto energético, de forma que el gasto en reposo aumenta hasta en un 35%. Como consecuencia, existe una predisposición a padecer malnutrición, con un aumento del catabolismo relacionado tanto con el deterioro de la función pulmonar (infecciones de repetición, colonización bacteriana, etc.) como metabólico (insuficiencia pancreática exocrina, alteraciones del metabolismo de los hidratos de carbono)1.
El peso ha sido identificado como un indicador pronóstico, y la prevención de su pérdida es uno de los objetivos del tratamiento en la CF2. Los estudios longitudinales en adultos con CF, como la cohorte de Toronto, también señalan que los pacientes con menor índice de masa corporal (IMC) tienen una peor función pulmonar y mayor porcentaje de insuficiencia pancreática en comparación con los pacientes con sobrepeso u obesidad3.
Además, una escasa ganancia de peso está asociada a un empeoramiento de la función pulmonar y a una mortalidad más temprana. También el grado de intolerancia a los hidratos de carbono y el déficit de insulina se relacionan con el declive de la función pulmonar, de forma que los pacientes con CF y diabetes relacionada con la fibrosis quística (CFRD) tienen mayor riesgo de malnutrición y disfunción pulmonar4.
La enfermedad pulmonar es el principal predictor de mortalidad en estos pacientes, y el ratio de declive anual del porcentaje predicho del volumen espiratorio forzado en el primer segundo (FEV1%) es la variable predictora más importante5. Los niños con CF que aumentan de peso a un ritmo adecuado pueden tener un mejor FEV1%, por lo que el soporte nutricional para mejorar el crecimiento podría contribuir a una adecuada función pulmonar6. En este sentido, se ha relacionado la fuerza diafragmática y de la musculatura respiratoria con el estado nutricional, de forma que la malnutrición puede preceder a la aparición de una alteración en la función pulmonar detectada por test convencionales5,7,8.
Por tanto, el objetivo principal del presente estudio es determinar si existe una relación entre los cambios relativos de los parámetros clínicos de nutrición (peso, IMC) y la función pulmonar (FEV1%) en una cohorte de pacientes adolescentes y adultos con CF. El objetivo secundario es analizar la posible influencia del género y de CFRD en esta posible relación entre la función pulmonar y los parámetros de nutrición definidos.
Material y métodosSujetosLos datos de esta serie se recogieron como parte de las variables de seguimiento en la Unidad Multidisciplinar de Fibrosis Quística del hospital universitario Ramón y Cajal durante los años 2011-2012. Los pacientes fueron diagnosticados de CF según los criterios de Rosenstein y Cutting (1998) y la European Cystic Fibrosis Society. Los criterios de inclusión fueron: diagnóstico de CF, edad mayor de 14años y cribado anual de diabetes mediante la realización de un test de sobrecarga oral de glucosa (OGTT). Se excluyeron los casos de edad menor de 14años y datos incompletos en el OGTT, ausencia de registros de función pulmonar y parámetros nutricionales coincidentes en el tiempo, embarazo, infecciones virales por VIH, VHC y/o VHB, y el trasplante de órgano en el momento o previo a la realización del estudio. Las categorías de alteraciones de los hidratos de carbono utilizadas fueron las definidas según la North American CF Consensus Conference (2010) y la American Diabetes Association (ADA)9, y la realización de las pruebas respiratorias está descrita en trabajos previos10.
Como punto de referencia para la recogida de las variables, se tomó el año de realización del OGTT, en el cual existía alguna alteración en el metabolismo de los hidratos de carbono (o en su defecto el último registrado). Todos los sujetos tenían su peso (kg), talla (m) e índice de masa corporal (IMC; kg/m2) medidos (tomando como referencias las propuestas por la organización mundial de la salud [OMS]), y se recogieron los datos de función pulmonar obtenidos mediante una espirometría en fase de estabilidad, según la norma de procedimientos establecidos en nuestro centro. En el año previo se habían realizado las mismas mediciones como parte del seguimiento rutinario de los pacientes.
Análisis estadísticoSe comprobó la distribución normal de las variables mediante el test de Kolmogorov-Smirnov. Las variables cualitativas se expresaron en frecuencias; las continuas, en medias y desviación estándar (DE), o medianas y rango intercuartil (IQR, Ip25-p75), según correspondiera.
Se calcularon los cambios relativos (Δ) de las variables de peso e IMC, según la siguiente fórmula:
A continuación se procedió a una transformación a unidades estándar (z-score) de estos incrementos relativos (peso, IMC), es decir, se obtuvo una normalización de los porcentajes de cambio relativo obtenidos con la fórmula antes descrita. Con estas variables así obtenidas se procedió a realizar un método de jerarquización (cluster), según el método de Ward o de varianza mínima, ajustando los outliers para ±2DE. De este modo se definieron los grupos de z-score según los siguientes parámetros: ≤−0,5DE (grupo1, pérdida superior al 2%), entre −0,5 y +0,5DE (grupo2, pérdida del −0,5% hasta ganancia de +4,7%) y, finalmente, ≥+0,5DE (grupo3, ganancia superior al 6%).
Se realizó la comparación de los grupos así definidos para Δpeso y ΔIMC con la función pulmonar (FEV1%/ml), en el año del OGTT patológico, así como la influencia del género y de la presencia de diabetes (CFRD) o tolerancia normal (TGN). Para esta comparación se utilizó el método de ANOVA (univariado y múltiple, según estuviera indicado), y los test de Student-Newman-Keuls y Bonferroni para el cálculo del porcentaje de cambio de cada grupo. Los porcentajes de pérdida o ganancia de la función pulmonar en cada grupo de z-score fueron expresados tomando como referencia la media de FEV1 (% y ml), según los test indicados.
Para comparar los cambios relativos entre las variables nominales se aplicó el test de la t de Student y la χ2 de Pearson, según correspondiera.
También se realizó un modelo general con regresión lineal múltiple, con estrategia hacia atrás (backward), entre el FEV1% y estado nutricional (Δpeso, ΔIMC), ajustada por género (mujer, varón) y suplementos nutricionales y vitamínicos. Se realizaron ajustes para los outliers, nuevamente tomando como referencia los valores atípicos con±2DE.
Para todos los análisis se consideró una p significativa bilateral<0,05. Los análisis estadísticos fueron realizados con los programas SPSS versión 18.0 (Chicago, IL, EE.UU.) y MedCalc Statistical Software, versión 13.1.2 (MedCalc Software bvba, Ostende, Bélgica; http://www.medcalc.org; 2014).
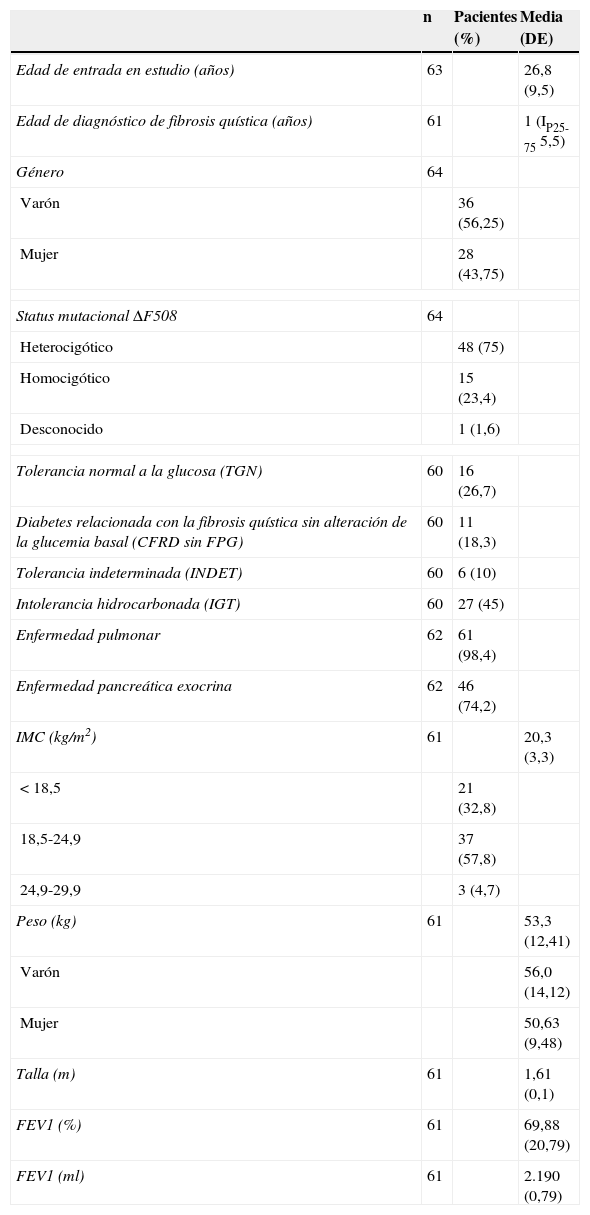
ResultadosCaracterísticas generalesLas características generales y las principales variables estudiadas en la cohorte se encuentran resumidas en la tabla 1.
Características clínicas, genéticas y de función pulmonar de los pacientes sometidos a test de sobrecarga oral de glucosa
| n | Pacientes (%) | Media (DE) | |
|---|---|---|---|
| Edad de entrada en estudio (años) | 63 | 26,8 (9,5) | |
| Edad de diagnóstico de fibrosis quística (años) | 61 | 1 (IP25-75 5,5) | |
| Género | 64 | ||
| Varón | 36 (56,25) | ||
| Mujer | 28 (43,75) | ||
| Status mutacional ΔF508 | 64 | ||
| Heterocigótico | 48 (75) | ||
| Homocigótico | 15 (23,4) | ||
| Desconocido | 1 (1,6) | ||
| Tolerancia normal a la glucosa (TGN) | 60 | 16 (26,7) | |
| Diabetes relacionada con la fibrosis quística sin alteración de la glucemia basal (CFRD sin FPG) | 60 | 11 (18,3) | |
| Tolerancia indeterminada (INDET) | 60 | 6 (10) | |
| Intolerancia hidrocarbonada (IGT) | 60 | 27 (45) | |
| Enfermedad pulmonar | 62 | 61 (98,4) | |
| Enfermedad pancreática exocrina | 62 | 46 (74,2) | |
| IMC (kg/m2) | 61 | 20,3 (3,3) | |
| < 18,5 | 21 (32,8) | ||
| 18,5-24,9 | 37 (57,8) | ||
| 24,9-29,9 | 3 (4,7) | ||
| Peso (kg) | 61 | 53,3 (12,41) | |
| Varón | 56,0 (14,12) | ||
| Mujer | 50,63 (9,48) | ||
| Talla (m) | 61 | 1,61 (0,1) | |
| FEV1 (%) | 61 | 69,88 (20,79) | |
| FEV1 (ml) | 61 | 2.190 (0,79) | |
La media de edad a la entrada en el estudio fue de 26,84años (DE9,46), con una evolución media de la enfermedad en el momento de la inclusión de 20,43años. Del total de casos, 17 tenían un rango de edad comprendido entre los 14 y los 20años.
El IMC en varones fue de 20,24 (3,17), y en mujeres, de 20,41 (3,44) (p=NS). El 32,8% (n=21) tenían un IMC<18,5, sin diferencias significativas entre género (dato no mostrado), y tan solo el 4,7% presentaban sobrepeso según la OMS.
El 90,3% de los sujetos tomaban suplementos vitamínicos en el momento del hallazgo del test patológico, y el 17,7% suplementos nutricionales.
En cuanto a la función pulmonar, el FEV1% medio del grupo fue de 69,88% (20,79). No se obtuvieron diferencias entre las categorías de IMC y FEV1% (bajo peso, FEV1% 66,43 (21,43); normopeso, FEV1% 71,19 (20,66); sobrepeso, FEV1% 70,33 (9,07); p=0,7). No se encontraron diferencias significativas (datos no mostrados) entre sexos para la presencia de TGN o CFRD sin alteración de la glucemia basal (FPG).
Además, los pacientes que estaban expuestos a la toma de suplementos nutricionales tenían menor peso, IMC y FEV1% (para IMC, si expuestos, 17,1kg/m2 [1,54] vs no, 21,03kg/m2 [3,12]; t −6,13 [IC95% −5,23 a 2,62]; p<0,001; para peso, si expuestos, 42,68kg [7,06] vs no, 55,92kg [12,09]; t −3,49 [IC95% −20,83 a −5,64]; p=0,001; y para FEV1%, si expuestos, 55,46% [17,52] vs no, 72,6% [19,85]; t −2,64 [IC95% −30,12 a −4,172]; p=0,01).
Para estimar la influencia de parámetros nutricionales sobre el FEV1%, en el modelo de regresión lineal múltiple las variables que permanecieron significativas fueron el Δpeso (β0,88 [IC95% 0,13 a 1,62]; p=0,023) y la exposición a suplementos nutricionales (β13,72 [IC95% −27,38 a −0,06]; p=0,049); R2 ajustado global del modelo, 0,15.
Función pulmonar, cambios relativos de peso e índice de masa corporal y géneroEn varones, el FEV1% medio (72,79 [20,52]) fue superior a las mujeres (65,64 [19,97]), pero sin llegar a alcanzarse una significación estadística (t 1,37 [IC95% −3,28 a 17,57]; p=0,18). Por otra parte, en el Δpeso sí se obtuvieron diferencias significativas (varones +4,86% [6,58] vs mujeres +0,58% [6,78], t 2,43 [IC95% 0,75 a 7,79]; p=0,018), a favor del sexo masculino. Estos resultados no se vieron reflejados en el ΔIMC (varones +1,82% [5,83] vs +0,05% [5,87]; t 1,15 [IC95% −1,31 a 4,85], p=0,26).
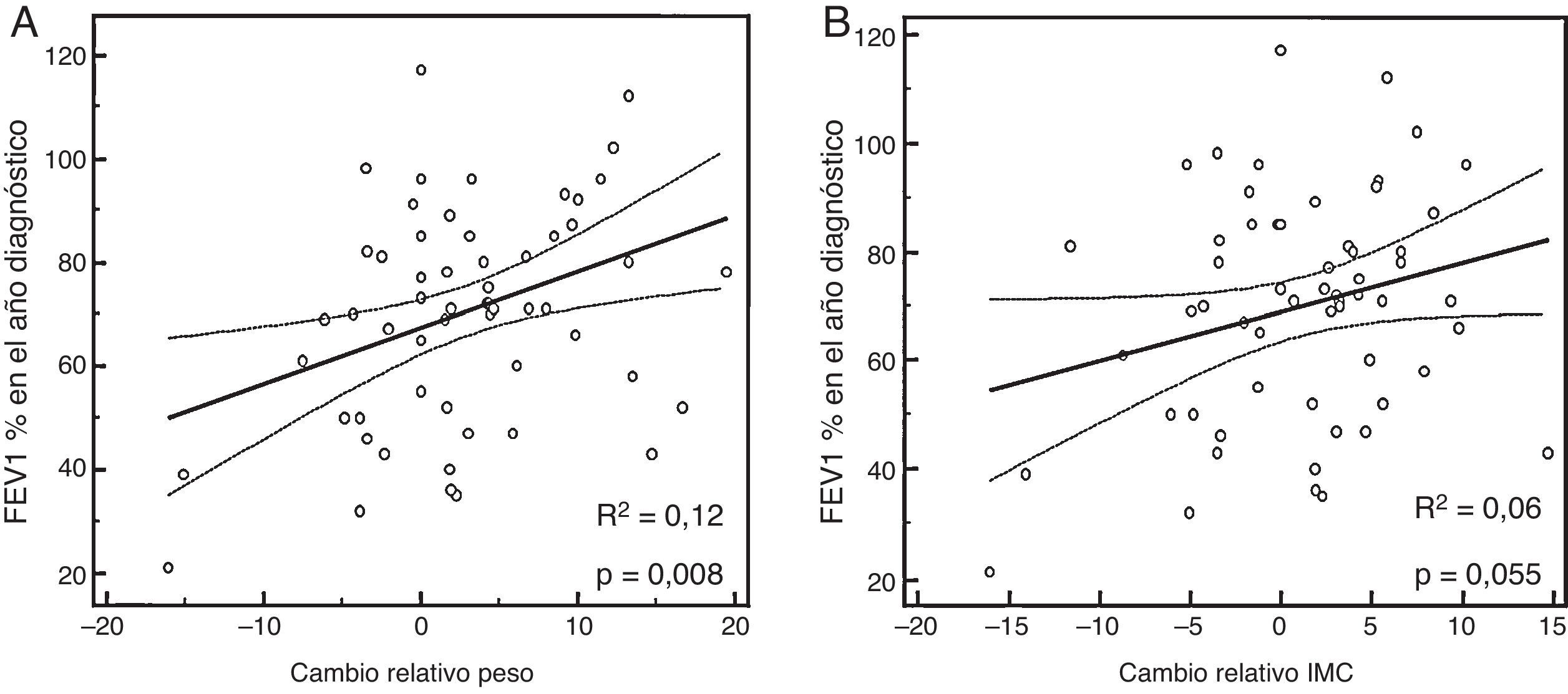
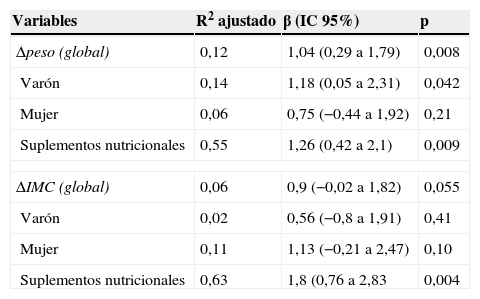
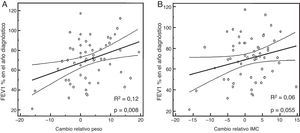
Función pulmonar (FEV1%), según Δpeso e ΔIMCAl comparar el Δpeso y la función pulmonar (FEV1%), se encontró que una ganancia de peso (o Δpeso positivo) se relacionaba con un mayor porcentaje de FEV1, sobre todo en varones (global: R2 ajustado 0,12, β 1,04 [IC95% 0,29 a 1,79]; p=0,008) (fig. 1A,B, tabla 2).
Relación lineal de las variables de incremento de peso e IMC (kg/m2), según género, y suplementos nutricionales, con la función pulmonar (FEV1%)
| Variables | R2 ajustado | β (IC95%) | p |
|---|---|---|---|
| Δpeso (global) | 0,12 | 1,04 (0,29 a 1,79) | 0,008 |
| Varón | 0,14 | 1,18 (0,05 a 2,31) | 0,042 |
| Mujer | 0,06 | 0,75 (−0,44 a 1,92) | 0,21 |
| Suplementos nutricionales | 0,55 | 1,26 (0,42 a 2,1) | 0,009 |
| ΔIMC (global) | 0,06 | 0,9 (−0,02 a 1,82) | 0,055 |
| Varón | 0,02 | 0,56 (−0,8 a 1,91) | 0,41 |
| Mujer | 0,11 | 1,13 (−0,21 a 2,47) | 0,10 |
| Suplementos nutricionales | 0,63 | 1,8 (0,76 a 2,83 | 0,004 |
Si los pacientes estaban expuestos a suplementos nutricionales, la influencia del Δpeso sobre FEV1% aumentaba (R2 ajustado 0,55, β 1,26 [IC95% 0,42 a 2,1]; p=0,009), al igual que en el caso de ΔIMC (R2 ajustado 0,63, β 1,8 [IC95% 0,76 a 2,83]; p=0,004).
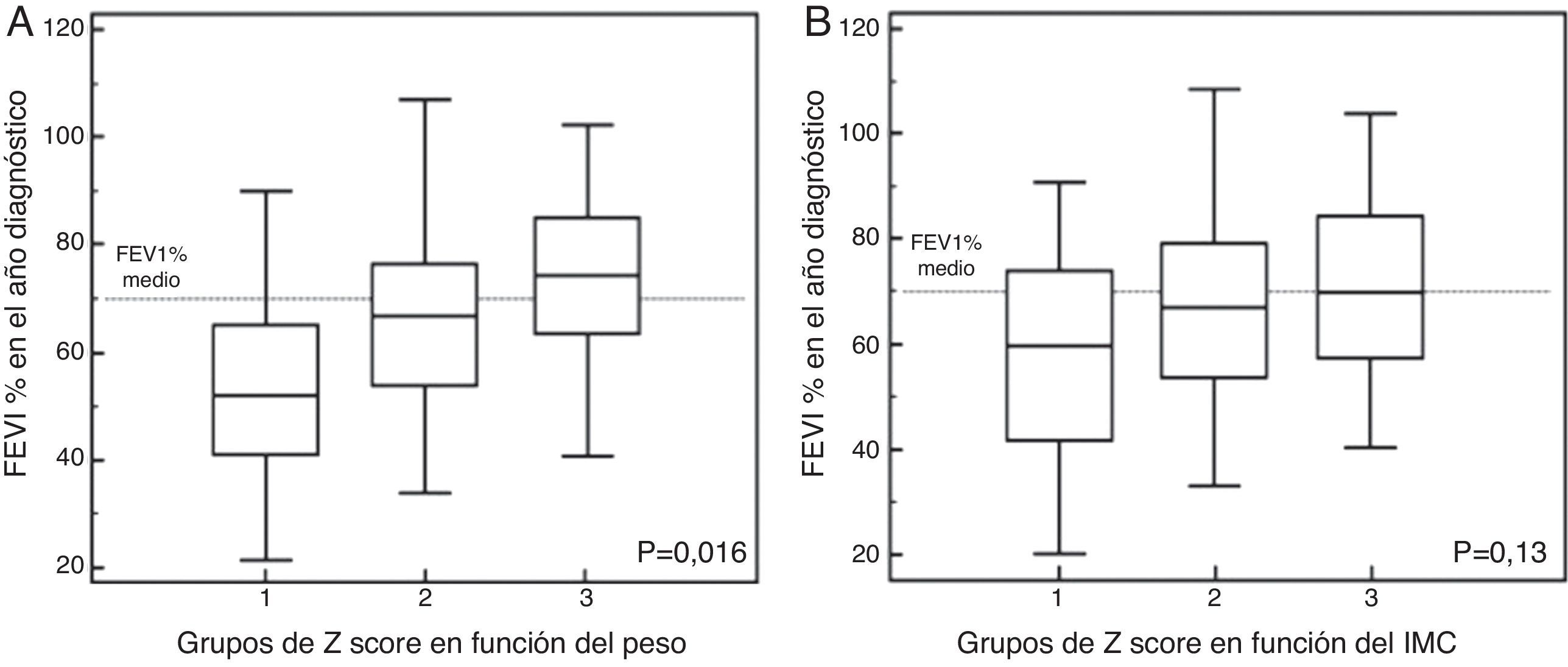
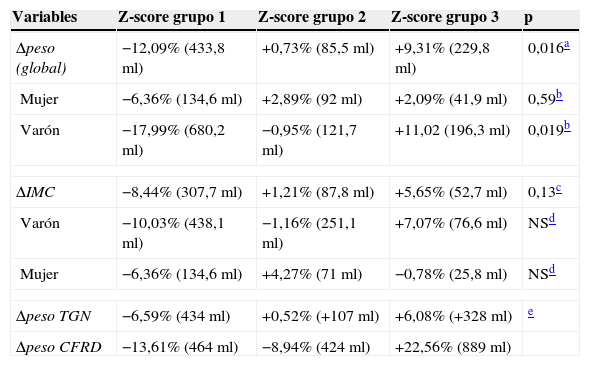
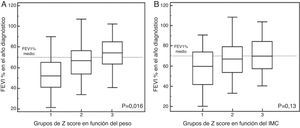
En el caso del Δpeso según el z-score (fig. 2A), el grupo1 presentaba un FEV1 en el año de diagnóstico del −12,09% (respecto a la media de la serie), mientras que los del grupo2 presentaban unos valores del FEV1 del +0,73%. En el grupo3 de z-score el FEV1 era del +9,31% (FEV1%, p global=0,016). Al ajustar estos datos por género, las diferencias obtenidas no fueron significativas en las mujeres (tabla 3).
Cambios relativos de las variables de incremento de peso (kg) e IMC (kg/m2), según género, en relación con la función pulmonar respecto a su media en el año diagnóstico de la alteración (FEV1%/ml)
| Variables | Z-score grupo 1 | Z-score grupo 2 | Z-score grupo 3 | p |
|---|---|---|---|---|
| Δpeso (global) | −12,09% (433,8ml) | +0,73% (85,5ml) | +9,31% (229,8ml) | 0,016a |
| Mujer | −6,36% (134,6ml) | +2,89% (92ml) | +2,09% (41,9ml) | 0,59b |
| Varón | −17,99% (680,2ml) | −0,95% (121,7ml) | +11,02 (196,3ml) | 0,019b |
| ΔIMC | −8,44% (307,7ml) | +1,21% (87,8ml) | +5,65% (52,7ml) | 0,13c |
| Varón | −10,03% (438,1ml) | −1,16% (251,1ml) | +7,07% (76,6ml) | NSd |
| Mujer | −6,36% (134,6ml) | +4,27% (71ml) | −0,78% (25,8ml) | NSd |
| Δpeso TGN | −6,59% (434ml) | +0,52% (+107ml) | +6,08% (+328ml) | e |
| Δpeso CFRD | −13,61% (464ml) | −8,94% (424ml) | +22,56% (889ml) | |
FEV1%: p global=0,016; grupo 1 vs 3, p=0,013; grupos 1 vs 2 p=0,15 y 2 vs 3, p=0,51. Para FEV1 (ml): p global=0,051, grupo 1 vs 3, p=0,06; p=NS para el resto de las comparaciones entre los grupos.
Varón: FEV1%: p global=0,019; grupo 1 vs 3, p=0,016; grupos 1 vs 2 p=0,23 y 2 vs 3, p=0,38. Para FEV1 (ml): p global=0,078. Mujer: FEV1%: p global=0,59, y FEV1 (ml): p=global=0,7. p=NS para todas las categorías y en las comparaciones entre los grupos.
FEV1%: p global=0,13; para FEV1 (ml): p global=0,19. p=NS para todas las categorías y en las comparaciones entre los grupos.
En el análisis de ΔIMC, según el z-score (fig. 2B), los casos del grupo1 presentaban un descenso del FEV1 del −8,44% (respecto a la media de la serie), en el grupo2 tenían un FEV1 del +1,21%, mientras que los del grupo3 presentaban aumentos de valor de FEV1, +5,65% (FEV1%, p=0,13). Al ajustar estos datos por género, tampoco se obtuvieron diferencias significativas (tabla 3).
Influencia de TGN y CFRD sin FPG.En el caso de pacientes con CFRD sin FPG, al comparar el Δpeso y la función pulmonar (FEV1%) se encontró una relación positiva, es decir, una ganancia (o Δpeso positivo) se asociaba a mayor FEV1% (global: R2 corregida 0,58, β 2,2 [IC95% 0,83 a 3,57]; p=0,006). Sin embargo, en el caso del grupo con TGN no se encontró esta relación lineal (global: R2 corregida −0,41, β −0,44 [IC95% −1,85 a 0,97]; p=0,51).
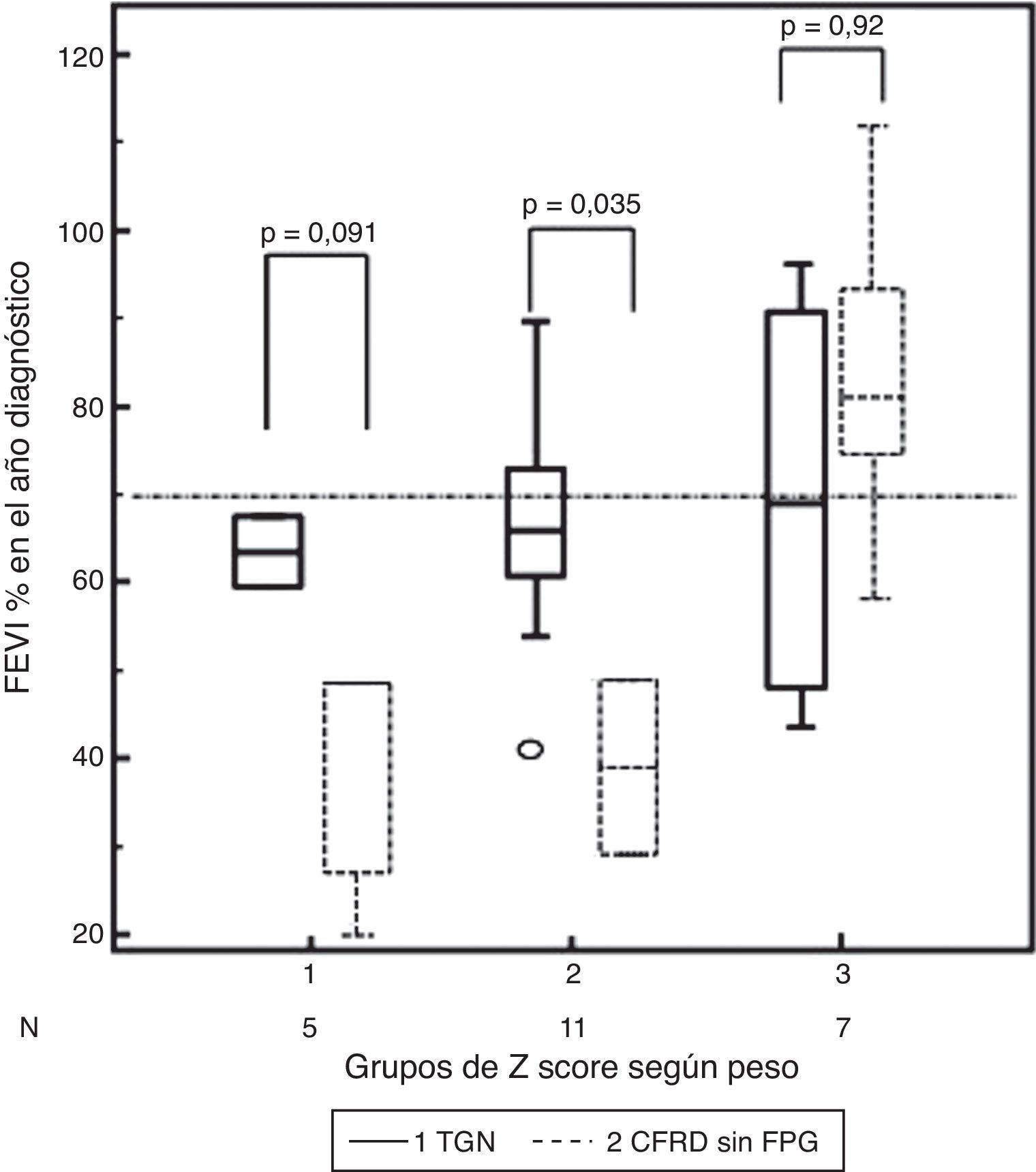
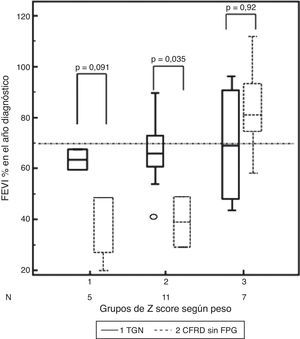
Además, se partía de una diferencia media significativa de la función pulmonar entre ambos grupos (para FEV1, TGN 71,59% vs CFRD 53,94% [IC95% 42,89 a 65,00], diferencia ±17,65 [IC95% 2,52-32,78], p=0,025). Así, en el análisis del Δpeso en función del grupo de z-score y la FEV1%, las diferencias para TGN frente a CFRD en cada grupo de Δpeso fueron: grupo1, +24,67% (p=0,091); grupo2, +27,11% (p=0,035), y grupo3, +1,17% (p=0,92) (a favor de TGN y siendo la categoría de referencia, tabla 3, fig. 3).
Diferencias en los grupos de z-score de cambio relativo de peso, según si presentaban tolerancia normal a la glucosa (TGN) o diabetes relacionada con la fibrosis quística sin alteración de la glucemia basal (CFRD sin FPG) y la función pulmonar (FEV1%) en el año de diagnóstico de la alteración del metabolismo de la glucosa.
El bajo peso y un estado de desnutrición se asocian con una peor función pulmonar, independientemente de la edad, el genotipo, el sexo, el status pancreático y la presencia de CFRD. El análisis de los datos del registro europeo (ECFS) de CF determinó que los pacientes con un IMC dentro de los límites de la normalidad (±2DE) tienen una media de FEV1 21,6% puntos superior a aquellos con un peor IMC (≤2DE), y además, un IMC bajo significaba una probabilidad 6 veces superior de tener un FEV1<40% respecto a un IMC normal11.
La presencia de malnutridos (IMC<18,5) en nuestro estudio, a pesar de ser una muestra heterogénea, alcanzaba el 32,8% (n=21), dato similar a la serie de Gozdzik et al.12, quienes establecían una prevalencia de malnutrición del 28,2%, y que alcanza el 38% en adultos.
En nuestro trabajo, el Δpeso tenía una relación lineal positiva con una mayor FEV1%. De este modo, el grupo que ganaba peso (≥6%) también presentaba un incremento del FEV1% (9,31%) respecto a los que presentaban una pérdida de peso mayor, superior al 2%, los cuales tenían una caída del FEV1 del 12,09%. En nuestra serie, cuando se estratificaba por género, la significación no se mantenía, debido al descenso del número de pacientes a analizar en cada categoría, y por tanto, a una pérdida de potencia estadística. De todos modos, la influencia del género en la función pulmonar es controvertida3,11,13, y probablemente contribuyan las mejoras en el tratamiento nutricional y respiratorio de estos pacientes en los últimos años.
Esta relación entre el peso y la función pulmonar también se ha objetivado en estudios longitudinales y en poblaciones mayoritariamente compuestas de niños o adultos jóvenes (incluidos adolescentes)5,6,14-16. Estos resultados resaltan la importancia de los cambios a lo largo del tiempo (es decir, el seguimiento longitudinal): la tendencia en los cambios de peso tiene mayor importancia que un valor absoluto en un momento determinado.
Así, Peterson et al.6 analizaron el efecto del incremento de peso sobre la función pulmonar en 319 niños de 6-8años de edad durante un periodo de 2años y objetivaron que una ganancia de 1kg de peso se asociaba a un aumento en 32ml de FEV1, y que 1kg más de peso al inicio del estudio ya suponía una diferencia de 55ml en el FEV1 medio. Los niños que presentaban una mayor ganancia de peso tenían un incremento mensual de 3,8ml de FEV1, en comparación con los niños con un menor cambio de peso.
Steinkamp y Wiedemann14 analizaron el estado nutricional y la función pulmonar (FEV1%) en cada grupo de edad, y determinaron que en los adolescentes (12-18años) malnutridos —es decir, aquellos que experimentaron una disminución del peso respecto a la altura superior al 5% durante un año— presentaron un descenso de FEV1 teórico que alcanzó el 16,5%, mientras que los casos que ganaron más del 5% de peso tuvieron un incremento del FEV1 predicho hasta del 2,1%. Sin embargo, en los adultos mayores de 18años con malnutrición, los autores señalan que el cambio de FEV1% por año aumentaba un 1,2% (IC95% 0,1-2,4), aunque el FEV1 predicho en el año del inicio del estudio era significativamente inferior (−23,9%; IC95% −28,2 a −19,6). Este incremento del FEV1% predicho no queda claro a qué factores es atribuible (suplementos nutricionales, vitamínicos, control de infecciones…). En el análisis longitudinal diseñado en el mismo artículo —2 años de seguimiento— los autores no encontraron diferencias en el cambio de FEV1% predicho o en la presencia de malnutrición o colonización por Pseudomonas aeruginosa en los mayores de 18años.
Zemel et al.17 estudiaron la relación entre el estado nutricional y la función pulmonar en un serie de niños del US CF Patient Registry desde 1991 a 1995. El declive de la función pulmonar durante este periodo de seguimiento se relacionaba con el FEV1 basal, con un mayor declive anual en aquellos pacientes con una FEV1 basal ≥90% en comparación con los casos con una FEV1<90%. Otras variables que claramente influían en el deterioro de la función pulmonar fueron el peso (z-score) y el crecimiento (altura apropiada para el peso), de forma que los autores concluyen que una intervención precoz sobre el estado nutricional puede enlentecer el declive de la función pulmonar en los niños con CF. En este mismo sentido, García Hernández et al.16 comunican que los pacientes con función pulmonar más deteriorada tenían un peor estado nutricional (valorado por el z-score del IMC) y mayor edad. Estos resultados se podrían analizar bajo la perspectiva práctica de una mayor probabilidad de recibir tratamiento nutricional en los casos con peor función pulmonar y bajo peso, tal y como sucede en nuestra serie.
En nuestra cohorte, al comparar ΔIMC con FEV1% se encontró que un aumento relativo positivo del primero se aproximaba a la significación para una mejoría del FEV1%, aunque la comparación por grupos según el z-score no alcanzó la significación estadística. A este respecto, Stephenson et al.3 defienden que, aunque la mejora del estado nutricional se asocia a una mejoría de la función pulmonar, esta es menor con un IMC dentro de los límites de la normalidad o en la categoría de sobrepeso. Su estudio longitudinal analizó mediante un modelo multivariable una cohorte de 908 adultos con CF entre los años 1985 y 2011. Los resultados fueron que en el grupo de sujetos con bajo peso (IMC<18,5), un incremento del 10% del IMC suponía un aumento relativo del FEV1 de un 4%, mientras que en aquellos con un IMC dentro de los límites de la normalidad (18,5-24,9), un incremento del mismo resultaba en un aumento relativo del FEV1 del 5%; finalmente, en el grupo de sobrepeso (25-29,9) este incremento conllevaba un aumento del FEV1 tan solo del 2%, sin diferencias significativas entre varones y mujeres. Los autores señalan que el grupo de mayor IMC eran pacientes con formas más leves de CF, según función pulmonar, insuficiencia pancreática y genotipo3. Una posible explicación a estos hallazgos estaría en el trabajo realizado por Kastner-Cole et al.18, quienes establecen un punto de corte de IMC de 23 en los pacientes adultos con CF, a partir del cual no se objetivan mejorías significativas de la función pulmonar con el aumento del IMC.
Otro dato de interés en nuestra serie es el hallazgo del impacto negativo del Δpeso en la FEV1% en los casos con CFRD sin FPG, con una magnitud mayor que en los casos con TGN. En general, los pacientes con CFRD presentan una peor función pulmonar. Milla et al.4 encuentran que los pacientes con TGN, en un seguimiento longitudinal, no tenían un cambio significativo de FEV1%, mientras que en el caso de CFRD perdían un 2,44% anual.
En la interpretación de nuestros resultados no hay que dejar de considerar que nuestra serie es una muestra de casos es pequeña y heterogénea (adolescentes y adultos). Otra causa de la ausencia de otros resultados significativos es que el IMC puede ser menos preciso que otras variables para identificar la malnutrición. En este sentido, y teóricamente, el estudio de la composición corporal en CF podría predecir mejor el pronóstico y podría alcanzar mayor precisión para identificar los estados de malnutrición, sobre todo en cohortes pequeñas de pacientes. Engelen et al.19 determinaron que hasta un 14% de los niños con CF tenían una depleción de la masa libre de grasa mediante absorciometría de rayosX de doble energía (DXA), y que hasta en el 50% de ellos esta depleción estaba asociada a un IMC (percentiles 25-50) adecuado. Por tanto, usando únicamente el IMC como parámetro nutricional, se dejaría una proporción considerable de pacientes con alteración del estado nutricional sin diagnosticar19-22. King et al.21 determinaron una prevalencia del 14% de baja masa corporal libre de grasa en una cohorte de 86 adultos con CF, siendo la sensibilidad del IMC para detectar esta alteración de tan solo el 42%. En el análisis multivariable realizado se objetivó que los niveles bajos de FEV1% se asociaban de forma independiente con una masa libre de grasa corporal baja, y proponen que dicho parámetro de composición corporal podría ser de utilidad como marcador pronóstico.
También debe señalarse que una serie pequeña puede dar lugar a intervalos de variables amplios, y por tanto traducir cambios esperados aparentemente mayores, siendo este un efecto estadístico ligado directamente a su potencia. Por otra parte, algunos datos de variación de la R2 son inferiores a 0,3, y por tanto, como hemos comentado, ligado a efectos de poca potencia (si bien sin fenómenos de colinealidad ni alteraciones reseñables en el estadístico de Dubin Watson).
ConclusionesDe forma global, el género no parece influir en la función pulmonar (FEV1%) en nuestra cohorte de adolescentes y adultos, siendo de mayor importancia un cambio relativo de peso.
El cambio relativo en el IMC no se asoció de forma significativa con el FEV1%, por lo que un análisis de composición corporal podría ser un factor pronóstico más preciso en su relación con la función pulmonar en CF.
Una ganancia relativa de peso (superior al 6%) tiene una repercusión positiva en la función pulmonar estimada por FEV1%. Por el contrario, la pérdida relativa de peso, igual o superior al 2%, tiene una influencia negativa en la función pulmonar en los pacientes con CF, incluidos aquellos con CFRD. Es más, para un mismo grupo de z-score, el descenso de FEV1% era más profundo en los diabéticos que en aquellos que no presentaban alteración del metabolismo hidrocarbonado. Por tanto, medidas orientadas a una intervención precoz sobre el estado nutricional y el control de las alteraciones del metabolismo de los hidratos de carbono podrían contribuir a enlentecer el declive de la función pulmonar.
FinanciaciónEsta investigación no ha recibido ninguna subvención específica de cualquier organismo de financiación en el sector público, comercial o del sector sin fines de lucro.
Conflicto de interesesLos autores declaran que no hay conflicto de intereses que pueda ser percibido como perjudicial para la imparcialidad de la investigación publicada.