El diagnóstico de acromegalia está basado en pruebas bioquímicas que muestran un aumento de secreción de somatotropina (GH). Más del 95% de los pacientes con acromegalia presentan un adenoma hipofisario productor de GH. La técnica de imagen de elección en el diagnóstico del adenoma es la resonancia magnética (RM). La utilización de nuevas técnicas, como la gammagrafía con 111In-pentetreotida (OctreoScan) y la tomografía por emisión de positrones (PET), puede aportar información adicional en algunos casos. Presentamos el caso de una mujer diagnosticada de acromegalia. Varias RM y el OctreoScan fueron normales y otras posibilidades diagnósticas fueron descartadas. La PET localizó el origen hipofisario de la hipersecreción de GH. En la acromegalia, la ausencia de hallazgos en la RM y el diagnóstico de localización por medio de PET son excepcionales.
Diagnosis of acromegaly is based on biochemical tests demonstrating increased growth hormone (GH) secretion. More than 95% of patients with acromegaly harbor a GH-secreting pituitary adenoma. The technique of choice in the diagnosis of an adenoma is magnetic resonance imaging (MRI). The use of new techniques such as 111In-octreotide scintigraphy (OctreoScan) and positron emission tomography (PET) can provide additional information in some cases. We report the case of a woman with acromegaly. The results of several MRI scans and OctreoScan were normal and other diagnostic possibilities were ruled out. The pituitary origin of the increased GH secretion was identified by PET. In acromegaly, the absence of MRI findings and identification of location by means of PET are exceptional.
La acromegalia es una enfermedad producida por la secreción crónica e inapropiada de somatotropina (GH) que se inicia después del cierre de los cartílagos. Su incidencia es de 3 a 4 nuevos casos por millón de habitantes y año, y su prevalencia es de 40 a 70 casos por millón. Más del 95% de los casos se deben a hipersecreción de GH por un adenoma hipofisario. La enfermedad afecta a múltiples órganos y sistemas, que conduce a un incremento de la morbilidad y la mortalidad, por lo que precisa de un diagnóstico y un tratamiento precoces1,2.
Más del 70% de los tumores secretores de GH son macroadenomas. Los carcinomas son muy raros y sólo pueden diagnosticarse por la presencia de metástasis. La producción ectópica de GH se ha demostrado en casos aislados de procesos neoplásicos, como linfomas o tumores pancreáticos. Una producción excesiva de somatoliberina (GHRH) puede producir hiperplasia de células somatotropas de la hipófisis y acromegalia. Algunos tumores hipotalámicos, como gangliocitomas, o tumores periféricos neuroendocrinos pueden secretar GHRH, con la proliferación de las células somatotropas que, raramente, pueden producir un adenoma con aumento de secreción de GH e IGF-1 (insulin-like growth factor 1)3.
El diagnóstico bioquímico de acromegalia se realiza con la demostración de la no frenación de la GH tras una sobrecarga oral de glucosa y la medición de IGF-1. Para el diagnóstico por la imagen, como suele ser habitual en la afección hipofisaria, la resonancia magnética (RM) es la prueba más utilizada. La tomografía computarizada (TC) ha dejado de emplearse. Otras pruebas, como la gammagrafía con 111In-pentetreotida (OctreoScan) y la tomografía por emisión de positrones (PET), pueden dar información sobre la funcionalidad del tumor o diferenciar los adenomas de otros procesos hipofisarios, como quistes, fibrosis, necrosis o sangrado4.
Presentamos el caso de una paciente diagnosticada de acromegalia sin adenoma visible en sucesivas RM, así como en la gammagrafía, cuya localización hipofisaria se estableció por PET.
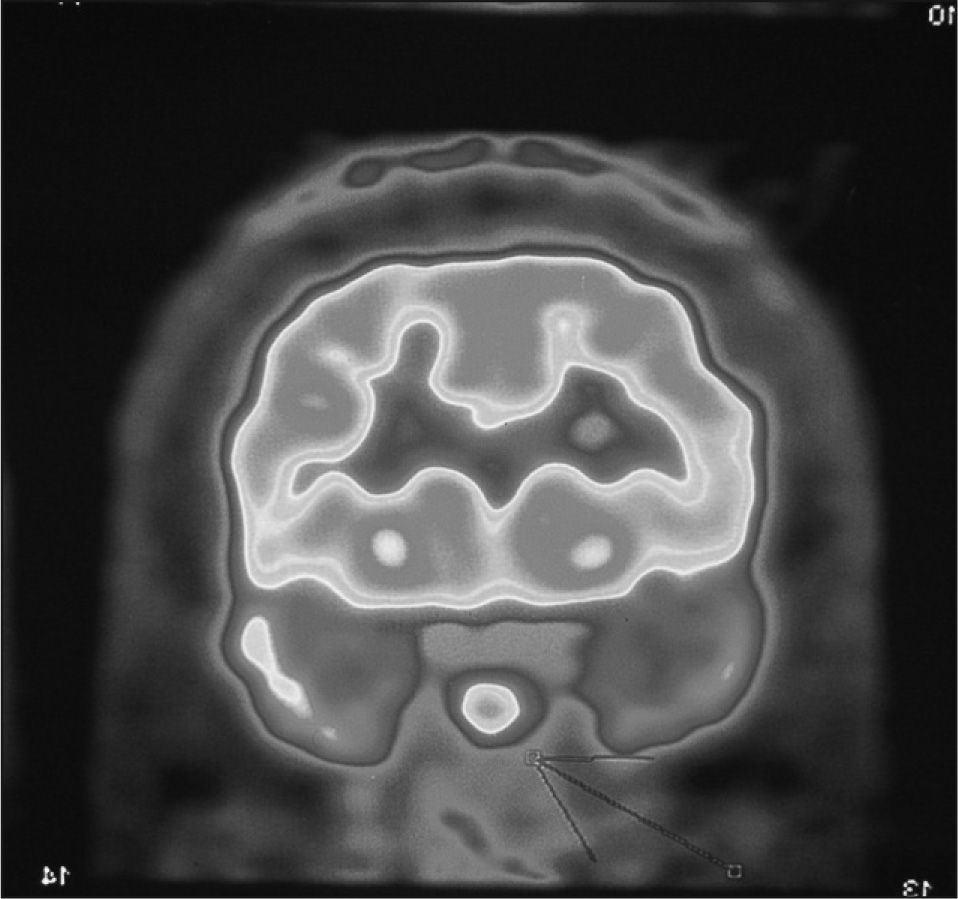
CASO CLÍNICOMujer de 61 años, remitida desde el servicio de reumatología por sospecha diagnóstica de acromegalia, que presentaba artrosis severa, divertículos colónicos, diabetes mellitus tipo 2 diagnosticada hacía 2 años e hipertensión arterial desde los 31 años. En la anamnesis dirigida refería incremento de la talla de zapato en dos números y engrosamiento de los dedos de las manos que le impedía colocarse los anillos. A la exploración física destacaba una macroglosia, la nariz y el arco supraciliar agrandados y los dedos gruesos. En el estudio analítico el hemograma fue normal y en la bioquímica destacaba: glucemia basal, 129mg/dl; glucohemoglobina (HbA1c), 5% (valor normal [VN], 3,5-5,5 para nuestro laboratorio); colesterol total, 255mg/dl; colesterol de las lipoproteínas de baja densidad (cLDL), 160mg/dl; colesterol de las lipoproteínas de alta densidad (cHDL), 56mg/dl, y triglicéridos, 195mg/dl. Se solicitó un estudio hormonal basal que mostró: tirotropina (TSH), 2,26 (VN, 0,47-4,2) μU/ml; tiroxina libre (T4L), 1,18 (VN, 0,93-1,7) ng/dl; cortisol basal, 20,8 (VN, 6-28) μg/dl; corticotropina (ACTH), 7 (VN, 9-40) pg/ml; folitropina (FSH), 58,2 (VN, 25-134) mU/ml; lutropina (LH), 16,9 (VN, > 25) mU/ml; prolactina, 26 (VN, 6-30) ng/ml; GH, 11,7 (VN, < 5,5) ng/ml, e IGF-1, 1.140 (VN para edad y sexo, 78-258) ng/ml. La sobrecarga oral con 75g de glucosa demostró ausencia de frenación para GH con un valor nadir de GH de 13,8ng/ml. Se solicitó RM hipofisaria que fue informada como normal, sin lesiones en la glándula. Una TC toracoabdominal negativa para proceso tumoral y una GHRH normal (12; VN: 10-60pg/ml) parecían descartar un origen ectópico. Se solicitó gammagrafía con 111In-pentetreotida que no mostró captación. Una PET con estudio cerebral y de cuerpo entero tras administrar 12,6mCi de 18fluorodesoxiglucosa (18FDG) mostró un foco hipermetabólico (SUV — standardized uptake value—, máximo 6,7g/ml) hipofisario (fig. 1). La paciente inició tratamiento con octeotrida a dosis creciente hasta 30mg cada 21 días, sin conseguir controlar la enfermedad (IGF-1, 560ng/ml), por lo que se pasó a pegvisomant 20mg/día, con lo que se normalizaron las concentraciones de IGF-1. Durante los 3 años posteriores al diagnóstico se solicitaron 3 sucesivas RM hipofisarias que nuevamente fueron informadas como normales.
DISCUSIÓNLa RM es la técnica de elección para detectar y caracterizar adenomas hipofisarios. Con ella se puede diferenciar tumores incluso de 2mm de diámetro. Además, es una técnica muy útil para evaluar las estructuras vecinas de la glándula, como la compresión quiasmática, la invasión del seno cavernoso y la extensión del crecimiento selar5. Aunque el origen más frecuente de la acromegalia es un macroadenoma hipofisario (el 75% de los casos), se ha descrito la coexistencia de acromegalia y silla turca vacía, donde el tumor puede adoptar una forma laminar en el fondo de la silla turca. Cuando la RM hipofisaria es normal, hay que pensar en un origen extrahipofisario, habitualmente por un tumor productor de GHRH que es la causa del 0,5% de las acromegalias. Entonces debe realizarse la determinación de GHRH y una TC toracoabdominal6.
La gammagrafía con 111In-pentetreotida puede ser útil para demostrar la captación del análogo de somatostatina por el adenoma, si bien no suele recomendarse en el manejo de la acromegalia dado que aporta poca información adicional a la obtenida mediante RM7. Aunque una captación de mayor intensidad se ha relacionado con una mejor respuesta al tratamiento, la aplicación práctica de la información obtenida es limitada8.
La PET ofrece una imagen anatómica y funcional del adenoma y se ha utilizado en algunos estudios para evaluar los adenomas hipofisarios, especialmente antes de la cirugía, con la intención de establecer diferencias entre la hipófisis normal y el tumor9. No obstante, su elevado coste y la escasa información adicional en el manejo de estos tumores la han relegado a ser una exploración poco utilizada.
La PET puede utilizar distintos ligandos para detectar un adenoma hipofisario como 18FDG para obtener imágenes basadas en el metabolismo de la glucosa, [11C]metionina y [11C]tirosina para las basadas en la síntesis proteica, y [11C]deprenilo, [11C]racloprida, [11C]metilespiperona y [18F]fluoroetilespiperona para las imágenes basadas en la expresión de receptores. Cada ligando puede aportar información para diferenciar el tejido tumoral adenomatoso de otras lesiones, como quistes, fibrosis, necrosis, sangrado y otros tumores, como craneofaringiomas, e incluso evidenciar diferencias entre tumores a la hora de responder a tratamientos farmacológicos o monitorizar su evolución. Ninguna de estas aplicaciones, sin embargo, ha llevado a ampliar su utilización en el manejo del incidentaloma hipofisario4.
En la acromegalia, la PET muestra un alto índice metabólico tumoral que puede verse reducido considerablemente tras instaurar tratamiento con análogos de la somatostatina, por lo que se ha propuesto como herramienta para monitorizar la eficacia del tratamiento10. Sin embargo, la existencia de marcadores bioquímicos fáciles de determinar y más económicos resta utilidad a la PET en este apartado. Teniendo en cuenta que la captación tumoral puede reducirse al utilizar los análogos de la somatostatina, se debe evitar su uso antes de realizar una PET diagnóstica, si bien no se ha formulado una recomendación concreta sobre este punto.
En nuestro caso la PET ha aclarado el diagnóstico de acromegalia de origen hipofisario, cuando la RM era normal. Esta posibilidad está poco contemplada en la literatura, probablemente por lo infrecuente de no visualizar el adenoma y por la escasa utilización de la PET en la afección hipofisaria. Sólo De Souza et al11 compararon la PET con otras exploraciones radiológicas (TC y RM) en 20 casos de microadenomas funcionantes (17 pacientes con enfermedad de Cushing y 3 con acromegalias) y 20 sujetos sanos. Esos autores hallaron que la PET pudo completar la información de 5 sujetos con microadenomas en los que la RM era normal o dudosa. La eficacia de la PET en la enfermedad de Cushing no ha sido bien establecida. Se ha postulado su utilidad diagnóstica complementaria en casos dudosos o sin imagen de adenoma en la RM, cuando se precisa la cateterización de senos petrosos.
En resumen, aunque la PET tiene una eficacia limitada en la evaluación de las lesiones hipofisarias, puede ser de utilidad para distinguir adenomas de otras lesiones no tumorales. Además, como en nuestro caso, podría demostrar la lesión hipofisaria en casos de microadenomas, especialmente funcionantes, no detectados por RM.