Las hormonas tiroideas tienen un papel fundamental en el desarrollo y el funcionamiento de diversos órganos, especialmente el cerebro. Las hormonas tiroideas ejercen sus funciones mediante la interacción de la triyodotironina (T3) con receptores nucleares y la regulación de la expresión de genes. En este trabajo hemos estudiado los efectos del hipotiroidismo y de la administración de T3 en la expresión de genes de cerebro y cerebelo durante el periodo posnatal en la rata. Se obtuvieron neonatos hipotiroideos mediante la administración de antiroideos a la madre durante la gestación y la lactancia. Se les administró T3 a dosis diarias de 15ng/g de peso desde el día posnatal 10 hasta el 15, y se los sacrificó 24h tras la última inyección. El hipotiroidismo produjo un aumento de las concentraciones de colesterol y disminución de la expresión de D1 en hígado y de Serca-2 en corazón, que fueron normalizados tras el tratamiento con T3. En el encéfalo, el hipotiroidismo redujo la expresión de los genes del núcleo estriado Ngrn y Rasd2, así como de los genes de cerebelo que codifican sinaptotagmina 12 (Syt12), hairless (Hr), neurotrofina 3 (Nt3) y RevErbAα (Nrd1d), que también se normalizaron tras la administración de T3, lo que indica que durante el periodo posnatal esta hormona llega directamente y tiene actividad en el cerebro. En paralelo, se ha estudiado la posible acción de un análogo de la T3, que se une in vitro preferentemente al receptor tiroideo α (TRα). Sin embargo, este compuesto no tuvo efecto alguno en los parámetros estudiados. Para comprobar si la falta de acción de este compuesto se debe a una rápida metabolización, se comparó su actividad con la de la T3 en ensayos de transactivación del gen indicador cloranfenicol acetiltransferasa en células Cos7 que expresan de forma transitoria, mediante transfección, TRα o TRα. Los resultados indican que Kb430 carece de actividad.
Thyroid hormones play a major role in the development and function of several organs, especially the brain. The actions of thyroid hormones are exerted through the interaction of T3 with nuclear receptors and regulation of gene expression. The present study analyzed the effects of hypothyroidism and T3 administration on gene expression in the rat brain and cerebellum during the postnatal period. To obtain hypothyroid pups, antithyroid drugs were administered to pregnant rats from gestational day 9, and after delivery. T3 was administered to the pups, at single daily doses of 5ng/g body weight from postnatal day 11 to 15. The pups were sacrificed 24hours after the last injection. Hypothyroid neonates showed increased cholesterol levels and decreased expression of D1 in liver and of Serca-2 in heart, which were normalized with T3 treatment. In the brain, there was decreased expression of Ngrn and Rasd2 in the striatum and of the genes encoding sinatotagmin12 (Syt12), hairless (Hr), neurotrofina3 (Nt3) and RevErbAα (Nrd1d) in the cerebellum, which were also normalized by T3 treatment. These results demonstrate that during the postnatal period, T3 reaches the brain and directly influences gene expression in this organ. In parallel, we studied the possible actions of a T3 analog, Kb430, which in vitro binds preferentially to thyroid receptor α (TRα). This compound had no effect on any of the parameters studied. To investigate whether the lack of activity of this compound was due to rapid metabolism, we compared its activity with that of T3 in T3 receptor transactivation assays using the reporter gene chloramphenicol acetyl transferase in Cos7 cells transiently expressed through TRα or TRα transfection. The results indicate that Kb430 lacks biological activity.
Las hormonas tiroideas (HT) triyodotironina (T3) y tiroxina (T4) regulan el desarrollo y multitud de procesos fisiológicos en la mayoría de los tejidos del organismo, y especialmente en el sistema nervioso central (SNC). Las HT ejercen sus funciones mediante la interacción de la hormona activa, T3, con receptores nucleares (TR), que son factores de transcripción regulados por ligando1-3. Los receptores se unen a secuencias específicas denominadas elementos de respuesta a HT (TRE), situadas en regiones reguladoras de los genes diana, principalmente en forma de heterodímeros con el receptor de ácido 9-cis-retinoico (RXR). En ausencia de hormona, el aporreceptor unido al ADN interacciona con un conjunto de correpresores inhibiendo la transcripción de genes diana. La unión del ligando (T3) produce un cambio conformacional que permite que los correpresores sean desplazados por coactivadores, con lo que se activa la transcripción. Existen varias isoformas de TR que resultan del procesamiento alternativo de dos genes TRα y TRβ.
La importancia de las HT en el desarrollo del SNC es bien conocida, y aunque aún no se conoce con precisión los fundamentos moleculares y celulares de sus acciones, tienen efectos importantes en la migración y la diferenciación de las células neurales, la génesis sináptica y la mielinización4-7. El hipotiroidismo altera la diferenciación de células piramidales, células de Purkinje, precursores de las interneuronas gabaérgicas, oligodendrocitos y astroglía. Como en el resto de los tejidos, las acciones de las hormonas tiroideas en el SNC se deben a la interacción de la T3 con los receptores nucleares y la regulación de la expresión de genes específicos8.
En este trabajo hemos analizado el efecto del hipotiroidismo y de la administración de T3 en la expresión de genes del cerebro y el cerebelo, en relación con otros parámetros de acción de la T3 en el hígado y el corazón. En paralelo, hemos analizado el posible efecto de un análogo de la T3 que interacciona de forma específica con la isoforma TRα.
MATERIAL Y MÉTODOAnimales y tratamientoSe ha utilizado ratas Wistar crecidas en el animalario de nuestro instituto. Los procedimientos para el manejo de los animales fueron aprobados por la Comisión de Experimentación Animal y siguieron las normas de la Unión Europea. Los animales se mantuvieron a temperatura controlada (22 ± 2°C) y ciclos de luz-oscuridad de 12h, con libre acceso a comida y agua. Los grupos experimentales fueron los siguientes: control (C), hipotiroideas (H) e hipotiroideas tratadas con T3 o con el análogo de la T3 Kb430 (Karo Bio, Estocolomo, Suecia). Para inducir hipotiroidismo se administró 2-mercapto-1-metilimidazol (MMI) (Sigma Chemical Co., St. Louis, Misuri, Estados Unidos) al 0,02% y perclorato potásico (Merck) al 1% en el agua de bebida de las madres preñadas, desde el día 9 de gestación y hasta el final del experimento, el día posnatal 16 (P16). La T3 (Sigma), en suero salino con albúmina sérica bovina al 0,01%, se administró en una inyección intraperitoneal diaria a partir del día posnatal 10 (P10) y hasta P15, a una dosis de 15ng/g de peso corporal9,10. Esta dosis es 5 veces la dosis fisiológica de inhibición de la tirotropina (TSH) en ratas adultas y de la producción total diaria de T3, que en la rata es 3ng/g. El compuesto Kb430 fue administrado a dosis equimolar de T3 (×5) y al doble de esta dosis (×10). Los animales fueron sacrificados el P16, 24h después de la última inyección. Se determinó el colesterol en plasma mediante la utilización de un kit comercial (Termo Electron) basado en métodos enzimáticos.
Preparación de ARN, northern blot y PCR cuantitativaSe preparó ARN total usando Trizol (Gibco BRL). Las pruebas de northern blot se realizaron usando protocolos establecidos11. Las sondas de ADNc utilizadas fueron: 1,6kb del extremo 5' de Serca-2 (ATPasa dependiente de Ca2+ del retículo endoplásmico, bomba de Ca2+) y sonda de 329 pb de desyodasa 1 (D1). Como control de carga, se utilizaron sondas de ADNc de los genes 18S y GAPDH, todas ellas marcadas con 32P. Para las pruebas de PCR cuantitativa se usaron sondas Taqman (Applied Biosystems) de los genes siguientes: hairless (Rn00577605_m1, Hr); Rev-ErbAα (Rn00595671_m1, Nr1d1), neurogranina (Rn00480741_m1, Ngrn, RC3); Rhes (Rn00592054_m1, Rasd2); neurotrofina 3 (Rn00579280_m1, Nt3); sinaptotagmina 12 (Rn00593706_m1, Syt12) y desyodasa 1 (Rn00572183_m1, D1).
Cultivo celular, transfección y análisis de cloranfenicol-acetiltransferasaPara los análisis de expresión transitoria de los receptores de T3 y de inducción de genes indicadores, se usaron células Cos-7. Las células se incubaron, 24h antes de la transfección, en medio DMEM suplementado con suero fetal (deplecionado de T3 y T4) al 10% y glutamina al 2%. Las células se transfectaron con Lipofectamina® (Invitrogen) y los siguientes plásmidos: pCMV Sport-βgal (Invitrogen), que permite el control interno de la transfección mediante actividad de betagalactosidasa; SalTK, que contiene el promotor de la timidincinasa (TK), el TRE y el gen reportero cloranfenicol acetiltransferasa (CAT); RXR, que contiene el gen del receptor de ácido 9-cis-retinoico controlado por el promotor de citomegalovirus; TRα o TRβ, controlado por el promotor de citomegalovirus. La mitad de las placas fueron transfectadas con la isoforma TRα y la otra mitad, con la isoforma TRβ. Tras 6h desde la transfección, se cambió el medio y se administraron los tratamientos correspondientes. A las 24h se recogieron los extractos celulares y se determinó la actividad CAT, corrigiendo los resultados con la medida obtenida de betagalactosidasa.
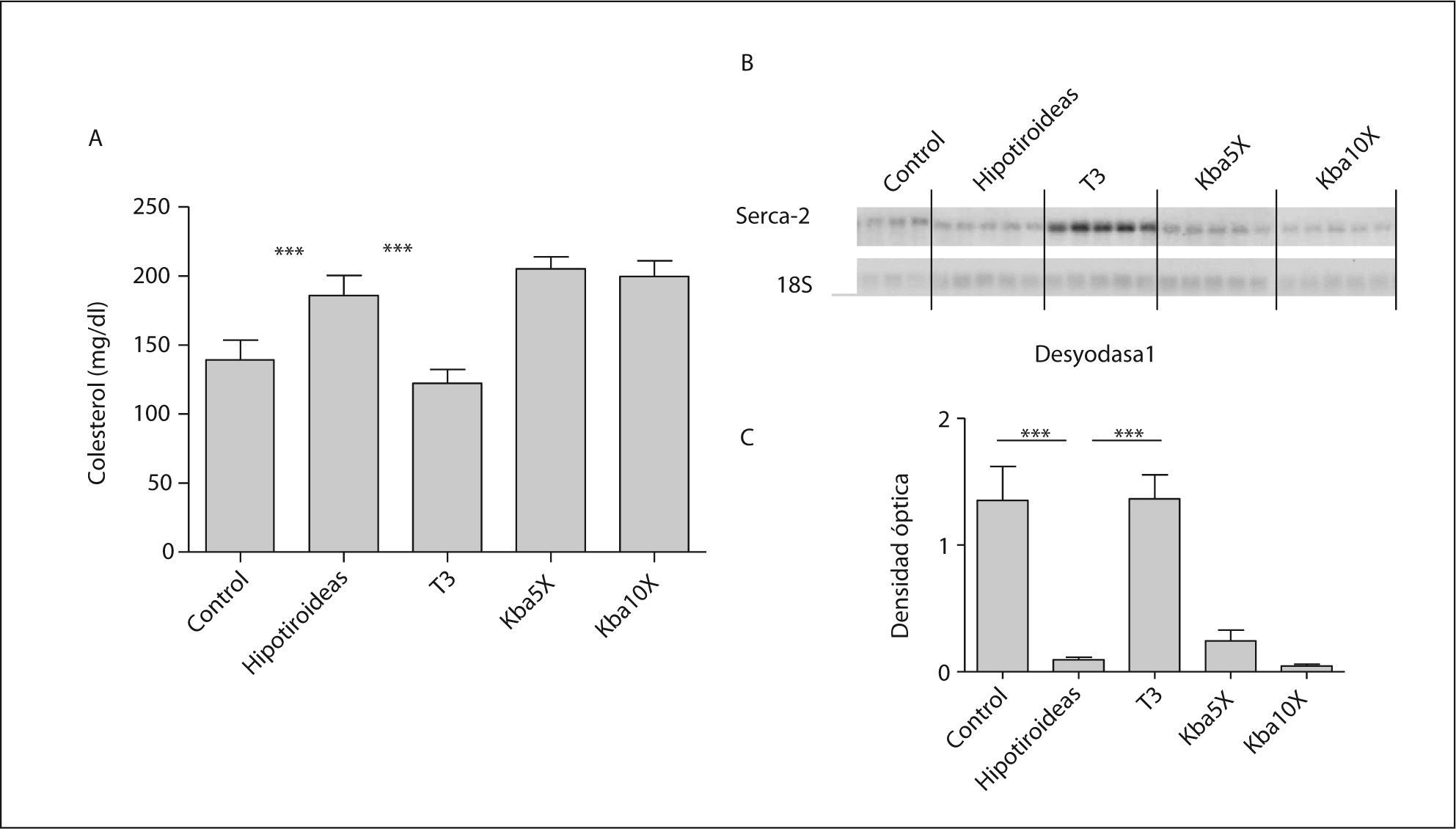
RESULTADOSEvaluación del hipotiroidismo neonatal y del tratamiento con hormona tiroideaLa administración de los agentes antitiroideos MMI y ClO4K a las madres gestantes a partir del día 9 de gestación y durante la lactancia dio lugar a un estado de hipotiroidismo neonatal, con disminución del peso corporal, retraso en la apertura de los párpados, aumento de la concentración de colesterol en plasma y disminución de la expresión de D1 en el hígado. En la figura 1 se indica que las concentraciones de colesterol de las ratas hipotiroideas estaban incrementadas respecto a las ratas control. La administración de T3 normalizó las concentraciones de colesterol de las ratas hipotiroideas.
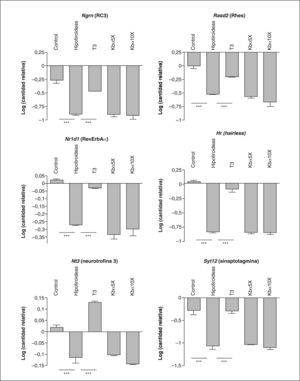
Efectos del hipotiroidismo y del tratamiento con T3 o de análogos selectivos para TRα en la concentración de colesterol plasmático (A) y de la expresión de desyodasa 1 en el hígado. La medida del ARNm de la desyodasa 1 se realizó mediante hibridación northern (B) y las bandas de ARN se cuantificaron mediante densitometría (C). La significación estadística se obtuvo mediante análisis de la variancia con el test de Tukey.
***p < 0,05.
Para evaluar el efecto del hipotiroidismo y del tratamiento hormonal en la función hepática, determinamos la expresión de D1, un gen regulado por la hormona tiroidea en la transcripción que es muy sensible al estado tiroideo en roedores12. Como se puede ver en la figura 1, la cuantificación del ARNm de D1 por hibridación northern blot o por PCR cuantitativa (no mostrado) arrojó resultados similares: una disminución muy acusada en las ratas hipotiroideas y un incremento tras la administración de T3. En el corazón13, la hormona tiroidea regula la expresión de la bomba de calcio sarcoplásmica Serca2. De acuerdo con esto, el hipotiroidismo disminuyó el ARNm de Serca2, y la administración de T3 lo normalizó. Es de interés que la administración del análogo de T3 Kb430 no tuvo ningún efecto en el colesterol, D1 o Serca2 cuando se administró en paralelo a la T3 a dosis equimolares (×5) o superiores (×10).
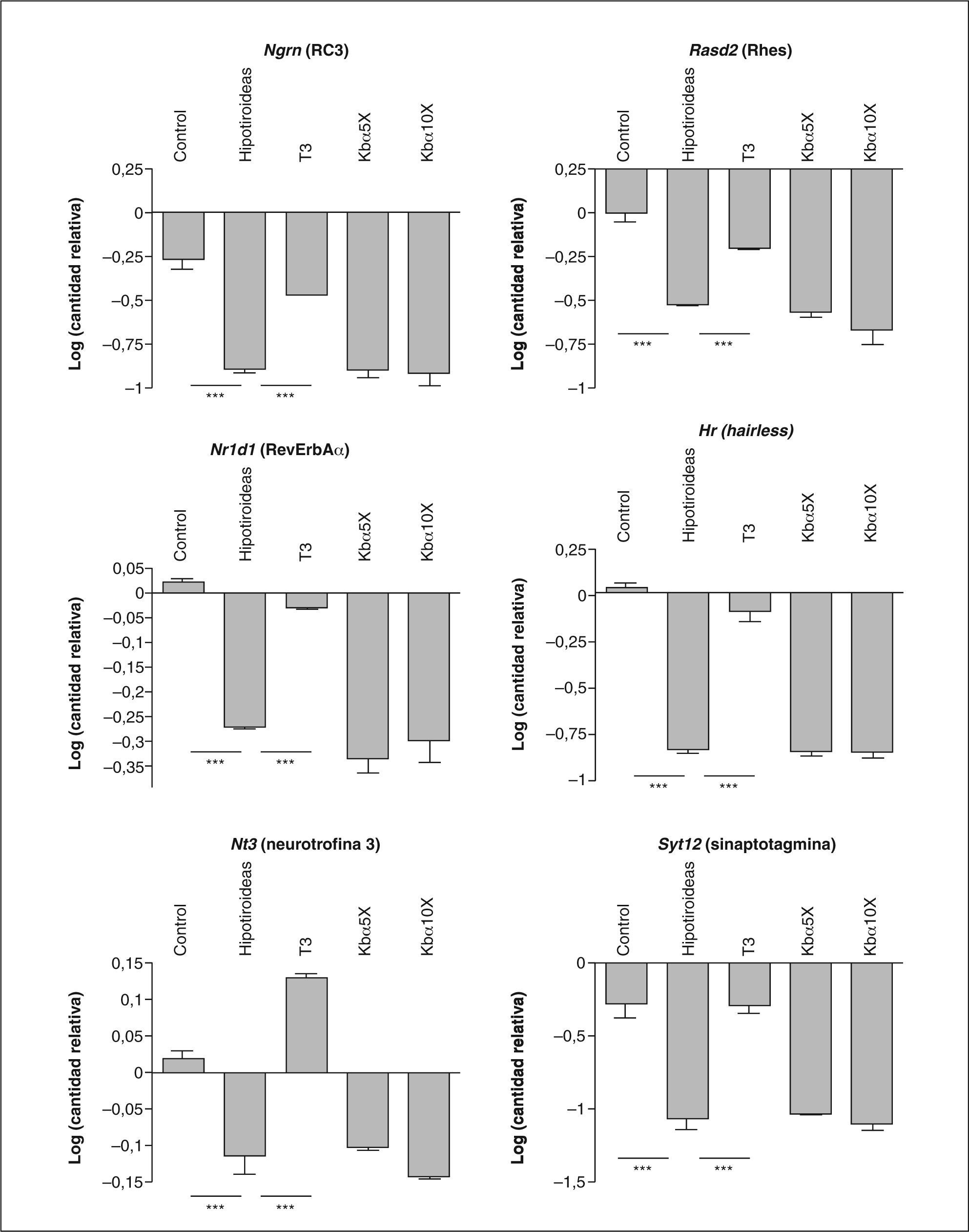
Expresión génica en el cerebro y el cerebeloEl efecto del hipotiroidismo y del tratamiento hormonal en el SNC se evaluó mediante el estudio de la expresión de genes diana de T3 usando la técnica de PCR cuantitativa. Los genes analizados fueron Ngrn (RC3)14 y Rasd2 (Rhes)15, en ARN procedente del núcleo estriado, y en cerebelo, Hr (hairless)16, Nr1d1 (Reverse ErbAα)10, Nt3 (neurotrofina 3)10 y Syt12 (sinaptotagmina 12)16. Los resultados se indican en la figura 2.
Efectos del hipotiroidismo y del tratamiento con T3 o de análogos selectivos para TRα en la expresión de genes del núcleo estriado (Ngrn y Rasd2) y de cerebelo (Nr1d1, Syt12, Nt3, Hr). La significación estadística se obtuvo mediante análisis de la variancia con el test de Tukey.
***p < 0,05.
En el núcleo estriado, el hipotiroidismo dio lugar a una disminución de las concentraciones de ARNm para Ngrn y Rasd2, y las concentraciones se recuperaron tras el tratamiento con T3. En el cerebelo, la expresión de los genes hairless, Nr1d1, Nt3 y Syt12 se encuentra disminuida en los animales hipotiroideos, y el tratamiento con T3 consigue la normalización e incluso un aumento respecto al control, como en el caso de la neurotrofina 3. Sin embargo, el tratamiento con Kb430 no tuvo ningún resultado.
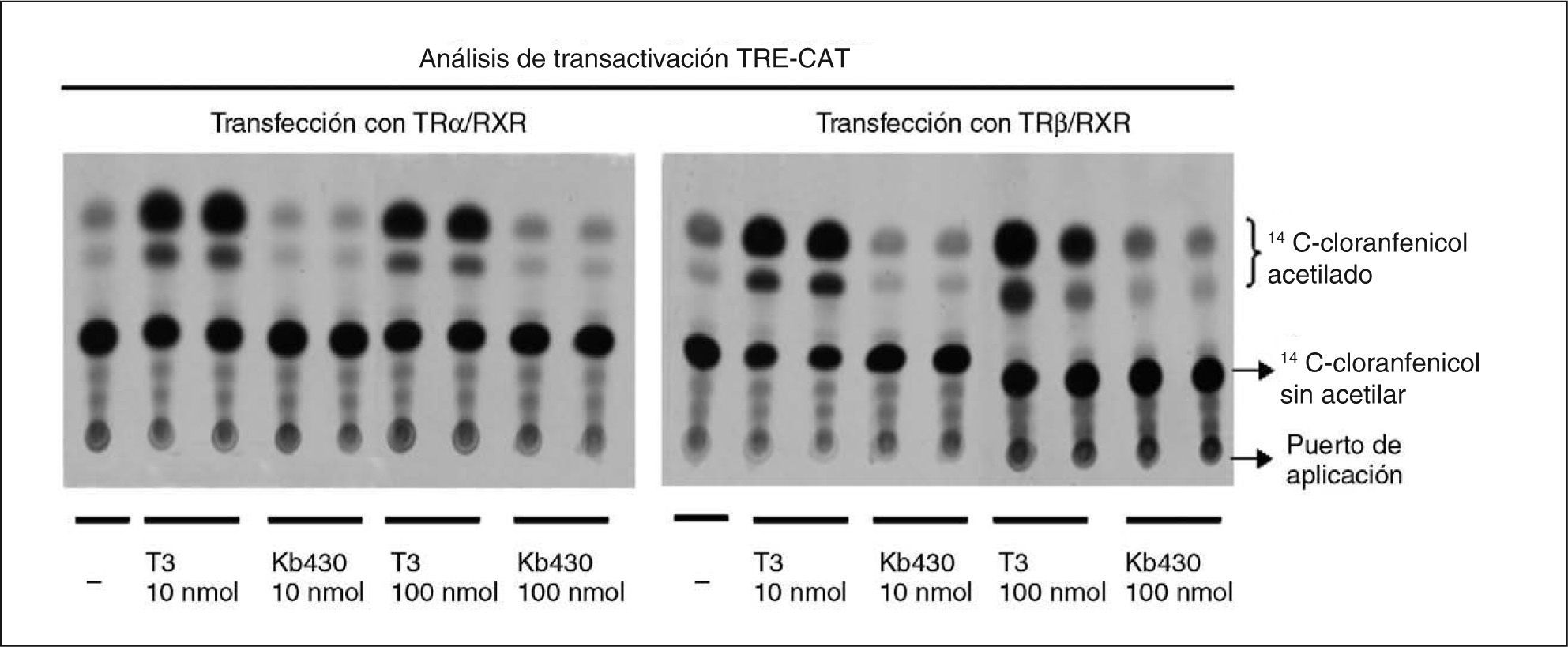
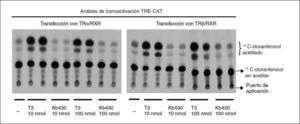
Interacción de T3 con sus receptores nuclearesEn los experimentos descritos, la administración de T3 fue eficaz en todos los parámetros de acción estudiados en diferentes tejidos. Sin embargo, el análogo específico para TRα no tuvo actividad. Para explicar la falta de actividad de este compuesto hay varias posibilidades, pero es necesario analizar si la falta de actividad in vivo se debe a una falta de activación del receptor. Para ello se analizó el efecto de T3 en la expresión de un gen indicador en células en cultivo que expresan las formas TRα1 o TRβ1 del receptor. Se usaron células Cos-7, que no expresan el receptor de T3, y se transfectaron con plásmidos de expresión de TRα1 o TRβ1 junto con un gen indicador que contenía el gen CAT (acetiltransferasa del cloranfenicol) controlado por el promotor de la timidincinasa del virus del herpes simple y de un TRE. Las células se incubaron con distintas concentraciones de T3 o Kb430, y al final de la incubación se determinó la actividad del gen indicador CAT. En las células tratadas con T3 a ambas dosis, se observa un aumento de la actividad CAT con respecto al basal. En el caso de las células tratadas con Kb430, tanto en las transfectadas con TRα como con TRβ, no se aprecia ninguna capacidad de transactivación (fig. 3).
Análisis de transactivación de receptores de T3 mediante expresión transitoria en células Cos-7. Las células se cultivaron en medio privado de T3 y T4, y se transfectaron con vectores de expresión de los receptores TRα o TRβ según se indica y de receptor del ácido 9-cis-retinoico RXRα, betagalactosidasa y cloranfenicol acetiltransferasa controlado por un elemento de respuesta a hormona tiroidea.
En este trabajo mostramos los efectos del hipotiroidismo y del tratamiento con hormona tiroidea en la expresión génica de cerebro y cerebelo. El hipotiroidismo de comienzo prenatal y prolongado durante las primeras 2 semanas de vida posnatal dio lugar a una disminución de la expresión de Ngrn y Rasd2 en el núcleo estriado y de Hr, Ntf3, Syt12 y Nr1d1 en el cerebelo. En el mismo grupo de animales hemos evaluado el efecto del hipotiroidismo y de la administración de T3 en otros tejidos, como la concentración de colesterol en suero, resultado de acciones de T3 en el hígado17, expresión de D1 en ese tejido y de Serca2 en el corazón. En conjunto, en este trabajo hemos descrito protocolos útiles para la evaluación del estado tiroideo de ratas durante el periodo neonatal. La mayoría de estos parámetros también pueden ser aplicables al animal adulto, aunque en el caso de los genes de respuesta a T3 en el cerebro y el cerebelo, sólo RC3 se ha demostrado sensible a las hormonas tiroideas después del primer mes de vida18.
En relación con el efecto de T3 en la expresión génica en cerebro y cerebelo, no son muchos los genes regulados por esta hormona, y para este trabajo hemos elegido los que mejor se prestan a un estudio mediante PCR. La regulación génica por T3 en el cerebro con frecuencia depende de la región, por lo que para la evaluación de sus efectos no es adecuado partir de ARN de todo el cerebro, y es necesario utilizar regiones aisladas. En este trabajo hemos usado el núcleo estriado y el cerebelo, porque su complejidad celular es menor que en otras estructuras. Las células que expresan RC3 y Rasd2 en el estriado son las espinosas gabaérgicas de mediano tamaño15, que constituyen el 95% de la población celular de esta región. En el cerebelo, la mayoría de las células son granulares, las que expresan los genes que hemos seleccionado para el estudio.
Que la administración de T3 dé lugar a cambios en la expresión génica en el cerebro indica que esta hormona es capaz de llegar a las células diana a través de la barrera hematoencefálica o de los plexos coroideos, es decir, la acción de la T3, como hormona activa, en el cerebro no depende exclusivamente de su formación local a partir de T4 y catalizada por la desyodasa 2, como parece ser el caso durante el período fetal en ratas19 y en humanos20. Efectivamente, en modelos de hipotiroidismo maternofetal, tras la administración de T4 a ratas gestantes, se puede detectar T3 en el cerebro de los fetos. Sin embargo, tras la administración de T3, se puede detectar esta hormona en el suero y diversos tejidos fetales, pero no en el cerebro, lo que indica que el cerebro fetal depende de la actividad Dio2. Nuestros resultados indican que esto no es aplicable al periodo posnatal. No se conocen las bases celulares de dicha discriminación, y es posible que estén implicados transportadores específicos de T4 y T321.
Para un mejor conocimiento de la acción de T3, tiene un gran interés definir las isoformas de receptor implicadas específicamente en sus acciones. Para el estudio de las funciones específicas de las isoformas de TR, se han seguido dos estrategias: por un lado, se han generado animales mutantes deficientes en alguna de las isoformas o que expresaran formas mutadas22,23. El uso de estos animales ha permitido conocer algunas de estas funciones, como la implicación de TRα1 en el control de la actividad del miocardio y el desarrollo intestinal y la implicación de TRβ en la regulación de la secreción de TSH, la audición y el metabolismo hepático. Otro abordaje ha sido la generación de compuestos análogos de la hormona tiroidea con especificidad selectiva por alguna de estas isoformas24. El estudio de dichos compuestos es de gran interés terapéutico, porque serían selectivos para determinadas acciones de las hormonas tiroideas que pueden resultar beneficiosas en afecciones distintas de las tiroideas25. En estudios previos hemos usado uno de estos compuestos, GC-1, que actúa selectivamente a través de TRβ, para identificar acciones de T3 mediadas por TRα o por TRβ en el sistema nervioso central10,26.
En este trabajo hemos tenido la oportunidad de evaluar un compuesto que, in vitro, se une con mayor afinidad a TRα que a TRβ, aunque su actividad in vivo no había sido explorada. Los experimentos realizados muestran que el tratamiento con Kb430 en animales hipotiroideos no consigue recuperar la expresión de los genes estudiados con ninguna de las dosis. Es razonable que este compuesto no haya tenido efecto en las respuestas hepáticas, pues éstas dependen fundamentalmente de TRβ; en el cerebro, una explicación a su falta de actividad podría ser que no atraviesa la barrera hematoencefálica. Sin embargo, este compuesto no tuvo actividad en la regulación de Serca2 en el corazón, que dependería de TRα.
Una razón para la falta de actividad in vivo podría ser una rápida metabolización que no permitiera la ocupación del receptor el tiempo suficiente. Sin embargo, los estudios de transactivación en células en cultivo indican que el compuesto carece de actividad. En esos experimentos se usaron células Cos-7 que no expresan TR, por lo cual se puede hacer que expresen transitoria y específicamente la isoforma de interés mediante transfección con plásmidos de expresión. Así, es posible estudiar en condiciones de equilibrio la respuesta del sistema a T3 o al análogo de interés mediante el uso de genes indicadores controlados por un TRE. Mientras que T3 tuvo un claro efecto en TRα o TRβ, el análogo de T3 no tuvo efecto alguno, lo que indica falta de actividad biológica.
Agradecemos al Dr. John Malm, Karo-Bio, Suecia, la cesión de Kb430 para estos estudios.
Este trabajo ha sido financiado con los proyectos BFU2005-01740 del Ministerio de Educación y Ciencia y el proyecto integrado de la Unión Europea CRECENDO (LSHM-CT-2005-018652), y ha contado con la participación técnica de Eulalia Moreno y Ana Torrecilla.