La neoplasia endocrina múltiple de tipo 1 (MEN1) es un síndrome hereditario raro conocido por la predisposición a la aparición de neoplasias endocrinas en distintos tejidos como paratiroides, hipófisis y tracto gastrointestinal. Se presenta el caso de un varón en el que además de manifestaciones tradicionalmente descritas (hipeparatiroidismo y gastrinoma) se objetivan otras lesiones tumorales procedentes de células de estirpe endocrinológica (insulinoma, carcinoide gástrico, adenoma suprarrenal, tumores neuroendocrino no funcionantes del páncreas) y no endocrinológica (lipoma y colagenoma). La frecuente recurrencia de las lesiones sobre los tejidos susceptibles no resecados en su totalidad (como en el caso del hiperparatiroidismo y del gastrinoma duodenal) y las dudas sobre su significado clínico en el MEN1 suscitan cierta controversia en la actualidad sobre las recomendaciones en el manejo terapéutico de dichas lesiones que se revisa brevemente.
The rare hereditary syndrome, multiple endocrine neoplasia type1 (MEN-1), is known to predispose affected individuals to endocrine neoplasms in a variety of tissues such as the parathyroid glands, the pituitary gland and the gastrointestinal tract. We describe the case of a man with traditionally-described manifestations (hyperparathyroidism and gastrinoma) and with other tumoral lesions arising from endocrine cells (insulinoma, gastric carcinoid, adrenal adenoma and pancreatic non-functioning neuroendocrine tumors) and non-endocrine cells (lipoma and collagenoma). Frequent recurrences in susceptible tissues that are not totally removed (as occurs in hyperparathyroidism and duodenal gastrinoma) and their unknown clinical significance have aroused current controversies in the therapeutic management of these entities, which is briefly reviewed.
El caso presentado, permite revisar 2 temas de actualidad relacionados con la neoplasia endocrina múltiple de tipo 1(MEN1) incluyendo: la diversidad de tumores potencialmente asociados y diferentes a los descritos tradicionalmente1 y las controversias persistentes acerca del tratamiento, sobretodo en lo referente a los tumores neuroendocrinos (TNE) del tracto digestivo como los gastrinomas2.
Caso clínico y evoluciónHombre de 28 años, que ingresa en marzo de 1985 para estudio etiológico de crisis convulsiva tónico-clónica coincidente con glucemia capilar de 25mg/dl que cede al administrar glucosa intravenosa. Entre sus antecedentes personales destacan cólicos nefríticos de repetición desde el año previo y entre sus antecedentes familiares el fallecimiento de su padre a los 45 años en relación con tumoración maligna del cuello, y entre cuyos antecedentes personales se halla una úlcera péptica complicada que precisó gastrectomía. En la analítica se objetiva una calcemia corregida de 11,9mg/dl (valor normal-VN-: 8,5-10,5) atribuida a hiperparatiroidismo primario (HPP) con PTH sérica de 549 pg/ml (VN: 10-65). A las 24 horas de un test de ayuno, el paciente presenta desorientación y somnolencia con glucemia venosa: 27mg/dl e insulinemia: 22μi/ml sin toma de sulfonilureas. La asociación de hiperinsulinismo endógeno y HPP dejan de manifiesto la presencia de un síndrome MEN 1. Las pruebas de localización del insulinoma incluyen una ecografía abdominal que identifica un nódulo de 2cm en cuerpo pancreático confirmado en una arteriografía que señala otra lesión nodular de 0,5cm en cola. Durante el acto quirúrgico se evidencian nuevos nódulos en cuerpo y cola pancreáticos que llevan a una pancreatectomía córporo-caudal, además de linfadenectomía peripancreática y esplenectomía. El estudio histopatológico confirma la presencia de 13 TNE (de 2,2cm, 2cm y el resto inferiores a 1cm) con infiltración de uno de los ganglios. Pese a no disponer de inmunohistoquimia confirmatoria, la evolución clínica con desaparición de las hipoglucemias y aparición de anomalía de glucosa en ayunas mantenida hasta la fecha actual llevan al diagnóstico de insulinoma multicéntrico resuelto tras la cirugía.
En aquel momento, el despistaje de otras neoplasias principales asociadas a MEN 1 resulta negativo: gastrinemia en ayunas: 65 pg/ml (VN: 25-115), TC abdominal postoperatorio sin evidencia de otras neoplasias, estudio hormonal basal y RM hipofisarios: normales.
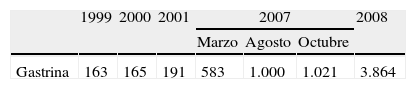
La cirugía del HPP se lleva a cabo 2 años más tarde mediante paratiroidectomía subtotal preservando parte de la paratiroides superior derecha. Con ello, la calcemia se mantiene normal hasta junio de 1997 en que se objetiva una recurrencia asintomática del HPP (calcemia: 10,5mg/dl y PTHi: 103 pg/ml) sobre el resto glandular no extirpado. En el estudio genético se aprecia una mutación en el exón 9 del locus 11q13 codon 423 (cambio de citosina por timina). El sujeto permanece asintomático hasta marzo de 1998 (13 años tras la laparotomía) en que un dolor abdominal lleva al diagnóstico endoscópico de úlcera en primera porción duodenal tratada con omeprazol. Pese a la respuesta satisfactoria con inhibidores de la bomba de protones llama la atención la reaparición del dolor abdominal junto con diarrea, cada vez que se suspende el tratamiento obligando a mantener el inhibidor de la bomba de protones. La gastrinemia se mantiene en rango normal hasta un año antes del episodio ulceroso (alcanzando 128 pg/ml en ausencia de inhibidores de la bomba de protones). Las gastrinemias sucesivas fueron determinadas bajo tratamiento con omeprazol a dosis constantes de 20mg/día y persiguen un ascenso progresivo como se aprecia en la tabla 1.
Las pruebas de imagen (ecografía, TC, RM) buscando un posible gastrinoma ofrecen resultados negativos entre 1998 y 2006, coincidiendo su positividad con una marcada elevación de la gastrina por esas fechas. Durante este intervalo de tiempo, la exploración del paciente y las pruebas de imagen permiten sin embargo objetivar otras lesiones:
- •
Carcinoide gástrico de 1cm, descubierto y resecado durante una endoscopia digestiva alta en el año 2002 (realizada con intención de descubrir un gastrinoma duodenal y descartar una gastritis crónica atrófica como causas de hipergastrinemia –ambos con resultado negativo–).
- •
Lesiones papulosas en antebrazo izquierdo a la exploración física compatibles con colagenomas.
- •
Aumento de la glándula paratiroides superior derecha desde 1997.
- •
Lesiones compatibles con lipomas subescapular y pleural desde 2006.
- •
Nódulo sugerente de adenoma suprarrenal derecho visible desde 1998 (de 1,5cm inicialmente y 2cm en 2009) con estudio de funcionalidad negativo.
A partir de enero de 2007, tras la confirmación bioquímica de gastrinoma con test de secretina, se evidencia una nueva lesión hipervascularizada en los TC y RM abdominales con criterios radiológicos de TNE adyacente a la cabeza del páncreas cuyo diámetro transversal pasa de 1cm en enero de 2007 a 2cm en febrero de 2008 y 3cm en mayo de 2008 y con captación positiva con Octreoscan. La ecoendoscopia con toma de biopsia en julio de 2008 confirma la existencia de una lesión de 3cm adyacente, aunque separada de la cabeza pancreática con inmunohistoquimia positiva para cromogranina A y gastrina sin poder establecer el órgano de asiento. El evidente crecimiento de la lesión lleva a nueva laparotomía en abril de 2009 consistente en:
- –
Extirpación de lesión lobulada de 5×3,5×1,3cm adyacente a la cabeza con resultado definitivo de metástasis ganglionar de TNE bien diferenciado con, índice KI 67 inferior al 5% e inmunohistoquimia intensamente positiva para gastrina.
- –
Enucleación de 2 nódulos intrapancreáticos hallados a la exploración manual de la cabeza compatibles con TNE no funcionantes de 0,8 y 0,3cm (inmunohistoquimia negativa para gastrina e insulina).
- –
Colecistectomía. No se practica duodenotomía.
A los dos meses se evidencia una gastrinemia normal (103 pg/ml) retirando el inhibidor de la bomba de protones, aunque con ascenso patológico tras infusión de secretina (pico de 675 pg/ml) y desaparición de la lesión peripancreática en un TC de control. Se establece así el diagnóstico de extirpación de metástasis ganglionar de gastrinoma con persistencia del tumor primario. En la actualidad, el paciente mantiene buen estado general, una vida activa y sin síntomas pese a la recurrencia del HPP y la persistencia bioquímica del gastrinoma. Sigue tratamiento con omeprazol (20mg/día) y desde hace unos meses con analógos de somatostatina (octreótida LAR 20mg cada 4 semanas im) con intención de detener la progresión maligna del gastrinoma primario.
Discusión y revisiónAunque para establecer la presencia de MEN1 es suficiente la presencia de 2 de las 3 neoplasias principales (HPP, TNE enteropancreático y adenoma hipofisario), es evidente la predisposición a otras neoplasias tanto en tejidos endocrinos como no endocrinos1. Entre los tumores endocrinos más prevalentes que en la población general se encuentran los carcinoides (tímicos en 5% de los MEN13, así como bronquiales y gástricos en el 2 y 10% respectivamente1). Como sucedió en este caso, los carcinoides gástricos suelen detectarse de manera incidental4. Su pequeño tamaño permite la resección endoscópica completa del tumor no funcionante en la mayoría de los casos5. Pese a que la hipergastrinemia mantenida es un estímulo conocido para la proliferación de las células enterocromafin-like, el riesgo de padecer un carcinoide gástrico es pequeño en pacientes con síndrome de Zollinger-Ellison esporádico. En pacientes con síndrome de Zollinger-Ellison asociado al MEN1 dicho riesgo es 20 a 30 veces superior6 lo que lleva a incluir el carcinoide gástrico en el espectro de tumores endocrinos asociados a esta entidad como corrobora la demostración de la inactivación de ambas copias del gen supresor tumoral MENINA en la células de carcinoides gástricos de los pacientes MEN17.
Otras neoplasias descubiertas en este caso ya descritas en el MEN1 aunque de escasa repercusión pronóstica fueron: un adenoma suprarrenal presente en cerca del 30% de los casos en algunas series8, lipomas cutáneos y viscerales en el 40%1 y colagenomas hasta en el 70%9.
En cuanto al HPP se trata de la manifestación más frecuente con penetrancia cercana al 100% a los 50 años de edad10. El diagnóstico en nuestro paciente a una edad temprana coincide con lo descrito en la literatura. La afectación multiglandular paratiroidea, no siempre sincrónica, representa otra diferencia respecto a los HPP esporádicos y justifica las elevadas recurrencias sobre restos de tejido paratiroideo no extirpados (como sucedió en el caso descrito) del 67% a los 8 años de la paratiroidectomía subtotal11. La elevada recurrencia sería consecuencia de la evolución inexorable de unas glándulas paratiroideas genéticamente susceptibles12. Por ello, la cirugía aconsejada en los HPP del MEN1 difiere de los esporádicos y va desde la paratiroidectomía subtotal13, a la total con reimplante de una glándula en antebrazo14. La elevada tasa de hipoparatiroidismo permanente en paratiroidectomías totales frente a la alta tasa de recurrencia en paratiroidectomías subtotales motivan divergencia de opiniones acerca de la mejor modalidad quirúrgica.
Los insulinomas en el MEN 1 a menudo se describen como pequeños y multicéntricos a lo largo del páncreas (como sugería el estudio histológico del caso). Esto convierte, para la mayoría, a la pancreatectomía corpocaudal con exploración de la cabeza (enucleando posibles lesiones) en la cirugía de elección15.Con ello se evitaría la recurrencia de la hipoglucemia descrita en 40% de MEN1 sometidos a simples enucleaciones16 (habitualmente suficientes en el insulinoma esporádico) lo que remeda el carácter genético de la enfermedad también a nivel del páncreas17. En el caso del insulinoma no existen dudas sobre la indicación de la cirugía dado los resultados habitualmente curativos y la escasa eficacia de los tratamientos médicos disponibles.
Entre los TNE enteropancreáticos funcionantes, el gastrinoma representa la neoplasia más frecuente del MEN1 demostrable en el 60%18. A diferencia de la forma esporádica, la indicación quirúrgica es controvertida2 pese a ser el gastrinoma el principal condicionante pronóstico por su malignidad potencial (metástasis hepáticas o ganglionares en casi la mitad de los sujetos19). A diferencia del insulinoma, las manifestaciones clínicas derivadas de la hipersecreción ácida inducida por el gastrinoma (úlcera péptica, pirosis, diarrea) se controlan satisfactoriamente y a largo plazo con fármacos antiácidos como los inhibidores de la bomba de protones20 cuya eficacia ha logrado evitar los antiguos procedimientos de cirugía gástrica para el control de la secreción ácida17. Así, el principal objetivo de la cirugía del gastrinoma se convierte hoy en evitar o retrasar la aparición de metástasis hepáticas para incrementar la supervivencia del paciente21. En efecto, las metástasis hepáticas halladas en el 24% de gastrinomas22 representan el principal factor predictor de mortalidad tanto en formas esporádicas como de MEN1 con supervivencias que oscilan desde 93% a los 15 años de seguimiento, al 26% a los 10 años en pacientes sin o con metástasis al diagnóstico respectivamente23. En las formas esporádicas, si bien la resección a menudo no logra la curación a largo plazo (sólo el 34% con gastrinemia basal y tras secretina normales a los 10 años24) si se relaciona con menor tasa de metástasis hepáticas (23 frente a 3% a los 8 años comparando sujetos no operados frente a operados25) y menor tasa de mortalidad específica (23 frente a 1% respectivamente a los 12 años26). En el caso de MEN1, varios motivos fomentan el debate sobre la idoneidad de la indicación quirúrgica del gastrinoma como son:
- –
Historia natural del tumor poco conocida con supervivencias prolongadas en algunas series (88 al 100% a los 10 años) incluso entre pacientes con metástasis hepáticas al diagnóstico (52% a 15 años)27.
- –
Carencia de estudios con número de sujetos y tiempo de seguimiento suficientes que comparen pacientes operados frente a no operados.
- –
Porcentajes de curación bioquímica aún inferiores a los de los gastrinomas esporádicos con los procedimientos quirúrgicos estándares (hasta 0% a los 5 años en algunos trabajos24,28).
También aquí la persistencia del tumor se atribuye a la multiplicidad de los gastrinomas y a su pequeño tamaño29 que dificultan la resección completa con las técnicas usuales30. El conocimiento de la distribución en duodeno de los gastrinomas en casi todos los MEN1 y en la mitad de los esporádicos31 llevan a recomendar la duodenotomía con exploración duodenal sistemática además de la exploración pancreática en aquellos sujetos sometidos a laparotomía32. En el caso presentado, el riesgo potencial de una pancreatectomía total y sus consecuencias en caso de realizar dicha técnica (en un sujeto cuyo único resto pancreático era la cabeza debido a la intervención realizada 24 años antes) llevaron a la decisión consensuada de resecar tan solo la lesión peripancreática en aumento sin proceder a la duodenotomía. Así, la falta de exploración del duodeno, la elevada probabilidad de su ubicación en esta región en los MEN129,33 y la escasa sensibilidad de las técnicas preoperatorias para los TNE duodenales34 podrían justificar en este paciente la persistencia bioquímica del gastrinoma tras la intervención. Sin embargo, incluso en estudios en los que se realiza duodenotomía sistemática junto con pancreatectomía distal, exploración capital y linfadenectomía regional, las tasas de curación del gastrinoma del MEN1 siguen siendo pobres (del 0 al 33%27,35). Como en el caso del HPP, tan solo la resección de todo el tejido susceptible ha demostrado la posible curación en series pequeñas de sujetos sometidos a duodenopancreatectomía cefálica en ocasiones asociadas a pancreatectomía total36,37. Sin embargo, la mayoría rechazan la duodenopancreatectomía cefálica sistemática, dada su elevada morbilidad (más del 30%) tanto a corto plazo (fístulas, abscesos, dehiscencias), como a largo plazo (insuficiencia endo y exocrina) y porque dificulta técnicamente posibles reintervenciones2. La lesión peripancreática extirpada de nuestro paciente resultó ser una metástasis ganglionar de un gastrinoma no resecado e ilustra la alta proporción de adenopatías metastásicas halladas en los gastrinomas (esencialmente aquellos asentados en duodeno35,36). Las metástasis ganglionares no suelen incluirse en los factores pronósticos de mortalidad22,38 a diferencia de las metástasis hepáticas que con frecuencia representan el único factor independiente de mortalidad de los gastrinomas30. Varios trabajos indican que del 15 al 30% de los pacientes con MEN1 fallecen por la progresión maligna de TNE38,39 y en un estudio prospectivo la mortalidad por gastrinoma de MEN1 al cabo de 8 años de seguimiento osciló del 23 al 0% en pacientes con y sin metástasis hepáticas respectivamente40. Extrapolando a los MEN 1 los resultados de la cirugía del gastrinoma esporádico, algunos sugieren que ésta podría frenar la aparición de metástasis hepáticas41,42 pese a no lograr la curación bioquímica. Los escasos estudios prospectivos con número limitado de pacientes MEN1 no han logrado sin embargo, demostrar el beneficio de la cirugía del gastrinoma sobre la incidencia de metástasis ni sobre la mortalidad19. Entre las variables biológicas asociadas a mayor incidencia de metástasis en hígado y mayor mortalidad se encuentran el tamaño del tumor primario (superior a 2-3cm) y su ubicación en páncreas tanto para los gastrinomas esporádicos como los del MEN123,38. El hecho de que en el MEN 1 estos tumores suelen ser de pequeño tamaño y más habitualmente duodenales podría justificar un comportamiento biológico menos agresivo con mayores tasas de supervivencia43,44 respecto a los esporádicos. Pese a todo, y al igual que sucede entre el 25 al 30% de los gastrinomas esporádicos22,23, en el 14% de las formas MEN1 se objetiva un comportamiento agresivo marcado por una elevada velocidad de crecimiento asociada a mayor probabilidad de desarrollar metástasis hepáticas y de fallecimiento40. En el caso presentado, aunque el crecimiento del gastrinoma fue inicialmente lento (no evidenciable en las pruebas de imagen entre 1997 y 2007 pese a gastrinemia en aumento), la velocidad de aumento de la metástasis ganglionar entre 2007 y 2008 y el tamaño crítico de 3cm alcanzado llevaron a indicar la resección de la lesión. Ni el índice Ki67 (inferior al 5%) ni la progresión inicial ayudaron a predecir un comportamiento agresivo.
La decisión de utilizar análogos de somatostatina se basa la posible estabilización de la enfermedad metastásica en el 40% o más de casos45 aunque es habitual la taquifilaxia a largo plazo46 (salvo en casos aislados)47. El beneficio de estos fármacos es mayor en TNE que expresan receptores de somatostatina demostrables con la positividad del Octreoscan48, con cierto grado de diferenciación y evidencia de enfermedad progresiva49,50. El cumplimiento de estas premisas en nuestro paciente y la buena tolerancia de estos fármacos comparado con otras modalidades terapéuticas51,52 llevaron a indicar el tratamiento aún sabiendo que su uso profiláctico (previo a la aparición de metástasis hepáticas) no ha demostrado mejorar la supervivencia en los TNE53.
En cuanto a otros TNE pancreáticos en el MEN1, la prevalencia de los no funcionantes es aún superior a la de los funcionantes (80 al 100% en piezas de series quirúrgicas o de autopsia18,54. En nuestro caso, algunos de los TNE de cuerpo y cola de la primera intervención podrían haber sido TNE no funcionantes (inmunohistoquimia no disponible) al igual que los que se hallaron en cabeza en la segunda laparotomía. La indicación quirúrgica de estas lesiones también suscita controversia dada su multiplicidad y pequeño tamaño33 que llevarían a resecciones masivas. Por ello, se tiende a intervenir cuando alcanzan un tamaño de 2 a 3cm o cuando se evidencia un crecimiento rápido para frenar la progresión maligna ya que algunas lesiones se mantienen estables durante años36. En caso de laparotomía necesaria para la escisión de TNE funcionantes algunos aconsejan resecar cuerpo y cola dada la constante asociación de TNE no funcionantes35,55.
Este caso ilustra la diversidad de tumores relacionados con este síndrome genético y su elevada penetrancia manifestada por la alta recurrencia en algunos tejidos. Parte del debate actual se centra en decidir entre una amputación definitiva de algunas estructuras para evitar la recidiva o procedimientos más conservadores que defienden una buena calidad de vida aún con la persistencia del tumor dada la supervivencia prolongada de la mayoría de los sujetos.