Introducción
El pronóstico a largo plazo de los niños con insuficiencia renal crónica (IRC) ha mejorado considerablemente como consecuencia de avances en diálisis y trasplante, nutrición agresiva y aparición de tratamientos hormonales sustitutivos. A pesar de estos avances, el hipocrecimiento constituye un serio problema en más del 50 % de los pacientes que alcanzan la edad adulta.
Según los datos del Registro Español Pediátrico de Insuficiencia Renal de 2004 (REPIR), la talla final en 400 pacientes tratados en unidades infantiles fue de 162 ± 11,9 cm en varones y 155 ± 8,1 en mujeres, lo que representa un Z score medio de 2 desviaciones estándar (DE) en el sexo masculino y 1 DE en el femenino 1.
El mayor defecto de crecimiento se observa en niños en los que el fallo renal comienza antes del año de edad como consecuencia de alteraciones estructurales como displasia, hipoplasia, hidronefrosis, válvulas de uretra, etc.2. Este grupo de patologías es la causa del 46 % de fracaso renal pediátrico 1.
En condiciones similares de estado nutricional no se ha demostrado diferencia significativa en el crecimiento entre pacientes en diálisis peritoneal o hemodiálisis.
Tras el trasplante renal la recuperación de talla sólo se observa en menos de la mitad de los receptores 3. Las factores predictivos más importantes sobre la talla final son la edad al trasplante y, especialmente, el Z score previo 4.
Fisiopatología del hipocrecimiento en la insuficiencia renal crónica
En el desarrollo estatural del niño se distinguen 3 fases bien diferenciadas. La primera comprende desde el período posnatal hasta los 2 o 3 años de edad. En esta etapa tiene lugar el 50 % del potencial total de crecimiento, y su desarrollo está determinado fundamentalmente por factores nutricionales.
Desde los 3 años hasta la prepubertad, el aumento de talla es estable, de 5 a 7 cm/año, y está fuertemente relacionado con valores y acción normales de la hormona de crecimiento (GH). Con la adolescencia tiene lugar el "estirón puberal" dependiente de la acción de las hormonas sexuales en combinación con GH.
La etiopatogenia del hipocrecimiento en la IRC es multifactorial (tabla I), y el desarrollo estatural depende de 2 factores fundamentales: edad de aparición y grado de alteración del filtrado glomerular 5. Cuando el fracaso renal es precoz, el déficit de talla producido es irrecuperable, al menos en su totalidad. En un período posterior, la velocidad de crecimiento puede ser normal cuando el filtrado glomerular es superior a 25 ml/min/1,73 m 2, pero no existe fenómeno de catch up o recuperación.
Al llegar a la pubertad (habitualmente retrasada una media de 2 años), se observa una nueva disminución de la velocidad de crecimiento y, como consecuencia, baja talla final.
El bajo aporte calórico es un determinante fundamental del hipocrecimiento en todas las edades, especialmente en pacientes menores de 3 años 6. Sus causas son la anorexia, los vómitos y el rechazo del alimento. En pacientes en diálisis peritoneal se añaden las pérdidas de proteínas originadas por la técnica.
Los niños con poliuria y nefropatías perdedoras de sal, en los que la eliminación urinaria no es adecuadamente corregida, experimentan un significativo retraso de crecimiento relacionado con depleción crónica de volumen y equilibrio negativo de sodio.
La acidosis es un factor importante en el retraso de talla, como lo demuestra su papel exclusivo en determinadas tubulopatías.
La anemia crónica ha sido considerada clásicamente como un factor importante en la estabilización de la talla. Los posibles mecanismos fisiopatológicos serían su contribución a la anorexia, la predisposición a infecciones frecuentes y una oxigenación reducida del platillo cartilaginoso.
No obstante, desde que se inició el tratamiento con rhEPO se ha comprobado que su corrección no conduce a catch up de talla 7.
Otro de los factores etiopatogénicos clásicamente considerados como favorecedores de talla baja es la osteodistrofia renal. Desde la disponibilidad de formas hormonales de vitamina D se ha comprobado que ni la administración de calcitriol ni la corrección de hiperparatiroidismo secundario mejoran la velocidad de crecimiento. Por el contrario, la frenación excesiva de hormona paratiroidea (PTH) y el uso de quelantes de fósforo pueden llevar a una enfermedad ósea de bajo recambio que disminuya la velocidad de crecimiento 8,9.
A pesar de un tratamiento clínico supuestamente óptimo, los registros europeos y estadounidenses de principios de la pasada década de los noventa demostraban que el hipocrecimiento y la baja talla final adulta seguían aconteciendo en más de la mitad de los pacientes que iniciaban la IRC en la edad pediátrica.
Corresponde a Mehls y Ritz 10 el mérito de haber demostrado que dosis suprafisiológicas de GH mejoraban los resultados.
Los valores plasmáticos de GH se encuentran elevados o en límites altos de la normalidad en pacientes con IRC. El análisis de la secreción ante estímulos como L-dopa, hipoglucemia o arginina han mostrado resultados variables. García et al 11 han comprobado en ratas urémicas una menor amplitud secretora de los pulsos sin modificaciones en la frecuencia y duración de los mismos. Otros autores encuentran un aumento de la secreción en preadolescentes 12, probablemente determinado por una deficiente retroalimentación bioactiva del eje somatotrópico. En pacientes adultos en hemodiálisis la liberación de GH está claramente elevada 13.
La variabilidad de estos resultados puede deberse a los distintos grupos de población estudiados, fundamentalmente a la edad, y a diferentes estados nutricionales, factores que condicionan fuertemente la producción y la liberación de la hormona.
En lo que coinciden todos los trabajos es en que el catabolismo de la GH está disminuido en la IRC, ya que el riñón es responsable de más del 70 % de su degradación. Por consiguiente, valores plasmáticos de GH pueden estar elevados por exceso de producción, enlentecimiento del catabolismo o ambas causas. La discrepancia entre valores altos-normales e hipocrecimiento ha llevado al concepto de resistencia a la acción de GH.
Un hallazgo importante en la uremia es la reducción en la expresión del receptor de GH en los órganos periféricos, así como de la concentración plasmática de proteínas transportadoras de GH que representan el dominio extracelular del receptor 14,15. El descenso se correlaciona con el grado de función renal, con el índice de masa corporal (lo que pone nuevamente de manifiesto la importancia del estado de nutrición) e, inversamente, con la velocidad de crecimiento.
La baja densidad de receptores GH en el hígado tiene como consecuencia una disminución en la expresión del gen de IGF-I (factor de crecimiento semejante a insulina), mediador parcial de la acción de la hormona sobre los condrocitos.
Los valores de IGF se encuentran dentro del rango normal en niños en IRC moderada, mientras que en pacientes en diálisis el IGF-I sérico está ligera pero significativamente disminuido y el IGF-II elevado 16. Por tanto, los niveles totales de IGF inmunorreactivos son normales, pero la bioactividad, medida por la incorporación de sulfato en el cartílago costal porcino, está marcadamente disminuida 17. Igualmente, los valores de IGF-I libre se hallan reducidos al 50% de su valor normal 18.
Estos hallazgos constituyen una de las anormalidades más importantes del eje GH/IGF en la insuficiencia renal.
El IGF-I se une a proteínas transportadoras (IGFBP) que evitan su rápido catabolismo y regulan su acceso a los receptores. La más abundante es la IGFBP-3, que forma un complejo ternario con IGF-I y una proteína subunidad ácido lábil. En la IRC se acumulan proteínas transportadoras de menor peso molecular (IGFBP-1, 2 y 4) con mayor afinidad por IGF-II, lo que origina menor vida media y disregulación de IGF-I.
Además de las alteraciones de IGF-I circulante, la insuficiencia renal interfiere en la respuesta de las células diana. En ratas urémicas se ha comprobado que en la placa de crecimiento óseo retrasa el proceso de maduración de los condrocitos y disminuye los valores de ARN mensajero 19.
Prevención y tratamiento
La adecuada nutrición del niño en IRCT es un elemento fundamental para disminuir la morbimortalidad y absolutamente necesaria para el crecimiento en peso y longitud, aunque este último esté disminuido. Se ha comprobado que existe correlación entre aporte energético y crecimiento 20.
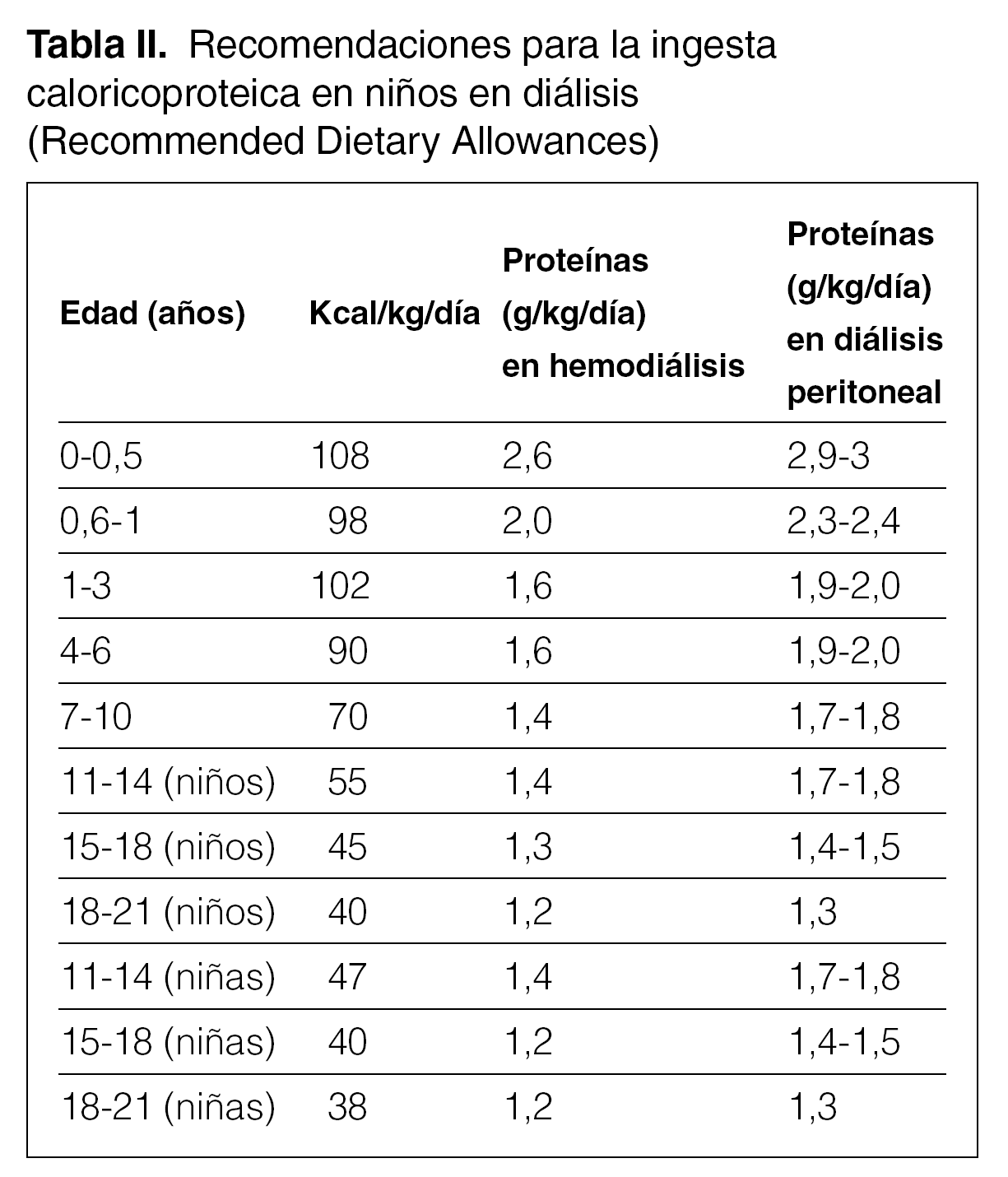
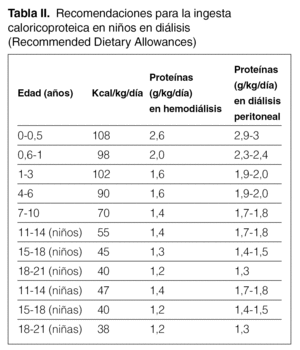
La prescripción inicial de aporte calórico debe ser, al menos, del 100 % de la recomendada en niños sin insuficiencia renal de la misma edad cronológica 21. Las cantidades medias de referencia se pueden encontrar en diferentes tablas pediátricas. La más utilizada es la de la RDA (Recommended Dietary Allowances; tabla II).
Los hidratos de carbono, preferentemente glúcidos complejos, deben aportar el 35 % de las calorías; los lípidos, alrededor del 50 %, con una relación entre ácidos grasos poliinsaturados/saturados de 1,5:1. Siempre que sea posible, los aportes deben ser tomados en las comidas regulares. Frecuentemente, la anorexia, los vómitos y otros factores obligan a recurrir a sondas nasogástricas, con débito continuo o nocturno, y gastrostomías.
El aporte proteico en el niño en diálisis peritoneal debe ser el recomendado en la RDA para la edad cronológica suplementado en 0,4 g/kg/día.
Es fundamental un aporte del 100% de las necesidades habituales de vitaminas del grupo B, A, C, ácido fólico y oligoelementos.
Las prescripciones iniciales deben modificarse a partir de los parámetros de seguimiento. Mientras que en el paciente adulto los modelos cinéticos de urea tienen un papel importante en la valoración nutricional, no existen evidencias para recomendar su uso rutinario en el paciente pediátrico. Igualmente, la determinación de prealbúmina y otras proteínas nutricionales es muy variable.
La corrección de la acidosis es muy importante. Habitualmente es preciso administrar bicarbonato en cantidad suficiente para mantener un equilibrio ácido-básico normal.
Las nefropatías estructurales suelen acompañarse de pérdidas de sodio importantes hasta insuficiencia renal muy avanzada. En estos pacientes es necesario mantener una dieta hipoosmolar, normal en sodio, e incluso corregir las pérdidas de este catión con suplementos que oscilan entre 2 y 4 mEq/kg/día 6.
Como se ha comentado anteriormente, la osteodistrofia renal con valores altos de PTH no produce retraso de talla, a menos que se acompañe de deformidades esqueléticas importantes. En el control de la enfermedad ósea, para evitar un efecto pernicioso sobre el crecimiento hay que considerar los siguientes elementos:
Los valores diana de fósforo plasmáticos recomendados en las guías K/DOQUI 22 (entre 3,5 y 5,5 mg/dl) no son de referencia en el niño pequeño, con fosfatemia fisiológica más elevada: en la edad de 1 a 3 meses, una media de 6,2 mg/dl (intervalo, 4,8 a 7,4), descendiendo a una media de 5 mg/dl (intervalo, 4,5 a 5,8) a los 2 años, manteniéndose en estos valores hasta el período prepuberal, en el que vuelven a ascender. Por tanto, la administración de quelantes de fósforo debe adaptarse a estos parámetros.
Los valores recomendados de PTH deben mantenerse entre 2 y 3 veces sobre el límite del rango normal en pacientes en insuficiencia renal crónica terminal 23.
De acuerdo con el punto anterior, no se recomienda iniciar tratamiento con metabolitos de vitamina D con PTHi < 200 pg/ml 24. La dosis inicial recomendada de calcitriol oscila de 0,01 a 0,05 mg/kg/día, aumentando progresivamente hasta alcanzar calcemias de entre 10 y 10,5 mg/dl.
En la combinación de altas dosis de calcitriol, carbonato cálcico y solución de diálisis con elevada concentración de calcio debe vigilarse estrechamente la detención del crecimiento y la aparición de lesiones raquíticas.
En los últimos años, el tratamiento con GH humana recombinante (rhGH) ha supuesto un importante incremento de talla en niños con IRC. Los pacientes tratados tienen un marcado crecimiento en longitud, y es posible recuperar el retraso de talla. Fine et al 25 comprobaron que, en pacientes en prediálisis, el tratamiento con rhGH durante 5 años disminuía el Z score de 2,6 a 0,7 DE.
Son numerosos los estudios clínicos efectuados evaluados en una revisión Cochrane 26. La conclusión es que, en promedio, el tratamiento durante un año con 28 U/m 2/semana produce una velocidad de crecimiento de 4 cm/año por encima de los controles sin tratar. Sin embargo, no es seguro que produzca un aumento en la talla adulta final. Los beneficios de tratamientos más largos o con dosis más elevadas merecen otro estudio.
A pesar de la falta de estudios amplios de población sobre la talla final, los datos disponibles sugieren una superior longitud que la de los pacientes no tratados. Los mejores resultados se obtienen cuando se inicia la administración en tratamiento conservador 25,27.
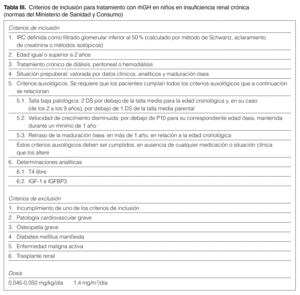
En España hace años que se utiliza la rhGH. El Ministerio de Sanidad y Consumo ha dictado unas normas para su prescripción (tabla III) muy restrictivas, ya que se definen como criterios auxológicos una talla baja (> 2 DE) y velocidad de crecimiento inferior al P10, a diferencia de las indicaciones de las guías estadounidenses, que exigen tan sólo uno de los 2 criterios.
Tampoco está autorizado legalmente el uso de rhGH en pacientes trasplantados con riñón funcionante. La dosis recomendada se muestra en la tabla III.
Los efectos adversos descritos del tratamiento con rhGH son escasos si previamente se han corregido alteraciones como la osteodistrofia renal. Los más frecuentemente observados fueron el incremento de insulina basal y posprandial sin trastorno en el metabolismo de la glucosa, y necrosis de la cabeza femoral.
La posible predisposición al aumento de rechazos en el paciente trasplantado no se ha comprobado, si bien los valores séricos de creatinina son más elevados en el grupo tratado con hormona.
El uso de IGF-I en el déficit de talla podría ser un tratamiento más específico del déficit de talla. Hasta el momento, los datos disponibles en niños son escasos.
En ratas urémicas se ha comprobado un efecto similar al de rhGH 28. El tratamiento combinado con GH e IGF-I es aditivo y complementario, y promete resultados esperanzadores 29.
Correspondencia: Dr. J. Martín-Govantes.
Unidad de Nefrología Pediátrica. Hospital Virgen del Rocío.
41013 Sevilla. España.
Correo electrónico: govantes@us.es
© Sociedad Española de Diálisis y Trasplante