El objetivo de elaborar este consenso ha sido colaborar con el nefrólogo en el manejo del metabolismo mineral del paciente con ERC. Para su realización, partimos de formular preguntas que necesitamos respuesta para el manejo clínico de nuestros pacientes. Se consultaron fuentes bibliográficas y guías internacionales intentando adaptarlas a la realidad de nuestro país, Argentina. Hemos tenido en cuenta las nuevas definiciones y el sistema de clasificación más integrado que recientemente propuso la Fundación Kidney Disease Improving Global Outcomes (KDIGO). Desarrollamos el capitulo iv sobre el tratamiento de la hiperfosfatemia y mantenimiento del calcio en pacientes con enfermedad renal crónica estadio 5 en diálisis.
The aim of preparing this consensus was to aid nephrologists in the management of mineral metabolism in patients with chronic kidney disease. First, we formulated questions that required answers for the clinical management of these patients. Literature sources and international guidelines were consulted with a view to adapting them to the Argentine context. The new definitions and the more integrated system recently proposed by the Kidney Disease - Improving Global Outcomes Foundation have been taken into account. The present chapter discusses the treatment of hyperphosphatemia and calcium maintenance in patients with chronic kidney disease stage 5 under dialysis.
- 1.1.
Dieta
La restricción de la ingesta de fósforo debe ser de 800–1.000mg/d ajustada a las necesidades proteicas y peso adecuado. Para mejorar la adhesión del paciente es necesaria una orientación dietética individualizada realizada por nutricionista, mediante programas de educación nutricional.
- 1.2.
Uso de quelantes del fósforo
Los quelantes del P deben utilizarse en todo paciente que presenta un fósforo sérico mayor o igual a 5mg% con prescripción de dieta restringida en fósforo. Las sales de calcio, de aluminio, de magnesio, el carbonato de sevelamer y el carbonato de lantano son efectivos para reducir los niveles séricos de fósforo. El carbonato de calcio debe ser ingerido inmediatamente antes de las comidas. La nicotinamida se puede ingerir por la noche, alejada de las comidas y junto al uso de ácido acetilsalicílico. Para el caso del resto de los quelantes se sugiere que sean ingeridos durante la ingesta alimentaria, adecuando la dosis y número de acuerdo a la carga de fósforo de la dieta.
- 1.2.1
Quelantes con calcio
Se recomienda el uso de acetato de calcio por encima del carbonato de calcio. La dosis total de calcio elemental provista por los quelantes con calcio no debe exceder los 1,5g/d con un límite superior de tolerancia incluyendo la ingesta alimentaria de 2g/d.
- 1.2.2
Quelantes sin calcio
Se recomienda el uso de quelantes sin calcio en las siguientes situaciones:
- •
pacientes con calcio corregido mayor a 10mg/dl a pesar de estar dializando con un calcio de 2,5mEq/l o
- •
pacientes con una hiperfosfatemia persistente y sostenida mayor o igual a 6,5mg/dl o
- •
pacientes con calcificaciones vasculares (tratando conjuntamente a los otros factores de riesgo vasculares) o
- •
calcifilaxis
- 1.2.2.1
Uso de hidróxido de aluminio: Se recomienda no utilizar hidróxido de aluminio por un período mayor a cuatro semanas seguidas a una dosis que no supere 1g/d, asegurando una concentración adecuada de niveles de aluminio en el dializado. Se recomienda en lo posible dializar con membranas de alto flujo.
- 1.2.2.2
Uso de carbonato de sevelamer: no se asocia a acidosis metabólica.
- 1.2.2.3
Uso de nicotinamida: la nicotinamida permitiría disminuir la dosis de los otros quelantes administrados de manera conjunta. El inconveniente está dado por los efectos adversos que limitan su uso.
- 1.2.2.4
Uso de carbonato de magnesio: no existe una dosis máxima establecida y conocida para el uso de carbonato de magnesio como único quelante utilizando un baño de diálisis con una concentración convencional de magnesio. La asociación con otros quelantes cálcicos permitiría por un lado reducir la carga de calcio para el paciente y por el otro el uso de un baño de diálisis convencional.
- 1.2.2.1
- •
- 1.2.3
Dosis y tipo de diálisis
La hemodiálisis nocturna extendida y la hemodiálisis corta diaria han mostrado ser efectivas para un control adecuado del fósforo y reducir la dosis de quelantes requeridos.
Agregar una sesión corta de hemodiálisis de 2 a 3h al esquema trisemanal (4.a sesión) incrementa la cantidad de fósforo removido en el dializado.
- 1.2.4
Concentración de calcio en el baño de diálisis
Se debe individualizar la concentración de calcio en el baño de diálisis de acuerdo a los parámetros del metabolismo fosfocálcico y a la adherencia al tratamiento con quelantes de calcio de cada paciente. Situaciones especiales deben ser consideradas como en los casos de bajo recambio óseo y calcio sérico normal, donde se debe utilizar de preferencia dializado con Ca 2,5mEq/l con control estricto de la PTHi; o en presencia de hipercalcemia, independientemente de los niveles de PTHi. Se recomienda utilizar esta misma concentración cuando el paciente esta bajo tratamiento con calcitriol o análogos.
- 1.2.1
La concentración de 3,5mEq/l debe limitarse solo a aquellos pacientes que requieran un balance positivo rápido como en el caso del hueso hambriento posparatiroidectomía.
Racional (discusión)La hiperfosfatemia en la insuficiencia renal crónica es el resultado de tres factores principales: una ingesta relativamente excesiva de fósforo, una reducción de la depuración renal o dialítica, o un estado de remodelación ósea alto o bajo.
La hiperfosfatemia contribuye al desarrollo de hiperparatiroidismo secundario y está asociada a una mayor morbimortalidad en los pacientes con ERC en estadio v1–14. En esta población de pacientes con fósforo elevado la principal causa de morbimortalidad es la cardiovascular y se observa una incidencia de calcificación vascular desproporcionada al grupo etario10. Si bien no se ha establecido aún una relación causa-efecto, la calcificación vascular sería el resultado de la transformación fenotípica de las células musculares lisas a nivel de la media arterial por la acción directa del fósforo o indirectamente a través del desarrollo de hiperparatiroidismo secundario16–19.
El tratamiento de la hiperfosfatemia en el estadio v de la insuficiencia renal crónica incluyen la dieta, el uso de quelantes de fósforo y la diálisis1–7.
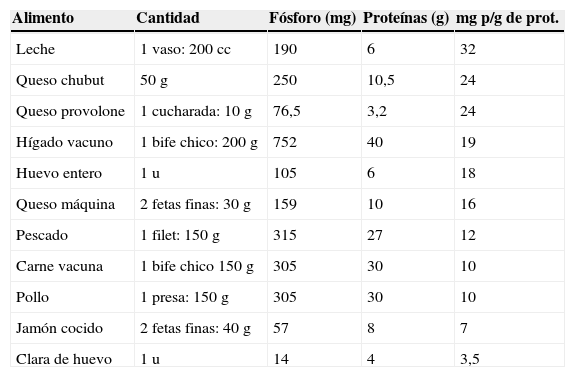
La restricción de fósforo debe ser de 800–1.000mg/d ajustada a las necesidades proteicas y peso adecuado1–3–7–20. En diálisis los requerimientos proteicos deben ser superiores a los recomendados para la población general, dada la condición catabólica de la técnica y la enfermedad. Lógicamente también son superiores a las recomendadas al enfermo urémico aún no en diálisis. Siempre lo primero debe ser garantizar un adecuado soporte calórico, proteico y mineral. Nunca el precio a pagar por una dieta presuntamente adecuada debe ser la nutrición insuficiente. El sentido común marca las normas de una dieta equilibrada. Cuatro comidas al menos, balanceada en cuanto a los principios inmediatos (hidratos de carbono, grasas y proteínas). Se considera que la ingesta óptima de proteínas debe ser de 1–1,2g/kg/d (de las cuales el 50% deben ser de alto valor biológico, es decir, proteínas animales) y la calórica de 30–35kcal/kg de peso (35 para menores y 30 para mayores de 65 años). En diálisis peritoneal la recomendación incluso es mayor (1,2–1,3g/kg de peso/d). Esta mayor liberación de la dieta proteica puede ocasionar un efecto adverso en la entrada del fósforo (tabla 1).
Relación entre la cantidad de fósforo de los alimentos y su aporte en proteínas
| Alimento | Cantidad | Fósforo (mg) | Proteínas (g) | mg p/g de prot. |
| Leche | 1 vaso: 200cc | 190 | 6 | 32 |
| Queso chubut | 50g | 250 | 10,5 | 24 |
| Queso provolone | 1 cucharada: 10g | 76,5 | 3,2 | 24 |
| Hígado vacuno | 1 bife chico: 200g | 752 | 40 | 19 |
| Huevo entero | 1 u | 105 | 6 | 18 |
| Queso máquina | 2 fetas finas: 30g | 159 | 10 | 16 |
| Pescado | 1 filet: 150g | 315 | 27 | 12 |
| Carne vacuna | 1 bife chico 150g | 305 | 30 | 10 |
| Pollo | 1 presa: 150g | 305 | 30 | 10 |
| Jamón cocido | 2 fetas finas: 40g | 57 | 8 | 7 |
| Clara de huevo | 1 u | 14 | 4 | 3,5 |
Fuente: Base de datos de composición de alimentos ARGENFOOD, Universidad Nacional de Luján, Argentina. Esta tabla indica qué alimentos son ricos en proteínas y hábito frecuente en nuestro medio que ofrecen mayor beneficio en relación al P. Es una forma de jerarquizar aportes proteicos en función del P, esto sin mencionar los aportes de sodio, colesterol etc. que tienen algunos de los alimentos aquí citados y que frecuentemente nuestros pacientes nos cuentan que consumen.
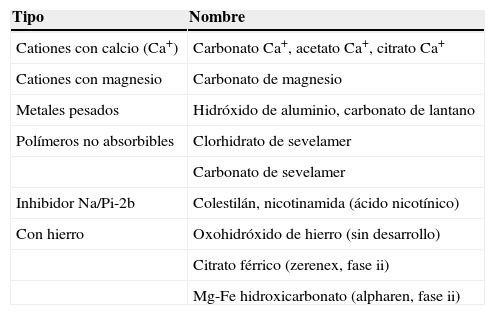
Los quelantes del fósforo deben utilizarse en todo paciente que presenta un fósforo sérico mayor o igual a 5mg con una dieta prescrita restringida en fósforo (tabla 2).
| Tipo | Nombre |
| Cationes con calcio (Ca+) | Carbonato Ca+, acetato Ca+, citrato Ca+ |
| Cationes con magnesio | Carbonato de magnesio |
| Metales pesados | Hidróxido de aluminio, carbonato de lantano |
| Polímeros no absorbibles | Clorhidrato de sevelamer |
| Carbonato de sevelamer | |
| Inhibidor Na/Pi-2b | Colestilán, nicotinamida (ácido nicotínico) |
| Con hierro | Oxohidróxido de hierro (sin desarrollo) |
| Citrato férrico (zerenex, fase ii) | |
| Mg-Fe hidroxicarbonato (alpharen, fase ii) |
Tipos de quelantes utilizados y en desarrollo.
No existe evidencia actual para recomendar un tipo de quelante único y específico para todos los pacientes. Las sales de calcio, de aluminio, de magnesio, el sevelamer, la nicotinamida y el carbonato de lantano son efectivos para reducir los niveles séricos de fósforo2. El uso de quelantes debe ir acompañado de una adecuada educación a los pacientes acerca de los riesgos de la hiperfosfatemia, la importancia de la dieta y mecanismo de acción de los quelantes7.
El carbonato de calcio debe ser ingerido inmediatamente antes de las comidas y es menos efectivo cuando se utiliza junto a inhibidores de la secreción gástrica, dado que requiere un pH ácido gástrico6. La nicotinamida se puede ingerir por la noche, alejada de las comidas y junto al uso de ácido acetilsalicílico, dado que su mecanismo de acción es diferente a los otros quelantes21. Para el caso del resto de los quelantes se sugiere que sean ingeridos durante la ingesta alimentaria, adecuando la dosis y número de acuerdo a la carga de fósforo de la dieta.
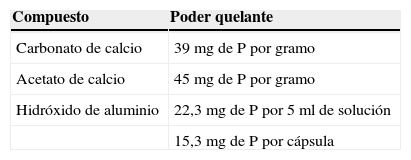
Los quelantes que contienen calcio son efectivos2–22. El acetato de calcio a diferencia del carbonato de calcio, no es influenciado por el pH gástrico, aporta menos calcio elemental y produce menos hipercalcemia23–26. Por estas razones se recomienda el uso de acetato de calcio por encima del carbonato de calcio1–6.
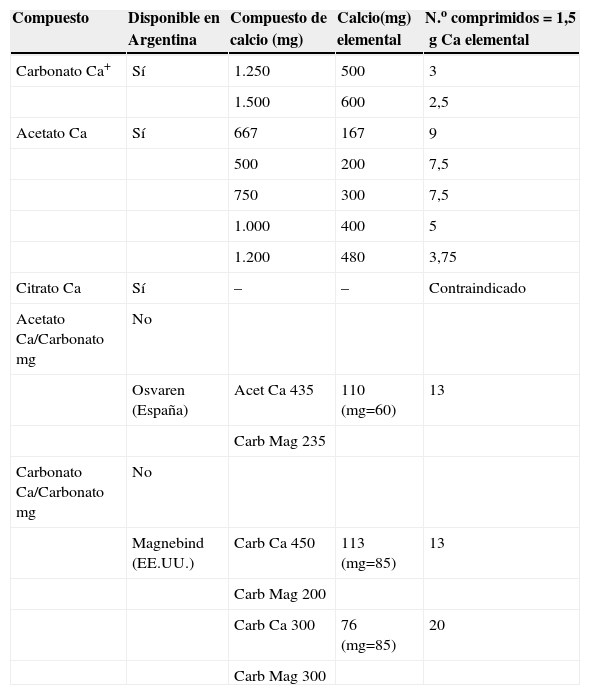
En pacientes anúricos en diálisis la pérdida diaria de calcio se encuentra reducida y solo se realiza a través del sudor y de las heces, es por ello que la ingesta de calcio debería limitarse27. Considerando que la absorción del calcio absorbido por la dieta o quelantes con calcio es del 15 al 30%, se ha calculado la dosis máxima teórica de aporte calcio en los pacientes con ERC en estadio v27. Si bien aún no se puede establecer una dosis máxima de calcio basada en estudios prospectivos2, la opinión de expertos es que la dosis total de calcio elemental provista por los quelantes con calcio no debe exceder los 1,5g/d con un límite superior de tolerancia incluyendo la ingesta alimentaria de 2g/d1 (tabla 3).
| Compuesto | Disponible en Argentina | Compuesto de calcio (mg) | Calcio(mg) elemental | N.o comprimidos = 1,5g Ca elemental |
| Carbonato Ca+ | Sí | 1.250 | 500 | 3 |
| 1.500 | 600 | 2,5 | ||
| Acetato Ca | Sí | 667 | 167 | 9 |
| 500 | 200 | 7,5 | ||
| 750 | 300 | 7,5 | ||
| 1.000 | 400 | 5 | ||
| 1.200 | 480 | 3,75 | ||
| Citrato Ca | Sí | – | – | Contraindicado |
| Acetato Ca/Carbonato mg | No | |||
| Osvaren (España) | Acet Ca 435 | 110 (mg=60) | 13 | |
| Carb Mag 235 | ||||
| Carbonato Ca/Carbonato mg | No | |||
| Magnebind (EE.UU.) | Carb Ca 450 | 113 (mg=85) | 13 | |
| Carb Mag 200 | ||||
| Carb Ca 300 | 76 (mg=85) | 20 | ||
| Carb Mag 300 |
Distintos tipos de quelantes con cálcio. Se incluye el contenido en miligramos del compuesto y del contenido de Ca+ elemental por comprimido. En la última columna se detalla el número de comprimidos permitido a razón de 1,5g/d de Ca+ elemental por día. El citrato de calcio está contraindicado debido a que el citrato favorece la absorción de aluminio.
No hay un número suficiente de trabajos y pacientes donde se haya evaluado o comparado la adhesión al tratamiento y efectividad de las diversas formas farmacéuticas con calcio28–29. Se requieren trabajos prospectivos con número suficiente de pacientes para extraer conclusiones definitivas al respecto. La alternativa de otras formas farmacéuticas debería ser explorada no solo para las sales con calcio, sino para todos los tipos de quelantes.
La elección de un quelante estaría influenciado por el estadio de enfermedad renal crónica y la presencia de otros parámetros como bioquímicos, evidencia de calcificaciones vasculares o de partes blandas, biopsia ósea, así como la consideración de otros efectos beneficiosos o adversos2. Excepto para el caso del sevelamer, los efectos de otros quelantes sin calcio en la progresión de las calcificaciones vasculares y la mortalidad de los pacientes con ERC estadio v, no han sido sistemáticamente estudiados. El clorhidrato de sevelamer en comparación con los quelantes con calcio en términos de reducción de progresión de calcificación arterial ha mostrado ser efectivo en algunos, pero no todos los estudios2–30–40. Son necesarios estudios prospectivos con gran número de pacientes y suficiente duración para confirmar el beneficio de los quelantes sin calcio en términos de progresión de las calcificaciones vasculares y sobrevida de los pacientes2. Hasta el momento, entonces, teniendo en cuenta los resultados obtenidos30–40, las opiniones de expertos y de guías1–6–7, se recomienda el uso de quelantes sin calcio en las siguientes situaciones (individuales o asociadas) (tabla 4):
- •
pacientes con calcio corregido mayor a 10mg/dl a pesar de estar dializando con un calcio de 2,5mEq/l o
- •
pacientes con una hiperfosfatemia persistente y sostenida mayor o igual a 6,5mg/dl (sin indicación de paratiroidectomía quirúgica) o
- •
pacientes con calcificaciones vasculares (tratando conjuntamente a los otros factores de riesgo vasculares) o
- •
calcifilaxis.
El hidróxido de aluminio es un quelante de fósforo efectivo2. Pero el uso de aluminio durante un largo período de tiempo es tóxico, particularmente en pacientes con bajo recambio óseo1–5–7. En caso de ser requerido, se recomienda no utilizar hidróxido de aluminio por un período mayor a 4 semanas seguidas y en dosis menor a 1 g/d; no utilizar conjuntamente sales con citrato, dado que favorecen la absorción intestinal del aluminio, y si es posible se debe dializar al paciente con membranas de alto flujo1–5.
El clorhidrato de sevelamer se asocia a acidosis metabólica, dado que carece de amortiguador en su fórmula. El carbonato de sevelamer de equivalente eficacia no se asocia a acidosis metabólica44.
La nicotinamida permitiría disminuir la dosis de otros quelantes administrados de manera conjunta. Existen trabajos controlados con pequeño número de pacientes que han mostrado eficacia en la reducción de la fosfatemia y aumento de los niveles de colesterol HDL21–45. Los efectos adversos limitan su uso46. Estos incluyen intolerancia digestiva, enrojecimiento facial y trombocitopenia47, para evitarlos se recomienda el uso concomitante de ácido acetilsalicílico a razón de 100–500mg/d, junto a la nicotinamida, pero esto no asegura la tolerancia al mismo.
Con referencia al de sales de magnesio como quelante, hay pocos trabajos controlados y con pequeño número de pacientes6. El hidróxido de magnesio es un quelante efectivo, pero causa diarrea. El trisilicato de magnesio no tiene poder quelante alguno6.
El carbonato de magnesio ha mostrado ser un quelante efectivo, pero de utilizarse como único quelante, existe el riesgo de hipermagnesemia, por lo que se deben controlar los niveles de magnesemia y utilizar baño de diálisis con bajo magnesio47. No existe una dosis máxima establecida y conocida para el uso de carbonato de magnesio como único quelante utilizando un baño de diálisis con una concentración convencional de magnesio.
La asociación con otros quelantes cálcicos permitiria, por un lado reducir la carga de calcio para el paciente y por el otro el uso de un baño de diálisis convencional48.
La hemodiálisis nocturna extendida y la hemodiálisis corta diaria han mostrado ser efectivas para un control adecuado del fósforo y reducir la dosis de quelantes requeridos49,50.
Agregar una sesión corta de hemodiálisis de 2 a 3h al esquema trisemanal (4.a sesión), incrementa la cantidad de fósforo removido en el dializado y puede ser considerada cuando la dieta y los quelantes no logran reducir los niveles de fósforo7,51,52.
Las prácticas convectivas, en especial la hemodiafiltración, presentan una mayor remoción de fósforo en el dializado, que en el caso de la hemodiafiltración esto podría traducirse en cambios significativos en los niveles de fósforo53.
Es un tema de controversia cuál debe ser el contenido de calcio en el líquido de diálisis. Valores de 2,5mEq/l en el baño de diálisis se han asociado con balance negativo de calcio y tendencia al incremento de la PTH, además con esa concentración existe peor tolerancia hemodinámica a la ultrafiltración, que se potencia si el contenido de magnesio no es adecuado5. Niveles más elevados de Ca, de 3,5mEq/l frenan la secreción de PTH pero producen un balance positivo de calcio1,5.
Se debe individualizar la concentración de calcio en el baño de diálisis de acuerdo a los parámetros del metabolismo fosfocálcico y a la adherencia al tratamiento con quelantes de calcio de cada paciente7, salvo en los casos de bajo recambio óseo y calcio sérico normal donde se debe utilizar de preferencia dializado con Ca 2,5mEq/l con control estricto de la PTHi o en presencia de hipercalcemia, independientemente de los niveles de PTHi. Se recomienda utilizar esta misma concentración cuando el paciente esta bajo tratamiento con calcitriol o análogos.
La concentración de 3,5mEq/l debe limitarse solo a aquellos pacientes que requieran un balance positivo rápido como en el caso del hueso hambriento posparatiroidectomía.
Preguntas de importancia clínica- 1)
¿Cuándo se debe iniciar una dieta con restricción de fósforo?¿Es compatible una dieta con 800–1.000mg de fósforo diarios con una dieta de 1g/kg/d de proteínas por día?
- 2)
¿Cuándo deben utilizarse los quelantes del fósforo? ¿En qué momento de la ingesta de alimentos es adecuado el uso de cada tipo de quelante (antes, durante o después de la comida)? Por ejemplo, ¿es conveniente que el carbonato de calcio se ingiera inmediatamente antes de la comida? ¿Y en el caso del acetato, hidróxido de aluminio, carbonato de magnesio, sevelamer, nicotinamida, lantano, etc.?
- 3)
¿Es preferible el uso de acetato sobre carbonato de calcio?
- 4)
¿Cuál es la dosis máxima de calcio aportada por quelantes con calcio permitida? ¿Existe una dosis adecuada a nuestra situación?
- 5)
¿Existe alguna forma más conveniente o efectiva que los comprimidos con calcio (polvo, galletas con calcio, etc.)?
- 6)
¿En qué situaciones debemos utilizar quelantes sin calcio?
- 7)
¿El uso de sevelamer se asocia a mayor acidosis metabólica?
- 8)
¿Podemos continuar usando hidróxido de aluminio a bajas dosis junto a los otros quelantes? Y, ¿durante cuánto tiempo?
- 9)
¿La nicotinamida es eficaz y segura? ¿Cómo evitamos los efectos adversos?
- 10)
¿Cuál es la dosis máxima que podemos usar de magnesio como quelante único en el caso de utilizar un baño de diálisis con concentración de magnesio convencional?
- 11)
¿Son útiles la 4.asesión de hemodiálisis, la diálisis corta diaria y la diálisis extendida nocturna para el mejor control de fósforo?
- 12)
¿Es efectiva la hemodiafiltración on-line para un mejor control de la fosfatemia? ¿Y la high flux hemodiálisis?
- 13)
¿Qué concentración de calcio debemos manejar en el baño de diálisis y para qué tipo de pacientes? ¿2,5 a todos? ¿3,5 a nadie? ¿Y la concentración de 3? ¿Es mejor dializar con calcio bajo (2,5)?
Los autores declaran no tener ningún conflicto de intereses.
Grupo de Trabajo de Metabolismo Óseo y Mineral
A todos los socios de la Sociedad Argentina de Nefrología que participaron con sus opiniones a través de la encuesta.
A las autoridades de la Sociedad Argentina de Nefrología (Anexo I)* , siendo Presidente: Dr. Walter Douthat.
Al Dr. Julen Ocharan-Corcuera, por su publicación en esta revista.
*Comisión Directiva de la Sociedad Argentina de Nefrología
Presidente: Dr. Walter Douthat
Secretario: Dr. Claudio Mascheroni
Tesorero: Dr. Juan José Di Bernardo
| Vocales | |
| Buenos Aires: | Catamarca |
| Dr. Bruno Lococo | Dr. Segundo Fernandez |
| Dra. Mónica Calvo | |
| Dr. Heriberto Demicheli | Córdoba |
| Dr. Helio Geandet | Dr. Sergio Boni |
| Dra. Mirta López | Dr. Nestor Garcia |
| Dra. Sandra Mendez | Dr. Marcelo Orias |
| Dra. Silvia Russomando | |
| Dr. Daniel D’Errico | Entre Ríos |
| Dr. Rodolfo Piscitelli | Dr. Eugenio Bernhardt |
| Dra. María Inés Marone | |
| Dr. Eduardo Sanguinetti | Norpatagonia |
| Dra. Beatriz Rizzo | |
| Mendoza | Salta |
| Dr. Jose Ascar | Dra. NoraMarcheta |
| Dr. Carlos Abate | |
| Nordeste | |
| Dr. Marcelo Ferreyra | San Juan |
| Dr. Raul Morales | Dr. Hugo Ramírez |
| Noroeste: | Santa Fe |
| Dra. Mariela Sal | Dr. Alberto Alles |
| Dra. Sara Muhamad | |
| Vocales Suplentes | |
| Buenos Aires: | Noroeste: |
| Dra. Olga Guardia | Dr. Norberto Gómez |