Evaluar los resultados perinatales de 500 casos consecutivos de transfusión feto-fetal (TFF) tratados en nuestro Hospital mediante fetoscopia láser.
Material y métodosEstudio prospectivo con 500 casos de TFF grave tratadas con fetoscopia láser como primera opción. Evaluamos la supervivencia, evolución perinatal, complicaciones obstétricas y tasa de lesión neurológica a los 6 meses de vida.
ResultadosLa edad gestacional media al tratamiento fue 19,4 semanas (rango 15,0-31,4). La placenta fue anterior en el 48% (n=240). La tasa de conversión a oclusión de cordón fue del 1,2% (6/500). La supervivencia neonatal global fue del 74,8% (748/1.000), con un superviviente al menos en el 91,6% (458/500). La duración media del procedimiento fue de 29,4min (9-64). No se observó ningún caso de corioamnionitis o desprendimiento de placenta asociado al procedimiento. Se observó persistencia de TFF en 2 casos (0,4%) y TAPS en 8 (1,6%). Se produjo rotura prematura de membranas (RPM) antes de las 32 semanas en 32 casos (6,4%). La edad gestacional media al parto fue de 33,6 semanas (26,4-38,5), con un 92% después de las 28 semanas. El peso medio en receptores fue 1.920 g (rango 680-3.660) y en donantes 1.615 g (rango 440-2.530). La tasa de anomalías severas del neurodesarrollo fue del 6,4%.
ConclusiónEn una de las mayores series consecutivas de TFF en el mismo centro, los resultados se sitúan en rango alto de las series publicadas. La coagulación fetoscópica láser de las anastomosis vasculares es segura para la madre y presenta resultados consistentes en centros con experiencia.
To evaluate the perinatal outcome in the 500 consecutive cases of severe twin-twin transfusion syndrome (TTTS) treated in a single centre with fetoscopic laser coagulation.
Material and methodsA prospective study including 500 cases of severe TTS treated with laser therapy as a first option. Main outcome measures were survival, perinatal outcome, obstetrical complications and rate of neurological damage at 6-12 months of life.
ResultsMean gestational age at therapy was 19.4 weeks (range 15.0-31.4). The placenta was anterior in 48% (n=240) of the cases. The rate of conversion to cord occlusion was 1.2% (6/500). Overall neonatal survival was 74.8% (748/1,000), with at least one survivor in 91.6% (458/500). Mean duration of surgery was 29.4min (range 9-64). There were no cases of intra- or post-operative abruptio placenta or chorioamnionitis. TTTS persisted in 2 cases (0.4%) and TAPS occurred in 8 (1.6%). Premature rupture of membranes (PROM) at <32 weeks occurred in 32 cases (6.4%). Mean gestational age at delivery was 33.6 weeks (26.4-38.5), with 92% beyond 28 weeks. Mean birth-weight was 1,920 g (range 680-3,660) in recipients and 1,615 g (range 440-2,530) in donors. Severe neurological damage was observed in 6.4%.
ConclusionsIn this large consecutive series of TTTS treated by fetoscopy in the same centre, results lie in the high range of those previously reported. Fetoscopic laser coagulation of the placental anastomosis is a safe therapy and offers consistent results in centres with experience.
El síndrome de transfusión feto-fetal (TFF) grave se desarrolla aproximadamente en el 15% de los embarazos gemelares monocoriales1 lo que representa una incidencia aproximada de uno por cada 2.000 embarazos y por tanto uno de cada 1.000 fetos. A pesar de su baja incidencia, constituye una de las complicaciones perinatales de mayor impacto en especialistas y pacientes por su dramática presentación clínica y consumo de recursos sanitarios. Hasta hace pocos años, la TFF grave representaba una condición tratable solo de forma paliativa, vivida con tradicional impotencia y falta de efectividad de los tratamientos para las formas graves y precoces, y asociada finalmente a una extrema mortalidad perinatal y morbilidad postnatal, en forma de secuelas neurológicas graves.
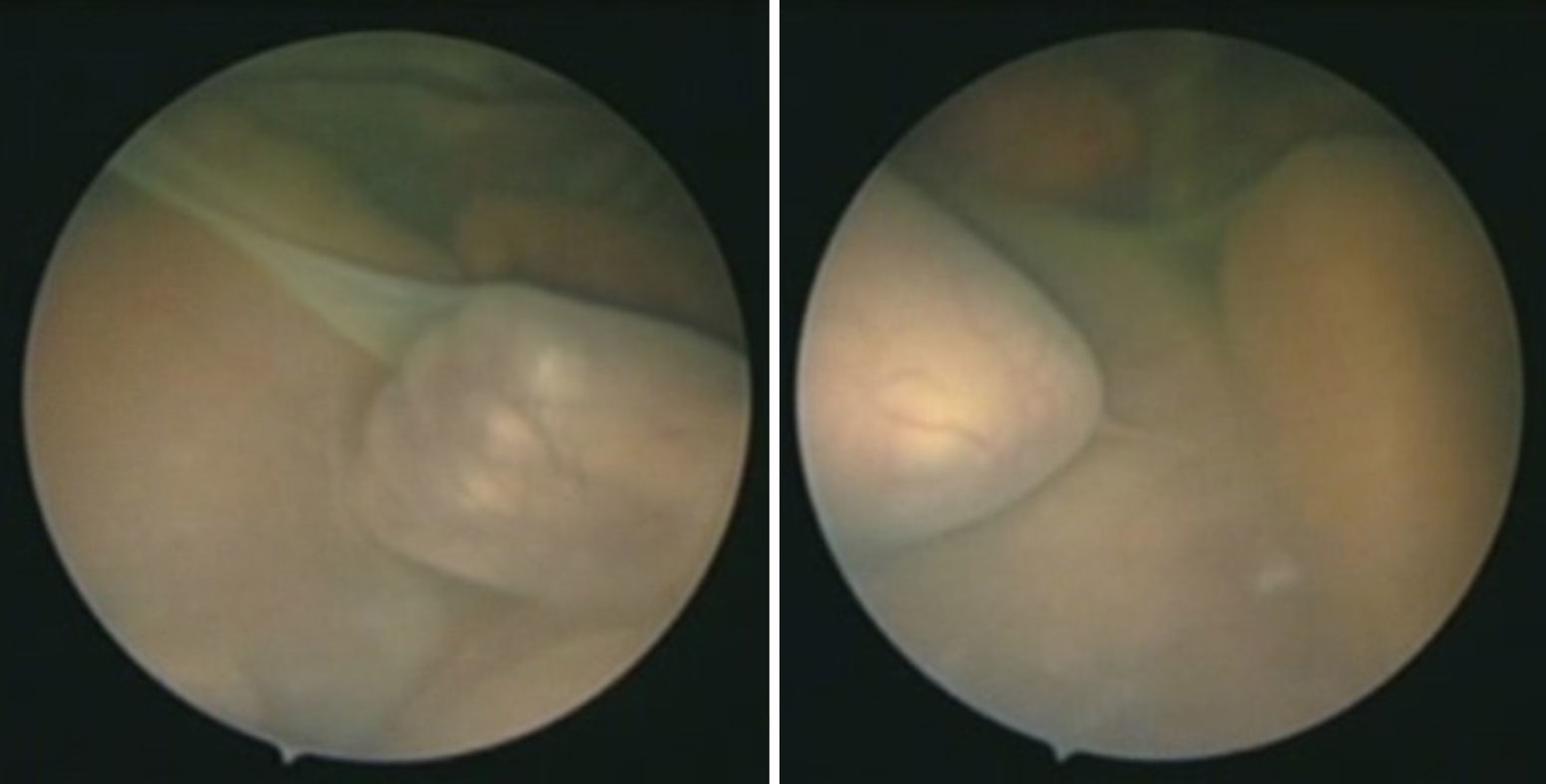
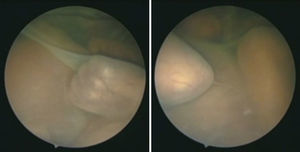
El diagnóstico del síndrome se basa en la presencia de una secuencia polihidramnios-oligohidramnios, que traduce las profundas alteraciones hemodinámicas resultantes del paso desequilibrado de sangre de un feto a otro. El feto receptor sufre una hipervolemia extrema, con poliuria y vejiga extremadamente distendida, polihidramnios severo, y finalmente fallo cardíaco por sobrecarga1. El feto donante desarrolla hipovolemia marcada, con oligoanuria y vejiga no visible, oligoanhidramnios, y finalmente, alteraciones del crecimiento e hipoxia (fig. 1). A estas profundas alteraciones hemodinámicas se unen las complicaciones del polihidramnios, como son la rotura prematura de membranas (RPM) y el parto prematuro, que se asocian a prematuridad extrema en la mayoría de casos. Esto supone una mortalidad cercana al 100% para casos que comienzan antes de las 22 semanas, y del 80% cuando el síndrome se inicia entre las semanas 22 y 26, con una incidencia de hasta el 60% de secuelas neurológicas graves en supervivientes1–3. Las series iniciales incluían solo casos hasta las 26 semanas, dado que hay una tendencia a que los casos de TFF más tardíos sean de menor agresividad. Sin embargo, para aquellos casos que cumplen claramente criterios de TFF progresiva, existe cierto consenso en ofrecer terapia más allá de las 26 semanas, como mínimo hasta al menos las 28 semanas y 6 días.
Visión fetoscópica de la placenta desde el saco del receptor.Se aprecia la membrana divisoria que marca el límite del donante, con vasos sanguíneos que la atraviesan. En más oscuro, azulado, y saltando por encima de los otros están las arterias, mientras que las venas se identifican como más rojizas, ya que llevan una mayor saturación de oxígeno.
La base anatómica para el desarrollo de TFF es la existencia prácticamente constante de comunicaciones vasculares en la placenta monocorial, entre los 2 cordones de cada feto4. Existen anastomosis directas, «arteria-arteria» o «vena-vena», o anastomosis arterio-venosas (AV), que en realidad son cotiledones compartidos en los que una arteria de un gemelo perfunde el cotiledón, que es drenado por una vena del otro feto. Las anastomosis AV son por definición unidireccionales, mientras las otras conducen sangre en uno u otro sentido en función de la presión de cada feto. La existencia de una distribución de anastomosis AV que favorece, por número o tamaño, el desarrollo de flujo descompensado de un feto a otro es la base para el desarrollo de la TFF4. A este requisito anatómico deben unirse necesariamente otros factores hormonales y vasoactivos, todavía poco definidos, que finalmente conducirán a una situación de círculo vicioso traducida en el síndrome en su máxima expresión5. Independientemente de la fisiopatología exacta del síndrome, la interrupción del requisito anatómico para su existencia (las anastomosis placentarias) conduce a la interrupción de las alteraciones.
Considerando el pronóstico infausto de la TFF grave sin tratamiento, el amniodrenaje seriado para reducir las consecuencias del polihidramnios y prolongar la gestación representó durante mucho tiempo la única opción terapéutica, reconociéndose como una medida únicamente paliativa6–9. Desde su introducción a principios de los 90, la identificación fetoscópica y coagulación láser de las anastomosis placentarias es el tratamiento de elección. Amplias series clínicas10–16 y un estudio aleatorizado del grupo Eurofetus15aportaron evidencia de que el tratamiento láser mejora marcadamente el pronóstico de la TFF, con resultados muy superiores a los del amniodrenaje, tanto en términos de supervivencia como de secuelas neurológicas15.
El tratamiento láser representa por tanto la primera opción terapéutica en la TFF. En la práctica clínica, no todos los casos se tratan de esta forma. La coexistencia de malformaciones, lesión cerebral evidente, o retraso de crecimiento fetal con gran deterioro hemodinámico, suelen motivar que los progenitores opten por una oclusión de cordón como primera opción. En este trabajo presentamos los resultados perinatales y evolución neurológica precoz, con al menos 6 meses de vida, de 500 casos consecutivos de TFF tratados por fetoscopia láser como primera opción en nuestro centro. La serie se inició cuando los médicos que realizaban el procedimiento habían completado ya la curva de aprendizaje en la técnica, y por tanto representa los resultados esperables en un centro con experiencia.
Material y métodosEste es un estudio prospectivo que incluye una cohorte de 500 gestantes diagnosticadas de TFF grave tratadas mediante fetoscopia en el Hospital Clínic de Barcelona, desde el año 2005 al 2011. El diagnóstico de TFF severa se estableció en función de los criterios definidos en su momento por el grupo Eurofetus17: 1) gestación gemelar monocorial confirmada por ecografía realizada antes de las 14 semanas; 2) polihidramnios en el saco del receptor (columna máxima>8cm si menos de 20 semanas y>10cm si más de 20 semanas) y oligohidramnios en el saco del donante (<1cm) y 3) vejigas muy discordantes, con marcada distensión en el receptor y vejiga no visible en el donante durante la mayor parte de la exploración. El estudio fue aprobado por el Comité de Ética institucional.
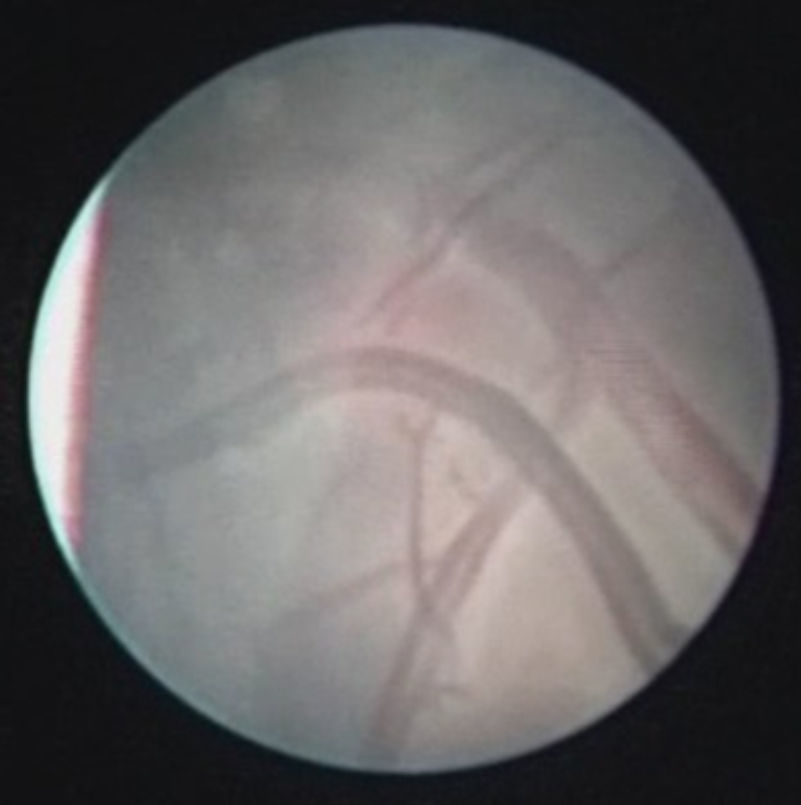
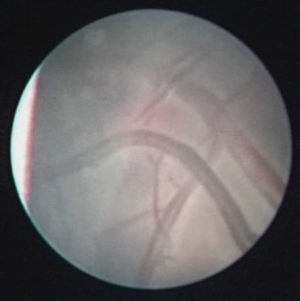
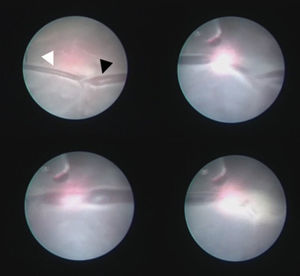
El tratamiento láser se realizó con fetoscopios de 1,2-2mm (Karl Storz GmbH, Tutlingen, Alemania) y vainas operatorias (Karl Storz) adaptadas para la introducción de fibras láser de 400-600μm de diámetro. El procedimiento consistió en la práctica de fetoscopia según protocolos ya descritos17. El protocolo contempla el uso de anestesia local, mediante infiltración en piel, subcutáneo y miometrio de levo-bupivacaína, junto con sedación materna. En algunos casos tardíos puede considerarse la realización de una peridural, especialmente si se considera que podría haber riesgo de necesitar realizar una cesárea urgente por complicaciones quirúrgicas. Se accede con el trocar al saco del receptor. El protocolo de tratamiento habitual consiste en identificar el ecuador vascular y visualización sistemática de la superficie y vasos placentarios con el fin de establecer un mapa vascular (fig. 2). Todas las anastomosis que conectan los 2 fetos son coaguladas con el fin de separar completamente las 2 circulaciones placentarias y crear una placenta funcionalmente bicorial (fig. 3). En caso de imposibilidad de separar completamente las 2 circulaciones por dificultad técnica, con el consentimiento de los padres, se ofrece realizar una oclusión de cordón del gemelo más crítico hemodinámicamente. Finalmente se realiza con bomba aspiración por el mismo trocar de la fetoscopia el amniodrenaje del receptor hasta que la columna vertical máxima es <8cm.
Visión fetoscópica del feto donante desde el saco del receptor. Se aprecia la ausencia de líquido amniótico, por lo que la membrana la tiene completamente adherida al cuerpo («stuck» twin), como si estuviera «envasado al vacío». Únicamente en las zonas de los pliegues o de las flexiones de las extremidades se puede identificar a veces una mínima cantidad de líquido.
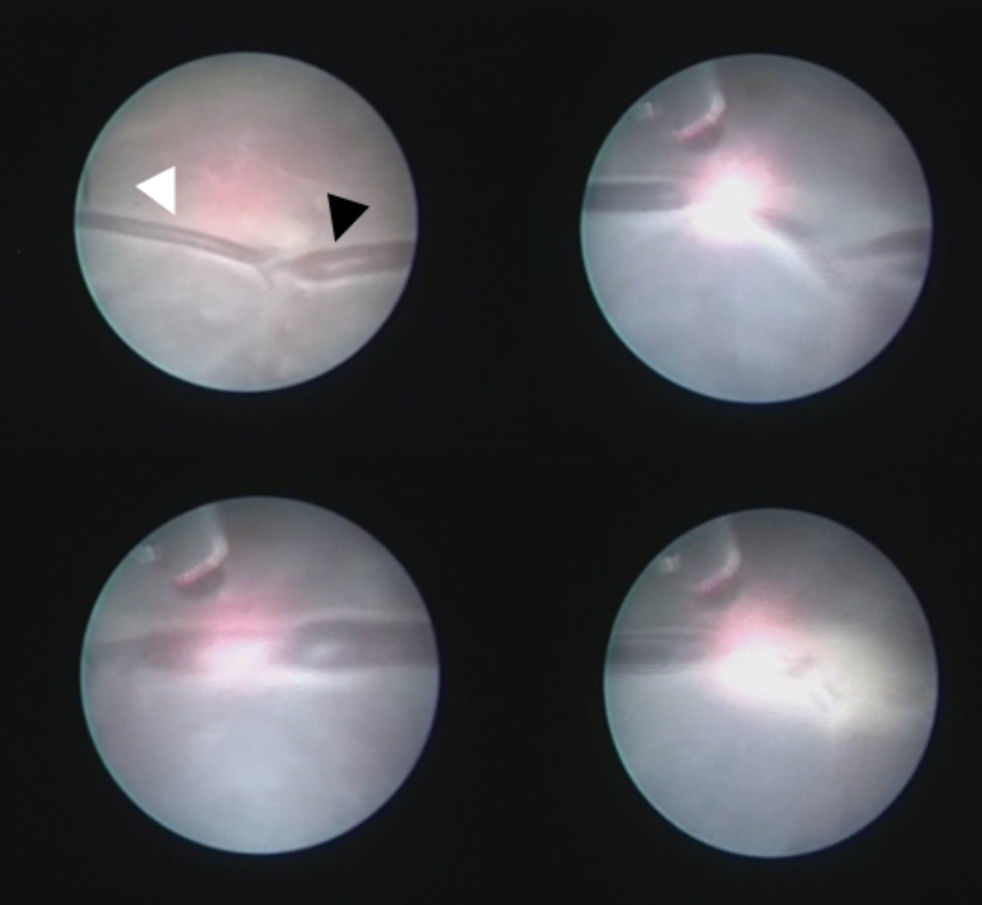
Visión fetoscópica de la secuencia de ablación láser de una anastomosis arteriovenosa. Se observa el cotiledón compartido por la arteria (azulada, punta de flecha blanca) que viene del donante a la izquierda y que conecta con la vena (rojiza, punta de flecha negra) que va hacia el receptor a la derecha. Se procede a la coagulación de las 2 ramas de la anastomosis de forma independiente y finalmente de la zona entre ambas en la superficie de la placenta.
Después del láser, los criterios de curación son la ausencia de reacumulación de líquido en el saco del receptor, aumento de líquido en el donante y normalización de ambas diuresis (tamaños de las vejigas). La recurrencia de TFF, directa o inversa (antiguo donante nuevo receptor y viceversa), se definió como la no resolución o recidiva de los signos de TFF. Se definió una secuencia de anemia-policitemia (twin anemia polcytemia syndrome[TAPS]) como la identificación de una discordancia de la velocidad sistólica máxima en la arteria cerebral media (PVS-ACM), con aumento por encima de 1,5MoMs en un gemelo (feto anémico) junto a disminución por debajo de de 0,8MoMs en el otro (gemelo policitémico) o por una discordancia de hemoglobinas de >5g/L en sangre de cordón junto con la presencia de reticulocitos >2%. Se definió como rotura de membranas (RPM) precoz a la que ocurrió antes de las 32 semanas de gestación.
Además de la recurrencia de la TFF o el desarrollo de TAPS, se recogieron prospectivamente complicaciones intraoperatorias, la incidencia de RPM, corioamnionitis y parto prematuro, supervivencia y evolución neonatal. Se definió supervivencia neonatal como supervivencia al alta hospitalaria del neonato. Se obtuvo información de los padres o pediatras y a través de informes clínicos, sobre el seguimiento neonatal en un margen de 6 meses a un año. Se definió como lesión neurológica mayor el desarrollo de ceguera, sordera, retraso mental, o parálisis cerebral.
Toda la información se recoge en bases de datos y se analizó con el paquete estadístico SPSS 15.0 (SPSS Inc., Chicago, California, EE. UU.).
ResultadosLa edad gestacional media al tratamiento fue 19,4 semanas (rango 15,0-31,4). La placenta fue anterior en el 48% (n=240) de los casos, mientras que la distribución de casos por estadificación de Quintero fue: i 13,6% (n=68), ii 34,8% (n=174), iii 43,2% (n=216), iv: 8,4% (n=42). En 6 casos (1,2%) incluidos en esta serie, en los que se había indicado coagulación láser, se decidió reconvertir a oclusión de cordón. Las razones fueron la dificultad técnica combinada o no con la existencia de un feto más deteriorado que el otro. La duración del procedimiento en toda la serie fue de 29,4min (rango 8-62).
Después de la fetoscopia se observó persistencia de la TFF en 2 casos (0,4%) y 8 casos (1,6%) desarrollaron signos de TAPS en la semanas posteriores al procedimiento. Los casos de TFF persistente se asociaban a deterioro franco del receptor y en los 2 se ofreció oclusión de cordón. Los casos de TAPS fueron precoces en 6 y tardíos en 2. Los casos precoces se detectaron en las 6 semanas postprocedimiento y se manejaron con transfusiones fetales en 4, con nuevo láser en uno y con oclusión de cordón en otro. Los 2 casos tardíos se manejaron de forma expectante y permitieron un parto con buenos resultados perinatales. Además, en 24 casos (4,8%) se observaron discordancias de velocidad de la arteria cerebral media sin llegar a cumplir criterios de TAPS. En 15 (3%) casos la discordancia se observó inmediatamente post-láser, pero no persistió, siendo interpretada como una sobrecarga aguda intra-láser. En 9 casos (1,8%) se observó la presencia de discordancia de velocidades, pero sin llegar a cumplir los criterios ni fetales ni neonatales.
No existieron complicaciones maternas intraoperatorias o a corto plazo en ninguno de los casos descritos. En la serie descrita no se produjo ningún caso de corioamnionitis, desprendimiento de placenta u otra complicación atribuible directamente al procedimiento. En 4 casos se produjo un«mirror syndrome», uno antes y 3 después del procedimiento, que se manejaron con balance de líquidos y no requirieron finalizar la gestación. Se observó RPM antes de las 32 semanas en 32 casos (6,4%). Se reportó hidrorrea autolimitada en la que no se confirmó RPM persistente en 52 (10,4%).
La edad gestacional media al parto en las gestaciones con al menos un feto vivo fue de 33,6 semanas (26,4-38,5). Un 92% de los partos se produjo más allá de las 28 semanas. Un 27% fueron partos vaginales y un 73% cesáreas. El peso medio para los receptores fue de 1.920 g (rango 680-3.660) y para los donantes de 1.615 g (rango 440-2.530).
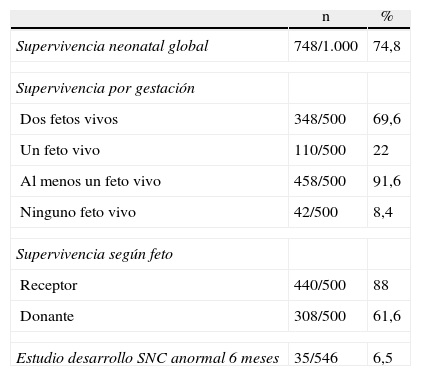
La supervivencia neonatal global fue de 74,8% (748/1.000). En el 69,6% (348/500) de las gestaciones sobrevivieron ambos y en el 22% (110/500) solo uno, lo que supone un 91,6% (458/500) de casos con al menos un superviviente neonatal, y por lo tanto con un 8,4% (42/500) sin supervivientes. La supervivencia para los receptores fue del 88% (440/500) y para los donantes, de 61,6% (308/500).
Se consiguió información de los progenitores y/o pediatras en 369 casos (el 80,5% de los casos con al menos un superviviente neonatal), que representaban un total de 546 niños. El 6,4% (35/546) reportó una anomalía del neurodesarrollo según lo definido en este estudio.
DiscusiónLos resultados descritos en esta serie de tratamiento por fetoscopia de la TFF se sitúan en el rango alto de los descritos en la literatura en grandes centros de terapia fetal. Los datos ilustran las expectativas que pueden ofrecerse a las parejas afectas de TFF con la coagulación fetoscópica láser de las anastomosis placentarias: alrededor del 90% de supervivencia de al menos un feto con un 5-6% de lesión cerebral en los supervivientes. Como se demuestra en estudios anteriores, el riesgo de secuelas viene fundamentalmente determinado por la prematuridad10–16. Debe recordarse que se trata de gestaciones gemelares que de base presentan una edad gestacional al parto más baja y por definición riesgo de parto antes de las 32 semanas del 10%. Por tanto, aunque desarrollar una complicación grave como la TFF y ser tratado con una fetoscopia incrementan sin duda el riesgo, el riesgo de parto prematuro de un embarazo gemelar monocorial «no complicado» ya es muy alto1. De Lia14 fue el primer autor en proponer esta modalidad terapéutica, pero realizaba una laparotomía materna. Ville y Nicolaides11 idearon la aplicación de la técnica de forma completamente percutánea, lo que ha permitido extender masivamente su utilización al aumentar la aceptación por parte de las pacientes. La visualización de la placenta permite establecer un mapa vascular e identificar las conexiones vasculares inter-fetales.
El objetivo de la técnica de obliteración de las comunicaciones vasculares es convertir la situación de monocorionicidad en una situación funcional de dicorionicidad. Los fundamentos fisiopatológicos en los que se basa el tratamiento mediante láser son los siguientes: 1) la TFF es debida a comunicaciones vasculares en una gestación gemelar monocorial, con un desequilibrio hemodinámico que resulta en un flujo neto del feto donante al receptor; 2) la obliteración de estos vasos puede interrumpir la fisiopatología del proceso; 3) todas las comunicaciones, tanto las llamadas superficiales como las profundas, pueden ser identificadas e interrumpidas en algún punto de su trayecto en la superficie placentaria. Por lo tanto, el láser de las anastomosis vasculares es el único tratamiento «causal» que interrumpe el mecanismo fisiopatológico responsable del síndrome, permite una máxima tasa de supervivencia fetal por embarazo (al menos un feto superviviente), así como la posibilidad de supervivencia de ambos fetos. El riesgo de secuelas neurológicas es significativamente inferior que el riesgo descrito en caso de amniocentesis seriadas. El éxito del tratamiento es independiente del estadio del síndrome, a diferencia del amniodrenaje, con una supervivencia similar tanto en estadios i como en iv1,2,18–20.
La tasa de recurrencia (0,4%) de TFF tras tratamiento se sitúa en el rango más bajo en comparación con una revisión sistemática muy reciente de la literatura, que la cifra en un 0-16%21. Esto es normal dado que nuestra serie recoge la realizada por cirujanos con más de 300 fetoscopias en el momento del inicio. Debe considerarse que muchas series reportan toda la experiencia de un centro, y esto incluye la curva de aprendizaje. En la actualidad deberían ser excepcionales las situaciones de recurrencia tras tratamiento si se dispone de la formación y experiencia adecuadas21.
El desarrollo de una TAPS es una de las complicaciones inevitables del tratamiento láser. Sea por la no coagulación durante el procedimiento, o por la repermeabilización de vasos de muy pequeño tamaño semanas más tarde, se produce una transfusión de baja magnitud que produce un trastorno hematológico (anemia/policitemia) pero no hemodinámico como en la TFF22,23. Ville et al. describieron en su serie inicial un 9% de TAPS, pero las series contempladas en su conjunto ofrecen un rango mucho más amplio del 2 al 13%24.
La RPM es el principal riesgo de todas las técnicas invasivas y puede suceder en cualquier momento después del tratamiento. La tasa antes de las 32 semanas fue del un 6%. Otra causa habitual de malos resultados, que explica la mayoría de casos con un superviviente, es la distribución de placenta, en ocasiones extremadamente desigual, que determina una frecuencia elevada de retraso de crecimiento asociado a la TFF. Por ello, la tasa de muerte intrauterina no solo depende del éxito de la técnica quirúrgica. Finalmente, una parte de malos resultados se produce porque los casos son remitidos en fases muy avanzadas y con gran deterioro fetal. En la actualidad, se intenta detectar de la forma lo más fiable posible estos casos con una estricta evaluación hemodinámica, ecocardiográfica y cerebral (con estudio mediante resonancia magnética si se considera necesario) para evitar, en lo posible, intervenciones con mal resultado previsible. Por tanto, la morbimortalidad del feto donante depende fundamentalmente de la arquitectura vascular (presencia o ausencia de anastomosis) y de la masa placentaria funcionante (asimetría placentaria), mientras que la morbimortalidad del receptor depende fundamentalmente de la situación de sobrecarga cardíaca, con una alta prevalencia de estenosis pulmonar y de miocardiopatías, y también de accidentes relacionados con el cordón umbilical.
En este momento, y con más de 6.000 procedimientos fetoscópicos practicados en el mundo desde 1980, parece evidente que los riesgos de la fetoscopia, que en la actualidad implica una entrada única de 3mm en el útero, son similares a los de otros procedimientos invasivos en la gestación17. Debe recordarse que existen casos reportados de embolia de líquido amniótico con muerte materna en procedimientos aparentemente sencillos como amniocentesis genética25 o amnioinfusión intraparto26. La existencia de estas complicaciones, afortunadamente excepcionales, no ha motivado ninguna recomendación al respecto por parte de autoridades americanas. En este sentido, parecería un poco ingenuo asumir que la fetoscopia está exenta de riesgos asociados, pero considerando la experiencia previa y la similitud con procedimientos invasivos similares (como por ejemplo la colocación de drenajes fetales), es razonable asumir que estos riesgos son extremadamente bajos, y en todo caso similares a los asociados a otras técnicas, como por ejemplo la propia interrupción de la gestación27 o el cerclaje uterino28, a las que tradicionalmente se presta menos atención. Debe recordarse también que, en la mejor serie disponible de amniodrenaje, el riesgo de presentar una o más complicaciones en cada procedimiento fue del 15%9.
En conclusión, en función de la evidencia disponible, la fetoscopia con coagulación láser de anastomosis placentarias es el mejor tratamiento para la TFF grave. En centros como el nuestro, con volúmenes elevados de más 100-150 fetoscopias al año es posible ofrecer una alta tasa de supervivencia que supera el 90% para al menos un feto (tablas 1 y 2).
Características clínicas de los casos
| Edad gestacional al tratamiento (semanas) | 19,4 (15,0-31,4) |
| Edad gestacional al partoa(semanas) | 33,6 (26,4-38,5) |
| Peso de los supervivientesaal parto (gramos) | |
| Receptor | 1.920 (680-3660) |
| Donante | 1.615 (440-2530) |
Los resultados se expresan como mediana (rango).
Supervivencia y tasa de secuelas neurológicas neonatales (28 días de vida)
| n | % | |
| Supervivencia neonatal global | 748/1.000 | 74,8 |
| Supervivencia por gestación | ||
| Dos fetos vivos | 348/500 | 69,6 |
| Un feto vivo | 110/500 | 22 |
| Al menos un feto vivo | 458/500 | 91,6 |
| Ninguno feto vivo | 42/500 | 8,4 |
| Supervivencia según feto | ||
| Receptor | 440/500 | 88 |
| Donante | 308/500 | 61,6 |
| Estudio desarrollo SNC anormal 6 meses | 35/546 | 6,5 |
Los autores declaran no tener ningún conflicto de intereses.