El estudio de vellosidades coriales comprende realizar 2 cultivos celulares que pueden no tener resultados coincidentes. Estas discrepancias pueden ser debidas a mosaicos citogenéticos de origen in vivo o in vitro. En este trabajo nos planteamos analizar los cariotipos en mosaicos, ligado con los rendimientos de los cultivos celulares y los resultados citogenéticos.
Material y métodosSe han analizado 2.360 muestras prenatales y 510 de vellosidades de abortos. Con las muestras prenatales se efectúan rutinariamente 2 cultivos celulares, cultivo corto y cultivo largo, y para los abortos además se han estudiado muestras de restos fetales.
ResultadosEl porcentaje de muestras con resultado citogenético para el grupo prenatal fue del 99,9% y para el grupo de abortos del 87,1%. El porcentaje de anomalías cromosómicas en el grupo prenatal fue del 10,6% siendo las aneuploidías comunes (trisomías 13, 18, y 21) las más frecuentes, y para el grupo de abortos fue del 55,1% siendo las aneuploidías no-comunes las más frecuentes. El porcentaje de cariotipos en mosaico para el grupo prenatal fue del 3,1% y para el grupo de abortos del 6,8%. El mosaico confinado a la placenta tipo ii fue el más frecuente.
ConclusionesPara el estudio de los mosaicos en vellosidades coriales la mejor estrategia es realizar los 2 cultivos paralelos en muestras prenatales y los 3 cultivos en muestras de abortos. Teniendo en cuenta el riesgo que asume la pareja ante una prueba invasiva, es nuestro deber dar el resultado citogenético más completo posible.
The study of chorionic villus samples comprises performing two cell cultures that may not have matching results. These discrepancies may be due to cytogenetic mosaics of in vivo or in vitro origin. This study included analysing the karyotypes in mosaics, associated with the cell culture and cytogenetic results.
Material and methodsProspective study based on the analysis of 2,360 chorionic villus samples and 510 spontaneous abortion samples. Two cultures were routinely performed on the prenatal samples (short and long), as well as on the abortion samples.
ResultsThe success rate was 99.9% in the prenatal group, and 87.1% in the abortion group. The percentage of chromosomal anomalies in the prenatal group was 10.6%, with the common aneuploidies (trisomy 13, 18, and 21) being the most frequent. In the abortions group there 55.1% anomalies, with uncommon aneuploidy the most frequent. The percentage of mosaicism in the prenatal group was 3.1%, and it was 6.8% in the abortion group. The confined placental mosaicism type ii was the most frequent.
ConclusionsFor the study of the mosaicism in chorionic villi samples the best strategy is to perform 2 prenatal samples cultures in parallel, and 3 abortion samples cultures. Given the risk to the mother and child using this invasive test, it is our duty to give the most comprehensive cytogenetic results achievable.
Desde inicios de los años 80 las vellosidades coriales se utilizan en estudios citogenéticos. Estos pueden realizarse a través de biopsias de corion obtenidas de gestaciones en curso o de muestras de gestaciones interrumpidas. Para los estudios prenatales la extracción se realiza durante el primer trimestre de gestación, preferiblemente entre las 10 y las 13 semanas.
En los estudios citogenéticos de las vellosidades, tradicionalmente se han ido realizando 2 cultivos celulares en paralelo: el cultivo corto o directo, que permite analizar las células del citotrofoblasto, células que provienen de la masa celular externa, y el llamado cultivo largo, que analiza las células que provienen del mesodermo extraembrionario, es decir de la masa celular interna. Así pues, al realizar los 2 cultivos en paralelo es posible obtener 2 cariotipos fetales, de 2 linajes celulares distintos.
La técnica del cultivo corto es idónea durante el primer trimestre de gestación, cuando las células del citotrofoblasto tienen el índice mitótico más alto.
Los mosaicos cromosómicos se definen como «la presencia de 2 o más líneas celulares diferentes en un mismo individuo y que provienen del mismo embrión»1. En un mismo análisis citogenético pueden detectarse distintas líneas, y técnicamente también se consideran mosaicos cuando difieren los cariotipos de distintos tejidos, aunque sean homogéneos2. Según Hahnemann et al.3 un mosaico en vellosidades coriales se define como:
A/Presencia de por lo menos 2 metafases con idéntica anomalía cromosómica coexistiendo con una línea normal o con otra anomalía cromosómica en el cultivo corto, en el cultivo largo o en los dos.
B/Presencia de una anomalía cromosómica en línea pura en el cultivo corto coexistiendo con una línea pura normal o con otra anomalía cromosómica en el cultivo largo o viceversa.
Los mosaicos se forman a partir de errores de la división celular o errores de segregación que pueden generar una segunda línea celular y así originar un cariotipo en mosaico. Estos errores pueden ser: no-disyunción, retraso de anafase, duplicación poscigótica, reorganizaciones cromosómicas por errores en G2 (isocromosoma de origen poscigótico4), o deleción/duplicación de un mismo fragmento cromosómico5, etc.
El conocimiento de la proporción entre las líneas celulares divergentes nos ayudará a distinguir entre mosaicos verdaderos y seudomosaicos. Para que un mosaico se considere verdadero debe observarse como mínimo en 3 metafases si es una monosomía y en 2 metafases si es una trisomía1.
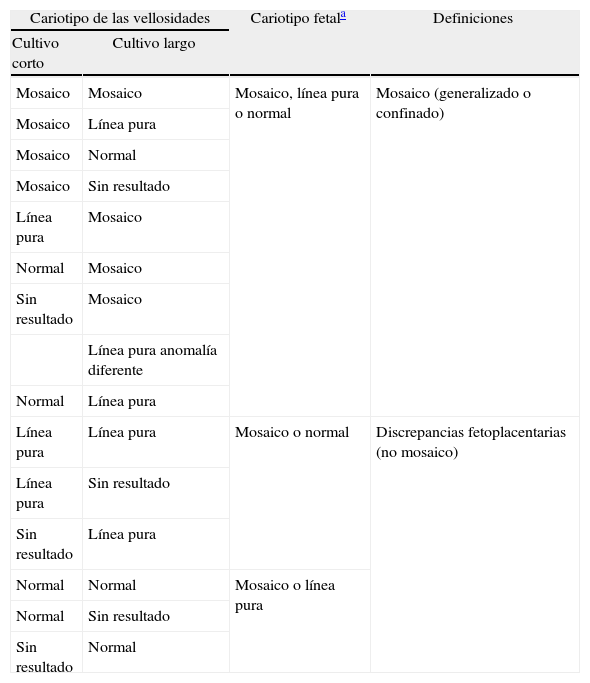
Es importante diferenciar los mosaicos de las discrepancias fetoplacentarias (tabla 1).
Definición de cariotipo en mosaico y discrepancias fetoplacentarias
| Cariotipo de las vellosidades | Cariotipo fetala | Definiciones | |
| Cultivo corto | Cultivo largo | ||
| Mosaico | Mosaico | Mosaico, línea pura o normal | Mosaico (generalizado o confinado) |
| Mosaico | Línea pura | ||
| Mosaico | Normal | ||
| Mosaico | Sin resultado | ||
| Línea pura | Mosaico | ||
| Normal | Mosaico | ||
| Sin resultado | Mosaico | ||
| Línea pura anomalía diferente | |||
| Normal | Línea pura | ||
| Línea pura | Línea pura | Mosaico o normal | Discrepancias fetoplacentarias (no mosaico) |
| Línea pura | Sin resultado | ||
| Sin resultado | Línea pura | ||
| Normal | Normal | Mosaico o línea pura | |
| Normal | Sin resultado | ||
| Sin resultado | Normal | ||
El concepto discrepancia fetoplacentaria es a veces un tanto ambiguo, ya que cada autor lo adapta a su trabajo3,6.
En el estudio citogenético de las vellosidades podemos obtener cariotipos en mosaico que pueden tener un origen in vivo (mosaicos generalizados, mosaico confinados o mosaicos raros) o un origen in vitro (contaminaciones maternas, limitaciones propias de la técnica o artefactos de cultivo).
Se considera un mosaico generalizado cuando observamos un cariotipo en mosaico en los 2 estudios de las vellosidades y también en los tejidos fetales. Los porcentajes pueden ser diferentes para cada cultivo. En estos casos, el error de la división celular se produce muy al inicio del desarrollo embrionario y, por lo tanto, afecta tanto a las células progenitoras del embrión (masa celular interna) como a las progenitoras de la placenta (masa celular externa).
Las consecuencias clínicas son difíciles de predecir y dependen de la distribución de las células anómalas en los tejidos y de la proporción entre células normales y anormales.
Algunas anomalías únicamente se pueden encontrar en mosaico, ya que su presencia en línea pura es letal in utero, como puede suceder con las trisomías 8 y 97 o la tetrasomía de 12p y la trisomía 208.
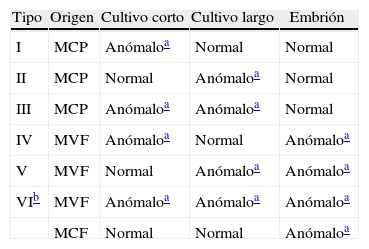
Sin embargo, si el mosaico se localiza en un tejido concreto, hablamos de mosaicos confinados; pudiendo ser mosaicos confinados a la placenta (MCP), mosaicos verdaderos fetales (MVF) o mosaicos confinados al feto (MCF).
Los MCP fueron definidos y clasificados por primera vez por Kalousek y Dill9 y se describen 3 tipos. De los MVF también se describen 3 tipos y de los MCF solamente uno3,10,11 (tabla 2).
Clasificación de los mosaicos confinados
| Tipo | Origen | Cultivo corto | Cultivo largo | Embrión |
| I | MCP | Anómaloa | Normal | Normal |
| II | MCP | Normal | Anómaloa | Normal |
| III | MCP | Anómaloa | Anómaloa | Normal |
| IV | MVF | Anómaloa | Normal | Anómaloa |
| V | MVF | Normal | Anómaloa | Anómaloa |
| VIb | MVF | Anómaloa | Anómaloa | Anómaloa |
| MCF | Normal | Normal | Anómaloa |
MCF: mosaico confinado al feto; MCP: mosaico confinado a la placenta; MVF: mosaico verdadero fetal.
Descripción de las anomalías consideradas ciertas o inciertas
| Hallazgo cierto (en los 2 cultivos)=no hacer estudio de seguimiento |
| Línea pura de trisomía 21 |
| Línea pura de triploidía |
| Línea pura de trisomía cromosomas sexuales |
| Línea pura de anomalía estructural |
| Línea pura de cromosoma marcador con marcadores o anomalías ecográficas asociadas |
| Línea pura de trisomía 13+marcadores o anomalías ecográficas asociadas |
| Línea pura de trisomía 18+marcadores o anomalías ecográficas asociadas |
| Línea pura de monosomía del cromosoma X+marcadores o anomalías ecográficas asociadas |
| Hallazgo incierto (en los 2 cultivos)=hacer estudio de seguimiento (estudio cromosómico, FISH o UPD) en muestras de líquido amniótico o sangre fetal, cariotipo de los pares, análisis ecográfico exhaustivo, y si es posible, confirmación de la anomalía cromosómica en aborto |
| Línea pura de trisomía 13 sin marcadores o anomalías ecográficas asociadas |
| Línea pura de trisomía 18 sin marcadores o anomalías ecográficas asociadas |
| Línea pura de monosomía del cromosoma sin marcadores o anomalías ecográficas asociadas |
| Línea pura de cromosoma marcador sin marcadores o anomalías ecográficas asociadas |
| Línea pura de todas las otras aneuploidías |
| Todos los mosaicos numéricos y estructurales |
La distribución de las líneas celulares depende del momento de la gestación en que se produce el error de división celular, del linaje celular afectado y del tipo de error que lo ha producido. Los errores de segregación que generan los mosaicos confinados tanto pueden ser mitóticos como meióticos.
Uno de los problemas que pueden originar los mosaicos de origen meiótico son la disomías uniparentales (DUP). La presencia de MCP alerta de posibles disomías uniparentales y un resultado normal en muestras de líquido amniótico no excluye que el feto pueda estar afectado de alguna12–14.
En los casos en que se produce un rescate de la trisomía después de un error de segregación de origen meiótico, hay un 33,3% de posibilidades de que se produzca una disomía uniparental10,15. En la serie de Grati et al.10, de un total de 15.109 casos estudiados de vellosidades coriales, se observaron 51 casos con posible disomía, aunque solo fue posible confirmar un único caso, lo que representa un 1,96%. Este bajo porcentaje refleja que la mayoría de los MCP eran de origen mitótico. Cox16 observa un 9,2% de casos susceptibles a DUP, pero todos tenían una herencia biparental. Soler et al.14 observan 18 casos con trisomías 7, 14 o 15, pero solamente se confirma una DUP 15 mat, y Toutain et al.17 de entre 13 casos de MCP tipo iii exclusivamente un caso fue isodisomía uniparental del cromosoma 15.
Clínicamente se ha observado que los MCP están asociados a un amplio espectro de manifestaciones clínicas que van desde gestaciones normales hasta gestaciones con muerte intrauterina. Algunos autores los relacionan con abortos espontáneos de primer trimestre o con pérdidas fetales de segundo o tercer trimestre18–21, otros con restricción del crecimiento intrauterino9,10,22–25, con malformaciones congénitas10, con variaciones de peso al nacer12,26,27 o simplemente con una pequeña restricción del desarrollo perinatal28,29.
El significado clínico que tienen los MCP depende de varios factores: del tipo de mosaico, es decir, de la distribución en los linajes celulares, también del origen mitótico o meiótico de la segunda línea celular, del porcentaje de células patológicas respecto a las normales, así como del par cromosómico que participa. Todos estos factores interactúan a la vez, haciendo que el asesoramiento genético de los mosaicos confinados sea complejo.
Otro grupo de cariotipos en mosaico son los mosaicos raros, por tener una frecuencia muy baja: debidos a gemelos reabsorbidos (vanishing twin) o a translocaciones múltiples simultáneas (jumping translocation) (TMS).
En los gemelos reabsorbidos puede producirse una mezcla de los 2 coriones, hecho que hace que se observe en los estudios citogenéticos como un cariotipo en mosaico cuando sus cariotipos son distintos, aunque ecográficamente se observa un único embrión con una única bolsa y una única placenta (placenta bicorial fusionada)30.
Las TMS se definen como translocaciones entre varios cromosomas y fueron descritas por primera vez por Lejeune et al.31. Solamente se han observado en muestras abortivas32–35 o en estudios citogenéticos hematológicos.
A veces los cariotipos en mosaico se generan in vitro (falsos cariotipos en mosaico), pudiendo ser debidos a contaminaciones con células maternas, artefactos del cultivo o a limitaciones propias de las técnicas.
Únicamente los cultivos de fibroblastos (cultivo largo de vellosidades y cultivo de restos fetales) tienen riesgo de contaminación materna, pues en los cultivos cortos, por ser de tiempo reducido, las posibles células maternas que hubiera no tendrían suficiente tiempo para crecer.
Además, los cultivos largos tienen cierta tendencia a producir artefactos del cultivo como los seudomosaicos, sobre todo si son lentos12. Por esta razón la Guía de Protocolos y Calidad de la European Cytogenetics Association (ECA)11 sugiere realizar 2 cultivos largos en paralelo y así poder discernir entre un mosaico verdadero y un seudomosaico.
Una limitación propia de la técnica en cultivo corto es la longitud reducida de los cromosomas que se obtienen (150bjh -bandas por juego haploide), pudiendo no observarse ninguna alteración cromosómica sutil. Sin embargo, con el cultivo largo se obtiene una longitud de los cromosomas parecida a los cromosomas del líquido amniótico.
Los objetivos planteados en el presente estudio son 3: primero, analizar el éxito de los cultivos celulares; segundo, analizar los resultados citogenéticos, para finalmente llegar al tercer objetivo, analizar los cariotipos en mosaico de 2 grupos de muestras de vellosidades coriales, gestaciones en curso y gestaciones interrumpidas.
Material y métodoSe recibieron 3.011 muestras de vellosidades (entre 1991 y 2010), de las cuales se analizaron 2.360 muestras de corion prenatales y 510 muestras de vellosidades procedentes de abortos. Las muestras no analizadas fueron consideradas inadecuadas por tener menos de 5mg de cantidad de muestra36, por estar contaminadas, por condiciones de mantenimiento y transporte no correctas37 y, en el caso de las muestras de gestaciones interrumpidas, cuando no se observaba material placentario. Las muestras procedían de una gran diversidad de centros médicos; algunos, públicos, sometidos a criterios de riesgo y otros, privados, donde la realización del estudio depende de la voluntad de la pareja. La indicación más frecuente fue edad materna avanzada (36,6%), seguida de ansiedad (14,4%) y anomalías o marcadores ecográficos (11,8%). A continuación siguen con un 6,8% doble indicación; un 5,8% gestación anterior con cromosomopatía; un 4,8% cribado bioquímico de primer trimestre; un 4,8% cribado bioquímico de segundo trimestre; un 3,8% abortos de repetición; un 0,6% progenitores portadores de cromosomopatía; un 1,9% otras indicaciones; y un 12,8% sin datos. Las muestras se extrajeron entre las 10 y las 14 semanas de gestación y se tuvo información solo de un 45% de las muestras.
En nuestro laboratorio se han practicado a todas las muestras recibidas los 2 cultivos celulares: cultivo corto38 y cultivo largo siguiendo la técnica de explantes. Para los estudios de los abortos, además se ha realizado un tercer cultivo; estudio de los restos fetales no placentarios, a partir de la técnica de cultivo por explantes. Para la interpretación de los resultados se han seguido los protocolos de las asociaciones UKNEQAS, ECA y la AEDP.
Para las tetraploidías se ha seguido el protocolo publicado por Noomen et al.39. Cuando se ha observado un mosaico nivel i o ii se ha realizado un recuento más exhaustivo, siguiendo los protocolos de Hsu y Benn40 de líquido amniótico a falta de protocolos propios para corion. Cuando se observa un mosaico de nivel iii, tanto si es generalizado como confinado, en función de la indicación del estudio y/o del tipo de alteración cromosómica se recomienda la confirmación de la alteración con un estudio genético de otra muestra fetal (líquido amniótico, sangre fetal…).
No todas las alteraciones cromosómicas visualizadas en los estudios citogenéticos de vellosidades tienen el mismo valor diagnóstico. Sikkema-Raddatz et al.41 clasifican los hallazgos en 2 grupos, según su representatividad del cariotipo fetal. En algunos casos, para complementar el diagnóstico se han utilizado estudios de hibridación in situ fluorescente (FISH) y estudios de disomías uniparentales.
ResultadosEn la gran mayoría de los casos prenatales analizados, 2.358 de un total de 2.360 (99,9%), se ha obtenido el cariotipo fetal, y 445 de un total de 510 casos abortivos (87,2%) El porcentaje de anomalías cromosómicas para el grupo prenatal fue del 10,6%, siendo las aneuploidías comunes (trisomías 13, 18 y 21) las más frecuentes. Para los casos abortivos fue del 55,1%, siendo las aneuploidías no-comunes las alteraciones más frecuentes.
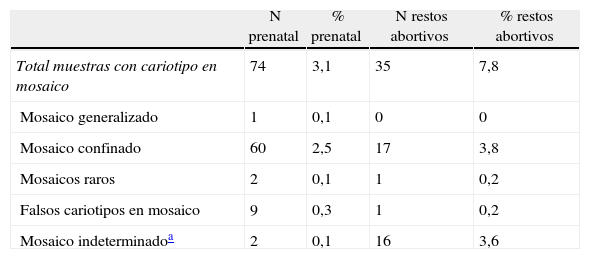
Para el grupo prenatal en el 3,1% de los resultados anómalos el cariotipo fue en mosaico y para los casos abortivos fue del 6,8%. Cuando se observa un cariotipo en mosaico para los 2 grupos de muestras lo más probable es que sea debido a un mosaico confinado (tabla 4).
Distribución de los cariotipos en mosaico
| N prenatal | % prenatal | N restos abortivos | % restos abortivos | |
| Total muestras con cariotipo en mosaico | 74 | 3,1 | 35 | 7,8 |
| Mosaico generalizado | 1 | 0,1 | 0 | 0 |
| Mosaico confinado | 60 | 2,5 | 17 | 3,8 |
| Mosaicos raros | 2 | 0,1 | 1 | 0,2 |
| Falsos cariotipos en mosaico | 9 | 0,3 | 1 | 0,2 |
| Mosaico indeterminadoa | 2 | 0,1 | 16 | 3,6 |
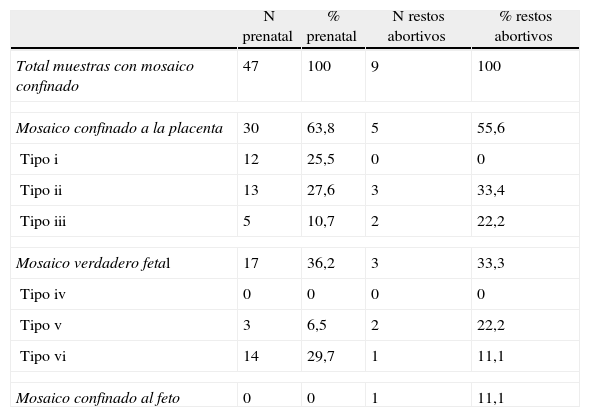
También en los 2 grupos de muestras, el mosaico más frecuente es el localizado únicamente en el mesodermo extraembrionario. No se observó ningún caso de MCP tipo i para el grupo de abortos ni ningún caso MVF tipo iv para el grupo prenatal (tabla 5).
Porcentajes de los mosaicos confinados
| N prenatal | % prenatal | N restos abortivos | % restos abortivos | |
| Total muestras con mosaico confinado | 47 | 100 | 9 | 100 |
| Mosaico confinado a la placenta | 30 | 63,8 | 5 | 55,6 |
| Tipo i | 12 | 25,5 | 0 | 0 |
| Tipo ii | 13 | 27,6 | 3 | 33,4 |
| Tipo iii | 5 | 10,7 | 2 | 22,2 |
| Mosaico verdadero fetal | 17 | 36,2 | 3 | 33,3 |
| Tipo iv | 0 | 0 | 0 | 0 |
| Tipo v | 3 | 6,5 | 2 | 22,2 |
| Tipo vi | 14 | 29,7 | 1 | 11,1 |
| Mosaico confinado al feto | 0 | 0 | 1 | 11,1 |
Si se visualiza una anomalía cromosómica únicamente en las células del citotrofoblasto, lo más probable es que esta esté localizada únicamente en la placenta y no se confirme en el feto. Por el contrario, si se visualiza la anomalía en los 2 cultivos placentarios lo más probable es que la alteración también esté presente en el feto (tabla 6).
Se observaron 2 casos de gemelos reabsorbidos. En el primer caso se observó un cariotipo 46,XX en cultivo corto y 46,XY/46,XX en el largo. En el segundo caso el cariotipo del cultivo corto fue 47,XX,+13, y el del cultivo largo, 46,XY. Después de conocer el resultado del cultivo corto, la pareja decidió interrumpir la gestación.
Posteriormente se supo que era una gestación procedente de técnicas de reproducción asistida, donde se implantaron 2 embriones, uno de los cuales murió, quedando reabsorbido. La biopsia de corion debió realizarse cerca de la fusión de los 2 coriones, observándose en cada cultivo el cariotipo de uno de los gemelos.
Solo se observó un caso de TMS, en una muestra procedente de una gestación interrumpida. El cariotipo del cultivo corto fue 46,XX,del(18p11.2)[16]/46,XX,r(13)(p11.2q32),der(18)t(13;18)(q32;p11.2)[36]/45,XX,-13,add(18)(p11.2)[4].ish t(13;18)(13qter+;wcp18+,D18Z1+), y el cariotipo del cultivo largo y del cultivo de los restos fetales 45,XX,der(15;18)t(15;18)(p11.2;p11.2).ish t(15;18)(D15Z1+,SNRPN+; wcp18+,D18Z1+).
DiscusiónLos resultados descritos respecto al éxito de cultivo en esta serie se sitúan en el mismo nivel que los descritos en la literatura3,14,42–45. Si se realizan los 2 cultivos en paralelo, la posibilidad de obtener un resultado citogenético es mayor. Por esta razón, para los estudios citogenéticos prenatales, se recomienda realizar las 2 técnicas de cultivo en paralelo ya que así se incrementa la posibilidad de obtener el resultado citogenético, teniendo en consideración que la pareja se somete a una técnica invasiva.
Sin embargo, para el grupo de muestras abortivas nuestros valores son más bajos que los descritos en la literatura. Esta diferencia recae en la técnica para la obtención de las muestras, pues las obtenidas por biopsia antes de la expulsión del feto tienen valores de crecimiento celular más altos46–49. Por lo general, en nuestro centro no se nos informa de la técnica utilizada para la obtención de la muestra fetal.
Para los estudios de restos fetales, la utilización de los 3 cultivos en paralelo permite obtener información más exhaustiva en caso de mosaico fetal y ayuda en el asesoramiento genético. Los controles de calidad externos recomiendan, en todos los casos de ILE por cromosomopatía, realizar estudios citogenéticos de los restos fetales para confirmar la anomalía cromosómica.
La distribución de las alteraciones también coincide con la descrita en la bibliografía36,50. Cuantas más parejas con alto riesgo tenga la serie, más elevado va a ser el porcentaje de alteraciones cromosómicas detectadas14. Otra manera de considerar la distribución de las indicaciones es analizando la indicación ansiedad; cuanto más alto sea este valor, más bajo va a ser el porcentaje de anomalías cromosómicas. Así, en la serie de la ACC50 el porcentaje de anomalías fue del 6,7% y el de la indicación ansiedad fue del 1,3%; y en el trabajo de Míguez43 el porcentaje de anomalías fue del 3,7% y el de la indicación ansiedad del 40,5%. De todas formas, estos datos son difíciles de comparar pues los baremos de indicaciones de riesgo alto van variando con el tiempo; la indicación edad materna ha pasado de ser a partir de los 35 años a los 38, y hoy en día, ya no es una indicación como tal. Por otro lado, el umbral del cribado bioquímico pasó de ser de 1/270 a 1/250.
En muestras abortivas, la presencia de anomalías cromosómicas está relacionada con la edad gestacional; a medida que aumentan las semanas de gestación la posibilidad de observar una anomalía cromosómica es menor18,51. Y curiosamente la edad gestacional también está relacionada con el tipo de anomalía cromosómica. Así, las aneuploidías no-comunes se observan principalmente durante el primer trimestre, y las comunes y aneuploidías de los cromosomas sexuales son más tardías52. No obstante, puede ser difícil establecer una relación directa entre semanas de gestación y anomalía cromosómica, ya que puede haber un retraso en el tiempo de expulsión de la gestación si el feto queda retenido53.
En el presente estudio la distribución de los mosaicos confinados prenatales es parecida a la publicada por Grati et al.10. El tipo de mosaico confinado más frecuente es aquel en que la anomalía cromosómica está localizada en las células del mesodermo extraembrionario, es decir, cuando la alteración cromosómica se visualiza solamente en el cultivo largo.
Para el grupo de abortos, no podemos comparar nuestros hallazgos porque no hemos encontrado publicaciones sobre mosaicos confinados en abortos, excepto el trabajo de Lestou y Kalousek22.
Es de esperar que las anomalías de origen poscigótico tengan una influencia en el desarrollo fetal más leve que las de origen precigóticas, pues las primeras afectan a menos tejidos y como se generan más tardíamente afectan a un número de células menor. Por el contrario, las anomalías de origen meiótico afectan a un mayor tipo de células y a un número mayor.
En las gestaciones en curso observamos más frecuentemente las aneuploidías no-comunes y no-viables preferentemente en uno de los 2 tejidos placentarios (MCP tipo i y ii), y las aneuploidías comunes y viables en los 2 tejidos placentarios o en el feto (MCP tipo iii y MVF o MCF)3,10. Sin embargo, en las gestaciones interrumpidas se observan las aneuploidías no-comunes en los tejidos fetales.
La detección de mosaicos en vellosidades coriales crea cierta incertidumbre por su dificultad de interpretación y su complejidad. En algunos casos se requiere una amniocentesis para confirmar el cariotipo fetal. Cuando la anomalía se detecta en MCP tipo ii y iii tiene más posibilidad de que sea confirmada que si es en tipo i. En el trabajo de Grati et al.10 en un 1,3% de los casos fue necesario realizar una amniocentesis para esclarecer el diagnóstico clínico y en nuestro trabajo el 1,2%. Toutain et al.17 recomiendan realizar la amniocentesis únicamente en los casos de sospecha de disomía uniparental de los cromosomas 7, 11, 14 y 15, y en los casos en que se observe una aneuploidía común sin marcadores o anomalías ecográficas asociadas.
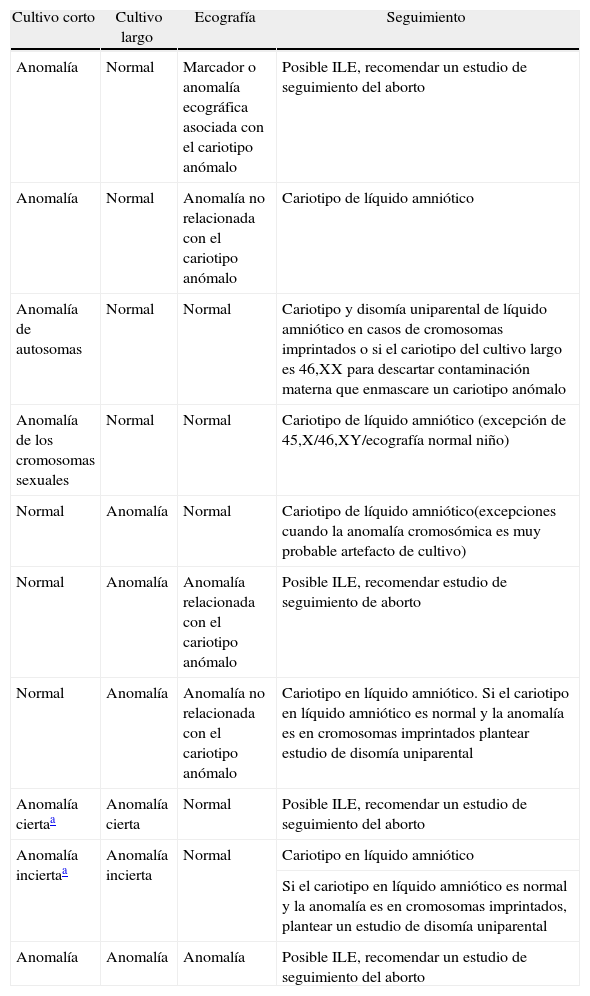
En la tabla 7 se describen los casos en que nosotros recomendamos hacer estudios de seguimiento.
Estrategias sugeridas para confirmar un resultado citogenético en vellosidades coriales
| Cultivo corto | Cultivo largo | Ecografía | Seguimiento |
| Anomalía | Normal | Marcador o anomalía ecográfica asociada con el cariotipo anómalo | Posible ILE, recomendar un estudio de seguimiento del aborto |
| Anomalía | Normal | Anomalía no relacionada con el cariotipo anómalo | Cariotipo de líquido amniótico |
| Anomalía de autosomas | Normal | Normal | Cariotipo y disomía uniparental de líquido amniótico en casos de cromosomas imprintados o si el cariotipo del cultivo largo es 46,XX para descartar contaminación materna que enmascare un cariotipo anómalo |
| Anomalía de los cromosomas sexuales | Normal | Normal | Cariotipo de líquido amniótico (excepción de 45,X/46,XY/ecografía normal niño) |
| Normal | Anomalía | Normal | Cariotipo de líquido amniótico(excepciones cuando la anomalía cromosómica es muy probable artefacto de cultivo) |
| Normal | Anomalía | Anomalía relacionada con el cariotipo anómalo | Posible ILE, recomendar estudio de seguimiento de aborto |
| Normal | Anomalía | Anomalía no relacionada con el cariotipo anómalo | Cariotipo en líquido amniótico. Si el cariotipo en líquido amniótico es normal y la anomalía es en cromosomas imprintados plantear estudio de disomía uniparental |
| Anomalía ciertaa | Anomalía cierta | Normal | Posible ILE, recomendar un estudio de seguimiento del aborto |
| Anomalía inciertaa | Anomalía incierta | Normal | Cariotipo en líquido amniótico |
| Si el cariotipo en líquido amniótico es normal y la anomalía es en cromosomas imprintados, plantear un estudio de disomía uniparental | |||
| Anomalía | Anomalía | Anomalía | Posible ILE, recomendar un estudio de seguimiento del aborto |
La aparición de nuevas técnicas en el laboratorio y la reducción de los costes suponen cambios estratégicos en el diagnóstico prenatal. Desde inicios de siglo xxi algunos laboratorios están sustituyendo el cariotipo del cultivo corto por el estudio de las aneuploidías más frecuentes con la técnica de QF-PCR54–57. Aunque si se sustituye el cultivo corto por la QF-PCR tal y como comentan Barranco et al.58, un porcentaje de las anomalías con significado clínico pasarían desapercibidas. Otros proponen sustituir el cultivo largo por la QF-PCR y hacer rutinariamente el cultivo corto14. En estos casos podría ser que no se detectasen un 6% de alteraciones cromosómicas con significado clínico15.
Como ya es sabido, la sustitución del cariotipo en uno de los 2 cultivos supondría obtener un resultado genético que no permitiría detectar algunas anomalías. Estas son: mosaicos inferiores al 20%, anomalías estructurales, las anomalías que afectan un par cromosómico no-común (entre las que se encuentran la mayoría de las anomalías de los mosaicos confinados que dan una señal de alerta para posible DUP) y además no podría diferenciar en los linajes en los posibles mosaicos confinados por trabajar con ADN total.
Si se hubiera realizado esta estrategia en nuestro trabajo, no se hubieran detectado un 30% de las alteraciones. De estas, un 2,5% corresponden a alteraciones estructurales desequilibradas, un 3,2% a aneuploidías no-comunes y cromosomas marcadores, un 5% a anomalías estructurales equilibradas, y un 19% a mosaicos más bajos del 20%.
Otras técnicas diagnósticas más específicas se están implantando en los laboratorios para estudios prenatales (CGH-Array, SNP-Array, o plataformas dirigidas como BoB's). Tienen la ventaja de observar ganancias y pérdidas cromosómicas muy pequeñas (menos de 10Mb, microduplicaciones o microdeleciones), anomalías que no son visibles con el cariotipo. Sin embargo, además de los inconvenientes anteriormente mencionados, algunas de ellas tienen el inconveniente añadido de detectar un número importante de desequilibrios génicos con un significado incierto. Respecto a los desequilibrios genéticos, no es posible conocer la reorganización cromosómica que los ha generado, información trascendental para establecer el riesgo de recurrencia y facilitar el asesoramiento genético preciso.
Una buena estrategia diagnóstica en prenatal sería el estudio del cariotipo más arrays, técnicas complementarias que abarcarían un gran número de alteraciones.
Más reciente es establecer a nivel rutinario la técnica del non-invasive prenatal test, que se caracteriza por estudiar alteraciones genéticas de origen fetal en sangre materna. A partir del ADN fetal libre circulante en el plasma materno es posible diagnosticar las aneuploidías comunes y las de los cromosomas sexuales. Pero, paralelamente a la implantación en España de esta técnica, aparecen en la literatura los primeros trabajos que describen los primeros casos de falsos positivos de la técnica59,60. La mayoría de ellos son debidos a los mosaicos confinados a la placenta, pues el ADN fetal circulante proviene del sincitiotrofoblasto (trofoblasto)61,62.
En conclusión, podríamos decir que para el estudio de mosaicos en vellosidades coriales lo más recomendable es realizar los 2 cultivos en paralelo. Así, es posible obtener un cariotipo en un plazo de 24-48h y detectar los posibles casos de contaminación materna. El hecho de obtener 2 resultados citogenéticos permite la confirmación del estudio, y contribuye a la prevención de posibles errores diagnósticos o por limitaciones técnicas. Además se pueden detectar las anomalías que hacen sospechar de posibles disomía uniparentales. Para el estudio de los mosaicos confinados la mejor estrategia es realizar los 2 cultivos celulares para las muestras prenatales y los 3 cultivos celulares en los restos fetales. Teniendo en cuenta el riesgo que asume la pareja ante una prueba invasiva, es nuestro deber dar el resultado citogenético más completo posible, aun suponiendo un incremento de costes debido a los múltiples cultivos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.