En el síndrome de transfusión feto fetal (STFF) existe una disfunción cardiaca, principalmente en el feto receptor. Se ha descrito una mejora de la misma tras la fotocoagulación mediante láser de las anastomosis vasculares.
ObjetivosEvaluar la función cardiaca en el STFF, su relación con los estadios de Quintero y el posible impacto del tratamiento intrauterino.
Material y métodosSe incluyeron de manera consecutiva 58 STFF (marzo 2009–marzo 2012) en los que se evaluó la función cardiaca de manera prospectiva, tanto en el feto receptor como en el donante, antes y 48-72 h tras el procedimiento (fotocoagulación mediante láser de las anastomosis vasculares u oclusión de cordón umbilical).
ResultadosEn el 88% (51/58) de los casos fue posible una exploración cardiovascular completa. Hasta en el 90% de los estadios i y ii el feto receptor presentó un índice de Tei en ventrículo izquierdo > 3 Z-Score. Tras la técnica, la función cardiaca derecha mejoró en el feto receptor. No se hallaron diferencias en el índice de Tei del ventrículo izquierdo. Los fetos donantes mostraron una mejora significativa en la onda de velocidad de flujo de la arteria umbilical y una tendencia a un empeoramiento de la función cardiaca derecha.
ConclusionesEn el STFF, el feto receptor presenta un menor o mayor grado de disfunción cardiaca en un porcentaje elevado de casos. Esta puede presentarse en estadios iniciales de Quintero. El tratamiento intrauterino induce modificaciones en la función cardiaca. A corto plazo, los fetos receptores muestran una mejora de la función cardiaca derecha y los donantes un deterioro.
Twin to twin transfusion syndrome (TTTS) leads to cardiac dysfunction, mainly in the recipient twin. After laser ablation of placental anastomoses, an improvement has been described.
ObjectivesTo assess cardiac function in both recipient and donor twins in TTTS, its association with Quintero stages, and the impact of intrauterine therapy.
Material and methodsProspective study based on 58 consecutive TTTS referred to a single centre (March 2008-March 2012). Assessment of cardiac function was performed on the recipient and donor fetuses before and 48-72h after the procedure (laser photocoagulation of placental anastomoses or cord occlusion).
ResultsA complete cardiovascular examination was possible in 88% (51/58). Up to 90% of stage i and ii recipients showed a left ventricle Tei index >3Z-Score. After intrauterine treatment of TTTS, the right heart function improved in recipient fetuses. No differences were found in left ventricle Tei index. In donor twins, there was a significant decrease in pathological blood flow velocity waveform in the umbilical artery and a trend to a worse right cardiac function.
ConclusionsIn TTTS, cardiac dysfunction commonly affects the recipient twin. This is already present at early stages of Quintero. Intrauterine therapy induces changes in cardiac function. Shortly after the procedure, right heart function improves in recipient twins but it worsens in the donors.
Está bien establecido que las anastomosis vasculares son el sustrato anatómico necesario para que se desarrolle el síndrome de transfusión feto fetal (STFF). Pero además, en la evolución del cuadro desempeña un papel fundamental la acción de factores hormonales vasoactivos producidos como respuesta fetal al desequilibrio hemodinámico1,2. En el feto donante, la hipovolemia activa el sistema renina-angiotensina-aldosterona (RAS). La angiotensinaii, potente vasoconstrictor, y la aldosterona, que aumenta la reabsorción tubular, mantienen la presión y el volumen circulante. Sin embargo, este mecanismo originariamente adaptativo puede producir hipoperfusión renal y placentaria, acentuando la oliguria y favoreciendo finalmente la aparición de crecimiento intrauterino restringido. En el receptor, aunque cabría esperar una inhibición del RAS, estos factores están elevados debido al transporte desde el donante a través de las anastomosis vasculares, dando lugar a un estado de hipertensión. La hipervolemia y el aumento de la postcarga inducen cambios funcionales cardiacos. La función diastólica es la primera en alterarse, seguida de la sistólica. El corazón del feto receptor aumenta de tamaño, en forma de cardiomegalia por hipertrofia miocárdica, aparece insuficiencia tricuspídea (IT), disminución de flujo a través de la válvula pulmonar con disminución de su calibre y diferentes grados de obstrucción del tracto de salida en el ventrículo derecho (OTSVD)1,2.
A pesar del papel clave del corazón en el STFF, principalmente en el feto receptor, los estadios de Quintero no incluyen en su clasificación la evaluación cardiaca. Recientemente, han sido descritos otros sistemas3–5 que sí la incorporan. Se ha visto que un porcentaje considerable de los estadios iniciales de Quintero presentan ya una disfunción cardiaca3,6,7. Se ha propuesto que su evaluación podría ser útil para seleccionar aquellos cuadros iniciales que probablemente evolucionen a estadios más avanzados, siendo, por tanto, tributarios de tratamiento intrauterino, si bien los resultados son contradictorios6–9
La evolución de estos cambios funcionales y/o estructurales «adquiridos» parece depender de la conducta adoptada ante el diagnóstico de STFF. Mientras que tras el amniodrenaje los signos de miocardiopatía hipertensiva del feto receptor se agravan10, cuando se realiza un láser de las anastomosis vasculares, la función sistólica se recupera rápidamente y la función diastólica lo hace de manera progresiva11–13.
El objetivo del presente estudio es evaluar la función cardiaca en el STFF, analizar su relación con los estadios de Quintero y el posible impacto de la fotocoagulación mediante láser de las anastomosis vasculares.
Material y métodosEstudio observacional, descriptivo y prospectivo incluyendo de modo consecutivo las gestaciones gemelares monocoriales complicadas con STFF diagnosticadas o referidas a la Unidad de Medicina Fetal del HGUGM a las que se les practicó fotocoagulación mediante láser de las anastomosis vasculares u oclusión de cordón umbilical (OC) (marzo 2009-marzo 2012).
El diagnóstico de STFF fue establecido según los criterios del Eurofetus14 y clasificados de acuerdo a los estadios de Quintero15. A su vez, en función de la severidad, los casos fueron agrupados en grado i o STFF inicial (estadios i y ii de Quintero) y grado ii o STFF avanzado (estadios iii y iv de Quintero).
Tras la información a los padres de las diferentes opciones, se realizó tratamiento quirúrgico intrauterino, incluyendo bien láser de las anastomosis vasculares u OC. Para la fotocoagulación de las anastomosis vasculares se utilizó un fetoscopio de 1,2-2mm (Karl Storz GmbH, Tutlingen, Alemania), examinando la superficie placentaria para la correcta identificación del ecuador vascular y coagulando sistemáticamente y de modo selectivo todas las anastomosis entre ambos fetos mediante fibra de láser diodo de 600μm14. La OC se realizó mediante pinza bipolar de 2,5mm de diámetro (Everest Medical, Minnesota, EE. UU.) bajo control ecográfico, coagulando a nivel de 2 segmentos de cordón, uno en asa libre y otro próximo a la inserción del mismo en el abdomen fetal16.
El estudio cardiovascular incluyó las siguientes variables:
- -
Arteria umbilical (AU): índice de pulsatilidad de la AU (IPAU) expresado en valor absoluto y en Z-Score; valoración cualitativa de la onda de velocidad de flujo (OVF) (flujo telediástolico ausente, reverso o intermitente).
- -
Ductus venoso (DV): índice de pulsatilidad del DV (IPDV) expresado en valor absoluto y en Z-Score; valoración cualitativa de la OVF (flujo ausente o reverso durante la contracción auricular).
- -
Pulsaciones en la vena umbilical (PVU): presencia de pulsaciones sincrónicas con el ciclo cardiaco a nivel del trayecto intrahepático de la vena umbilical.
- -
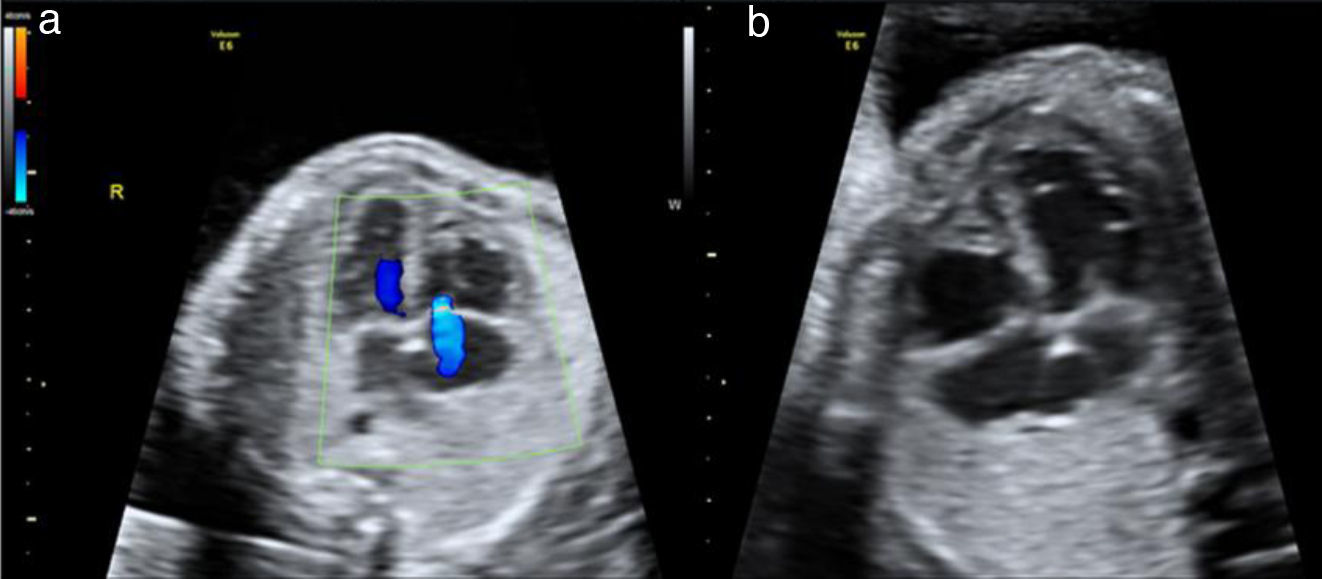
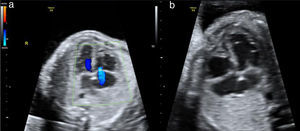
IT: presencia o ausencia (fig. 1a).
- -
Índice de función miocárdica modificado o índice de Tei en el ventrículo izquierdo (VI) expresado en valor absoluto y en Z-Score: patológico si >3Z-Score.
- -
Hipertrofia miocárdica: presencia o ausencia (fig. 1b).
- -
Signos de OTSVD: presencia o ausencia.
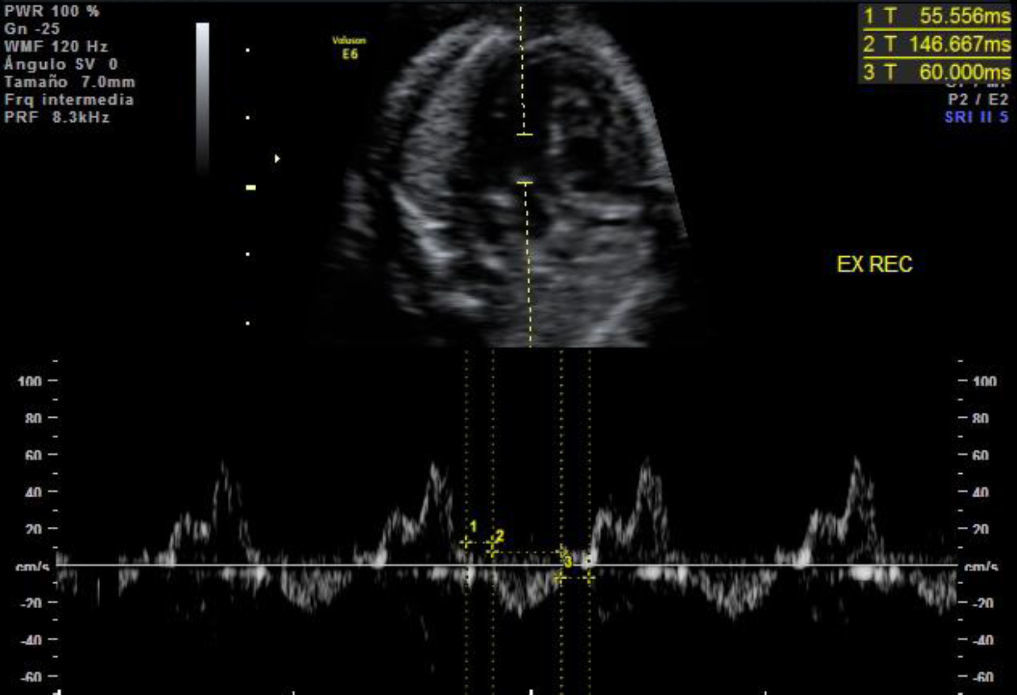
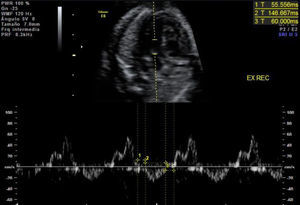
Para la valoración del índice de Tei en VI, se obtuvo un corte apical cardiaco a nivel de 5 cámaras, situando el volumen de muestra del doppler pulsado en la pared lateral de la aorta ascendente justo por encima de la válvula mitral. Se midió el tiempo de contracción (TCI) y relajación isovolumétricos (TRI) y el tiempo de eyección (TE), utilizando las señales doppler correspondientes a los «clicks» de apertura y cierre de la válvula aórtica y mitral (fig. 2). El índice de Tei fue calculado como el cociente de la suma de los TCI y TRI dividido por el TE17.
La exploración ecocardiográfica se realizó en el momento del diagnóstico de STFF y 48-72h tras tratamiento intrauterino. Se utilizó indistintamente un equipo Voluson E6 (GE Healthcare Technologies, Milwaukee, WI, EE. UU.) o Toshiba Aplio 80 (Toshiba Co., Tokyo, Japón), ambos dotados de sonda cónvex multifrecuencia.
Análisis estadísticoLos datos fueron almacenados en una base de datos Microsoft Excel 2007 y procesados posteriormente con el paquete estadístico SPSS 19.0 (SPSS Inc., Chicago, IL, EE. UU.). En la comparación de los parámetros de función cardiaca entre feto receptor y donante y en la valoración del grado de disfunción cardiaca con relación a los estadios de Quintero, se utilizó el test de Chi cuadrado para variables categóricas y el test de Mann Whitney para muestras independientes en las variables continuas. Los cambios en la función cardiaca tras la cirugía fueron analizados mediante el test de Wilcoxon para variables continuas y el test de McNemar para categóricas.
ResultadosSe incluyeron un total de 58 casos de STFF en el estudio. De ellos, en el 88% (51/58) se practicó láser de las anastomosis vasculares y en el 12% (7/58) OC. En el 82,7% (48/58) de las gestaciones se obtuvo al menos un recién nacido vivo a los 28 días. La mediana de la EG en el momento del parto fue de 34s (24,1-40s; DE4,29) y el peso de los recién nacidos receptores y donantes de 1.860g (680-3.600; DE756g) y 1.495g (420-3.700; DE753g), respectivamente.
En cuanto a la clasificación en función del grado de severidad, el 43,1% (25/58) correspondían a un grado i de severidad o STFF inicial (estadios i y ii de Quintero, 12 y 13 respectivamente) y el 56,9% (33/58) a un grado ii de severidad o STFF avanzado (estadios iii y iv de Quintero, 31 y 2 respectivamente). La mediana de la EG en el momento del procedimiento fue de 20,1s (16,5-25,4s; DE2,43). En el 88% de los casos (51/58) fue posible una exploración cardiaca completa en el momento del diagnóstico.
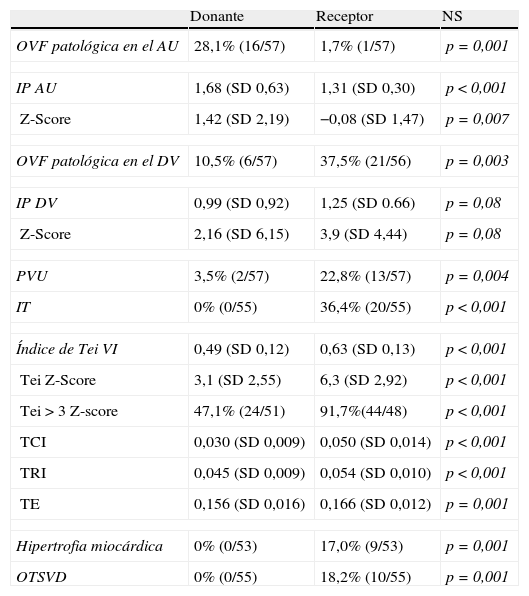
En la evaluación inicial previa a la cirugía, los fetos receptores presentaron una mayor alteración de los parámetros cardiovasculares que los donantes (tabla 1). El número de receptores con OVF patológica en el DV, PVU e IT fue significativamente mayor. Del mismo modo, tanto el IPDV como el índice de Tei en VI, a expensas de sus 3 componentes, TCI, TRI y TE, fueron superiores. El número de fetos receptores con un índice de Tei en VI > 3Z-Score fue casi el doble que el de donantes. Respecto a los parámetros morfológicos, el 17% de los gemelos receptores presentaron hipertrofia miocárdica y el 18,2% algún grado de OTSVD, no encontrándose estos hallazgos en ningún donante. Por el contrario, en el feto donante el IPAU fue significativamente superior así como la presencia de una OVF patológica en AU.
Parámetros cardiovasculares pre-quirúrgicos en fetos donantes y receptores
| Donante | Receptor | NS | |
| OVF patológica en el AU | 28,1% (16/57) | 1,7% (1/57) | p=0,001 |
| IP AU | 1,68 (SD 0,63) | 1,31 (SD 0,30) | p<0,001 |
| Z-Score | 1,42 (SD 2,19) | −0,08 (SD 1,47) | p=0,007 |
| OVF patológica en el DV | 10,5% (6/57) | 37,5% (21/56) | p=0,003 |
| IP DV | 0,99 (SD 0,92) | 1,25 (SD 0.66) | p=0,08 |
| Z-Score | 2,16 (SD 6,15) | 3,9 (SD 4,44) | p=0,08 |
| PVU | 3,5% (2/57) | 22,8% (13/57) | p=0,004 |
| IT | 0% (0/55) | 36,4% (20/55) | p<0,001 |
| Índice de Tei VI | 0,49 (SD 0,12) | 0,63 (SD 0,13) | p<0,001 |
| Tei Z-Score | 3,1 (SD 2,55) | 6,3 (SD 2,92) | p<0,001 |
| Tei > 3 Z-score | 47,1% (24/51) | 91,7%(44/48) | p<0,001 |
| TCI | 0,030 (SD 0,009) | 0,050 (SD 0,014) | p<0,001 |
| TRI | 0,045 (SD 0,009) | 0,054 (SD 0,010) | p<0,001 |
| TE | 0,156 (SD 0,016) | 0,166 (SD 0,012) | p=0,001 |
| Hipertrofia miocárdica | 0% (0/53) | 17,0% (9/53) | p=0,001 |
| OTSVD | 0% (0/55) | 18,2% (10/55) | p=0,001 |
Test de Mann Whitney (variables continuas) y prueba de Chi Cuadrado (variables dicotómicas).
AU: arteria umbilical; DV: ductus venoso; IP: índice de pulsatilidad; IT: insuficiencia tricuspídea; OTSVD: obstrucción del tracto de salida del ventrículo derecho; OVF: onda de velocidad de flujo; PVU: pulsaciones en vena umbilical; SD: desviación estándar; TCI: tiempo de contracción; isovolumétrica; TE: tiempo de eyección; TRI: tiempo de relajación isovolumétrica; VI: ventrículo izquierdo.
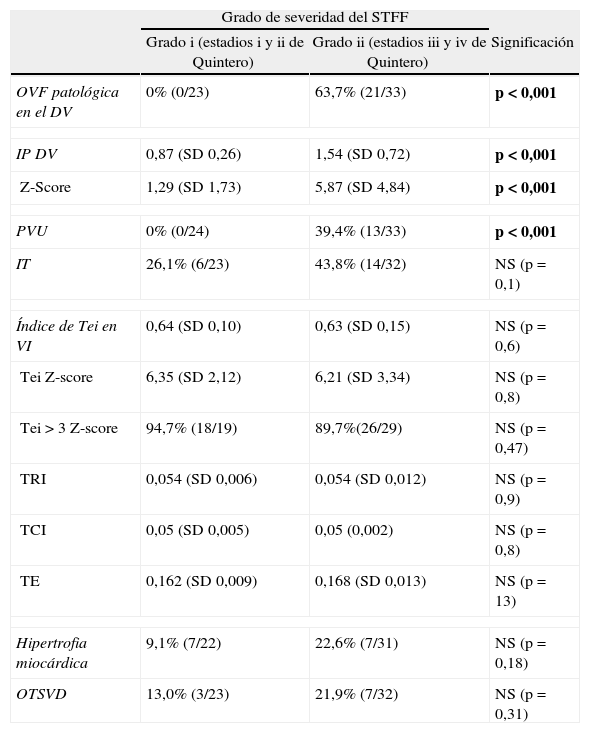
Cuando la disfunción cardiaca del receptor se analizó con relación a la severidad del STFF, en el grado II un mayor número de fetos presentó una OVF patológica en DV, PVU e IT. Además el IP en el DV fue más elevado que en el grado i. Sin embargo, no existieron diferencias significativas ni en el índice Tei en VI, ni en ninguno de sus 3 componentes. En la mayoría de los fetos receptores el índice de Tei fue superior a 3Z-score tanto en el grupo i como en el ii. En cuanto a las parámetros morfológicos, las diferencias tampoco alcanzaron la significación estadística ni respecto a la presencia de hipertrofia miocárdica ni a la OTSVD (tabla 2).
Parámetros cardiovasculares pre-quirúrgicos del feto receptor en función del grado de severidad del STFF
| Grado de severidad del STFF | |||
| Grado i (estadios i y ii de Quintero) | Grado ii (estadios iii y iv de Quintero) | Significación | |
| OVF patológica en el DV | 0% (0/23) | 63,7% (21/33) | p<0,001 |
| IP DV | 0,87 (SD 0,26) | 1,54 (SD 0,72) | p<0,001 |
| Z-Score | 1,29 (SD 1,73) | 5,87 (SD 4,84) | p<0,001 |
| PVU | 0% (0/24) | 39,4% (13/33) | p<0,001 |
| IT | 26,1% (6/23) | 43,8% (14/32) | NS (p=0,1) |
| Índice de Tei en VI | 0,64 (SD 0,10) | 0,63 (SD 0,15) | NS (p=0,6) |
| Tei Z-score | 6,35 (SD 2,12) | 6,21 (SD 3,34) | NS (p=0,8) |
| Tei > 3 Z-score | 94,7% (18/19) | 89,7%(26/29) | NS (p=0,47) |
| TRI | 0,054 (SD 0,006) | 0,054 (SD 0,012) | NS (p=0,9) |
| TCI | 0,05 (SD 0,005) | 0,05 (0,002) | NS (p=0,8) |
| TE | 0,162 (SD 0,009) | 0,168 (SD 0,013) | NS (p=13) |
| Hipertrofia miocárdica | 9,1% (7/22) | 22,6% (7/31) | NS (p=0,18) |
| OTSVD | 13,0% (3/23) | 21,9% (7/32) | NS (p=0,31) |
Test de Mann Whitney (variables continuas) y prueba de Chi cuadrado (variables dicotómicas).
DV: ductus venoso; IP: índice de pulsatilidad; IT: insuficiencia tricuspídea; NS: no significativo; OTSVD: obstrucción del tracto de salida del ventrículo derecho; OVF: onda de velocidad de flujo; PVU: pulsaciones en vena umbilical; SD: desviación estándar; TCI: tiempo de contracción; isovolumétrica; TE: tiempo de eyección; TRI: tiempo de relajación isovolumétrica; VI: ventrículo izquierdo.
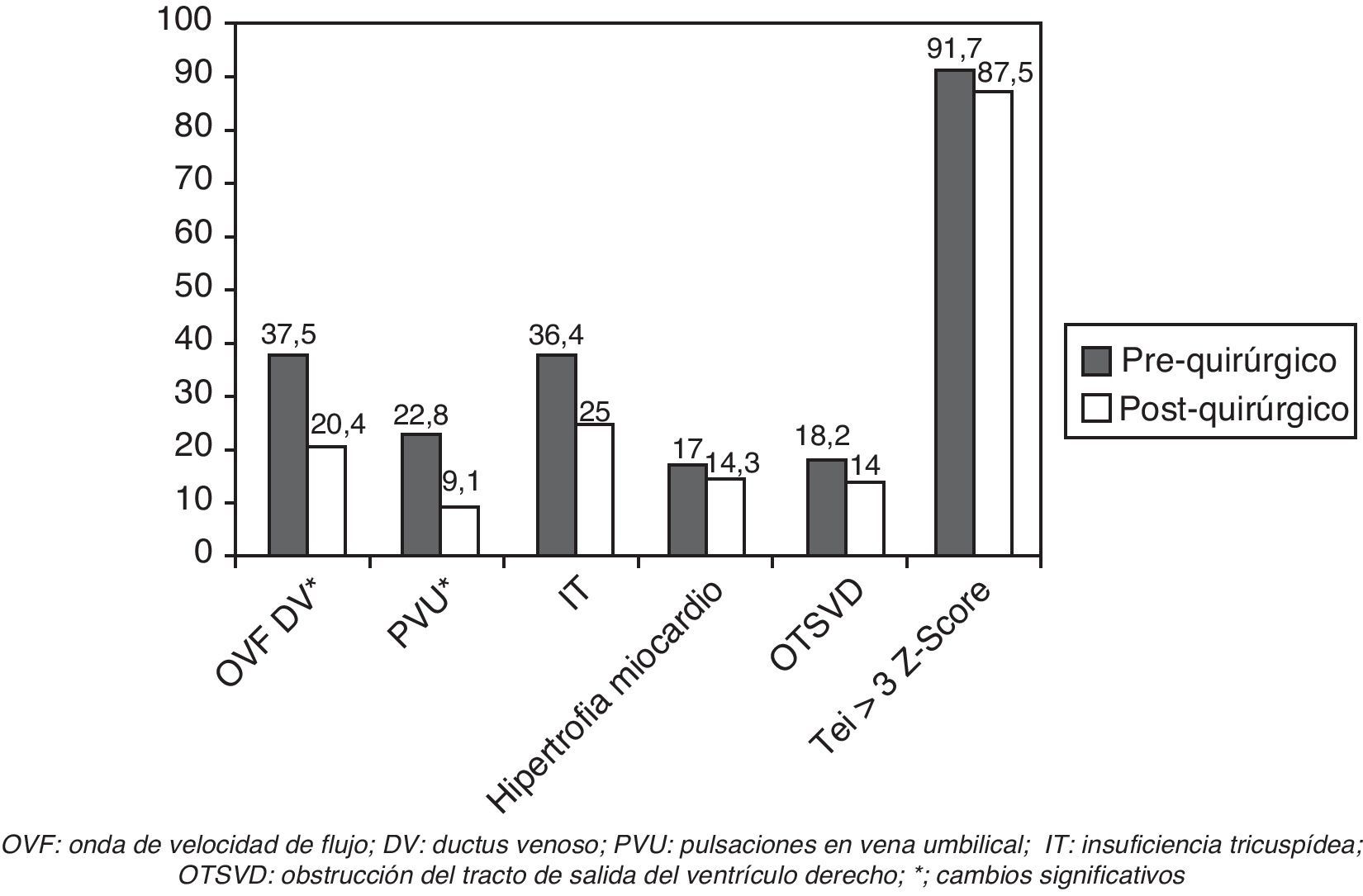
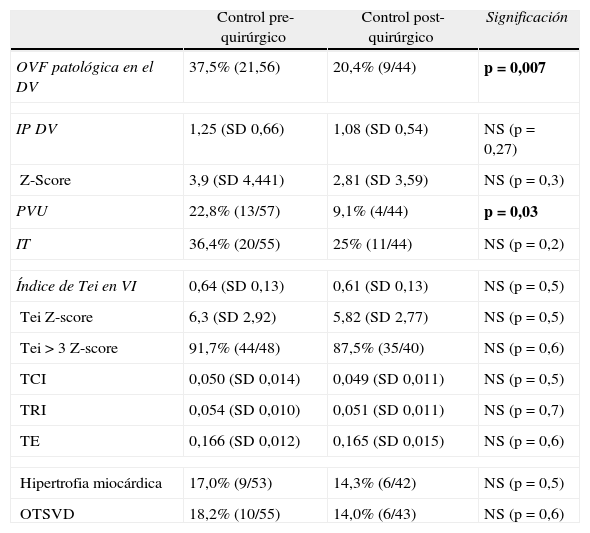
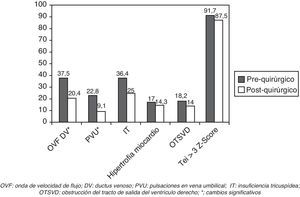
Respecto a los cambios en la función cardiaca tras la cirugía en el feto receptor, se observó una reducción significativa del número de fetos con OVF patológica en DV y de PVU. Aunque hubo una tendencia a que el IP del DV disminuyera tras el láser así como a una menor incidencia de IT, las diferencias no alcanzaron la significación estadística. Tanto el índice de Tei en VI y sus 3 componentes, como la presencia de hipertrofia miocárdica y de OTSVD permanecieron sin cambios. El índice de Tei en el VI fue patológico en la mayoría de los casos, tanto antes como después de la cirugía (tabla 3; fig. 3).
Parámetros cardiovasculares en el feto receptor antes del procedimiento y en el control post-operatorio inmediato (48-72h)
| Control pre-quirúrgico | Control post-quirúrgico | Significación | |
| OVF patológica en el DV | 37,5% (21,56) | 20,4% (9/44) | p=0,007 |
| IP DV | 1,25 (SD 0,66) | 1,08 (SD 0,54) | NS (p=0,27) |
| Z-Score | 3,9 (SD 4,441) | 2,81 (SD 3,59) | NS (p=0,3) |
| PVU | 22,8% (13/57) | 9,1% (4/44) | p=0,03 |
| IT | 36,4% (20/55) | 25% (11/44) | NS (p=0,2) |
| Índice de Tei en VI | 0,64 (SD 0,13) | 0,61 (SD 0,13) | NS (p=0,5) |
| Tei Z-score | 6,3 (SD 2,92) | 5,82 (SD 2,77) | NS (p=0,5) |
| Tei > 3 Z-score | 91,7% (44/48) | 87,5% (35/40) | NS (p=0,6) |
| TCI | 0,050 (SD 0,014) | 0,049 (SD 0,011) | NS (p=0,5) |
| TRI | 0,054 (SD 0,010) | 0,051 (SD 0,011) | NS (p=0,7) |
| TE | 0,166 (SD 0,012) | 0,165 (SD 0,015) | NS (p=0,6) |
| Hipertrofia miocárdica | 17,0% (9/53) | 14,3% (6/42) | NS (p=0,5) |
| OTSVD | 18,2% (10/55) | 14,0% (6/43) | NS (p=0,6) |
Pruebas de Wilcoxon (variables continuas) y McNemar (variables dicotómicas) para datos apareados.
DV: ductus venoso; IP: índice de pulsatilidad; IT: insuficiencia tricuspídea; NS: no significativo; OTSVD: obstrucción del tracto de salida del ventrículo derecho; OVF: onda de velocidad de flujo; PVU: pulsaciones en vena umbilical; SD: desviación estándar; TCI: tiempo de contracción; isovolumétrica; TE: tiempo de eyección; TRI: tiempo de relajación isovolumétrica; VI: ventrículo izquierdo.
En los donantes, tras el láser, el número de fetos con OVF patológica en la AU disminuyó de modo significativo (28,1% [16/57] vs. 7,3% [3/41], p=0,02]) mientras que se observó un aumento no significativo en el número de fetos con OVF patológica en el DV (10,5% [6/57] vs. 12,2% [5/41], p=0,9]) y presencia de IT (5,2% [3/58] vs. 9,8% [4/41], p=0,12]). Respecto al índice de Tei en VI, si bien este permaneció sin cambios, el TRI disminuyó de manera significativa (0,045 vs. 0,042, p=0,02) y el TE aumentó (0,156 vs. 0,167, p=0,02).
DiscusiónSe ha realizado el estudio de la función cardiaca en 58 STFF observándose que el feto receptor presentaba un grado de disfunción cardiaca superior al donante. Aunque en los estadios más avanzados de Quintero las alteraciones cardiacas eran más frecuentes y severas, hasta el 90% de los fetos receptores mostraban un índice de Tei en VI >3Z-score en estadios i y ii. Encontramos que la fotocoagulación mediante láser de las anastomosis vasculares produjo cambios en el postoperatorio inmediato, de manera que 48-72h tras la técnica, los marcadores de disfunción cardiaca derecha en el feto receptor mejoraron, aunque no los del corazón izquierdo, mientras que en los donantes los cambios más significativos fueron la normalización del flujo telediastólico en la AU y el empeoramiento agudo de la función cardiaca derecha y de la contractilidad miocárdica izquierda.
Los cambios en la función cardiaca y las diferencias entre el feto donante y receptor reflejan la base fisiopatológica del STFF. En el donante, la hipovolemia activa el sistema RAS, que, además de hipoperfusión a nivel renal, provoca un incremento de las resistencias placentarias1,2. En el receptor, el aumento de la precarga y de la postcarga, así como la síntesis de endotelina-1, inducen un aumento del tamaño cardiaco a través del fenómeno conocido como remodelación cardiaca1,2. Ello explica los hallazgos encontrados en nuestra serie. Mientras que en el donante los hallazgos más significativos fueron la presencia de una OVF patológica en la AU y un IPAU elevado, en el receptor lo fue una OVF patológica en el DV, un IPDV superior al del donante, una mayor frecuencia de PVU y de IT y un índice de Tei en VI más alargado. Además, ningún donante presentó cambios morfológicos cardiacos y sin embargo cerca del 20% de los receptores mostraron signos de hipertrofia miocárdica y OTSVD. Estos resultados son comparables a los descritos por el grupo del Children's Hospital of Philadelphia (CHOP)3.
El sistema de clasificación de Quintero ha sido cuestionado en los últimos años ya que, aunque de gran utilidad en homegeneizar los resultados de los diferentes grupos de trabajo, no contempla el principal órgano implicado en la fisiopatología del STFF, el corazón18. Así pues, aunque en los estadios más avanzados el grado de alteraciones cardiacas parece ser superior, la disfunción cardiovascular del feto receptor puede estar presente ya en estadios iniciales. De hecho, en nuestra cohorte, en el grado i de severidad, si bien el estudio de las venas precordiales era normal en todos los fetos receptores, el 26% presentaban IT, el 10% hipertrofia del VD y hasta un 13% OTSVD. Además, en la gran mayoría, el índice de Tei del VI era superior a los 3Z-Score, reflejando, tanto disfunción diastólica, a través de su componente TRI, como sistólica, a través de sus componentes TCI y TE.
Debido a estas limitaciones de la clasificación de Quintero, en los últimos años han aparecido otros sistemas como el «score» cardiovascular descrito por el CHOP3, el sistema de clasificación de Cincinnati4 o el perfil cardiaco fetal descrito por Fouron y Ville5. El «score» cardiovascular incluye, además del estudio doppler de la AU en el feto donante y de las venas precordiales en el receptor, contemplados ya en la estadificación de Quintero, parámetros cardiacos cualitativos (hipertrofia ventricular, cardiomegalia, disfunción ventricular, IT, insuficiencia mitral, OVF a nivel de válvulas aurículo ventriculares, OTSVD e insuficiencia pulmonar) y cuantitativos (índice de Tei en VI y VD). Sus resultados son similares a los nuestros, observando discrepancia en el grado de severidad según fuera valorado por la clasificación de Quintero o cuantificado por el «score» cardiovascular3. En la clasificación de Cincinnati, el estadio iii de Quintero se subclasifica en iiia, iiib y iiiC, en función del grado de miocardiopatía del feto receptor4. Fouron y Ville describen 3 perfiles cardiacos que representan estadios progresivos: en el primero existe un incremento del índice de Tei tanto en VD como VI, en el segundo una disminución de la fracción de acortamiento en ambos ventrículos, y en el tercero una elevación del IP del DV. Hasta el 55% de los estadios i de Quintero presentaba algún tipo de disfunción cardiaca5. Una crítica a estos nuevos sistemas de clasificación es la complejidad de los mismos, alargando el tiempo de exploración y siendo limitado el número de casos con un estudio cardiovascular completo3. El exceso de movimientos del feto receptor, debido al polihidramnios, y la mala calidad de imagen del feto donante, secundaria al oligoanhidramnios, son los principales inconvenientes. Sin embargo, en nuestras manos, este fue posible en la exploración inicial en aproximadamente el 90% de los casos.
Se ha apuntado que la incorporación de estos nuevos sistemas de clasificación podría ser útil tanto en la estratificación del riesgo como en la evaluación de la respuesta al tratamiento intrauterino.
Respecto al primer punto, algunos grupos de trabajo defienden su posible papel en diferenciar aquellos estadios iniciales que evolucionarán a estadios avanzados de aquellos que no lo harán, de manera que la probabilidad de que el STFF progrese sería mínima en el STFF estadio i sin disfunción cardiaca, pudiendo adoptar conducta expectante en estos casos6,7. Aún más, incluso gestaciones monocoriales con discordancia de líquido amniótico y de vejigas que no cumplen criterios estrictos de STFF pero que presentan disfunción diastólica, parecen tener un mayor riesgo de desarrollar un STFF9. Esto ha sido cuestionado por otros autores8. Por otro lado, esta supuesta aplicación clínica no parece tener ningún sentido en aquellos que defienden la fotocoagulación mediante láser de las anastomosis vasculares como tratamiento de elección para el STFF estadio i19. Dada la disparidad de opiniones con respecto a cuál debe ser la conducta en estos casos20,21, la realización de un estudio aleatorizado que compare láser con manejo expectante es de suma importancia22.
En segundo lugar, existen varios estudios en cuanto a la utilidad del estudio cardiaco en la valoración de la eficacia del tratamiento. Se ha descrito que tras el amniodrenaje las anomalías cardiovasculares persisten, e incluso los signos de miocardiopatía hipertrófica del feto receptor progresan10. Sin embargo, después de la práctica de la fotocoagulación mediante láser de las anastomosis vasculares, la función sistólica biventricular del feto receptor mejora de manera aguda y la función diastólica lo hace de modo progresivo11. De hecho, en nuestra serie, el porcentaje de receptores con OVF patológica en el DV se redujo del 37 al 20,4%, la presencia de pulsaciones venosas del 22,8 al 9,1% y la IT del 36,4 al 25%. No observamos cambios inmediatos respecto a la hipertrofia miocárdica ni a la OTSVD, probablemente porque estas anomalías indican una fase evolucionada de la enfermedad en la que los fenómenos de remodelación miocárdica ya están instaurados1. En el feto donante, los cambios más significativos son los que reflejan una disminución de las resistencias placentarias, con aparición de flujo telediastólico en la OVF de la AU. Además, desarrollan un estado de insuficiencia cardiaca transitoria, con empeoramiento de la función cardiaca derecha apareciendo incluso signos de hidrops23. Así, en nuestra cohorte, el número de fetos donantes con OVF patológica en DV aumentó discretamente y la incidencia de IT se duplicó, alcanzando casi el 10%.
El índice de Tei es un parámetro de función cardiaca que permite estudiar simultáneamente la función diastólica, a través del TRI, y la sistólica, mediante el TCI y el TE. Cuanto más alargado es el índice de Tei, mayor es el grado de disfunción. Inicialmente fue descrito para el estudio de la función cardiaca en el adulto. Recientemente se han establecido curvas de normalidad en vida fetal tanto para gestaciones únicas17 como para gemelos monocoriales13, habiendo demostrado una buena reproducibilidad de la medición de sus componentes24. Existen múltiples estudios que describen un alargamiento del índice de Tei en el feto receptor, principalmente en el corazón derecho3,12,25. Respecto a su normalización tras la práctica de fotocoagulación mediante láser de las anastomosis vasculares existe cierta discordancia en los resultados publicados11–13. Parece que, aunque de un modo inmediato este no se normaliza, sí que lo hace a medio plazo. De hecho, en un estudio longitudinal incluyendo 39 STFF, Van Mieghem et al. encontraron que mientras que la función ventricular derecha mejoraba de manera considerable a las 48h tras el láser, el índice de Tei del VI no se normalizaba hasta las 4 semanas13. En nuestra serie, en el control postoperatorio inmediato el índice de Tei en VI, así como sus 3 componentes, no se modificó en el feto receptor. En los donantes, tampoco hubo cambios en este índice, pero sí que encontramos un alargamiento del TE, que podría traducir la persistencia de una disfunción sistólica, y un acortamiento del TRI, que reflejaría una discreta mejora de la distensibilidad miocárdica. Así pues, y coincidiendo con la literatura, el índice Tei en VI no mostró cambios agudos tras el láser, posiblemente porque este parámetro depende de características inherentes al propio músculo cardiaco.
Por último, el estudio de la función cardiovascular puede ayudar a comprender en qué medida el entorno intrauterino puede afectar al desarrollo de enfermedad cardiovascular en la infancia y en la vida adulta. De hecho, en los fetos receptores se ha descrito un mayor riesgo de disfunción residual del VD, hipertrofia miocárdica, persistencia de OTSVD y mayor riesgo de hipertensión arterial en la infancia1,26. En el donante parece haber una disminución de la distensibilidad vascular, muy probablemente secundaria a los cambios que en vida intrauterina se han producido en sus vasos, mediados principalmente por la endotelina-1, que condiciona un aumento en la síntesis de colágeno, hipertrofia de la muscular y de la media1,27,28.
Una de las mayores limitaciones del presente estudio es la falta de seguimiento longitudinal que nos hubiera permitido analizar los cambios de la función cardiaca tanto a corto como a medio plazo. Por otro lado, la exploración cardiaca realizada carece de algunos parámetros de gran interés principalmente para el estudio de la función sistólica, como es la fracción de acortamiento tanto del VD como del izquierdo. Además, teniendo en cuenta que la disfunción en el feto receptor es mayor en el corazón derecho, el índice de Tei del VD nos habría podido dar una valiosa información.
En conclusión, la función cardiaca está alterada en el STFF, siendo el grado de disfunción del feto receptor mayor al del donante. Si bien esta es más severa en estadios avanzados, ya en fases iniciales la mayoría de los fetos receptores muestran ciertos signos de disfunción. De manera aguda, la fotocoagulación mediante láser de las anastomosis vasculares parece mejorar la función cardiaca del feto receptor mientras que en el donante produce un empeoramiento transitorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Datos preliminares del presente trabajo han sido presentados en forma de ponencia en el 10th World Congress in Fetal Medicine (Malta, junio de 2011).
La Sección de Ecografía y Medicina Fetal del HGUGM lleva a cabo diferentes líneas de investigación:.
- Estudio de la función cardiaca en las complicaciones de la gestación monocorial
- Estudio de la circulación cerebral en el síndrome de transfusión feto fetal
- Prevención de la prematuridad
- Predicción de la hipoplasia pulmonar en la hernia diafragmática congénita
- Estudio hemodinámico en el crecimiento intrauterino restringido
- Estudio del timo fetal en diferentes enfermedades (infección intraamniótica, crecimiento intrauterino restringido, pacientes con HIV, diabetes pregestacional)
- Marcadores bioquímicos de primer trimestre y resultados perinatales