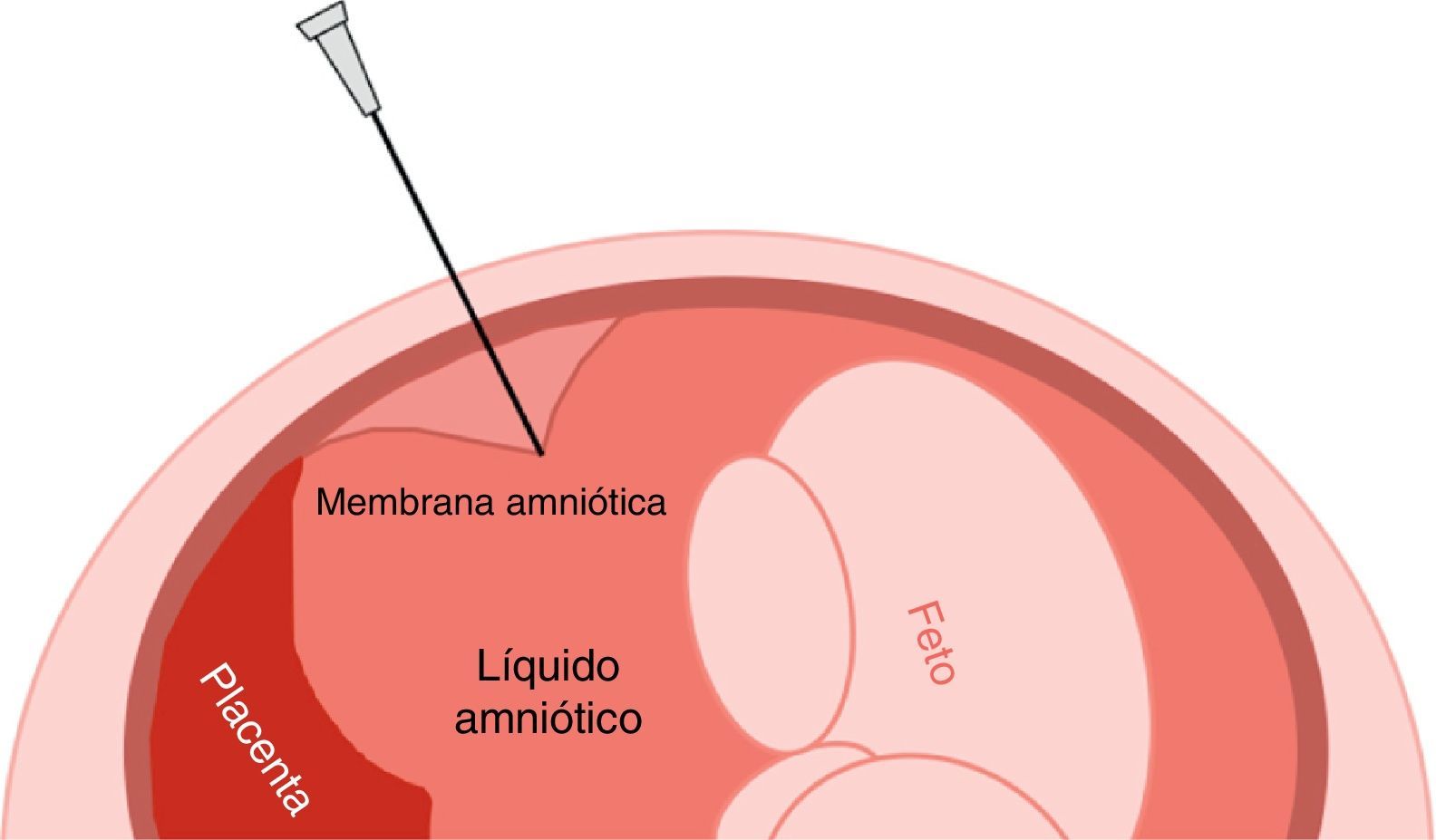
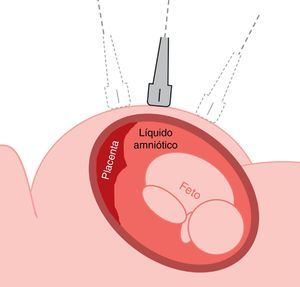
La amniocentesis es un procedimiento de diagnóstico prenatal invasivo de segundo trimestre, descrito inicialmente en 1966 por Steele y Berg. Consiste en la introducción de una aguja espinal a través de la pared abdominal, la pared uterina y la cavidad amniótica bajo guía ecográfica continua, de forma que se pueda aspirar una muestra del líquido amniótico que envuelve el feto y que contiene células de origen fetal. La amniocentesis se realiza a partir de las 16 semanas de gestación y en el líquido amniótico se pueden realizar estudios cromosómicos, bioquímicos, moleculares o microbiológicos.
El procedimiento conlleva un riesgo de pérdida fetal de aproximadamente el 0,5% cuando se realiza en el segundo trimestre, después de la fusión de la membrana amniótica con el corion, además de un riesgo menor de otras complicaciones, como la pérdida de líquido amniótico (0,3%), hemorragia placentaria, infección intraamniótica, hematoma de la pared abdominal o traumatismo fetal. A medida que la experiencia internacional se acumula, se van determinando los factores que pueden ayudar a mejorar aún más la seguridad y la facilidad técnica del procedimiento.
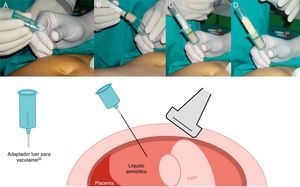
Hemos descrito un nuevo método de aspiración para realizar la amniocentesis que emplea un Vacutainer® (BD Vacutainer Systems, Plymouth, Reino Unido), para obtener un vacío continuo cuando la aguja ya está insertada dentro de la cavidad amniótica, en contraste con la técnica estándar de aspiración mediante jeringa o «pistola» en que las presiones negativas son discontinuas. Sin embargo, la técnica clásica con aspiración con jeringa continua siendo válida y la más utilizada.
Basados en la experiencia de 30 años y en el volumen de procedimientos realizados en nuestro centro (más de 20.000 procedimientos invasivos realizados), junto con una revisión de la bibliografía publicada hasta la fecha, hemos planteado una guía práctica actualizada para la realización de la amniocentesis.
Amniocentesis, initially described by Steele and Borg in 1966, is an invasive prenatal diagnostic procedure used in the second trimester. It consists of inserting an ultrasound-guided spinal needle through the abdominal and uterine wall and into the amniotic cavity in order that a sample of the amniotic fluid that surrounds the foetus, and contains cells of foetal origin, can be aspirated. Amniocentesis is performed after 16 weeks gestation, so that chromosomal, biochemical, molecular, or microbiological studies can be performed on the amniotic fluid.
The procedure carries a risk of foetal loss in approximately 0.5% when it is performed in the second trimester after the fusion of the amniotic and chorionic membrane, as well as lesser risk of other complications such as, loss of amniotic fluid (0.3%), placental haemorrhage, intra-amniotic infection, abdominal wall haematoma, or foetal injury. As international experience accumulates, more factors that can help to improve the safety and ease of the procedural technique are being determined.
We have described a new aspiration method to perform amniocentesis that uses a Vacutainer® (BD Vacutainer Systems, Plymouth, United Kingdom), to obtain a continuous vacuum when the needle is already inserted in the amniotic cavity, in contrast to the standard aspiration technique using a syringe or suction pistol where the negative pressures are discontinuous. However, the classic technique with continuous syringe aspiration continues being valid and the most used.
Based on 30 years experience, and on the volume of procedures performed in our centre (more than 20,000 invasive procedures), together with an up to date literature review, we have established an updated practice guideline for performing amniocentesis.
Como todo procedimiento invasivo, se requiere una lista de comprobación (checklist) previa al procedimiento, ya que dicha sistematización evitará la realización errónea o la interrupción de la amniocentesis por causas que se podrían haber evitado. A continuación se describe el checklist utilizado.
- 1.
Verificación del motivo de la amniocentesis. Es crucial ser consciente de cuál es la indicación médica de la realización de un cariotipo: a) anomalía fetal ecográfica detectada durante el estudio morfológico; b) cribado de segundo trimestre con riesgo ≥ 1/250; c) una anomalía cromosómica en gestación previa (sobre todo trisomías); d) antecedentes de anomalía cromosómica (hijo previo o en uno de los progenitores). A veces, por el contrario, la amniocentesis se realizará por riesgo de una enfermedad monogénica o de una enfermedad infecciosa fetal con diagnóstico disponible en líquido amniótico4. Finalmente, el motivo de una amniocentesis puede no ser una indicación médica, sino decisión de la gestante («ansiedad materna»).
- 2.
Edad gestacional. La amniocentesis no podrá realizarse antes de las 15 semanas completas de gestación (15+0), ya que la denominada early amniocentesis mostró presentar un riesgo aumentado de problemas ortopédicos (talipes) y complicaciones respiratorias neonatales1–3, conjuntamente con un riesgo mayor de fallo de cultivo4. Como criterio general será preferible realizar las amniocentesis a partir de las 16 semanas, sobre todo si las membranas corioamnióticas no se encuentran coaptadas.
- 3.
Asesoramiento genético en el momento de la programación de la amniocentesis, por parte de un médico genetista clínico u obstetra sobre los riesgos de anomalía cromosómica (enfermedad genética o infecciosa, en su caso) y sobre el alcance y limitaciones de los estudios genéticos que se vayan a llevar a cabo en el líquido amniótico. De cada test genético se debe informar de las posibilidades de quedarse sin resultado y de los falsos positivos, falsos negativos y resultados no concluyentes. También es importante que se haya decidido qué test genético se practicará: la «prueba rápida» (QF-PCR o FISH), el cariotipo o el array-CGH (cariotipo molecular). Se deben comentar las limitaciones de cada técnica: la «prueba rápida» solo determina el número de 5 cromosomas (13, 18, 21, X e Y), el cariotipo no detecta cambios submicroscópicos, el array-CGH no detecta las anomalías equilibradas y ninguna de ellas detecta los defectos monogénicos. A mayor complejidad de la técnica también se detectan más variantes de la normalidad con significado incierto.
- 4.
Consentimiento informado. Se debe proporcionar a la gestante información sobre el procedimiento de la amniocentesis, las complicaciones que la prueba puede acarrear, y las medidas de precaución que se deben adoptar5–7. La información sobre el procedimiento y sobre el procesamiento de la muestra debe incluirse en el consentimiento informado. Idealmente, debe firmarse con un plazo mínimo de 24 h antes de la realización del procedimiento.
- 5.
Conocimiento del RhD. En caso de que la gestante sea RhD negativa se pautará gammaglobulina anti-D antes de cumplir las 72 h posprocedimiento, excepto si se ha realizado un genotipado prenatal no invasivo, con resultado de feto RhD negativo. Como norma general, no se tendrá en cuenta el RhD de la pareja.
- 6.
Conocimiento de serologías: virus de inmunodeficiencia humana (VIH), hepatitis B (VHB) y en casos de riesgo, virus de la hepatitis C (VHC). Las serologías positivas no se consideran una contraindicación absoluta para el procedimiento y deberá valorarse cada caso de manera individual. En caso de presencia de infección por VIH, el procedimiento podrá realizarse bajo highly active antirretroviral therapy (terapia antirretroviral altamente activa [HAART]) e idealmente con una carga viral indetectable. En caso de antígeno «e» de VHB (HBeAg) o carga viral positiva, se recomendará administración de la gammaglobulina específica postamniocentesis. En toda sospecha de infección materna (VIH, VHB, VHC, infección TORCH) deberá evitarse atravesar la placenta por el riesgo de transmisión vertical durante el procedimiento.
- 7.
Valorar las contraindicaciones relativas al procedimiento:
- -
Mujeres seropositivas para VHB, VHC o VIH con carga viral alta.
- -
Isoinmunización.
- -
Fiebre o infección materna activa.
- -
Amenaza de aborto y sangrado genital reciente no filiado.
- -
Separación de las membranas corioamnióticas (detachment).
- -
Gran hematoma intracavitario.
- -
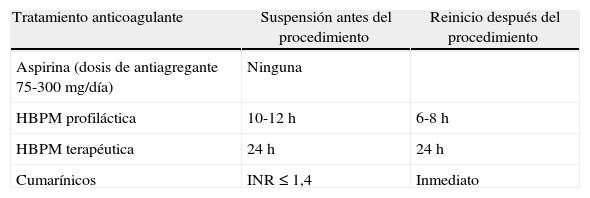
Alteración de la coagulación materna o tratamiento anticoagulante (tabla 1)8.
Tabla 1.Ajuste del manejo anticoagulante para la amniocentesis
Tratamiento anticoagulante Suspensión antes del procedimiento Reinicio después del procedimiento Aspirina (dosis de antiagregante 75-300mg/día) Ninguna HBPM profiláctica 10-12h 6-8h HBPM terapéutica 24h 24h Cumarínicos INR ≤ 1,4 Inmediato HBPM: hemoglobina de bajo peso molecular; INR: international normalised ratio.
Fuente: Butwick y Carvalho8.
- -
- 8.
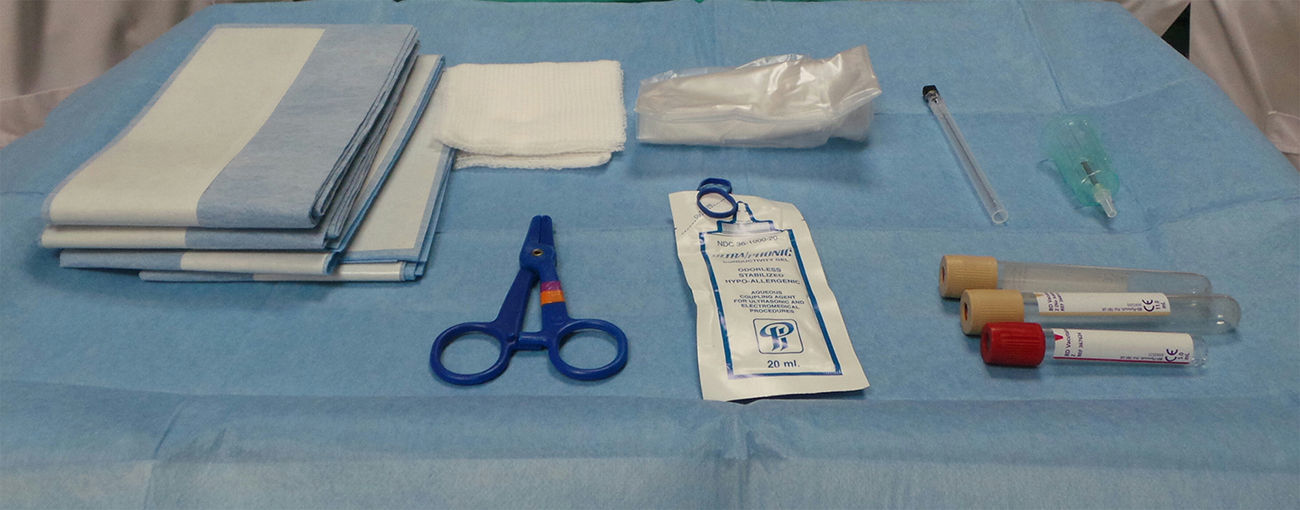
Disponibilidad de material y personal. Es necesaria la presencia de un operador que controle el transductor y la aguja, así como de un asistente que se responsabilice de la aspiración del líquido amniótico. En cuanto a instrumental, los requerimientos mínimos son (fig. 1):
- -
Ecógrafo;
- -
camilla o mesa de exploración ginecológica;
- -
gasas estériles y antiséptico (yodopovidona/clorehexidrina);
- -
tallas o campos estériles;
- -
funda estéril para la sonda ecográfica;
- -
gel estéril;
- -
aguja de calibre 22 G (0,7cm de diámetro, 9cm de largo) o 20 G;
- -
tubos Vacutainer® de 10ml sin ningún aditivo;
- -
adaptadores «Luer “enroscados al” holder» de plástico de los Vacutainer®;
- -
alternativamente, 2 jeringas de 10ml, si no se utiliza Vacutainer®.
- -
Cabe señalar que el coste de los 2 vacutainers + 1 adaptador + 1 holder es similar al de las 2 jeringas (< 1 euro).
Valoración y planeamientoSe debe colocar a la gestante en posición de decúbito supino, lo más horizontal posible, ya que esta posición permitirá un mejor acceso a la cavidad amniótica. También debe confirmarse la viabilidad fetal antes de la amniocentesis, así como una edad gestacional superior a las 15 semanas y una perfecta coaptación de las membranas corioamnióticas.
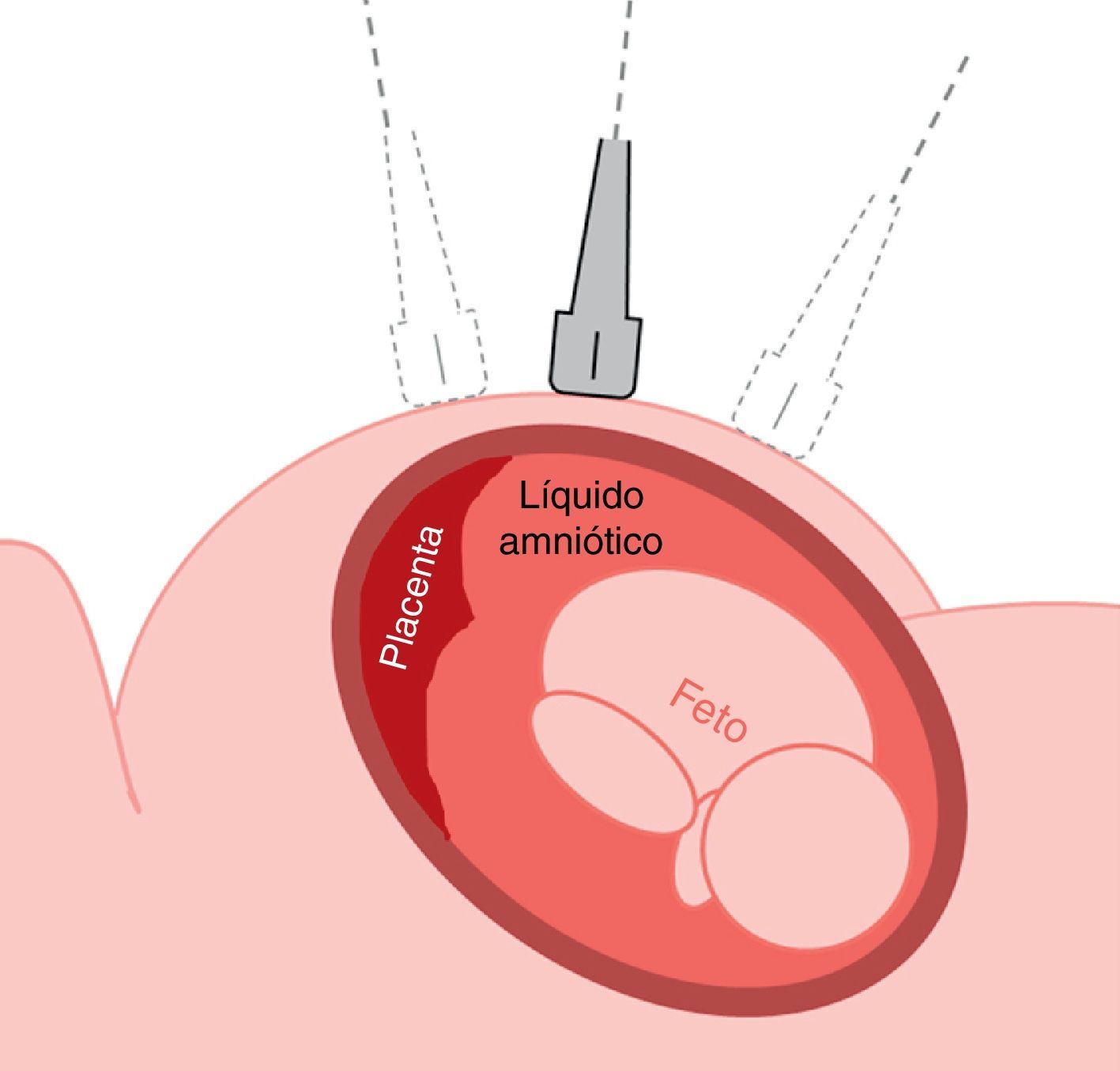
La evaluación ecográfica previa al procedimiento se basará en un barrido de la totalidad de la cavidad uterina en cortes transversos con relación al abdomen materno, con el transductor completamente horizontal, para definir la ubicación de la placenta, el pool máximo de líquido amniótico, la posición y el patrón de movimientos fetales (fig. 2). Debe tenerse extremo cuidado de no oblicuar la sonda desviándose del plano perpendicular exacto con relación a la superficie del abdomen materno; de lo contrario estaremos «enfocando» un campo que se halla situado debajo o encima de la sonda.
Debe localizarse el mayor pool de líquido amniótico en una visión transversa del útero, evitándose los pools periféricos (fúndico, polo inferior o los muy laterales) y observar los movimientos del feto, que normalmente son recurrentes. En la pantalla del ecógrafo debe visualizarse la piel del abdomen materno y la ampliación de la imagen no debe efectuarse con el zoom, sino disminuyendo la profundidad de la imagen, de manera que podamos planear la entrada de la aguja desde la piel materna al pool de líquido amniótico.
Siempre que sea posible se evitará una punción transplacentaria, aunque esta debe preferirse a una vía no transplacentaria con cierto riesgo al fracaso, por ser cercana al feto o por ser muy periférica en relación con la cavidad uterina. La vía transplacentaria está contraindicada en isoinmunización o en infección materna por VIH o hepatitis B o C.
Preparación de la gestante y del campo estérilEl operador y, en su caso, el asistente deben realizarse un lavado de manos con antiséptico (clorhexhidrina o esterilium) y colocarse guantes estériles.
Se procede a la aseptización de la piel del área abdominal expuesta utilizando las gasas y antisépticos recomendados, por ejemplo clorhexidina o yodopovidona alcohólica. Algunos grupos propugnan evitar el uso de antisépticos yodados durante la gestación debido a la posibilidad de producir una disfunción tiroidea en el primer trimestre9, o confundir las determinaciones del cribado neonatal10. Sin embargo, esta recomendación no ha estado secundada por otros grupos11 ni recogida en la mayoría de las guías de práctica clínica.
Idealmente, la sonda ecográfica deben ser descontaminada antes y después de cada uso, siguiendo las instrucciones del fabricante (limpieza con detergente, secado con una toalla desechable, desinfección con alcohol). De todos modos, se debe cubrir la sonda con una funda estéril, con gel en el interior para mejorar la transmisión sónica. El gel estéril debe ser preferentemente de bolsas individuales, para disminuir el riesgo de contaminación que se presenta con el uso de botellas de uso múltiple.
Introducción de la agujaEn los inicios de la amniocentesis, el control ecográfico solo se utilizaba para el planeamiento del procedimiento. Hace un par de décadas se realizaba la punción ecoguiada, pero la aspiración se realizaba a ciegas. En la actualidad, la totalidad del procedimiento debe realizarse bajo control ecográfico directo con visualización continua de la aguja. Los protocolos locales deben determinar si la ecografía durante el procedimiento debe ser realizada por la persona que inserta la aguja (técnica de un operador) o por un asistente ecografista (técnica de 2 operadores)12.
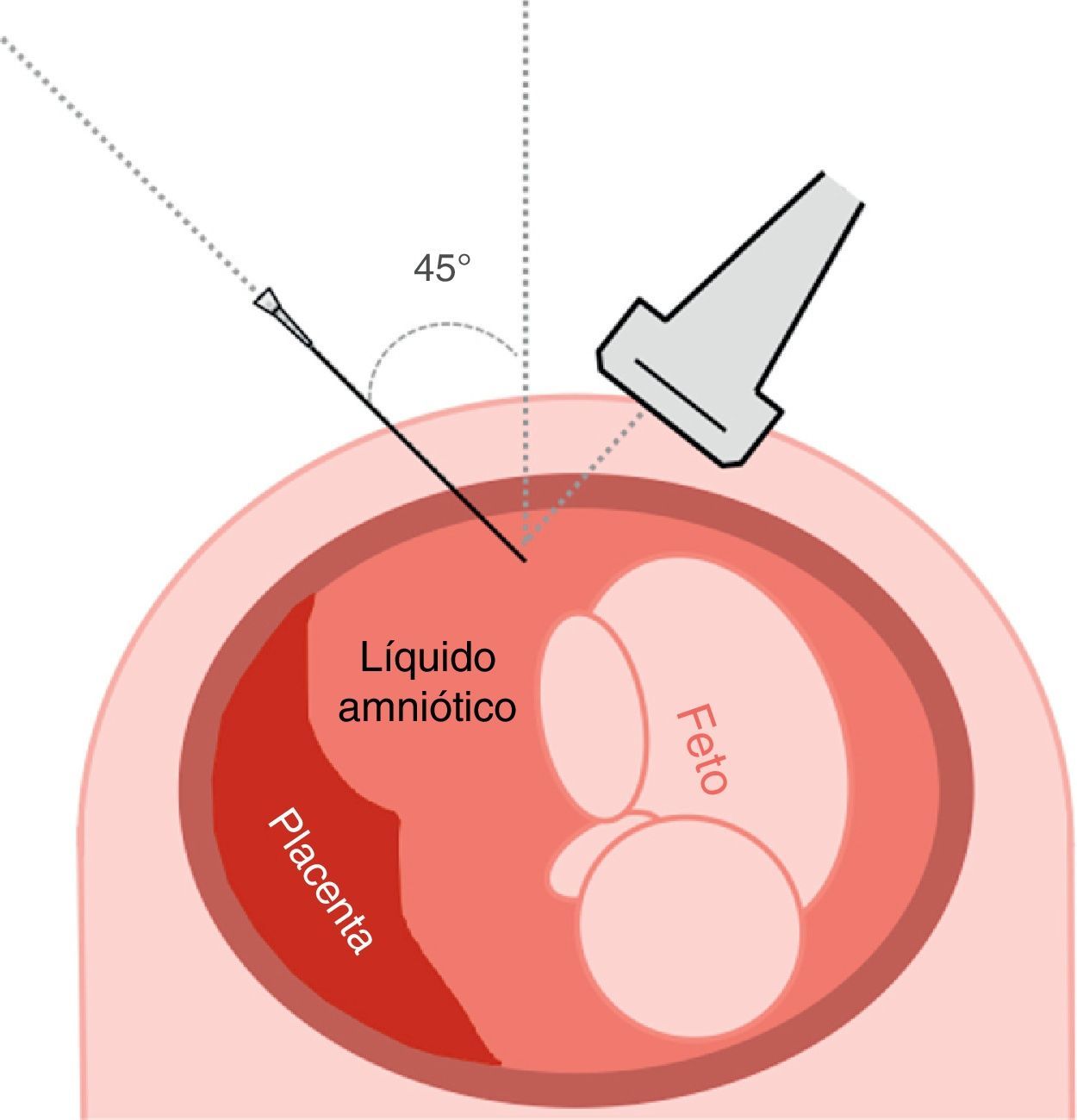
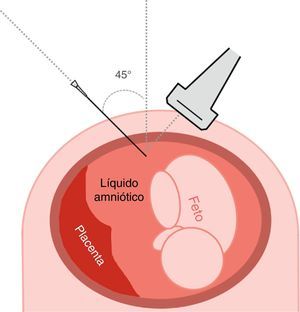
La sonda ecográfica debe situarse en un plano transverso del abdomen materno siempre perpendicular a la superficie del abdomen, sin oblicuarse hacia arriba ni abajo, tal como se ha descrito previamente para el planeamiento de la amniocentesis (fig. 2). Si el pool de líquido amniótico donde debemos acceder está situado en el hemiabdomen izquierdo, la sonda debe lateralizarse manteniéndose en el mismo plano transverso hacia el hemiabdomen derecho, de manera que forme un ángulo de unos 45¿ con el plano sagital de la madre y el útero (fig. 3).
La punción tiene 4 fases: la punción en la piel de la gestante, la punción del útero, la entrada en la cavidad amniótica y el punto donde se detiene el avance de la aguja.
- 1.
Punción abdominal. La aguja debe introducirse a 45¿ del plano lateral derecho complementario, de manera que aguja y sonda ecográfica incidan en un plano de 90¿ (fig. 3)13. En caso de considerarlo conveniente, se puede cambiar la lateralidad: sonda a la izquierda y aguja a la derecha de la gestante.
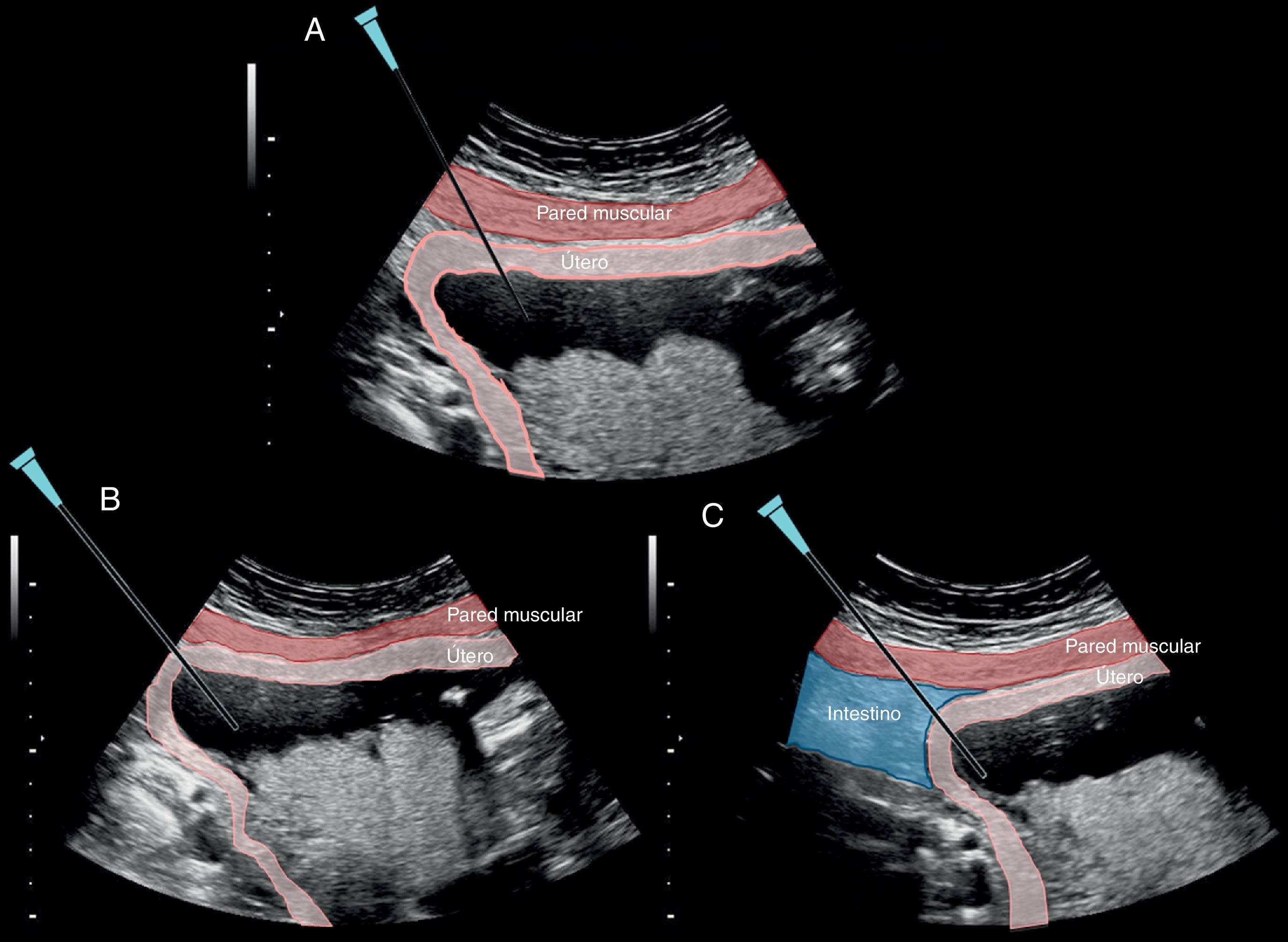
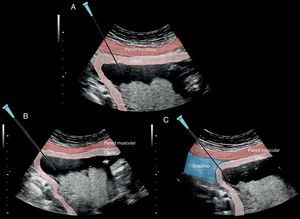
La aguja debe entrar lateral a la sonda, a 3cm de distancia de su límite y coincidiendo exactamente en el punto medio del ancho de la sonda, de manera inclinada hacia el centro del útero. La punción inicial de la piel requiere que se realice con cierta presión autolimitada mientras se avanza por el tejido subdérmico de la gestante (fig. 4A).
En el avance de la aguja entre la piel y el útero es importantísimo evitar la punción de asas intestinales no visualizadas por un ángulo «muerto» de visión ecográfica nula debido a un error en la inclinación lateral de la sonda (fig. 4C). La punción inadvertida de las asas intestinales sería la causa de corioamnionitis que puede conducir a una sepsis materna y eventualmente a su muerte.
- 2.
Punción uterina. La punción del útero puede ser dolorosa porque está recubierto por peritoneo. Debe confirmarse la orientación inicial de la aguja antes de pinchar la pared uterina, ya que después será demasiado tarde para rectificar su orientación, que puede verse desviada por un movimiento materno o por la contracción muscular abdominal.
- 3.
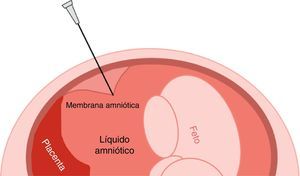
Entrada en cavidad amniótica. Siempre debemos parar antes de entrar a la cavidad amniótica para localizar con precisión la aguja, ya que a partir de ahora tendremos que ver toda la longitud de la aguja dentro de la cavidad uterina y no solo la punta. Debemos separar la sonda de la aguja para que incida en 90¿ con ella y pueda visualizarse mejor. Una localización parcial de la aguja puede conllevar la punción de la pared posterior del útero y la salida de la aguja por la parte posterior. La entrada en la cavidad amniótica debe realizarse con un movimiento decidido para evitar el tenting (imagen de tienda de campaña) de las membranas que impida una entrada real en la cavidad amniótica, cuando la aguja se ve aparentemente dentro de la cavidad pero no se puede extraer líquido (fig. 5). Normalmente en estos casos, en la punta de la aguja se ven 2 señales ecogénicas.
- 4.
Detención del avance de la aguja. Dentro de la cavidad amniótica no detendremos el avance de la aguja hasta 1-2cm antes de llegar a la pared posterior, para evitar que una contractura de la pared anterior nos disloque la aguja y para que la punta de la aguja no esté «apuntando» al feto y así evitar que en sus movimientos se pinche.
En caso de una punción fallida, si decidimos retirar la aguja y localizar un nuevo punto de entrada, deberemos realizar un cambio de aguja.
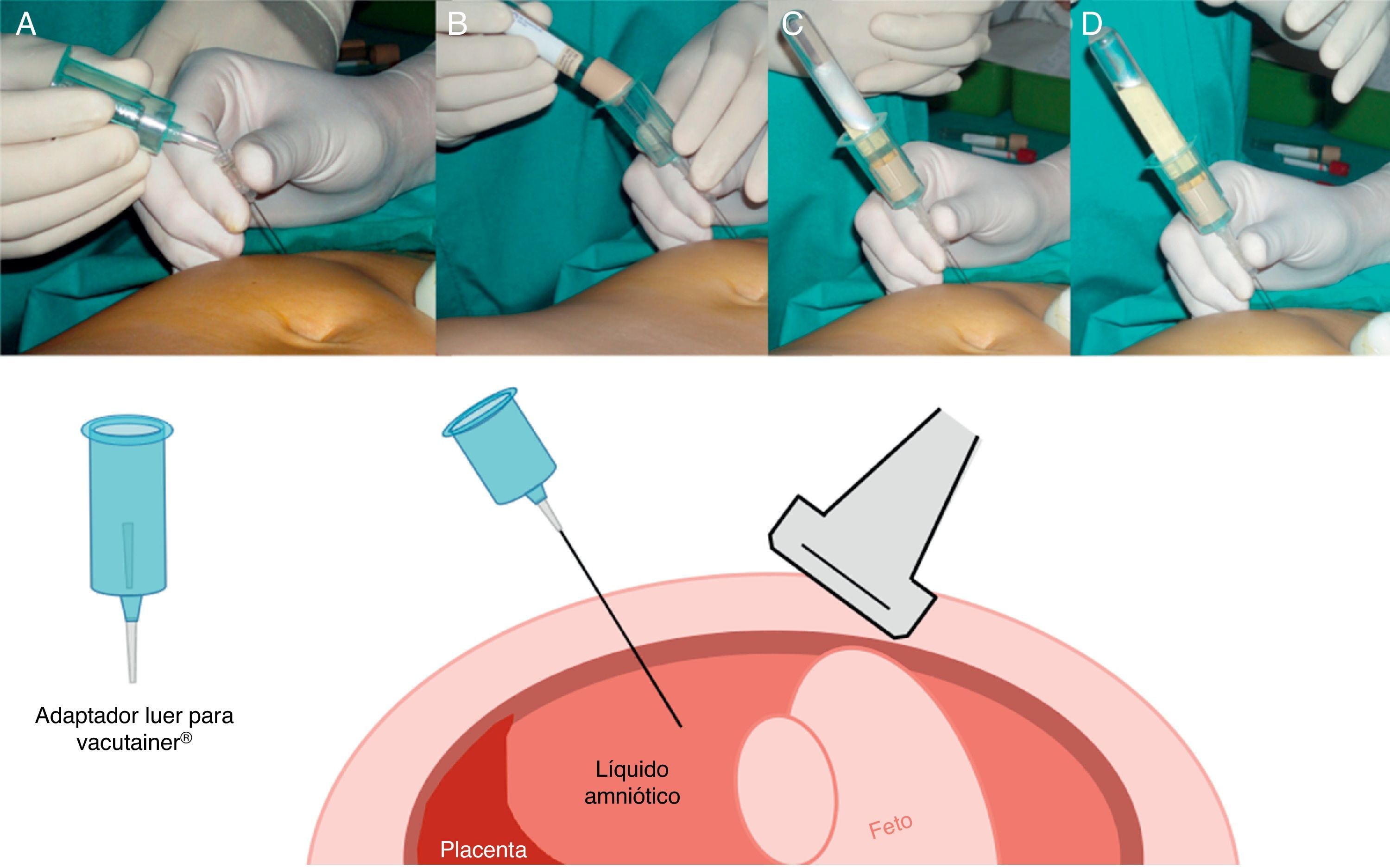
Aspiración del líquido amnióticoUna vez colocada correctamente la aguja, el estilete es retirado por el asistente y se conecta el adaptador Luer del soporte del Vacutainer® (fig. 6A).
Un tubo vacutainer es empujado por el asistente dentro del soporte de manera que la aguja recubierta de goma del adaptador perfore la tapa del vacutainer (fig. 6B) y así el vacío del tubo aspire el líquido y permita un autollenado sin manipulación adicional (fig. 6C). El tubo lleno se retira y uno nuevo se introduce y se llena de la misma manera (fig. 6D).
Se deben obtener unos 20ml de líquido amniótico, idealmente sin contaminación con células hemáticas maternas. Para evitarlo, antiguamente se desechaban los 2 primeros ml que se enviaban a bioquímica para la determinación de alfafetoproteína. En la actualidad se ha abandonado su determinación sistemática en todas las amniocentesis.
Si tras 2 intentos de punción uterina no se ha logrado obtener una cantidad mínima de líquido amniótico adecuada para el análisis, una nueva punción deberá demorarse hasta una semana más tarde. Si solo se obtiene 1ml, se puede recurrir a tener un resultado exclusivamente mediante una QF-PCR14.
Postobtención de líquido amnióticoDebe confirmarse la viabilidad fetal y comprobarse que no exista sangrado en el punto de entrada de la aguja en la cavidad uterina. Además, deberá verificarse el grupo sanguíneo materno, consignarse los campos de información clínica y demográfica en el formulario de solicitud de laboratorio que sean relevantes, y etiquetar o identificar bien la muestra para su estudio. Deberán dejarse bien claros a la gestante cuáles son los plazos y las vías de entrega de los resultados de los distintos estudios que se realicen en el líquido amniótico: prueba rápida (QF-PCR o FISH), cariotipo, array-CGH o estudio de alguna infección TORCH, para evitar malentendidos posteriores.
Recomendaciones posprocedimientoRecomendaciones para la gestante después del procedimiento:
- -
Administración de gammaglobulina anti-RhD (300μg) en gestantes RhD negativas.
- -
Administración de gammaglobulina anti-VHB en gestantes con HBsAg positivo: en caso de HBeAg positivo, carga viral positiva (DNA-VHB), en punción transplacentaria inevitable o amniocentesis de tercer trimestre, se administrará inmunoglobulina específica VHB posprocedimiento (600 UI IM, dosis única en las primeras 24 h).
- -
En líquidos hemáticos o punciones transplacentarias en que se realice una QF-PCR es recomendable obtener una muestra materna, enjuague bucal o sangre para remitirla al laboratorio.
- -
Reposo relativo domiciliario de 24 h. Se permitirán las actividades de cuidado personal y desplazamientos por casa, ya que el reposo absoluto está contraindicado15 (McCall). A pesar de que hay una gran presión social para aumentar el grado del reposo domiciliario, no existe ninguna evidencia científica sobre su efecto beneficioso. Signos de alarma para acudir a Urgencias son el sangrado o pérdida de líquido amniótico, dolor abdominal intenso o fiebre igual o superior a 38°C.
- -
En el periodo de una semana después de la amniocentesis es recomendable realizar un control ecográfico.
- -
Entrega de resultados: 2 días para la QF-PCR, una semana para el estudio molecular de infecciones (PCR), 2 semanas para el array-CGH y 3 semanas para el cariotipo.
En la gestación gemelar, la amniocentesis es un procedimiento seguro y efectivo que permite el diagnóstico cromosómico, molecular, bioquímico o microbiológico. El riesgo de confusión de sacos amnióticos es muy remoto, por lo que la infusión de colorante en el primer saco puncionado se ha abandonado en la actualidad, aunque debe tenerse un cuidado extremo en asignar correctamente cada muestra al feto correspondiente. Sin embargo, el riesgo de pérdida fetal podría ser el doble de la amniocentesis en gestación única16.
Existen indicaciones específicas de amniocentesis o biopsia corial en gestaciones gemelares. Debido a que los resultados de la amniocentesis se obtienen después de la semana 16, la biopsia corial debe considerarse como el procedimiento de elección para aquellas parejas con una gestación dicorial que puedan optar por una interrupción selectiva de un único gemelo afecto17. Por el contrario, en casos muy seleccionados de gestaciones monocoriales-diamnióticas con anomalía ecográfica discordante, la amniocentesis puede asegurar la obtención de 2 muestras diferentes (riesgo de gestación heterocariocítica).
En el planeamiento de la amniocentesis en gestación múltiple, es indispensable realizar un mapeado detallado de los sacos gestacionales, fetos y coriones existentes. Para evitar errores de asignación de muestras, es muy práctico, como norma general, realizar la punción del feto A en primer lugar y la del feto B en segundo lugar.
En gestaciones dicoriales se obtendrán 2 muestras mediante 2 punciones o punción uterina única, obteniéndose líquido del segundo saco amniótico a través de la punción de la membrana interamniótica18. En circunstancias excepcionales, cuando la indicación de la amniocentesis sea una malformación discordante, se puede decidir de forma individualizada junto con los progenitores, la obtención de una única muestra para disminuir el riesgo del procedimiento.
En gestaciones monocoriales, especialmente si se realiza por riesgo gestacional de aneuploidía, una punción única es suficiente19. Si está indicado obtener 2 muestras (sospecha de gestación heterocariocítica) se deberá realizar siempre doble punción uterina ya que la punción de la membrana interamniótica está contraindicada por el riesgo de septostomía.
Entrenamiento para amniocentesisLa amniocentesis genética de segundo trimestre es un procedimiento invasivo que no difiere sustancialmente de la amniocentesis de tercer trimestre para estudio de madurez fetal y de la infección intraamniótica, aunque su realización es de mayor complejidad y presenta mayores complicaciones. Debido a que la mayoría de obstetras tienen experiencia en la amniocentesis del tercer trimestre, algunos optan por realizar amniocentesis de segundo trimestre sin la supervisión o el entrenamiento necesarios.
Existen modelos que son muy útiles para el aprendizaje de los procedimientos invasivos, que ganarán importancia debido al descenso actual en el número de amniocentesis que se realizan para diagnóstico prenatal. También, se han desarrollado métodos electrónicos para iniciarse en la amniocentesis.
La formación y el mantenimiento de las habilidades adecuadas son importantes. Las habilidades para la realización de procedimientos prenatales invasivos guiados por ultrasonido superan las requeridas en la formación como especialista en Ginecología y Obstetricia según el Royal College of Obstetricians and Gynaecologists (RCOG). Para una adecuada práctica clínica, el RCOG recomienda un entrenamiento en ultrasonido en la actual subespecialidad de Medicina Materno-Fetal6.
A falta de recomendaciones en nuestro medio, no está establecido cuántas amniocentesis se deberían realizar en modelos, en gestaciones no evolutivas o durante el tercer trimestre antes de enfrentarse a una amniocentesis de segundo trimestre. Parece claro que esta decisión la ha de tomar el formador o tutor que tenga que supervisar la amniocentesis3.
Control de calidadEs conveniente monitorizar los siguientes indicadores por operador:
- -
No obtención de muestra o muestra insuficiente para un cariotipo: se debe monitorizar el centro y el laboratorio, ya que la tasa de «no resultado» debe ser inferior al 0,5%.
- -
Porcentaje de muestras con contaminación hemática.
- -
Pérdida fetal: existe un riesgo cercano al 0,5% de pérdida fetal cuando la amniocentesis se realiza por parte de un operador experimentado. Existen series que reportan un aumento de complicaciones al 1% si la punción es transplacentaria y del 1-2% si existe poco entrenamiento3, así como de riesgos inferiores al 0,01% en centros con gran experiencia.
- -
Rotura prematura de membranas: riesgo del 0,3%.
- -
Corioamnionitis: la infección intraamniótica es muy infrecuente. Sin embargo, su tiempo de incubación es corto y su progresión rápida, generalmente 24 h tras el procedimiento20. Puede evolucionar a sepsis materna y finalmente conducir a la muerte materna.
- -
La amniocentesis deberá llevarse a cabo por un operador experimentado.
- -
El procedimiento se debe realizar a partir de las 16 semanas de gestación, confirmadas por ecografía.
- -
Se debe utilizar una aguja de calibre 22 G bajo control ecográfico continuo6.
- -
La profilaxis antibiótica actualmente no está indicada21.
- -
Se deben obtener entre 10 y 20ml de líquido amniótico para un cariotipo, idealmente mediante aspiración continua con Vacutainer®.
- -
Previamente al procedimiento, la gestante debe firmar un documento de consentimiento informado, después de comentar los riesgos del procedimiento, así como la información que proporcionan los distintos estudios genéticos y sus limitaciones. La pareja debe tomar la opción que considere mejor de acuerdo con su propia evaluación y la información disponible4,6.
- -
Se deben realizar las recomendaciones posprocedimiento pertinentes, incluyéndose la profilaxis con inmunoglobulina anti-D a mujeres que son RhD negativo4,6.
Ambos autores, Miguel Parra-Saavedra y Mónica Cruz-Lemini, contribuyeron por igual a este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.