El síndrome carcinoide es una condición relativamente rara que puede afectar el hígado y el corazón derecho. En algunos pacientes se requiere tratamiento quirúrgico y un manejo multidisciplinario.
Presentación del casoPresentamos una paciente con diagnóstico de síndrome carcinoide con compromiso hepático y cardíaco, quien inició con disnea progresiva hasta el reposo, hipotensión arterial y rubor facial. La paciente fue llevada a cirugía en dos tiempos: la resección de las metástasis hepáticas inicialmente y, en un segundo tiempo, cirugía cardíaca para el cambio de la válvula tricúspide. Ambas intervenciones se realizaron con éxito y sin complicaciones.
ConclusiónPresentamos aquí una revisión del caso, la evolución y el manejo intraoperatorio y la información disponible en la literatura para decidir qué procedimiento se debe realizar en primera instancia, ya que estos casos no son frecuentes en la práctica clínica.
Carcinoid syndrome is a relatively rare condition that may affect the liver and the right heart. Some of these cases may require surgical treatment with a multidisciplinary approach.
Case reportWe report the case of a patient with progressive dyspnea, arterial hypotension and facial flushing, diagnosed with liver and cardiac involvement from carcinoid syndrome. The patient was taken to surgery in two different occasions, first for metastatic liver resection, and then to subsequent cardiac surgery for tricuspid valve replacement.
ConclusionsWe report here a case review, including the clinical course, the intra-operative management, and the information available in the literature regarding which procedure to perform initially in these types of cases which are not very common in clinical practice.
El tumor carcinoide es un tumor de comportamiento maligno que se deriva de las células del sistema neuroendocrino y tiene la capacidad de producir sustancias bioactivas, como péptidos vasoactivos y aminas. La incidencia de los tumores carcinoides es cercana a un caso en 100.000 personas, de los cuales el 50% aproximadamente desarrollarán el síndrome carcinoide1,2. Sin embargo, en un reporte más reciente se encontró una incidencia mucho mayor, de 3,65 casos por cada 100.0003.
Las localizaciones más comunes de los tumores carcinoides son el tracto gastrointestinal (67,5%) y el pulmón (25,3%). En el tracto gastrointestinal, los sitios más frecuentemente afectados son el intestino delgado, el recto y el estómago4.
Las hormonas vasoactivas secretadas por el tumor producen lo que se denomina «síndrome carcinoide», y los síntomas más comúnmente descritos son rubor facial, hipotensión arterial, diarrea, prurito y broncoespasmo. Estas sustancias vasoactivas incluyen: serotonina, 5-hidroxitriptamina, 5-hidroxitriptófano, calicreínas, histamina, prostaglandinas, hormona adrenocorticotrópica, insulina, catecolaminas, paratohormona, gonadotropinas y sustancia P, entre otras5.
Una vez que la pared intestinal es infiltrada por el tumor carcinoide, las células tumorales pueden extenderse más allá de esta y se propagan por el sistema linfático y vascular. Las células tumorales alcanzan el hígado través de la circulación portal y se disminuye así la capacidad hepática para metabolizar los productos derivados de estos tumores. Al implantarse las células tumorales en el hígado, sus productos humorales pueden afectar al corazón derecho a través de la vena cava inferior5. La estenosis pulmonar y la insuficiencia tricúspide son, por lo general, las afecciones cardíacas predominantes en este síndrome.
El manejo farmacológico actual del síndrome carcinoide incluye el uso de análogos de la somatostatina, como el octreotide y el lanreotide; en algunas ocasiones altas dosis de octreotide son requeridas para un adecuado control de los síntomas6.
El tratamiento quirúrgico del corazón está indicado cuando el paciente desarrolla insuficiencia cardíaca, específicamente falla del ventrículo derecho, y/o cuando hay una disfunción valvular grave7. La cirugía cardíaca ofrece un tratamiento definitivo a estos pacientes y ha reducido de una forma importante la mortalidad asociada a esta entidad en las dos últimas décadas8,9.
En la literatura médica hay descritos unos pocos casos de tratamiento quirúrgico de las metástasis hepáticas y de la enfermedad cardiaca por el síndrome carcinoide10,11. En este reporte de caso se describe el tratamiento quirúrgico de la enfermedad metastásica del tumor carcinoide en dos etapas: la resección hepática en un primer tiempo quirúrgico y, posteriormente, el reemplazo de la válvula tricúspide.
Caso clínicoLa paciente otorgó su consentimiento firmado para la discusión y publicación del caso.
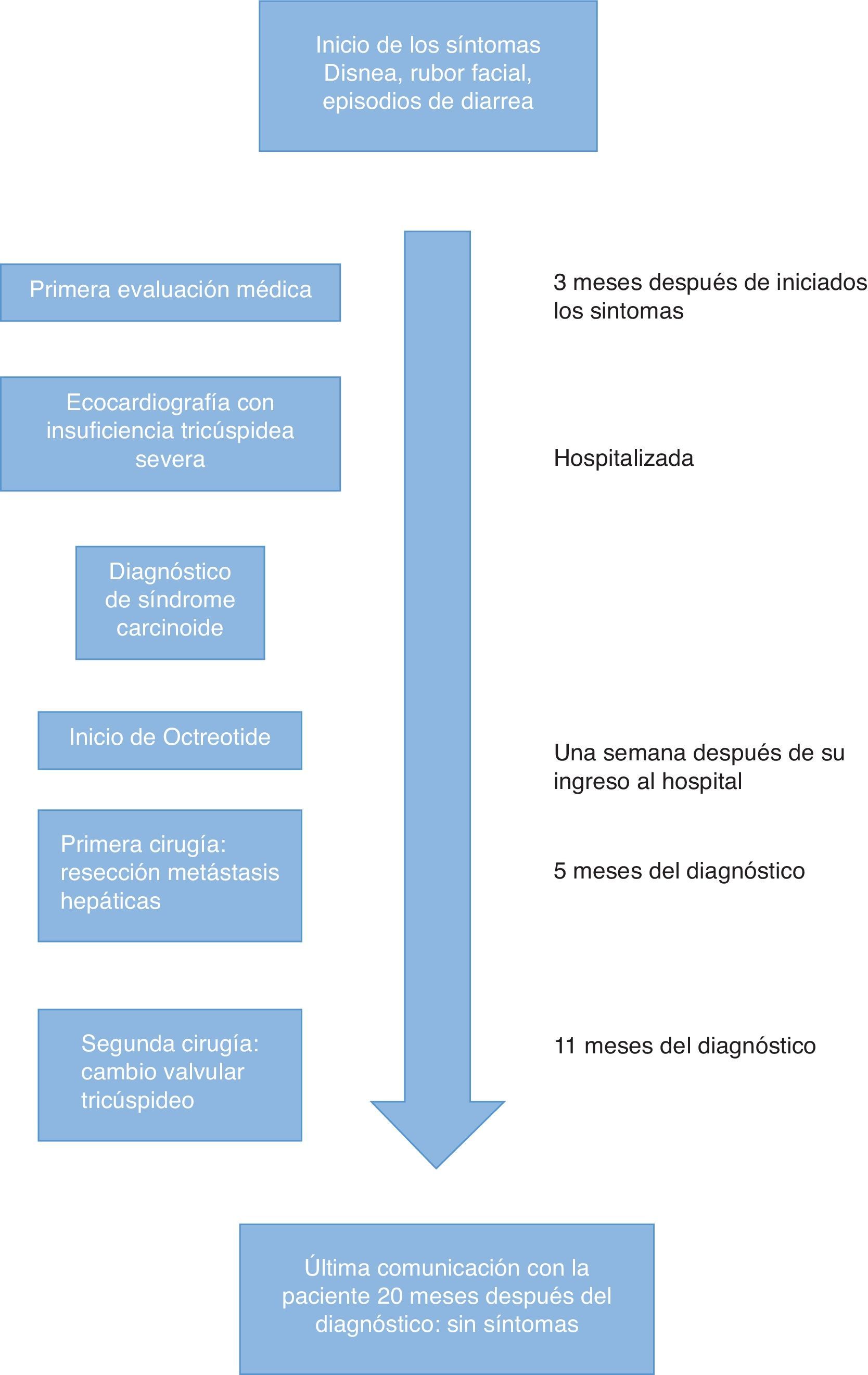
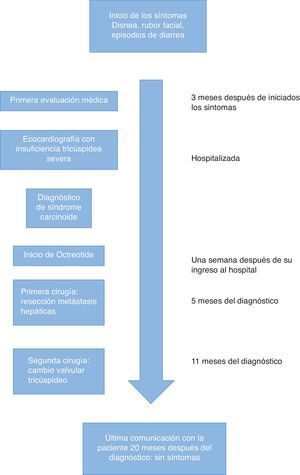
La paciente es una mujer de 54 años quien se presentó a consulta con disnea progresiva hasta el reposo asociada a episodios súbitos de calor, diarrea, tos y enrojecimiento facial que se iniciaron cinco meses atrás. Su historia clínica carecía de antecedentes de importancia y su historia quirúrgica incluía apendicectomía y colecistectomía realizadas hace más de diez años; dichas cirugías habían sido llevadas a cabo sin ninguna complicación anestésica o quirúrgica.
La paciente fue ingresada al hospital para el estudio de sus síntomas, ya que durante el examen físico inicial se encontraba disneica y se le auscultó un soplo holosistólico grado 4/4.
En la ecocardiografía transtorácica inicial, la fracción de eyección del ventrículo izquierdo (FEVI) fue del 60%, la función del ventrículo derecho era normal, pero se encontraba significativamente dilatado, con una regurgitación tricuspídea severa asociada a una insuficiencia pulmonar moderada y una estenosis pulmonar leve. El cateterismo cardíaco reveló arterias coronarias normales. Las presiones arteriales pulmonares eran normales y solo se encontró una elevación moderada de la presión en la vena cava inferior y la aurícula derecha (25mmHg) debido a la regurgitación tricúspide y un aumento de la presión telediastólica del ventrículo derecho (35/18mmHg), muy probablemente debido a insuficiencia de la válvula pulmonar.
La tomografía de abdomen evidenció una masa hepática de 14cm de diámetro comprometiendo los segmentosii y iva y otras lesiones hepáticas de menor tamaño; las lesiones dominantes se encontraban en los segmentos hepáticosi, ii, vii, viii yx. No se describió la presencia de hipertensión portal ni se describió el estado de la vena cava inferior.
También se encontró una tumoración a 1,7cm de la válvula ileocecal, que presumiblemente era la lesión tumoral primaria, la cual desapareció con el uso de análogos de la somatostatina y no requirió resección quirúrgica. Estos hallazgos, junto con los niveles urinarios de ácido 5-hidroxiindolacético (derivado del metabolismo de la 5 hidroxitriptamina) mayores de 500nanogramos en 24h confirmaron el diagnóstico de síndrome carcinoide.
Tras el diagnóstico, la paciente inició tratamiento con octreotide (Sandostatin Novartis, Basilea, Suiza) 30mg i.m. cada 28días, y cuatro meses antes de cirugía se realizó una quimio-embolización transarterial preoperatoria de las principales metástasis hepáticas del tumor carcinoide buscando la reducción de su tamaño antes de la resección quirúrgica.
Después de 12meses de iniciado el tratamiento y con una mejoría evidente de los síntomas, el caso se lleva a discusión para definir el orden de los procedimientos. Se decide entonces realizar inicialmente la hepatectomía para evitar el daño que pudiera producirse al reemplazo valvular tricúspide proveniente de las metástasis hepáticas, hasta el momento en que estas fueran resecadas. La paciente fue llevada a cirugía hepática, donde se realizó una lobectomía hepática derecha parcial, con la escisión en cuña del segmentoii yiva.
Se administraron 500microgramos de octreotide por vía subcutánea a su llegada a la zona de preparación quirúrgica.
La inducción anestésica se realizó con fentanilo 2μg/kg, propofol 1,5mg/kg y cisatracurio 10mg; la intubación orotraqueal no tuvo dificultad. Se canalizó la arteria radial con un catéter 20G y la vena yugular interna derecha con un introductor de Swan-Ganz 9 French (Arrow-Teleflex corp. Morrisville, NC EE.UU.) guiado por ecografía. La anestesia se mantuvo con una mezcla de oxígeno y aire con sevoflurano a una concentración espirada entre 1,5 y 2,5% (Baxter Health Care Deerfield, Il, EE.UU.).
Se realizó clampaje de la arteria hepática y vena porta a nivel del ligamento hepatoduodenal, seguido de clampaje de la vena cava inferior, lo cual no fue bien tolerado por la paciente, con una disminución casi inmediata de la presión arterial y del gasto cardíaco. Por esta razón se decidió realizar una derivación veno-venosa femoro-yugular (sin oclusión de la vena cava inferior) con un flujo entre 0,5 a 2,3l/min y que fue utilizada durante 80min. La canulación de la vena femoral y la vena yugular interna se realizó con una cánula de perfusión arterial de 16Fr (Edwards Lifescience OptiSite, Irvine, CA, EE.UU.). La canulación yugular fue realizada por el anestesiólogo (doble canulación de la vena yugular interna derecha guiadas por ultrasonido) y la canulación femoral, por el equipo quirúrgico y de perfusión. El activated clothing time (ACT) basal fue de 121s y se mantuvo alrededor de los 350s con el uso de heparina intravenosa. La anticoagulación en este paciente fue manejada de acuerdo con el protocolo de anticoagulación para circulación extracorpórea de la institución.
La presión venosa central se mantuvo cerca de los 25mmHg, la presión arterial media fue sostenida entre 60 y 70mmHg mediante el uso de cristaloides y coloides (albúmina al 5%), hemoderivados y vasopresores.
El sangrado intraoperatorio fue de 5l aproximadamente y la paciente recibió 6unidades de glóbulos rojos, 4 unidades de plasma fresco congelado y dos dosis (500ml) de albúmina humana recombinante. La paciente fue trasladada a la unidad de cuidados intensivos (UCI) estable, con una infusión de noradrenalina a dosis bajas. En el postoperatorio se presentaron derrames pleurales bilaterales, más significativamente en el lado derecho, que fueron evacuados con sondas a tórax. La paciente se mantuvo en la UCI hasta el décimo día postoperatorio y fue dada de alta del hospital el día decimoquinto.
El reporte de las lesiones hepáticas evidenció abundante material necrótico y la presencia de células argentafines, confirmando el diagnóstico de tumor carcinoide.
A los cuatro meses de la cirugía hepática se realizó una nueva ecocardiografía transtorácica, que mostró anomalías triviales de la válvula pulmonar y una menor dilatación del ventrículo derecho, pero manteniéndose el mismo grado de insuficiencia tricúspide severa. El tratamiento con octreotide se mantuvo durante esos meses y la paciente mejoró casi completamente de los síntomas.
Seis meses después de la resección hepática, la paciente fue llevada de nuevo al quirófano para realizarle un cambio de la válvula tricúspide. La inducción anestésica se realizó con midazolam 5mg, fentanilo 500μg, propofol 60mg y rocuronio 100mg. Se inició una infusión de ácido tranexámico de 1g/h y de octreotide a 500μg/h. La monitorización invasiva incluyó una línea arterial y un catéter central con diámetro de 9Fr (Arrow-Teleflex corp. Morrisville, NC, EE.UU.) guiado por ecografía en la vena yugular interna derecha. El mantenimiento anestésico se realizó con una mezcla de oxígeno y de aire más sevoflurano a una concentración espirada entre 1,5 y 2,5%. Durante la cirugía se introdujo la sonda de ecocardiografía transesofágica, cuya evaluación no mostró hallazgos diferentes a los de la ecocardiografía transtorácica anteriormente realizada, incluyendo la dilatación del ventrículo derecho sin alteración funcional con una tricuspid annular plane systolic excursion (TAPSE) mayor de 20mm y un diámetro de la válvula tricúspide de 36mm. La circulación extracorpórea se realizó sin complicaciones, con una duración de 69min y con 39min de pinzamiento aórtico. La válvula tricúspide fue sustituida por una bioprótesis porcina No. 29mm (Medtronic, Minneapolis, EE.UU.). No hubo complicaciones mayores durante la cirugía y no fue necesario el uso de productos sanguíneos o fármacos vasopresores. Luego de terminado el reemplazo valvular, la paciente fue trasladada a la UCI sin complicaciones.
A los doce meses de seguimiento la paciente no refería síntomas cardiacos o relacionados con el síndrome carcinoide ni había niveles detectables de 5-HIAA en la orina de la paciente a esa fecha (fig. 1).
DiscusiónEl tumor carcinoide es un tumor neuroendocrino de crecimiento lento, con una incidencia baja en la población general y con una evolución clínica impredecible. La incidencia de estos tumores ha aumentado sustancialmente en la última década debido a la disponibilidad de mejores y más rápidas herramientas para su diagnóstico3.
Las metástasis hepáticas están presentes en el 50 al 70% de los casos, de los cuales el 20% desarrollarán síndrome carcinoide; de estos pacientes con síndrome carcinoide, el 50% tendrán manifestaciones cardiacas12.
Una vez afectado el hígado, el compromiso del corazón derecho es el siguiente paso de la enfermedad. El mecanismo por el cual se forman placas fibrosas en las cavidades derechas del corazón, endocardio, válvulas y aparato subvalvular no se conoce hasta ahora con exactitud, pero podría estar relacionado con la influencia de ciertos factores del crecimiento liberados por este tipo de tumor que favorecen la aparición de tejido fibroso en el endocardio5.
El síndrome carcinoide compromete el corazón derecho en la gran mayoría de los casos, siendo la válvula pulmonar y tricúspide las más afectadas13 por la formación de depósitos de tejido fibroso en el endocardio derecho. El compromiso del corazón izquierdo, aunque poco común, puede ser también visto en casos de tumor carcinoide de origen broncogénico14 o en pacientes con foramen oval permeable15. El tabique interventricular también puede verse comprometido como una manifestación inusual de esta enfermedad16.
Las indicaciones para el tratamiento quirúrgico de la enfermedad cardiaca causada por el síndrome carcinoide son la insuficiencia cardiaca y/o la disfunción valvular tricúspide severa. Por lo general, los pacientes con compromiso cardíaco y hepático se llevan inicialmente al reemplazo de la válvula tricúspide con el fin de disminuir las presiones elevadas en el ventrículo derecho y en la vena cava inferior, disminuyendo la congestión venosa hepática y reduciendo así el riesgo de sangrado, difícilmente controlable, en el caso de una hepatectomía parcial17. Las presiones altas en el corazón derecho aumentan el riesgo de hemorragia durante una hepatectomía, según lo informado por Dobson et al.18.
En el caso que presentamos, la paciente fue llevada inicialmente a una hepatectomía parcial, a pesar de haberse confirmado un aumento de las presiones en la vena cava superior y el ventrículo derecho durante el primer cateterismo cardiaco. La decisión de realizar inicialmente la cirugía hepática fue tomada por un equipo multidisciplinario (cirujano cardiaco, cirujano hepatobiliar, anestesiólogo de trasplantes, anestesiólogo cardiovascular), basada en el temor de los cirujanos cardiovasculares de empeorar el compromiso valvular tricuspídeo por las metástasis hepáticas, además de los severos síntomas presentados por la paciente debido al síndrome carcinoide. En un primer momento, la resección de las metástasis hepáticas puede ayudar a la reducción de los niveles de hormonas y sustancias vasoactivas, que conduce a una disminución o incluso a la desaparición de los síntomas asociados al tumor carcinoide y, por lo tanto, a un manejo perioperatorio menos proclive a complicaciones durante la segunda intervención, como la aparición de una crisis carcinoide.
La implementación de un bypass veno-venoso para este tipo de cirugías y en trasplante hepático ha sido previamente descrita11,19. La hemorragia de difícil control durante la hepatectomía puede manejarse de forma exitosa con el uso de este tipo de técnicas de derivación del flujo sanguíneo venoso. El objetivo del bypass veno-venoso es la derivación del flujo hacia la aurícula derecha y mejorar el retorno venoso; en es te caso se utilizó porque la paciente no toleró el clampaje temporal de la vena cava inferior, presentando marcada inestabilidad hemodinámica. El flujo mantenido durante el bypass veno-venoso osciló entre 0,5 a 2,3; esta gran variación puede atribuirse al sangrado intraoperatorio y a la subsecuente hipovolemia. Los datos de flujo fueron tomados de la hoja de perfusión. La variación del flujo puede deberse a factores como la hemorragia masiva u otros factores no especificados en este caso. Las altas presiones en la aurícula derecha también pueden haber influido en la aparición del sangrado masivo intraoperatorio.
Los retos más importantes durante la anestesia en una cirugía por tumor carcinoide son la aparición de una crisis carcinoide y el desarrollo de insuficiencia cardíaca derecha durante el procedimiento20. La crisis carcinoide se manifiesta con hipotensión arterial, rubor generalizado y aumento de las presiones en la vía aérea. El tratamiento de las crisis carcinoides comienza con evitar del uso de medicamentos que puedan causar la liberación de histamina, tales como los opioides de acción larga (morfina y meperidina) o relajantes musculares (rocuronio, vecuronio). La hipotensión arterial debe ser tratada con la reposición de volumen guiada idealmente por indicadores dinámicos y el uso de fármacos inotrópicos o vasopresores como la fenilefrina y la noradrenalina, que están indicados para mantener una adecuada presión de perfusión en los órganos vitales, contrarrestando la vasodilatación que producen la mayoría de péptidos secretados por esta clase de tumor. El octreotide es la mejor opción que existe en la actualidad para prevenir y tratar las crisis relacionadas con el tumor carcinoide, y su uso —a veces en altas dosis— es necesario en este tipo de intervenciones.
ConclusiónEl síndrome carcinoide es una enfermedad poco común que involucra el corazón en algunos casos, principalmente las válvulas del lado derecho. Produce cambios fisiopatológicos importantes que pueden suponer un reto para el manejo anestésico tanto en la cirugía hepática como en la cardíaca.
El anestesiólogo debe conocer y estar preparado para manejar estos casos haciendo uso de fármacos que incluyen el octreotide, vasopresores e inotrópicos.
Definir la severidad de la enfermedad y el compromiso hepático, así como la presencia y el grado de afectación de las válvulas cardiacas y de la función ventricular, son pasos muy importantes en la planeación y preparación del caso, así como la utilización de herramientas de circulación extracorpórea y bypass veno-venoso que pueden ser de gran utilidad en el manejo perioperatorio de esta enfermedad poco frecuente pero de una gran complejidad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLos autores declaran no haber recibido financiamiento para la elaboración de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.