En los neonatos existen diferencias significativas de desarrollo en la fisiología y la farmacología que hacen que sea mucho más difícil llevar a cabo una anestesia segura.
ObjetivosCompletar una revisión focalizada del conocimiento actual sobre las diferencias fisiológicas y farmacológicas observadas en recién nacidos que tienen un impacto en la administración segura de la anestesia.
MétodosSe llevó a cabo una revisión selectiva de la literatura sobre cambios en el desarrollo fisiológico y farmacológico.
ResultadosEl conocimiento adquirido en esta revisión fue usado para establecer principios comunes para la administración segura de la anestesia en pacientes recién nacidos.
ConclusiónA pesar de la persistencia de grandes lagunas en nuestro conocimiento en esta fisiología y farmacología, los principios modernos y comunes del manejo de la anestesia en cirugía neonatal han mejorado significativamente los resultados clínicos.
There are significant developmental differences in physiology and pharmacology in neonates that make the conduct of a safe anesthetic much more challenging in a neonate.
ObjectivesComplete a focused review of the current knowledge of the physiological and pharmacologic differences seen in newborns that impact the safe administration of anesthesia.
MethodsA selective review of literature in developmental changes in physiology and pharmacology was completed.
ResultsThis knowledge acquired in the review was used to establish common principles for the safe administration of anesthesia to newborn patients.
ConclusionIn spite of the persistence of large gaps in our knowledge in this physiology and pharmacology, common modern anesthetic management principles for neonatal surgery have significantly improved clinical outcomes.
Una de las tareas más difíciles que un anestesiólogo puede enfrentar es la de proveer una anestesia segura y eficaz para cirugía en un recién nacido. La anestesia neonatal exige una profunda comprensión sobre la fisiología y la patología rápidamente cambiantes del neonato, así como de la farmacocinética y la farmacodinámica de los medicamentos usados para proporcionar la anestesia. Luego, este conocimiento debe ser incorporado a un plan de cuidado anestésico bien programado. Asimismo, son esenciales una gran habilidad manual y experiencia continua con los desafíos únicos que representan los neonatos para obtener óptimos resultados clínicos con estos pacientes vulnerables. Esta revisión selectiva tiene como objetivo proporcionar un breve resumen de los aspectos teóricos de la anestesia neonatal y presentar algunas directrices prácticas de cuidado para esta población de pacientes.
Fisiología del neonatoEl sistema respiratorio tiene que someterse a cambios fisiológicos importantes en su funcionamiento en segundos durante la transición del ambiente fetal al neonatal. Para facilitar el paso a través del canal del parto, la pared torácica (caja torácica) del neonato es flexible, con poca calcificación de los huesos1. En contraste, los pulmones de los recién nacidos están llenos de alvéolos inmaduros que contienen poca elastina, lo que los hace rígidos y difíciles de inflar2. Esta combinación de una pared torácica flexible con pulmones rígidos incrementa el volumen de cierre de pulmón y promueve el colapso pulmonar3. Cuando se normaliza por el peso corporal, la capacidad funcional residual es relativamente constante desde el nacimiento hasta la edad adulta4. Los neonatos que respiran espontáneamente compensarán dinámicamente su mecánica respiratoria inmadura con respiración rápida sin pausa espiratoria y aire espiratorio saliendo a través de la laringe5. Para superar estos desafíos de desarrollo en condiciones pasivas, los anestesiólogos pediátricos reclutan alvéolos después de cada breve periodo de apnea y usan presión positiva al final de la expiración (PEEP) al ventilar de forma mecánica a un neonato para mantener el volumen pulmonar normal.
A pesar de tener capacidades funcionales residuales equivalentes, los neonatos se desaturan rápidamente con apnea incluso con preoxigenación eficaz con 100% de oxígeno inspirado6. Esto se debe principalmente a una duplicación en la tasa de consumo de oxígeno cuando se normaliza por el peso corporal en comparación con un adulto7. Para compensar este alto consumo de oxígeno, los neonatos tienen 2 veces la ventilación alveolar de un adulto. Los anestesiólogos pediátricos habitualmente aprovechan esto durante la inducción inhalatoria de la anestesia, en la cual el rápido lavado de anestésicos conlleva una inducción más rápida de la anestesia en los jóvenes en comparación con los adultos8.
Los anestesiólogos también deben comprender que los neonatos son respiradores nasales obligados y experimentan más fácilmente obstrucción de la vía aérea bajo anestesia debido a su lengua relativamente más grande y sus vías respiratorias de tejido blando más compatible (plegable)9. De manera similar, con los recién nacidos los médicos se dan cuenta de la importancia del diámetro de la vía aérea artificial, porque la resistencia de la vía aérea aumenta en la cuarta potencia cuando el radio disminuye10.
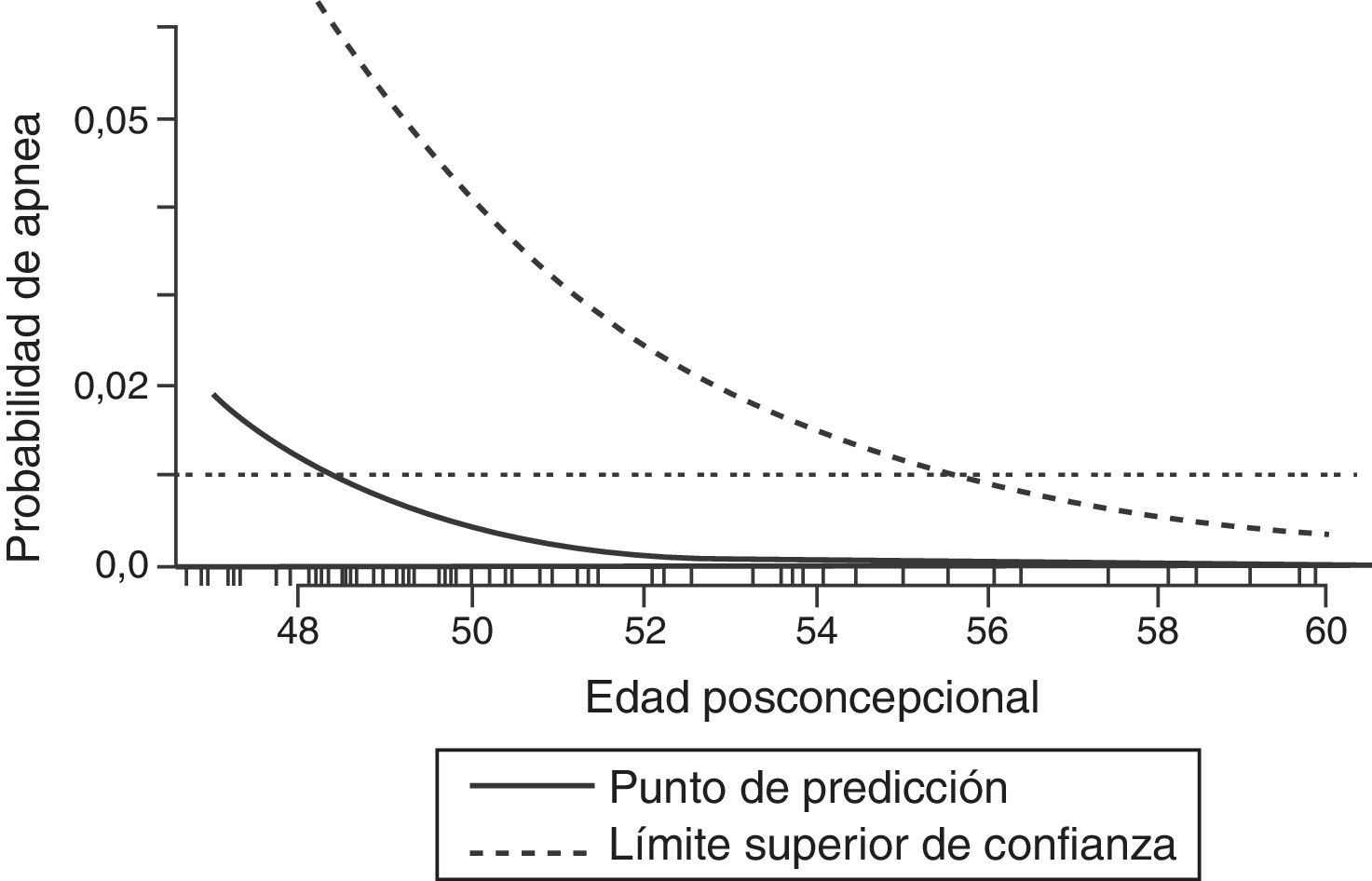
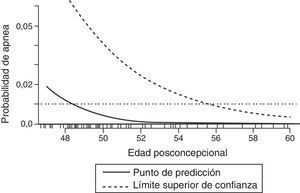
Durante el periodo neonatal el control de la respiración varía significativamente del observado en niños mayores y adultos. El aumento de la ventilación a la hipercapnia es menor en un neonato comparado con un adulto; sin embargo, la respuesta a la hipoxemia se diferencia drásticamente. Mientras que un adulto presenta un aumento sostenido de ventilación cuando está expuesto a la hipoxia, los neonatos muestran un aumento breve seguido por una depresión sostenida de la actividad ventilatoria cuando están expuestos a la hipoxemia11. Es probable que la inmadurez de los centros respiratorios en el sistema nervioso central de los neonatos sea responsable, en parte, por el efecto pronunciado que los anestésicos tienen en esta población. En la única revisión sistemática publicada de estudios que evalúen la apnea perioperatoria en esta población, la anestesia general aumentó el riesgo de apnea postoperatoria en infantes prematuros de menos de 60semanas de edad posconcepcional12. Este riesgo aumenta aún más por anemia (hematocrito <30%). Incluso a las 56 semanas posconcepcionales el riesgo de apnea postoperatoria se mantiene en aproximadamente el 1% (fig. 1); por tanto, la mayoría de los libros de texto y de líderes en el campo de la anestesia pediátrica recomiendan que los pacientes por debajo de este umbral deban ser admitidos en el hospital para ser monitoreados de 12 a 24h13.
Predicción de probabilidad de apnea por semanas posconcepcionales (línea continua) con 95% límite superior de confianza (línea discontinua). El 1% de riesgo de apnea posoperatoria alcanza el 95% de confianza aproximadamente a las 56 semanas de edad posconcepcional.
Fuente: reproducido con autorización de Coté et al.12.
Después del nacimiento, el sistema circulatorio experimenta cambios drásticos. Deja de ser un sistema de circulación fetal en paralelo donde ambos ventrículos bombean la mayor parte de su producción en la circulación del sistema para convertirse en un sistema de circulación extrauterina en serie, con los ventrículos derecho e izquierdo asumiendo la responsabilidad por la circulación sistémica y pulmonar, respectivamente14. Asimismo, los 3 cortocircuitos fetales (foramen oval, conducto venoso y conducto arterioso) dejarán de funcionar en el periodo posnatal temprano.
Ciertas afecciones neonatales (es decir, asfixia al nacer, aspiración de meconio, septicemia y hernia diafragmática congénita) pueden impedir que se produzca esta transición normal en la circulación debido a la elevación persistente en la resistencia vascular pulmonar y en la presión sanguínea. Esta circulación fetal persistente, también conocida como hipertensión pulmonar persistente neonatal, se caracteriza por una hipoxia profunda ocasionada por la derivación de derecha a izquierda a través de los cortocircuitos extrapulmonares fetales combinados con isquemia ventricular derecha y compromiso circulatorio15. El tratamiento convencional para esta condición incluye intubación traqueal y ventilación mecánica para restaurar el volumen pulmonar normal sin distención excesiva. También incluye la corrección de la acidosis metabólica, la inducción de la alcalosis leve a través de la hiperventilación, la restauración del volumen circulatorio y el soporte inotrópico. Durante la última década, la vasodilatación pulmonar selectiva por medio de la inhalación de óxido nítrico (INO) se ha convertido en uno de los tratamientos principales para la hipertensión pulmonar persistente neonatal16. El rango de dosis eficaz parece estar entre 1 y 30 partes por millón (ppm). La interrupción brusca de la INO puede resultar en un rebote repentino y severo de hipertensión pulmonar, y por esta razón debe ser destetada gradualmente una vez haya sido iniciada. En los pacientes que no respondieron a la INO, el uso a corto plazo de un soporte vital extracorpóreo por varios días ha demostrado lograr una supervivencia del 90% en pacientes con una mortalidad estimada del 50%17.
El miocito cardiaco neonatal contiene más elementos no contráctiles, una disposición intracelular desorganizada de las proteínas contráctiles y es menos alargado que en el adulto18. Esto conduce a una reducción en la capacidad de generación de fuerza del miocardio neonatal. Adicionalmente, el retículo sarcoplasmático y el sistema tubularT también son inmaduros, lo que lleva a una mayor dependencia del calcio extracelular para la contracción19. Cambios de desarrollo en el citoesqueleto y en la matriz extracelular hacen al miocardio neonatal menos compatible con un llenado diastólico temprano y tardío reducido en comparación con los adultos20. La inervación parasimpática del corazón del recién nacido se considera más madura en comparación con el sistema simpático, lo que conduce a una reducción en la frecuencia cardiaca con estimulación. Mientras que las frecuencias cardiacas lentas pueden reducir el gasto cardiaco, la frecuencia cardiaca rápida del neonato también puede limitar el llenado diastólico y el volumen sistólico. Luego de optimizar las presiones de llenado mediante la administración de la solución cristaloide, una frecuencia cardiaca entre 120 y 180 latidos por minuto debería ser el objetivo para los neonatos.
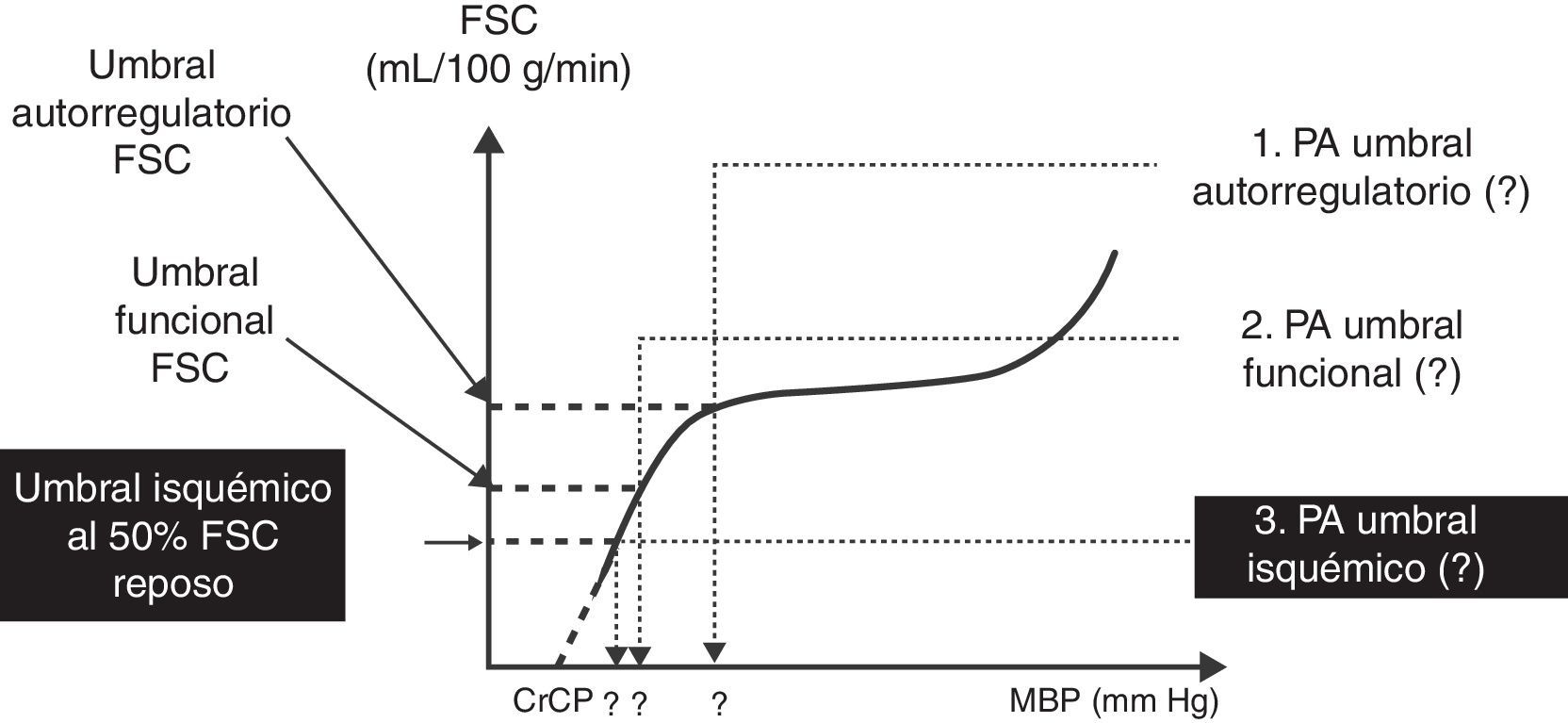
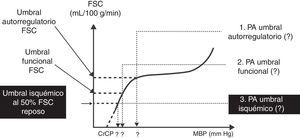
El sistema nervioso central no está desarrollado por completo al momento del nacimiento. No obstante, las vías del dolor están integradas con los cambios somáticos, neuroendocrinos y autonómicos desde un momento temprano en la gestación. Las respuestas hormonales al dolor y al estrés pueden ser exageradas en los recién nacidos21, aunque la importancia clínica de este aspecto aún no ha sido definida. Estudios recientes sugieren que las respuestas del flujo sanguíneo cerebral al oxígeno y al dióxido de carbono, así como a la autorregulación del flujo sanguíneo, están presentes en los recién nacidos22,23; sin embargo, el rango de autorregulación es limitado y está muy cerca de los límites de la presión arterial normal (fig. 2). El umbral inferior de la autorregulación sigue siendo incierto. Aunque se ha notado una asociación entre la incidencia de hemorragia intraventricular y las fluctuaciones en la presión arterial24, aún no se ha confirmado una relación causal.
Dibujo esquemático de la relación flujo de sangre/presión media arterial del flujo sanguíneo cerebral (FSC) normal en el recién nacido prematuro. La parte plana representa el nivel de autorregulación. El umbral más bajo de autorregulación de presión arterial es de 30mmHg o menos.
Fuente: reproducido con autorización de Cayabyab et al.23.
La inmadurez del sistema nervioso central también contribuye al desarrollo de la retinopatía del prematuro (ROP). Esta condición se inicia como estrechamiento vascular retiniano y obliteración seguida por neovascularización, hemorragia y, en los casos más severos, desprendimiento de retina y ceguera. Los infantes que sufren ROP requieren con frecuencia anestésicos para la exploración ocular y un potencial tratamiento láser para la hemorragia y el desprendimiento de retina. Aunque es probable que la etiología de la ROP sea multifactorial25, la toxicidad del oxígeno (tal vez resultado de la exposición a corto plazo durante procedimientos quirúrgicos breves) contribuye a esta complicación común en la prematuridad.
La termorregulación en el neonato difiere considerablemente en comparación con los niños mayores y los adultos. La pérdida de calor se ve favorecida por la relación comparativamente más grande de superficie corporal/peso corporal, los tejidos subcutáneos aislantes poco desarrollados y la inhabilidad para usar la termogénesis con temblor. Estas limitaciones se ven compensadas parcialmente por la capacidad térmica única de termogénesis sin temblor a través de la grasa marrón. Tanto los anestésicos volátiles como los intravenosos han mostrado inhibir la termogénesis sin temblor26,27, lo que potencialmente contribuye a la pérdida de calor en el periodo perioperatorio. La hipotermia puede reducir el metabolismo de los medicamentos, retardar el despertar de la anestesia y someter al neonato a estrés cardiovascular. Resulta beneficioso mantener un ambiente térmico neutro (36-37°C) a través del calentamiento de la sala de operaciones, el uso de calentadores radiantes, calentadores de aire y de fluidos intravenosos y de irrigación calentados28.
El agua corporal total es significativamente mayor en el neonato pretérmino (>80%) y a término (75%) si se compara con un adulto (60%)29. El agua extracelular representa más del 50% del peso corporal de un infante prematuro. De forma similar, el volumen de la sangre es más alto en infantes prematuros (90-100ml/kg) que en neonatos a término (85ml/kg) en comparación con adultos30. El requerimiento de fluidos aumenta en los primeros días de vida (60, 80, 100, 120ml/kg/día en el día 1, 2, 3 y 4, respectivamente) y luego se mantiene estable en lo que resta del periodo neonatal (aproximadamente 150ml/kg/día)31. La tasa de filtración glomerular es baja en el infante a término y luego se duplica en las 2 primeras semanas de vida; sin embargo, no alcanza los niveles normales de un adulto hasta los 2 años de edad32. Las reservas de glucógeno se desarrollan en las últimas semanas de gestación. Por tanto, los infantes prematuros son susceptibles a la hipoglucemia si están privados de una fuente de administración continua de glucosa33.
Farmacología del desarrolloLas vías de eliminación más importantes a través de las cuales los fármacos y sus metabolitos dejan el cuerpo son los sistemas hepatobiliar, renal y respiratorio, los cuales experimentan una maduración significativa después del nacimiento34. El aclaramiento hepatobiliar mediante las isoenzimas P450 está presente en el neonato a término y alcanza aproximadamente el 85% de los niveles adultos a las 44 semanas de edad gestacional corregida35. La unión de la proteína a la albúmina y a la α1-glucoproteína ácida se reduce en neonatos debido a las concentraciones más bajas de estas proteínas en el suero36. Esta unión de proteínas más baja conlleva a cantidades más grandes de fármaco libre (no unido), lo que potencia el riesgo de efectos secundarios adversos en neonatos (particularmente los anestésicos locales)37. Estas proteínas alcanzan concentraciones de adulto aproximadamente a los 6meses de edad.
La eliminación renal de fármacos y sus metabolitos está determinada por la filtración glomerular, la secreción tubular y la reabsorción tubular. La tasa de filtración glomerular alcanza el 10% de su valor maduro a las 25semanas, el 35% a término y el 90% del valor de adulto al año de edad32. Esta reducción tiene implicaciones significativas en los intervalos de dosificación de fármacos eliminados principalmente a través del aclaramiento renal (es decir, aminoglucósidos). Los mismos factores que determinan la absorción anestésica por vía pulmonar (la ventilación alveolar, la capacidad funcional residual, el gasto cardiaco y la solubilidad sangre/gas) también contribuyen a su cinética de eliminación.
Las variables farmacocinéticas importantes para los anestesiólogos son conocidas. El aclaramiento es la más importante, pues determina la dosis de mantenimiento o la velocidad de infusión de los fármacos. El volumen de distribución (VD) tiene una importancia relativamente menor excepto en relación con las dosis de carga. Estos parámetros determinan la forma de la curva tiempo-concentración. Las 3 fuentes principales de variabilidad farmacocinética en neonatos han sido identificadas (tamaño, edad y función de órgano)38. El tamaño es la covariable más común usada para determinar la dosis en niños, a pesar de que la variación normal en peso con relación a la edad es grande. El tamaño, por sí solo, es insuficiente para predecir aclaramiento en neonatos e infantes, por lo que se requiere adicionar un efecto de maduración (edad). La causa del aclaramiento más lento del fármaco, observado en los recién nacidos, no se limita solo a los cambios normales del desarrollo en la función orgánica hepática o renal; la función del órgano comprometido debido a una enfermedad crítica también juega un papel significativo en la desaceleración del aclaramiento del fármaco en neonatos39.
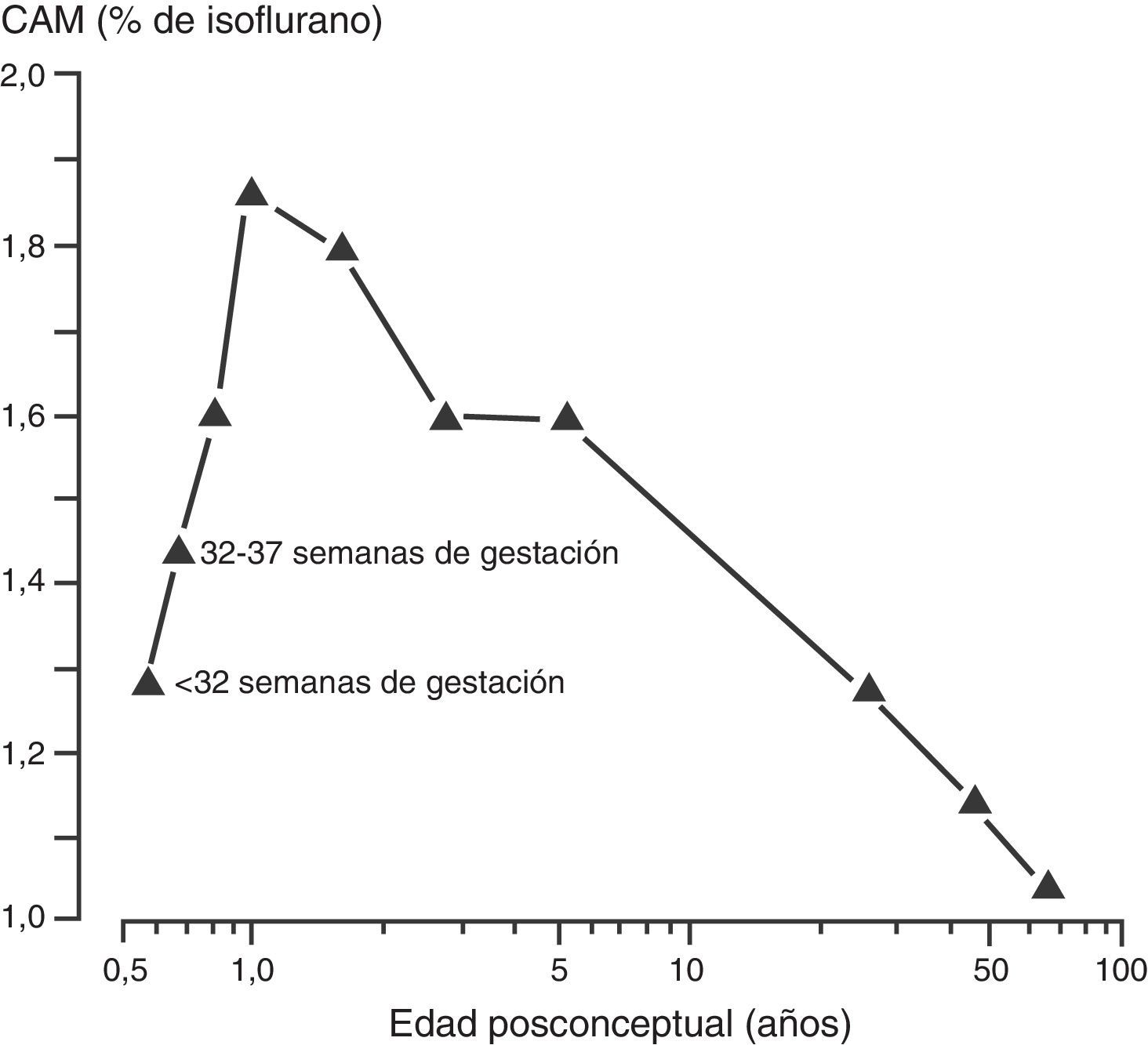
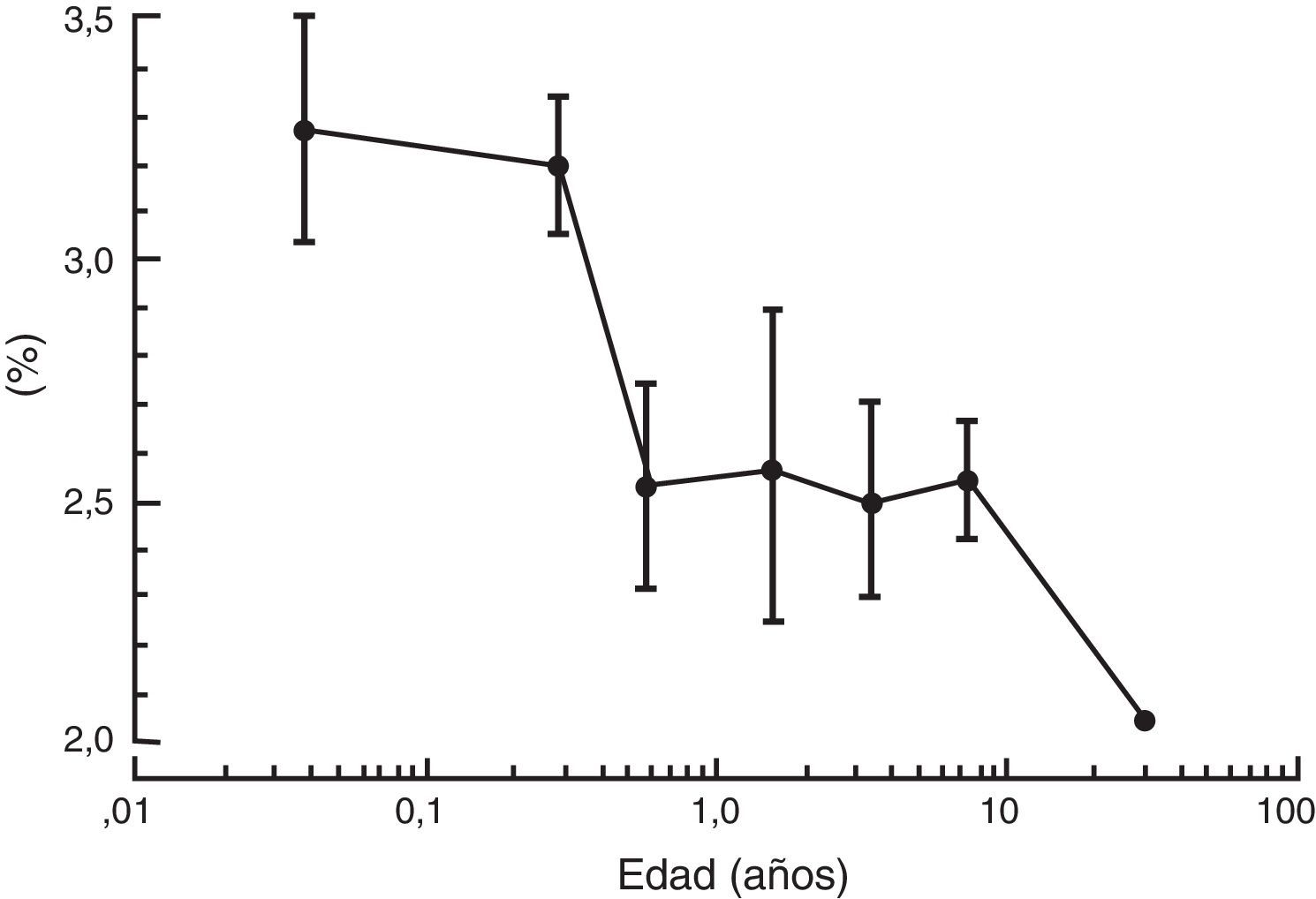
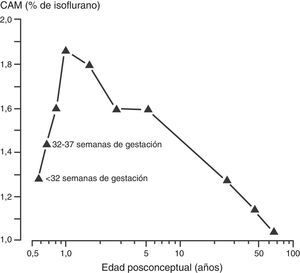
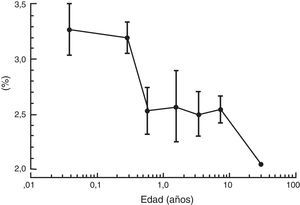
Como se describió anteriormente, el aumento en la tasa metabólica (es decir, el consumo de oxígeno) conduce a un aumento en la ventilación alveolar y en la absorción del anestésico volátil en neonatos en comparación con los adultos. Además, un porcentaje mayor del gasto cardiaco es suministrado a órganos ricos en vasos (el cerebro y otros órganos vitales) y la solubilidad de los anestésicos volátiles se ve reducida. Ambos factores contribuyen al aumento en la absorción de los anestésicos volátiles40. La concentración alveolar mínima (CAM) se usa frecuentemente para expresar la potencia del vapor anestésico. Generalmente, la CAM se reduce en los infantes pretérmino y alcanza el pico a los 1 a 6 meses de edad antes de disminuir a valores adultos en la adolescencia (fig. 3)41. Estos agentes tienden a tener una mayor depresión miocárdica en los recién nacidos en comparación con los adultos. A diferencia de otros agentes anestésicos volátiles, la CAM del sevoflurano no se reduce en prematuros y en recién nacidos en comparación con niños mayores (fig. 4)42. Por tanto, la CAM del sevoflurano en el neonato es del 3,2% aproximadamente, similar a los valores de CAM para los infantes de 1 a 6 meses de edad. La seguridad de estos agentes está potencialmente comprometida por la habilidad de suministrar concentraciones múltiples de CAM desde el vaporizador y por la habilidad de aumentar aún más la absorción a través de la ventilación minuto excesiva con asistencia respiratoria mecánica. Este problema se ha reducido significativamente por la eliminación de la producción de halotano en países desarrollados.
Concentración alveolar mínima (CAM) del isuflorano y edad posconceptual.
Fuente: reproducido con autorización de LeDez y Lerman41.
Media (± desviación estándar) de la concentración al final de la espiración del sevoflurano en oxígeno para cada uno de los 6 grupos de edad, desde neonatos a niños mayores de hasta 12 años de edad.
Fuente: Reproducido con autorización de Lerman et al.42.
Los agentes intravenosos juegan un papel significativo en el suministro de cuidados anestésicos modernos al neonato. No hace falta decir que el suministro de cualquier medicación vía intravenosa requiere un acceso estable al sistema circulatorio del paciente. Los anestesiólogos especializados en anestesia neonatal deben ser capaces de establecer de manera segura el acceso venoso periférico y, ocasionalmente, el acceso venoso central para el suministro del fármaco.
Por desgracia, los datos sobre la relación dosis-respuesta de la mayoría de los medicamentos son bien conocidos en adultos pero frecuentemente no se comprenden muy bien en los neonatos. Por tanto, es una práctica común extrapolar las pautas de dosificación para neonatos a partir de los datos conocidos para adultos. Como se describió anteriormente, los neonatos generalmente tienen niveles reducidos de proteínas en suero, lo que conduce a concentraciones más altas de fármaco libre (no unido). Además, las reducciones en el metabolismo hepático y en la eliminación renal aumentan, por lo general, el intervalo entre las dosis necesarias para el efecto terapéutico.
Debido a su frecuente uso, la farmacología y los efectos secundarios de los narcóticos en los neonatos se comprenden más a fondo43. La morfina ha sido asociada con mayor hipotensión y con el desarrollo de una vida media de eliminación más prolongada debido a su dependencia de la eliminación renal. El lanzamiento del potente narcótico sintético fentanilo en la década de 1980, con su efecto mínimo en el sistema cardiovascular, permitió el primer tratamiento seguro y efectivo del dolor quirúrgico en el neonato. Las dosis más elevadas fueron capaces de suprimir parcialmente la respuesta al estrés quirúrgico del neonato y de mejorar los desenlaces (supervivencia) después de la cirugía neonatal44. También se han filtrado en la práctica neonatal el amplio uso de propofol para la inducción de la anestesia y la facilitación en la colocación de un tubo endotraqueal para adultos. El propofol ha demostrado causar eventos hemodinámicos adversos (hipotensión) con mayor frecuencia cuando ha sido administrado para la colocación de tubos endotraqueales en neonatos críticamente enfermos45. Adicionalmente, el propofol ha retrasado la redistribución y el aclaramiento, lo que conduce a una acción prolongada en neonatos. Por último, la infusión continua de propofol a largo plazo (de horas a días) ha sido asociada con el desarrollo de acidosis metabólica, falla de órgano y muerte en neonatos y niños pequeños46; por tal motivo, la dosis y la duración de infusiones para sedación deben ser limitadas o prohibidas para evitar complicaciones graves.
Es muy común usar agentes bloqueadores neuromusculares para facilitar la relajación del paciente durante la cirugía neonatal. El uso de un agente neuromuscular despolarizador (succinilcolina) está reservado típicamente para la colocación de emergencia de un tubo endotraqueal. Debido a su gran volumen de distribución, la dosis recomendada para intubación en un neonato (2mg/kg) es el doble de la recomendada en un paciente adulto (1mg/kg). A pesar de esta gran dosis, la duración de la acción de la acción no se prolonga debido al rápido aclaramiento por esterasa plasmática. La similitud en la estructura de la succinilcolina y de la acetilcolina, junto con el sistema nervioso parasimpático completamente maduro del neonato, resulta comúnmente en el desarrollo de una bradicardia relativa con la administración de succinilcolina. Por esta razón, muchas autoridades recomiendan el pretratamiento con una agente anticolinérgico (atropina o glucopirrolato).
La respuesta en los neonatos a los agentes no despolarizantes musculares es bastante variable y difícil de predecir. Todos estos agentes presentan un aumento en su volumen de distribución y una disminución en su aclaramiento. Además, la unión mioneural neonatal parece demostrar una mayor sensibilidad a esta clase de agentes. Históricamente, el pancuronio ha sido popular en esta población de pacientes debido a sus propiedades líticas y vagales (aumento en la frecuencia cardiaca). No obstante, este tipo de uso está limitado significativamente por la larga duración de la acción en neonatos. El vecuronio y el rocuronio tienen menos propiedades líticas y vagales y reportan una duración menor. Sin embargo, su duración de la acción permanece más de 60min en la mayoría de los infantes.
Cuidado perioperatorio del neonatoEl anestesiólogo programado para cuidar a un recién nacido debe contar con un sistema integral fiable para evaluar la estabilidad del paciente y usar esta información en el desarrollo de su plan de cuidado anestésico. La información histórica importante que puede desprenderse de la historia clínica incluye la edad gestacional, el peso y eventos de nacimiento (incluyendo puntuaciones de Apgar al minuto 1, 5 y 10). El anestesiólogo debe consular con sus colegas de las áreas neonatales y quirúrgicas para determinar la presencia de anomalías congénitas. Los exámenes de ultrasonido se utilizan con frecuencia para identificar estas anomalías de forma no invasiva. Por último, el anestesiólogo debe inspeccionar de cerca las necesidades de cuidado de los recién nacidos de las últimas 24h para determinar el posible punto de partida para soporte en la sala de operaciones.
Se requiere un examen físico para evaluar la estabilidad y la permeabilidad de la vía aérea y el intercambio de gases del neonato. Si se requiere asistencia respiratoria mecánica, es necesario contar con una inspección detallada de la colocación de la vía aérea en una radiografía torácica, la configuración actual del ventilador y los últimos resultados de los gases sanguíneos. El profesional encargado de administrar la anestesia debe realizar una evaluación cuidadosa en busca de signos o síntomas de anormalidades cardiovasculares y estabilidad. El estado de hidratación (volumen) debe ser evaluado a través de los signos vitales (frecuencia cardiaca, presión arterial), el llenado capilar y el gasto urinario. Cualquier evidencia de deshidratación debe ser corregida por completo antes de la inducción de la anestesia, excepto en situaciones de emergencia que amenacen la vida. Por último, los anestesiólogos deben evaluar la seguridad de los accesos vasculares actuales y de las infusiones asociadas para determinar si el acceso será suficiente para el cuidado perioperatorio.
La última tarea en la evaluación preoperatoria es la revisión de los estudios de laboratorio disponibles. Por lo general, están disponibles los hemogramas completos para evaluar el riesgo de anemia asociado con la pérdida significativa de sangre y los recuentos de plaquetas para buscar evidencia de coagulopatía intravascular diseminada. Un recuento bajo de plaquetas (menos de 100.000) indica un probable consumo intravascular y debería impulsar un diagnóstico exhaustivo de coagulopatía. Los electrólitos séricos ayudarán en la valoración ácido-base y el posible riesgo de hiperpotasemia con una rápida transfusión de sangre. Adicionalmente, el nivel de glucosa en suero durante la terapia en curso ayudará al anestesiólogo a disminuir el riesgo de hipoglucemia intraoperatoria.
Las prácticas de anestesia comunes en neonatos incluyen el uso rutinario de monitores fisiológicos (ECG, presión arterial no invasiva, temperatura, oximetría de pulso y dióxido de carbono espiratorio final). Se debe tener cuidado de preservar la temperatura normal durante el transporte desde y hasta las salas de operaciones, así como también debe calentarse el ambiente operatorio. Se requiere la entrega continua de glucosa a lo largo del procedimiento con capacidad para monitorear los niveles intermitentes de glucosa en suero. Por lo general se requiere anestesia general con colocación de tubo endotraqueal para la atención segura del neonato. La anestesia consiste, normalmente, en una combinación balanceada del agente volátil complementado con narcótico (fentanilo, generalmente) para la estabilidad hemodinámica. Este anestésico a base de fentanilo conduce, con frecuencia, a retrasar el despertar anestésico y requiere ventilación mecánica postoperatoria. Se aplican maniobras de reclutamiento pulmonar después de cada periodo de apnea a presión ambiente para restaurar los volúmenes pulmonares normales. La asistencia respiratoria mecánica incluye rutinariamente entrega de PEEP para mantener volúmenes pulmonares normales con suficiente presión positiva intermitente para asegurar la ventilación alveolar y el aclaramiento del dióxido de carbono normales.
Con estos modernos avances en la práctica de la anestesia, múltiples estudios realizados en las 3 últimas décadas han mostrado que el riesgo de mortalidad asociada con la anestesia ha disminuido significativamente en el tiempo tanto en pacientes adultos como en pacientes pediátricos47-50; no obstante, los neonatos siguen teniendo el mayor riesgo de paro cardiaco perioperatorio de cualquier grupo de edad51,52. Además, el riesgo de mortalidad seguida del paro cardiaco es mucho mayor es este grupo vulnerable de pacientes. Fue esta evidencia de un mayor riesgo relacionado con la anestesia la que llevó, principalmente, a la creación de un programa de becas de capacitación formal (y certificada) en anestesia pediátrica avanzada en Estados Unidos. También, más recientemente, condujo al desarrollo de la certificación de la junta de anestesiología pediátrica por la Junta Americana de Anestesiología (ABA).
Controversias en anestesia neonatalA pesar de las mejoras considerables en el cuidado del neonato en el entorno perioperatorio alcanzadas durante la última década, siguen existiendo muchos problemas sin una evidencia clara de mejores prácticas. Es claro que aún quedan muchas oportunidades para los investigadores clínicos para evaluar de cerca las opciones de práctica actuales en un esfuerzo por reducir el riesgo de la anestesia para el vulnerable recién nacido.
Durante los últimos 15 años muchos investigadores han producido evidencia en el entorno del laboratorio que ha demostrado que muchos agentes anestésicos diferentes pueden, potencialmente, inducir lesiones en el sistema nervioso en desarrollo con efectos nocivos de larga duración53. Estas preocupaciones teóricas sobre la neurotoxicidad relacionada con anestesia en recién nacidos, junto con las notables mejoras técnicas en los equipos portátiles de ultrasonido, han provocado un resurgimiento en el interés y la aplicación de anestesia regional en el neonato. Las ventajas y desventajas potenciales de la anestesia regional comparada con la analgesia sistémica en neonatos han sido objeto de debate (tabla 1)54. Si bien no hay un consenso claro sobre la opción preferida, es evidente que muchos anestesiólogos están valorando cada día más los beneficios de la anestesia regional en neonatos con base en el aumento en el uso de esta opción de cuidado55.
Comparación de los pros y contras de la anestesia regional comparada con la analgesia sistémica en neonatos
| Técnica | Pros | Contras |
|---|---|---|
| Anestesia regional | • Bloqueo de estrés quirúrgico • No inestabilidad hemodinámica • Evita opiáceos sistémicos • No ventilación postoperatoria • ¿Neurotoxicidad relacionada con anestesia? | • Dificultad en la colocación • Riesgo de punción dural y traumatismo de la médula espinal • Familiaridad limitada con el sistema • No han sido probados beneficios en neonatos |
| Analgesia sistémica | • Ampliamente usado y estudiado en recién nacidos • Ventilación postoperatoria segura y ampliamente disponible a corto plazo | • Se requiere cuidado postoperatorio en la UCI • Respuesta al estrés quirúrgico eliminada, no bloqueada • Tolerancia y abstinencia • Hiperalgesia inducida por opiáceos |
Fuente: autor.
Una revisión exhaustiva resume la creciente evidencia que demuestra que el uso de altas concentraciones de oxígeno durante la reanimación neonatal está asociado con el estrés oxidativo, eventos adversos en la fisiología de la respiración y en la circulación cerebral y daño potencial del tejido causado por radicales libres del oxígeno56. Esta misma evidencia ha sido usada para sugerir que las exposiciones cortas a exceso de oxígeno en el periodo perioperatorio también podrían causar efectos adversos57. De hecho, algunos investigadores ahora recomiendan evitar el exceso de oxígeno incluso en periodos breves de tiempo en el ambiente perioperatorio con un límite superior de saturación de oxígeno del 95%58.
FinanciamientoLa autora no recibió patrocinio para llevar a cabo este artículo.
Conflicto de interesesNinguno.