La tolerancia y la hiperalgesia por opioides son 2 fenómenos que pueden generar grandes dificultades en el manejo del dolor tanto agudo como crónico. El enfoque diagnóstico y terapéutico exige gran conocimiento de la farmacología de los opioides y de fenómenos relacionados, como adicción y pseudoadicción.
En el presente artículo se expone el caso de una paciente poliintervenida, con tracto gastrointestinal no funcional, con dolor de aumento progresivo, no controlado y expuesta a altas dosis de opioides.
Se diagnosticó tolerancia e hiperalgesia por opioides, se inició esquema de rotación de opioides y posteriormente infusiones de ketamina y dexmedetomidina, con lo que finalmente se obtuvo respuesta.
La tolerancia y la hiperalgesia por opioides son 2 fenómenos cuyo enfoque terapéutico es sumamente complejo en ausencia de tracto gastrointestinal funcional. La rotación de los opioides, la ketamina y la dexmedetomidina fueron pilares del tratamiento en este caso.
Opioid tolerance and hyperalgesia are two occurrences that can pose great difficulty in managing both acute and chronic pain. The diagnostic and therapeutic approach requires profound knowledge of opioid pharmacology and related issues such as addiction and pseudoaddiction.
This paper presents the case of a patient with multiple interventions, non-functional gastrointestinal tract, increasing uncontrolled pain, exposed to high-dose opioids.
Opioid tolerance and hyperalgesia were diagnosed. An opioid rotation regimen was initiated followed by ketamine and dexmedetomidine infusions until a response was finally obtained.
Opioid tolerance and hyperalgesia are very difficult to manage and treatment is very complex in the absence of a functional gastrointestinal tract. Opioid rotation, ketamine and dexmedetomidine were the mainstays of treatment in this case.
Son bien conocidos los efectos deletéreos del dolor no controlado en la calidad de vida de los pacientes, en cuanto al aumento en la incidencia de complicaciones cardiacas, pulmonares, tromboembólicas e infecciosas1,2, de manera que cualquier fenómeno que pueda interferir con un control óptimo del dolor es de especial interés.
Caso clínicoMujer de 24 años y 60kg de peso, ocupación ama de casa, gestante de 14semanas, víctima de heridas múltiples por arma de fuego en abdomen. Ingresa en malas condiciones, choque hipovolémico con hemoperitoneo de 3.000cc, herida de estómago, bazo, colon en ángulo esplénico y descendente, heridas múltiples del yeyuno proximal desde la primera porción posterior al ángulo de Treitz, riñón izquierdo y psoas izquierdo (sección completa).
Se realiza cirugía de control de daños con nefrectomía izquierda, esplenorrafia del polo inferior del bazo, gastrectomía parcial, ligadura del ángulo esplénico del colon, ligadura de la iv porción de duodeno y yeyuno proximal, múltiples ligaduras en meso, lavado de cavidad, empaquetamiento de cavidad abdominal y colocación de sistema vaccum.
Requiere transfusión de múltiples unidades de glóbulos rojos, plasma, crioprecipitado y plaquetas por coagulopatía; soporte vasoactivo y ventilación mecánica.
Nuevamente es sometida a cirugía, en la que se evidencian necrosis intestinal de 80cm del yeyuno, de bocas ligadas del duodeno, de ilion distal y de colon transverso y descendente, por lo que se realiza anastomosis íleo-duodenal laterolateral y anastomosis laterolateral de colon transverso y descendente. Se deja abdomen abierto con sistema vaccum, se evidencia fascitis necrotizante en cuadrante superior izquierdo del abdomen, por lo que requiere lavado y desbridamiento en múltiples ocasiones.
Evolución tórpida, con peritonitis secundaria a estas lesiones, y posteriormente sepsis con estancia prolongada en la UCI, desarrollo de múltiples fístulas, abdomen bloqueado, intestino corto y necrosis de la pared abdominal, múltiples intervenciones quirúrgicas con desarrollo de cuadro doloroso abdominal severo de difícil control, manejada inicialmente por el grupo de cuidados intensivos con escalada-rotación de opioides (morfina e hidromorfona) por horario con dosis fija, y a pesar de esto el dolor es severo, valorado en escala de dolor con puntuaciones por encima de 7.
Dentro del abordaje de esta paciente se encontró la dificultad adicional de un tracto gastrointestinal no funcional que limitaba el uso de adyuvantes y analgésicos por vía oral, sumado a un fenómeno de pseudoadicción que influía negativamente en los rescates suministrados por enfermería y en la confianza de la paciente en el equipo de trabajo.
Ante esta situación fue interconsultado el grupo de dolor, que consideró rotar el esquema horario de morfina que tenía en el momento de la evaluación a tratamiento con PCA de hidromorfona sin límite y adicionalmente infusión continua a 0,1mg/h asociada a paracetamol i.v. y fentanilo transdérmico, titulándose este último hasta 200μg, más un consumo de 30mg/día de hidromorfona con empeoramiento de los síntomas y extensión del campo doloroso a la región dorsolumbar.
No se consideraron técnicas regionales por tener focos infecciosos muy cercanos a las aéreas de punción
No se consideró el uso de metadona porque solo estaba disponible por vía oral.
Dada la mala respuesta a la terapia instaurada, se consideró el diagnóstico de hiperalgesia inducida por opioides y se inició disminución gradual de los opioides asociado a infusión continua de ketamina, que se pudo titular hasta una dosis máxima de 0,3mg/kg/h con leve mejoría en la escala de dolor (puntaje de 6) pero con aparición de alucinaciones, por lo que fue necesario suspender el anterior esquema, con nuevo empeoramiento en la escala de dolor (intensidades 8-10).
Finalmente se decidió iniciar terapia combinada de ketamina a 0,1mg/kg/h en infusión continua asociada a dexmedetomidina titulada hasta 0,5μg/kg/h, con mejoría dramática en la puntuación del dolor (escala 2-3) y mínima sedación, permitiendo el desmonte de los opioides.
DiscusiónEn el manejo de esta paciente nos vimos enfrentados a desafíos como la ausencia de un tracto gastrointestinal funcional, la presencia de infección concomitante adyacente a las áreas que pudieran ser objeto de analgesia regional, y a fenómenos como la pseudoadicción, la tolerancia y la hiperalgesia. Los retos impuestos por la paciente pudieron ser sorteados gracias a una titulación cuidadosa de medicamentos i.v. y al desmonte gradual de opioides.
La tolerancia y la hiperalgesia por opioides son fenómenos relacionados que pueden aparecer en el contexto de tratamiento agudo o prolongado por opioides3, precisan de enfoques diferentes y a menudo generan gran dificultad para quienes manejan el dolor4,5.
La tolerancia se define como la necesidad de dosis crecientes de opioides para obtener el mismo efecto6-9; en este fenómeno el incremento gradual permite mantener el efecto10, y dentro de su génesis predominan fenómenos de tipo farmacodinámico, como la internalización de los receptores opioides11,12, asociado a destrucción citoplasmática y disminución de su reexpresión11,12. Este efecto farmacodinámico se puede agravar por tolerancia farmacocinética, que tiene que ver con efectos que interfieren con la absorción y la distribución del opioide6.
En cuanto a la hiperalgesia, es un fenómeno puramente farmacodinámico que tiene que ver con la modulación de las vías del dolor hacia un estado pronociceptivo11-13 causado por el mismo opioide. Este comienza, al igual que la tolerancia, con internalización del receptor opioide, el cual, por interacción repetida con su ligando, tiende a estar menos disponible11,12. Además, esta interacción repetida conduce a regulación al alta de las proteínasG estimulantes (recordemos que el receptor opioide está acoplado a una proteínaG inhibidora), lo cual va a favorecer la activación de proteincinasas, que van a mediar la entrada de calcio a la célula, a revertir la hiperpolarización inducida por los opioides y a favorecer la síntesis de neurotransmisores excitatorios agonistas de los receptores NMDA con conocido efecto pronociceptivo3,7,11-13.
Adicionalmente, en el contexto de la tolerancia y la hiperalgesia juegan un papel muy importante, y a menudo pasado por alto, la regulación al alta de vías ascendentes del dolor que no son dependientes de opioides; son divisiones de los tractos espinotalámicos y talamocorticales que, en lugar de hacer sinapsis en la láminaii de Rexed, que tiene alta concentración de receptores opioides, lo hacen en las láminasvi a viii, donde su población es mínima o inexistente. Lo anterior es un mecanismo que nos permite explicar en primer lugar la falta de respuesta a dosis altas de opioides y, en segundo lugar, la eficacia de los adyuvantes analgésicos, principalmente agonistas GABA, que al modular las vías sobreexcitadas independientes del sistema opioide pueden mejorar la analgesia10.
Por otro lado, opioides como la morfina pueden inducir a largo plazo la liberación de péptidos anti-opioides como la dinorfinaA11,12, el cual es agonista de los receptores NMDA, y a través de metabolitos propios, como la morfina 3 glucurónido, ejercer efectos antagonistas opioides directos11,12.
Los fenómenos descritos van a activar sistemas pronociceptivos a nivel central, cambiando el patrón normal de activación de células on y off en la sustancia gris periacueductal y en la médula oblonga, favoreciendo las vías pronociceptivas11,12.
Desde el punto de vista clínico se presentará un dolor difuso de calidad menos definida que característicamente aumenta con la escalada de dosis del opioide6,11-13.
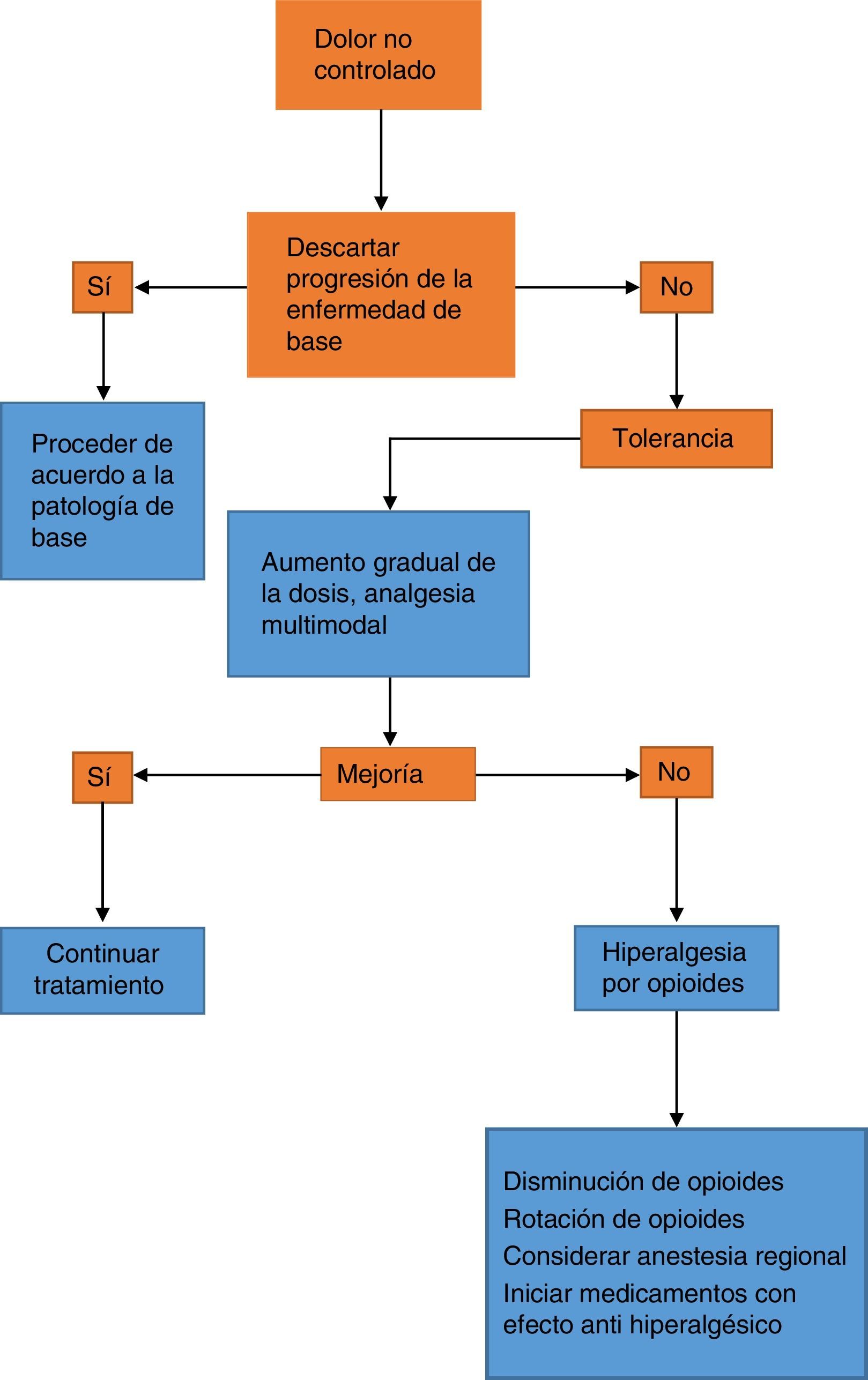
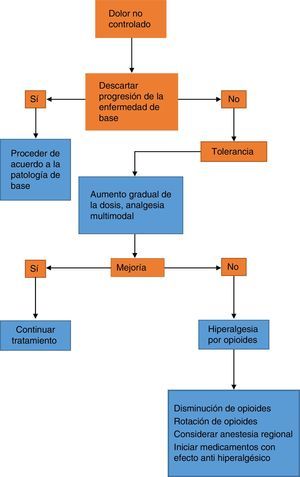
El abordaje terapéutico del aumento del dolor en un paciente que viene siendo tratado con opioides implica descartar la progresión de la enfermedad de base y, además, descartar fenómenos farmacológicos como tolerancia e hiperalgesia6. Se requiere superar la escasa formación en dolor del personal de salud que conduce a una inadecuada valoración de este y a la opiofobia, la cual, además del desconocimiento, surge en primer lugar por causa del temor a la adicción y, en segundo lugar, debido a la preocupación por los efectos adversos, principalmente depresión respiratoria. El primer escenario constituye un fenómeno infrecuente en el contexto hospitalario, y el segundo, con una dosificación y una titulación juiciosas del opioide, es un evento raro. Sin embargo, la opiofobia es un obstáculo común para el suministro de las dosis de rescate y genera un círculo vicioso de dolor no controlado por parte del paciente, menoscabo en su calidad de vida, comorbilidades asociadas y el fenómeno de pseudoadicción6, el cual se caracteriza por cambios conductuales de búsqueda activa del opioide y demanda de más dosis. Esto genera sospecha por parte del personal de salud y menos suministro de dosis analgésica, generando un círculo vicioso de mayor dolor, reducción de la analgesia y empeoramiento de los cambios conductuales (fig. 1).
Desde el punto de vista farmacológico, el manejo de la hiperalgesia por opioides incluye acetaminofén y antagonistas COX 2 selectivos y el uso de opioides con actividad antagonista NMDA como la metadona6,11,12, que no se usaron porque nuestra paciente tenía un tracto gastrointestinal no funcional, hecho que impedía garantizar una absorción confiable de estos medicamentos, los cuales solo estaban disponibles por vía oral.
Finalmente, son de gran utilidad en el contexto de hiperalgesia por opioides el uso de la ketamina, por su efecto antagonista de los receptores NMDA11,12,14, que le confiere, además de las propiedades antihiperalgésicas, propiedades analgésicas y ahorradoras de opioides, y el uso de la dexmedetomidina agonista alfa-2, con efecto sobre los receptores del locus coeruleus y en la médula espinal, con efectos sedantes, analgésicos y antihiperalgésicos. Como limitación está la sedación excesiva, la bradicardia y la hipotensión15; estos 2 últimos efectos podrían ser atenuados por la ketamina, y el éxito terapéutico también dependerá de encontrar la dosis mínima efectiva con una titulación juiciosa.
ConclusionesTolerancia e hiperalgesia por opioides son fenómenos complejos que involucran diversos mecanismos fisiológicos, farmacodinámicos e incluso farmacocinéticos, que van desde alteraciones en la interacción ligando receptor, activación de sistemas pronociceptivos y regulación al alta de sistemas nociceptivos ascendentes, independientes de los opioides. La comprensión de estos mecanismos debe ser la base para un enfoque terapéutico adecuado que nos permitirá aliviar el dolor y el sufrimiento.
Este caso nos enseña la complejidad de las interacciones farmacocinéticas y farmacodinámicas en un paciente con dolor severo, tracto gastrointestinal no funcional y expuesto a altas dosis de opioides; nos brinda elementos para hacer un diagnóstico diferencial en ese contexto, y nos da pautas para establecer una estrategia farmacológica adecuada.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.