Determinar la distribución teórica de marcadores de síndrome de Down (SD) del test combinado (Nuchal Translucency [NT], PAPP-A y free-beta-HCG) en una población de gestantes iberoamericanas reclutadas mediante el estudio multicéntrico Fetaltest, y evaluar la eficiencia teórica del cribado con el uso de tales parámetros poblacionales.
Material y métodosSe analizan retrospectivamente los marcadores del test combinado en 19.995 gestantes simples consecutivas con fetos no afectados y 72 con fetos afectados por SD. Se obtuvieron los parámetros poblacionales que definen las distribuciones teóricas de los marcadores (media, desviación estándar y correlaciones) en fetos afectados y no afectados. Se analizó, mediante técnica estándar de modelado, la eficiencia del cribado combinado usando los parámetros poblacionales estimados en comparación con los usados actualmente.
ResultadosSe observó una importante reducción de la SD de Log MoM NT en fetos no afectados respecto a los parámetros actualmente en uso, con una tendencia estadísticamente significativa a la reducción con el avance de la gestación. La eficiencia del cribado combinado evaluada mediante modelo mejoró con el uso de los parámetros estimados, obteniéndose una tasa de detección de un 90,5% para una tasa de falsos positiva fija del 5%, frente al 86,1% que se obtendría con los parámetros actualmente en uso.
ConclusionesLa actualización de los parámetros poblacionales de los marcadores con los obtenidos de nuestra propia población podría mejorar sensiblemente la eficiencia del cribado de SD.
To determine the theoretical distribution of Down syndrome (DS) markers in the combined test (nuchal translucency [NT], PAPP-A and free beta-HCG) in a population of pregnant Ibero-American women recruited by the Fetaltest multicenter study, and to evaluate the theoretical efficiency of screening with the use of these population parameters.
Materials and methodsWe retrospectively analyzed the combined test markers in 19,995 single consecutive pregnancies with unaffected fetuses and 72 fetuses with DS. We obtained the population parameters that define the theoretical distributions of the markers (mean, standard deviation and correlations) in affected and unaffected fetuses. A standard modeling technique was employed to analyze the efficiency of the combined screening test by using the estimated parameters in comparison with those currently used.
ResultsWe observed a significant reduction in the standard deviation of Log MoM NT with respect to the parameters currently in use in unaffected fetuses, with a statistically significant reducing trend as pregnancy progressed. The efficiency of combined screening evaluated by modeling techniques improved with the use of the estimated parameters, yielding a detection rate of 90.5% for a fixed false-positive rate of 5% compared with 86.1%, obtained with the parameters currently in use.
ConclusionsUpdating the population parameters of the markers with those obtained from our own population could noticeably improve the efficiency of screening for DS.
El cribado prenatal de cromosomopatías constituye hoy una práctica generalizada en muchos países. Uno de los métodos más ampliamente usado para dicho cribado es el test combinado, en el que la medición ecográfica de la Translucencia Nucal (TN) y la concentración en sangre materna de los marcadores bioquímicos se estandarizan en función del valor mediano de referencia, para obtener los Múltiplos de la Mediana (MoM), los cuales se comparan matemáticamente con las distribuciones teóricas de MoM en 2 poblaciones de gestantes con fetos afectados y no afectados, para obtener una razón de probabilidad de que el feto esté afectado. Dicha razón de probabilidad se combina por métodos bayesianos con el riesgo a priori dependiente de la edad materna para obtener un índice final de riesgo1. En general, la mejor opción para evitar inexactitudes en el cálculo del riesgo es usar parámetros de las distribuciones teóricas de los marcadores obtenidos de una muestra representativa de la propia población donde se realizará el cribado, y, si ello no es posible, obtenerlos de la literatura, bien usando los parámetros publicados en grandes estudios simples2,3 o bien estimarlos, a partir de estos, mediante metaanálisis4.
En un trabajo previo5, examinamos los parámetros poblacionales de los marcadores de cromosomopatías usados en el test combinado (TN, PAPP-A y free-beta-HCG) disponibles en la literatura para determinar cuál era la mejor opción para el estudio Fetaltest, (www.fetaltest.com), un estudio multicéntrico iberoamericano impulsado por la Sociedad Española de Ginecología y Obstetricia y la Sociedad Iberoamericana de Diagnóstico y Tratamiento Prenatal. Tras dicho análisis, concluimos que los parámetros publicados en el Serum, urine and ultrasound screening study (SURUSS)2,6 se adaptaban mejor que otros a nuestra población. Sin embargo, en los últimos años se vienen publicando cambios en la distribución de los parámetros de TN en los fetos no afectados, por ejemplo, disminución de la mediana7 y desviación estándar7,8, que hacen necesaria una revisión de tales parámetros. Por otro lado, el estudio Fetaltest dispone ya de una casuística relativamente amplia que podría permitir extraer los parámetros de todos los marcadores de nuestra propia población. El objetivo del presente estudio es examinar la distribución de TN, PAPP-A y free-beta-HCG en la población de gestantes del estudio Fetaltest (que incluye gestantes de varios países iberoamericanos y de España), para estimar los parámetros que definen sus distribuciones teóricas en fetos afectados y no afectados, y evaluar la eficiencia del cribado que podría conseguirse con el uso de tales parámetros respecto a los del SURUSS2,6, usados hasta ahora en el cálculo de riesgo.
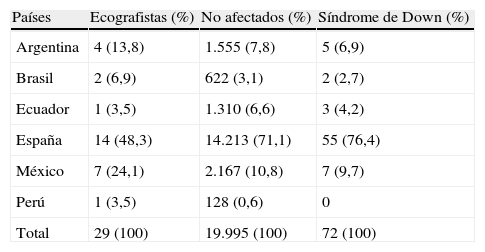
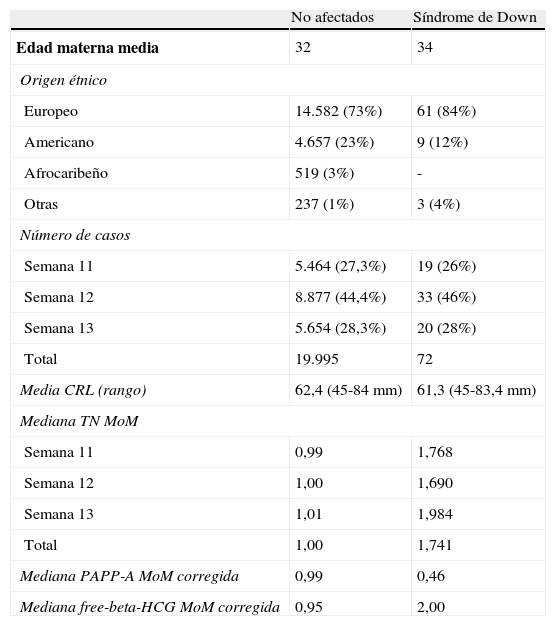
Material y métodosExaminamos retrospectivamente los datos almacenados en la base de datos del estudio Fetaltest entre los años 2003 y 2009 correspondientes a gestaciones simples en las que se hubo medido la TN, que supusieron un total de 32.497 casos. Para obtener los parámetros poblacionales de TN se seleccionaron los casos almacenados por los ecografistas que reunieron las siguientes condiciones: a) realizaron más de 100 mediciones de TN, b) las mediciones fueron realizadas a gestantes no seleccionadas, c) habían superado los controles de calidad de precisión en las mediciones y d) habían completado mayoritariamente el seguimiento de las gestaciones. Reunieron estos requisitos 29 ecografistas y sus correspondientes registros de 19.995 gestaciones simples con fetos no afectados de cromosomopatías y 72 fetos afectados de DS. Los ecografistas habían sido entrenados en la técnica estándar de medición de TN mediante un curso de adiestramiento previo a su incorporación al estudio, y la TN se midió dentro del rango de longitud cefalo-caudal (crown rump length [CRL]) entre 45 y 84mm. El análisis de los marcadores bioquímicos se restringió a un subgrupo constituido por 17.260 casos no afectados y 48 casos de DS, que cumplieron, además, las siguientes condiciones: e) disponían de los datos de los 3 marcadores (PAPP-A, free-beta-HCG y TN) necesarios para el análisis, f) la determinación de los marcadores bioquímicos se había efectuado dentro del rango de las semanas 8 y 13. En la tabla 1 se presenta la distribución de ecografistas y casos en función de los países en los que se realizaron las mediciones de TN. En la tabla 2 se presentan las características de las gestantes incluidas en el estudio. No fue posible el análisis de las marcas y modelos de ecógrafos y analizadores empleados porque no fueron recogidas en la base de datos en gran parte de los casos.
Distribución por países de ecografistas y casos
| Países | Ecografistas (%) | No afectados (%) | Síndrome de Down (%) |
| Argentina | 4 (13,8) | 1.555 (7,8) | 5 (6,9) |
| Brasil | 2 (6,9) | 622 (3,1) | 2 (2,7) |
| Ecuador | 1 (3,5) | 1.310 (6,6) | 3 (4,2) |
| España | 14 (48,3) | 14.213 (71,1) | 55 (76,4) |
| México | 7 (24,1) | 2.167 (10,8) | 7 (9,7) |
| Perú | 1 (3,5) | 128 (0,6) | 0 |
| Total | 29 (100) | 19.995 (100) | 72 (100) |
Características de las gestantes estudiadas
| No afectados | Síndrome de Down | |
| Edad materna media | 32 | 34 |
| Origen étnico | ||
| Europeo | 14.582 (73%) | 61 (84%) |
| Americano | 4.657 (23%) | 9 (12%) |
| Afrocaribeño | 519 (3%) | - |
| Otras | 237 (1%) | 3 (4%) |
| Número de casos | ||
| Semana 11 | 5.464 (27,3%) | 19 (26%) |
| Semana 12 | 8.877 (44,4%) | 33 (46%) |
| Semana 13 | 5.654 (28,3%) | 20 (28%) |
| Total | 19.995 | 72 |
| Media CRL (rango) | 62,4 (45-84mm) | 61,3 (45-83,4mm) |
| Mediana TN MoM | ||
| Semana 11 | 0,99 | 1,768 |
| Semana 12 | 1,00 | 1,690 |
| Semana 13 | 1,01 | 1,984 |
| Total | 1,00 | 1,741 |
| Mediana PAPP-A MoM corregida | 0,99 | 0,46 |
| Mediana free-beta-HCG MoM corregida | 0,95 | 2,00 |
A partir de los valores de los marcadores y la edad gestacional derivada de la medida ecográfica del CRL, se obtuvieron los MoM, dividiendo el valor de los marcadores entre el valor esperado. Para calcular la edad gestacional a partir del CRL se usó un algoritmo previamente publicado9. El valor esperado de TN se obtuvo a partir de la curva de referencia del estudio Fetaltest previamente publicada10, que fue obtenida por regresión no lineal (de segundo orden) de los Log MoM TN individuales contra CRL entre 45 y 84mm, siguiendo métodos estándares11. Los valores de MoM de los marcadores bioquímicos fueron obtenidos por cada uno de los laboratorios de referencia de los ecografistas y corregidos en función de la edad gestacional derivada del CRL, peso, hábito tabáquico, reproducción asistida y origen étnico de las gestantes.
La distribución de los marcadores se estimó a partir de los valores de las medias de MoM y las desviaciones estándares (DE) de Log MoM, bien en el conjunto de los datos o bien en función del CRL. Todos los logaritmos que se mencionan en este estudio son en base 10. La DE de Log MoM TN de los fetos no afectados se obtuvo por regresión lineal contra el CRL de los residuos absolutos escalados11.
La eficacia del cribado se evaluó mediante técnica estándar de modelado basado en integración numérica12. En el modelo se usó la distribución de edad de las gestantes españolas de 2006 publicadas por el Instituto Nacional de Estadística13. Para realizar la comparación de la eficacia del cribado se usaron los parámetros estimados en el presente estudio en comparación con los publicados en el SURUSS2,6, y se determinó la tasa de falsos positivos para una tasa de detección fija del 80, 85 y 90% y la tasa de detección para una tasa de falsos positivos fija del 3 y el 5%.
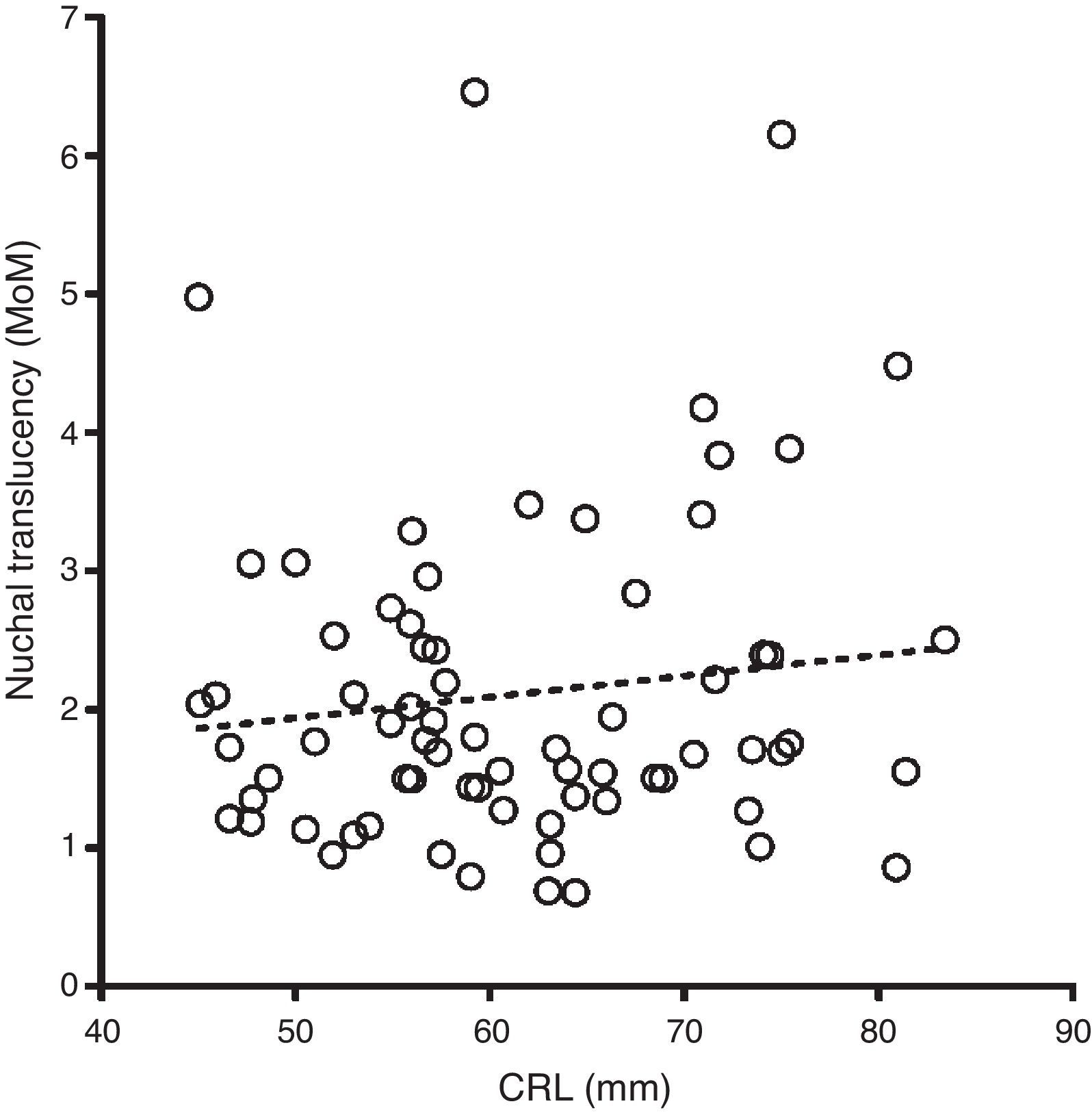
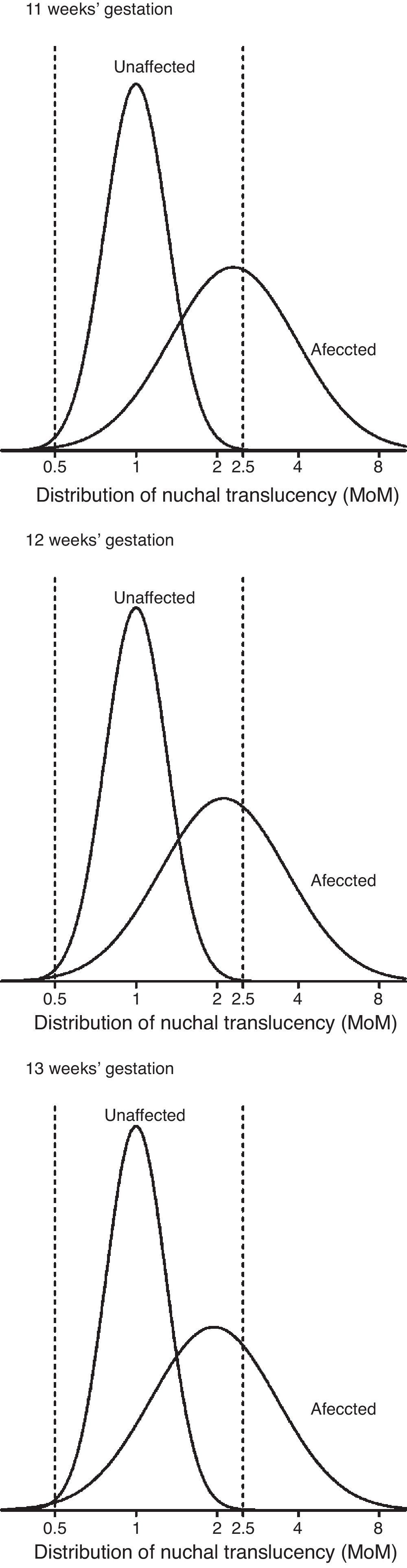
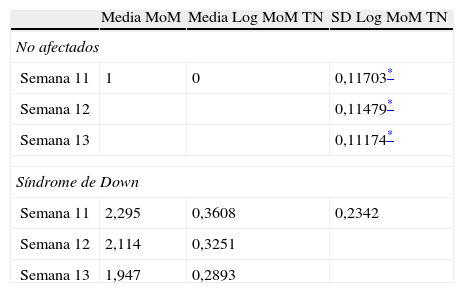
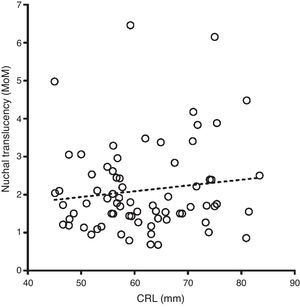
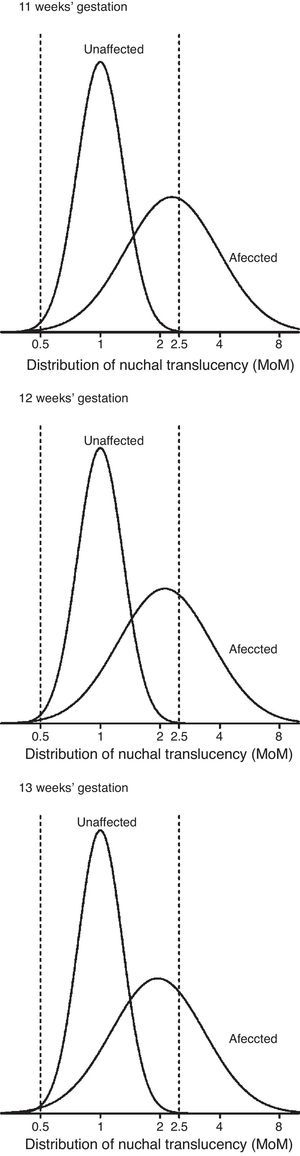
ResultadosEn los fetos no afectados, las distribuciones de Log MoM TN, examinadas mediante una gráfica de probabilidades, fueron aproximadamente normales en el rango entre 0,5 y 2,5 MoM, en cada semana gestacional. La DE de Log MoM TN disminuyó significativamente con el aumento del CRL, según la ecuación de regresión: 0,1272 - 0,0002034 × CRL (p=0,0056), de donde se obtienen los valores de 0,11703, 0,11479 y 0,11174, para la mitad de las semanas 11, 12 y 13. La media de los MoM de TN en los fetos afectados de SD no mostró una tendencia significativa a modificarse con el CRL (media MoM = 1,179+0,01521 × CRL) (fig. 1), y fue, para todo el conjunto de fetos afectados, de 2,114. La ausencia de la tendencia decreciente establecida en otros estudios con mayor número de casos afectados14 fue debida a un desproporcionado reparto de casos con NT > 3mm en cada semana gestacional, que fue de 26,3 (5/19), 30,3 (10/33) y 50% (10/20) en las semanas 11, 12 y 13, respectivamente. Para incorporar la tendencia de 11% de descenso semanal de la media Log MoM observada por otros grupos14, se usó la media MoM general como base para estimar las medias de MoM de 2,295, 2,114 y 1,947, para las semanas 11, 12 y 13, respectivamente. La DE de Log MoM tampoco mostró, en los fetos afectados, una tendencia significativa a modificarse con la edad gestacional y fue de 0,2342 para el conjunto de los casos, calculada dividiendo entre 2,563 el rango entre los percentiles 10 y 90. La diferencia entre la varianza de NT en fetos afectados y no afectados fue de 0,041, para las semanas 11 y 12, y 0,042 para la semana 13. En la tabla 3 se resumen los parámetros de TN estimados para fetos afectados y no afectados. Para evaluar si las distribuciones de Log MoM TN estimadas en los fetos afectados y no afectados hace necesaria alguna modificación del límite de truncamiento para evitar el fenómeno de inversión del riesgo, se representaron gráficamente (fig. 2) las correspondientes distribuciones de TN en cada semana gestacional. En dicha gráfica puede observarse que la cola izquierda de la distribución de afectados no sobrepasa en altura a la cola izquierda de la distribución de no afectados en ninguna semana, por lo que el límite de truncamiento inferior puede situarse en 0,50 MoM, para todo el periodo entre las 11 y 13 semanas, sin que ello condicione una inversión del riesgo.
Media y desviación estándar de valores de TN MoM en embarazos no afectados y afectados por síndrome de Down
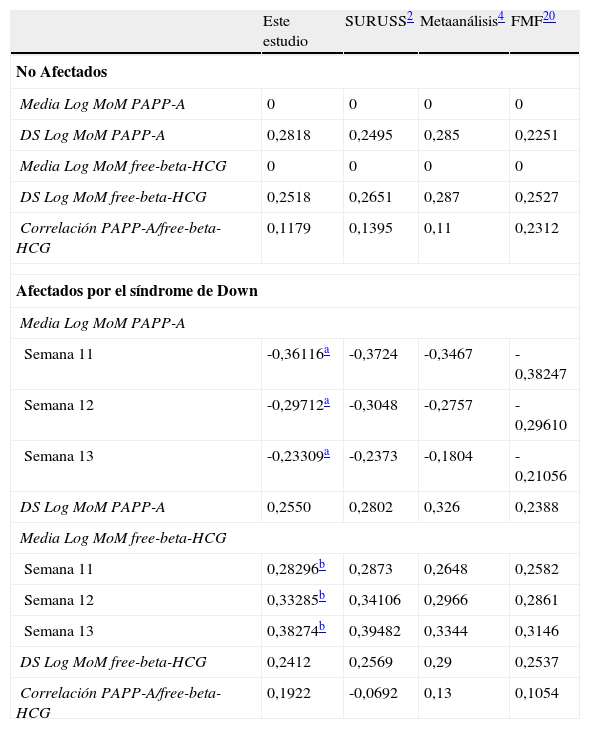
La tabla 4 presenta los parámetros estimados de los marcadores bioquímicos (media, DE y correlaciones) en fetos afectados y no afectados. No se observó correlación significativa entre la free-beta-HCG y TN, en ningún caso, y sí se observó una correlación significativa, aunque pequeña (r=0,02921, p<0,0001), entre los Log MoM de PAPP-A y TN, en los fetos no afectados.
Media, desviación estándar y correlaciones de PAPP-A y free-beta-HCG en el presente estudio en comparación con los publicados por otros grupos
| Este estudio | SURUSS2 | Metaanálisis4 | FMF20 | |
| No Afectados | ||||
| Media Log MoM PAPP-A | 0 | 0 | 0 | 0 |
| DS Log MoM PAPP-A | 0,2818 | 0,2495 | 0,285 | 0,2251 |
| Media Log MoM free-beta-HCG | 0 | 0 | 0 | 0 |
| DS Log MoM free-beta-HCG | 0,2518 | 0,2651 | 0,287 | 0,2527 |
| Correlación PAPP-A/free-beta-HCG | 0,1179 | 0,1395 | 0,11 | 0,2312 |
| Afectados por el síndrome de Down | ||||
| Media Log MoM PAPP-A | ||||
| Semana 11 | -0,36116a | -0,3724 | -0,3467 | -0,38247 |
| Semana 12 | -0,29712a | -0,3048 | -0,2757 | -0,29610 |
| Semana 13 | -0,23309a | -0,2373 | -0,1804 | -0,21056 |
| DS Log MoM PAPP-A | 0,2550 | 0,2802 | 0,326 | 0,2388 |
| Media Log MoM free-beta-HCG | ||||
| Semana 11 | 0,28296b | 0,2873 | 0,2648 | 0,2582 |
| Semana 12 | 0,33285b | 0,34106 | 0,2966 | 0,2861 |
| Semana 13 | 0,38274b | 0,39482 | 0,3344 | 0,3146 |
| DS Log MoM free-beta-HCG | 0,2412 | 0,2569 | 0,29 | 0,2537 |
| Correlación PAPP-A/free-beta-HCG | 0,1922 | -0,0692 | 0,13 | 0,1054 |
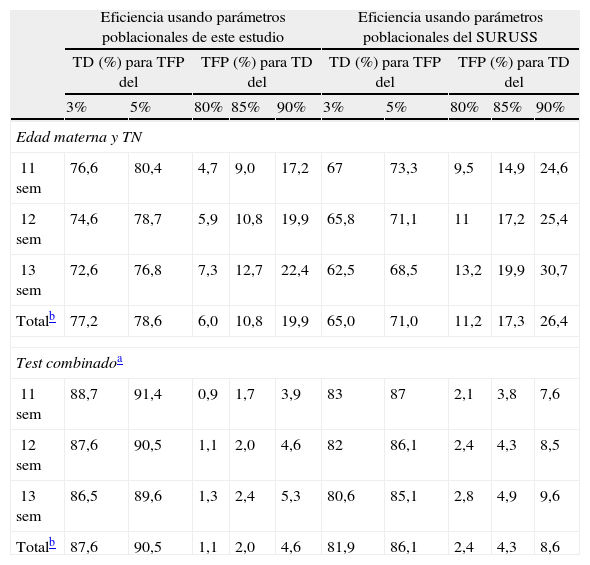
La tabla 5 presenta el resultado del modelo de la eficacia de un test basado en NT y edad materna y del test combinado, en la población española de 200613, usando los parámetros poblacionales estimados en el presente estudio, en comparación con la eficacia que se obtendría usando los parámetros publicados en el SURUSS2,6, y en ella se observa que los parámetros estimados en este estudio pueden mejorar la eficiencia del cribado en nuestra población. Usando una distribución por semanas igual a la observada en este estudio (27,3; 44,4; 28,3%, para las semanas 11, 12 y 13, respectivamente) se obtuvo la eficacia global de cada conjunto de parámetros. Así, el test combinado basado en los parámetros del presente estudio podría incrementar la tasa de detección en más de un 4% (desde 86,1 hasta el 90,5%) cuando se use una tasa de falsos positivos fija del 5%. Como se puede observar en la misma tabla 5, esta sustancial mejora de la eficiencia del cribado es dependiente, fundamentalmente, de los parámetros de TN, que por sí solos incrementan en más de 7% la tasa de detección (desde el 71 hasta el 78,6%) para una tasa de falsos positivos fija del 5%.
Eficiencia del cribado basado en edad materna y translucencia nucal y test combinado en función de la edad gestacional en la que fue medida la TN: estimada con parámetros poblacionales del presente estudio y usando los parámetros publicados en el SURUSS
| Eficiencia usando parámetros poblacionales de este estudio | Eficiencia usando parámetros poblacionales del SURUSS | |||||||||
| TD (%) para TFP del | TFP (%) para TD del | TD (%) para TFP del | TFP (%) para TD del | |||||||
| 3% | 5% | 80% | 85% | 90% | 3% | 5% | 80% | 85% | 90% | |
| Edad materna y TN | ||||||||||
| 11 sem | 76,6 | 80,4 | 4,7 | 9,0 | 17,2 | 67 | 73,3 | 9,5 | 14,9 | 24,6 |
| 12 sem | 74,6 | 78,7 | 5,9 | 10,8 | 19,9 | 65,8 | 71,1 | 11 | 17,2 | 25,4 |
| 13 sem | 72,6 | 76,8 | 7,3 | 12,7 | 22,4 | 62,5 | 68,5 | 13,2 | 19,9 | 30,7 |
| Totalb | 77,2 | 78,6 | 6,0 | 10,8 | 19,9 | 65,0 | 71,0 | 11,2 | 17,3 | 26,4 |
| Test combinadoa | ||||||||||
| 11 sem | 88,7 | 91,4 | 0,9 | 1,7 | 3,9 | 83 | 87 | 2,1 | 3,8 | 7,6 |
| 12 sem | 87,6 | 90,5 | 1,1 | 2,0 | 4,6 | 82 | 86,1 | 2,4 | 4,3 | 8,5 |
| 13 sem | 86,5 | 89,6 | 1,3 | 2,4 | 5,3 | 80,6 | 85,1 | 2,8 | 4,9 | 9,6 |
| Totalb | 87,6 | 90,5 | 1,1 | 2,0 | 4,6 | 81,9 | 86,1 | 2,4 | 4,3 | 8,6 |
La eficiencia del cribado de cromosomopatías depende, entre otros factores, de una adecuada selección de los parámetros de las distribuciones teóricas de los marcadores en los fetos afectados y no afectados y, especialmente, de la distribución de TN, por ser este el marcador con mayor poder discriminatorio para el cribado de SD. Sin embargo, la distribución de los marcadores no resulta fácil de obtener en un único centro, por la escasa prevalencia de fetos afectados, y tampoco es fácil de obtener a partir de datos previamente publicados, pues en el caso de la TN, cada estudio usa metodologías diferentes en alguna o todas las fases de la evaluación de la TN: por ejemplo, medianas de TN universales3 versus centro-específicas2,6, o inclusión2,3 versus exclusión15 de los fetos con higroma quístico septado, o incluso uso de métodos de cálculo complejos7 basados en parámetros de TN no útiles con el método de los MoM gaussianos simples. En el presente estudio se han estimado unos parámetros de marcadores basados en los datos de nuestra propia población para efectuar el cálculo de riesgo por el método de los MoM gaussianos simples, con una curva de medianas de TN estudio-específica.
Los parámetros de TN estimados son comparables a otros previamente publicados, si bien presentan algunas particularidades. En los fetos no afectados de nuestro estudio, la desviación estándar de Log MoM TN es sensiblemente menor a las publicadas en otros grandes estudios multicéntricos de la década pasada2,3, pero está en línea con la disminución de dicha DE de TN a través del tiempo, que vienen observando todos los grupos en los últimos años7,8,16. Aunque no se ha establecido el origen de la disminución de la DE a lo largo de los años, especulamos con que puede deberse, en parte, al mejor conocimiento general de la técnica de medición y a su mejor control de calidad y, en parte, a la extensión del uso de ecógrafos que dibujan con un trazo de mayor grosor las líneas que delimitan la propia TN. También, nuestro estudio confirma un descenso significativo de la DE de Log MoM en los fetos no afectados a lo largo de la gestación, observado también por otros grupos2,7,8, y que tiene cierta influencia en las diferencias de eficacia del cribado con relación a la semana de edad gestacional en que se mida la TN. La disminución de la DE de TN en fetos no afectados tiene como consecuencia, además, la posibilidad de que el riesgo se invierta con valores pequeños de TN MoM, por la extensión de la cola izquierda de la distribución de TN en fetos afectados más allá de la cola izquierda de los no afectados7,8. Los parámetros estimados en el presente estudio, sin embargo, como puede observarse en la figura 2, no producen ese efecto, por lo que los límites de truncación de TN pueden mantenerse en los clásicos 0,5 y 2,5 MoM.
En los fetos afectados de DS, la DE de Log MoM TN observada en nuestro estudio (0,2342) es algo mayor que la publicada en el estudio SURUSS (0,2313)2, pero algo menor que la publicada en su última actualización (0,2382)7. La diferencia entre las varianzas de Log MoM de TN entre fetos no afectados y afectados, 0,041 y 0,042, está en línea con la de 0,04 usada por otros autores4 para estimar la DE de Log MoM en los afectados. La estimación de la media de los MoM de TN en los fetos afectados presenta habitualmente dificultades relacionadas con el tamaño de la muestra y con el sesgo propio de los estudios intervencionistas17. Creemos que nuestra serie de casos afectados adolece de ambas limitaciones, y que por ello la media de los MoM de los afectados no recoge, en nuestro estudio, la establecida tendencia a disminuir con la gestación6,14,18, que tiene un importante efecto sobre la temporización de la medición de la TN. Ello nos ha obligado a efectuar una estimación de este parámetro apoyándonos en las observaciones de otros grupos14, resultando en unas medias de los MoM de TN (2,295; 2,114; 1,947) muy próximas a las estimadas por otros mediante metaanálisis (2,310; 2,100; 1,910)18,19 o por otros grandes estudios simples14 (2,53; 2,12; 1,94), pero algo más elevadas que las publicadas en el SURUSS6 (2,18; 1,96; 1,77).
Los parámetros de los marcadores bioquímicos estimados en nuestro estudio están en línea con los publicados por otros grupos, como se muestra en la tabla 4, en la que se presentan en comparación con los publicados en el SURUSS2, con los obtenidos por otros mediante metaanálisis4 y con los publicados más recientemente por el grupo de la Fetal Medicine Foundation20.
En el modelo ensayado sobre la población española, el test combinado mejoraría su eficiencia con el uso de los parámetros estimados en este estudio, con los que incrementaría la tasa de detección en más de un 4% (desde el 86,1 hasta el 90,5%) respecto a la que se obtendría con los parámetros del SURUSS2,6, si se acepta una tasa de falsos positivos del 5%, o incrementaría la tasa de detección en más de un 5% (desde 81,9 hasta 87,6%) si se opta por una tasa de falsos positivos del 3%.
Nuestro estudio tiene las limitaciones dependientes de un número no demasiado grande de fetos afectados de SD y las relacionadas con la circunstancia de ser un estudio intervencionista, lo que nos ha obligado a efectuar las correcciones matemáticas mencionadas para estimar la media de los MoM de TN para los fetos afectados. No obstante, la necesidad de realizar correcciones matemáticas para calcular este parámetro es práctica común en otros grupos6,17,18 por parecidas circunstancias. También nuestro estudio tiene algunas fortalezas, como es la circunstancia de ser un estudio multicéntrico, que evita errores dependientes de obtener los parámetros a partir de los datos de un único centro, de unos pocos ecografistas o de unos pocos ecógrafos o analizadores. Los parámetros obtenidos son consistentes con los de otros grupos, recogen las tendencias de modificación de los parámetros de NT observadas en los últimos años y permitirían, aplicándolos en nuestra población, obtener una mejor eficiencia en el cribado prenatal de SD del primer trimestre.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.