Las neoplasias hematológicas secundarias representan una complicación grave del tratamiento oncológico, aunque se desconoce su incidencia real en las pacientes con tumores ginecológicos. El diagnóstico de la leucemia mieloide aguda secundaria a platinos se basa en la sospecha clínica, las alteraciones morfológicas y el estudio citogenético. A pesar de la quimioterapia paliativa y el trasplante alogénico, que está limitado a ciertos casos, su pronóstico es desfavorable. Por ello deben optimizarse las pautas terapéuticas en los tumores ginecológicos con posibilidad de obtener largas supervivencias y mantener a los pacientes en programas de seguimiento prolongado.
Secondary haematological malignancies represent severe complication of cancer treatment, although their real incidence is unknown in gynaecological tumours. The usual presentation of an acute leukaemia associated with platinum is based on clinical and cytogenetic features. Diagnosis is based on clinical suspicion, morphological alterations and cytogenetic studies. Conventional chemotherapy is mainly palliative, whereas allogenic transplantation allows the cure but just a small percentage of cases, so prognosis is dismal. Thus, potential curative therapies for solid tumours should be optimized and patients maintained in long-term surveillance programs.
La inducción de neoplasias secundarias al tratamiento quimioterápico es una complicación infrecuente pero grave del tratamiento oncológico. Desde hace más de 50 años, las leucemias mieloides agudas (LMA) secundarias se conocen como entidades clínicas asociadas tradicionalmente al uso de agentes alquilantes1. Aunque inicialmente se describieron en supervivientes de linfomas a largo plazo, posteriormente también se han objetivado en otro tipo de tumores como los ginecológicos2. El mecanismo de leucemogénesis que se postula está asociado al daño del ADN de las células hematopoyéticas de la médula ósea por los agentes quimioterápicos con los que se tratan los tumores. En general el pronóstico es desfavorable y en la actualidad la opción curativa es el trasplante alogénico de médula ósea, con tasas de curación a los 5 años del 25-30%3,4. Debido al aumento de la supervivencia media de los pacientes oncológicos es probable que el número de casos de LMA secundarias vaya en aumento en los próximos años5. Además aún no disponemos de técnicas de prevención y de diagnóstico precoz de dichas neoplasias secundarias.
Nuestro propósito es reflejar una serie de 2 casos clínicos que presentaban tumores ginecológicos, y describir las características clínicas, analíticas y citogenéticas de estas LMA.
Caso 1Paciente de 53 años, sin antecedentes de interés que en septiembre de 2005 es diagnosticada de un carcinoma escamoso de cérvix moderadamente diferenciado estadio IB1 tras una histerectomía.
Tras un intervalo libre de enfermedad de 5 años y 5 meses, en diciembre de 2010 presenta una recaída a nivel ganglionar, pulmonar y hepático. Se realiza una biopsia ganglionar, confirmado una recaída por un carcinoma de origen cervical. Recibe tratamiento de primera línea con cisplatino 50mg/m2 y topotecán 0,75mg/m2 × 6 ciclos desde febrero a mayo de 2011, con una respuesta parcial. La dosis acumulada de cisplatino y de topotecán fue de 477 y 21mg, respectivamente.
En octubre de 2011 la paciente presentó una progresión pulmonar y hepática, por lo que recibió tratamiento con paclitaxel 75mg/m2 semanal desde octubre de 2011 hasta julio de 2012, con estabilización de la enfermedad.
En octubre de 2012 se identificó una nueva progresión de enfermedad a nivel pulmonar. Se trató con paclitaxel 175mg/m2 y carboplatino (área bajo la curva de 6). Desde octubre de 2012 a agosto de 2013 recibió 8 ciclos, con una respuesta parcial.
En noviembre de 2013 presenta nueva progresión pulmonar, la paciente fue incluida en un ensayo fase I con carboplatino (área bajo la curva 5) y Myocet® 60mg/m2. Desde enero a abril de 2014 recibe 4 ciclos (4.080mg dosis total acumulada desde el diagnóstico de carboplatino).
Las dosis acumuladas desde el diagnóstico de carboplatino y paclitaxel fueron de 4.080 y 2.100mg, respectivamente.
En marzo de 2014 la paciente consulta por síndrome anémico, epistaxis y petequias. En la analítica presenta una bicitopenia mantenida (anemia grado 2 con hemoglobina menor de 9g/dl) (trombocitopenia grado 2 cifras de plaquetas medias menores de 75.000μl) y se objetivaron blastos en la biopsia de médula ósea. Se valora por hematología, diagnosticando una LMA con la pérdida del cromosoma 7. La paciente presenta un rápido deterioro del estado general con performance status (PS) 3, por lo que no es subsidiaria de tratamientos hematológicos, siendo exitus el 22/3/2014.
Caso 2Paciente de 63 años, BRCA2 mutada, diagnosticada en abril de 2012 de un carcinoma ovárico de patrón mixto estadio IIIC tras la cirugía óptima. Recibe tratamiento con paclitaxel 175mg/m2 y carboplatino (área bajo la curva de 5) × 6 ciclos entre abril y septiembre de 2012.
Tras intervalo libre de platino de 13 meses, en octubre de 2013, presenta una recaída ganglionar peripancreática e implantes periesplénicos. Recibe 3 ciclos de gemcitabina 1.000mg/m2 y carboplatino (área bajo la curva de 5) y en marzo de 2014 se procede a resección completa ganglionar y del implante tumoral. Posteriormente completa 3 ciclos de gemcitabina 1.000mg/m2 y carboplatino (área bajo la curva de 5) entre junio y septiembre de 2014.
En mayo de 2015 presenta una progresión biológica, con elevación de marcador Ca 12.5 objetivando una recaída hepática y carcinomatosis peritoneal. Tras 8 meses de intervalo libre de platino, se propone tratamiento con Caelyx®-trabectedina. Entre julio a diciembre de 2015 recibe 6 ciclos consiguiendo una respuesta completa hepática y respuesta parcial ganglionar con índice de carcinomatosis peritoneal de 6. En febrero de 2016 se realiza citorreducción terciaria dejando a la paciente libre de enfermedad. Como complicaciones la paciente presenta una fístula gástrica, que se resuelve con tratamiento conservador.
Tras intervalo libre de platino de 9 meses, en septiembre de 2016 presenta nueva progresión biológica y se evidencia una carcinomatosis peritoneal. Inicia tratamiento con carboplatino semanal en monoterapia, con área bajo la curva de 2 de noviembre de 2016 a febrero de 2017, consiguiendo una respuesta parcial y normalización del marcador Ca 12.5. En atención a la mutación BRCA2 conocida y tras una vez más, respuesta a tratamiento con platino, se solicita autorización para proseguir tratamiento con olaparib 400mg/12h, consiguiendo una respuesta completa hasta la actualidad.
En marzo de 2019, tras 3 años libre de progresión, la paciente presenta astenia y fiebre asociada a clínica infecciosa digestiva. En la analítica destaca una bicitopenia mantenida (anemia grado 3 hemoglobina menor de 8g/dl) (neutropenia grado 4 neutrófilos menores de 500μl). Se remite a hematología para estudio, tanto en sangre periférica como en la biopsia de médula ósea se objetivan células blásticas y es diagnosticada de una LMA secundaria. Tras resolución de la infección y mejoría del estado general, la paciente es derivada al centro de referencia para tratamiento hematológico de la LMA. La paciente tras el traslado presentó un descenso de las plaquetas grado 4 con plaquetas <10.000/mm3 asociado a sangrados repetidos a pesar de recibir trasfusiones de plaquetas. La paciente fue exitus en abril de 2019.
DiscusiónLas LMA se caracterizan por la proliferación incontrolada de blastos de estirpe mieloide en la médula ósea y los tejidos periféricos5. Se pueden clasificar en primarias (sin factor etiológico asociado) o secundarias (desencadenados por agentes quimioterápicos)6,7. La incidencia de las LMA secundarias está alrededor de un 10%8.
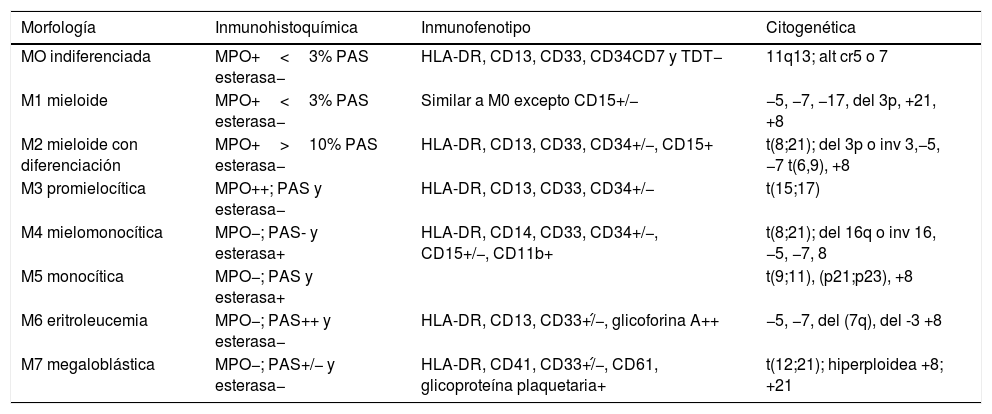
Se diferencian en 7 subtipos, de acuerdo a las características citológicas, inmunofenotípicas y citogenéticas según la clasificación French-American-British (FAB) (tabla 1)6,9.
Clasificación de las LMA; características citológicas, inmunofenotípicas y citogenéticas de acuerdo a la clasificación French-American-British
| Morfología | Inmunohistoquímica | Inmunofenotipo | Citogenética |
|---|---|---|---|
| MO indiferenciada | MPO+<3% PAS esterasa− | HLA-DR, CD13, CD33, CD34CD7 y TDT− | 11q13; alt cr5 o 7 |
| M1 mieloide | MPO+<3% PAS esterasa− | Similar a M0 excepto CD15+/− | −5, −7, −17, del 3p, +21, +8 |
| M2 mieloide con diferenciación | MPO+>10% PAS esterasa− | HLA-DR, CD13, CD33, CD34+/−, CD15+ | t(8;21); del 3p o inv 3,−5, −7 t(6,9), +8 |
| M3 promielocítica | MPO++; PAS y esterasa− | HLA-DR, CD13, CD33, CD34+/− | t(15;17) |
| M4 mielomonocítica | MPO−; PAS- y esterasa+ | HLA-DR, CD14, CD33, CD34+/−, CD15+/−, CD11b+ | t(8;21); del 16q o inv 16, −5, −7, 8 |
| M5 monocítica | MPO−; PAS y esterasa+ | t(9;11), (p21;p23), +8 | |
| M6 eritroleucemia | MPO−; PAS++ y esterasa− | HLA-DR, CD13, CD33+/́−, glicoforina A++ | −5, −7, del (7q), del -3 +8 |
| M7 megaloblástica | MPO−; PAS+/− y esterasa− | HLA-DR, CD41, CD33+/́−, CD61, glicoproteína plaquetaria+ | t(12;21); hiperploidea +8; +21 |
LMA: leucemias mieloides agudas; MPO: mieloperoxidasa; PAS: ácido periódico de Schiff.
A nivel clínico, la sintomatología predominante es la astenia y la debilidad generalizada debida a la anemia. Pero también se presenta con episodios de epistaxis, petequias o fiebre8. El diagnóstico se establece mediante el análisis de la sangre periférica y de la médula ósea en el contexto clínico adecuado (por ejemplo, anemia refractaria no filiada en un paciente oncológico como ocurre en nuestros 2 casos).
En las LMA secundarias, están representados la mayor parte de los subtipos de la FAB, con predominio de M1-M2 y M5-M69. Se presenta un fenotipo clínico y morfológico característico: típicamente presenta una fase mielodisplásica previa que culmina en una LMA con un subtipo de la FAB poco frecuente (M6 y M7). El pico de incidencia es entre 4 a 6 años después del tratamiento quimioterápico del tumor primario, aunque la latencia puede variar desde un año hasta 20 años, estando directamente relacionadas con la dosis acumulada del agente alquilante y con la edad del paciente7. En los casos comentados en esta serie, la LMA secundaria se diagnosticó a los 4 y 7 años, respectivamente.
A diferencia de las alteraciones citogenéticas descritas en la LMA primaria, como t(15,17), t(8,21) e inv(16), en las leucemias secundarias las alteraciones cromosómicas más frecuentes son las pérdidas del cromosoma 7 y la delección de 5q. Estos codifican una serie de genes clave que dirigen la hematopoyesis y pueden jugar un papel en el comienzo y en la progresión del clon leucémico10. En uno de nuestros casos clínicos, se demostró que el cromosoma 7 estaba implicado.
Los agentes alquilantes contienen en su estructura grupos químicos capaces de formar enlaces covalentes y provocar entrecruzamientos dentro de la misma cadena de ADN, interfiriendo en la replicación del ADN11. La determinación de la distinta leucemogenicidad de los agentes alquilantes es difícil de establecer debido a que raramente se utilizan dichos agentes en monoterapia. El empleo de agentes alquilantes en los tumores ginecológicos está claramente establecido y se centra actualmente en los platinos, habitualmente combinados, para el tratamiento de la enfermedad metastática12. Los fármacos utilizados en nuestra serie de casos son el cisplatino y el carboplatino. Se ha descrito un riesgo leucemogénico asociado al uso de cisplatino (RR: 4). La radioterapia aislada no está asociada a un riesgo significativo (RR: 0,4), aunque hay un discreto aumento de la incidencia con la asociación de cisplatino y radioterapia (RR: 8,1). Sin embargo, el RR para ambos fármacos aumenta progresivamente con el aumento de las dosis totales acumuladas12.
Por otro lado, el tratamiento con los inhibidores de PARP también se ha sugerido un aumento de la incidencia de LMA. De hecho, en nuestro segundo caso, la paciente se encontraba en tratamiento con olaparib en el momento del diagnóstico de la LMA secundaria. En el ensayo clínico fase III SOLO-2, se incluyen pacientes con recaída de cáncer de ovario platino-sensible con una mutación de BRCA en la línea germinal tratados con olaparib 400mg/12h como tratamiento de mantenimiento tras la respuesta a platinos. Los eventos de LMA se reportaron en pacientes tratados con olaparib, pero no se ha establecido una relación causal clara en un análisis post hoc que evalúa la incidencia de síndrome mielodisplásico y LMA. La incidencia global de síndrome mielodisplásico/LMA fue similar en los grupos con olaparib y placebo (2,1 versus 4,0%) Sin embargo, tanto con olaparib como con placebo, la incidencia de síndrome mielodisplásico/LMA pareció aumentar con un número creciente de líneas de tratamiento con platino previo. Aunque esta tendencia no parece incrementar por la edad de las pacientes. Una limitación de este análisis es el pequeño número de eventos que ocurrieron en cada grupo; sin embargo, los resultados de un análisis agrupado más amplio e independiente de los datos de los ensayos respaldan estos hallazgos13.
Se ha demostrado que el principal factor pronóstico para conseguir la curación de la enfermedad es la ausencia de alteraciones citogenéticas desfavorables. La respuesta completa a la quimioterapia se objetiva en torno al 13% de los pacientes con anormalidades del cromosoma 5 mientras que en los pacientes con monosomía del cromosoma 7 es del 32%14. Otros factores pronósticos desfavorables incluyen la edad avanzada en el momento del diagnóstico (>60 años), los antecedentes de mielodisplasia, la expresión del gen de resistencia multifarmacológica MDR1 y la presencia de blastos CD34+.
El tratamiento de inducción con antraciclinas junto al citarabina presenta una actividad escasa en las leucemias secundarias, alcanzándose respuestas completas (RC) solo en el 50% de los pacientes y habitualmente de corta duración (media de <5 meses). El trasplante alogénico es la única opción curativa disponible, aunque los resultados son también peores que en el caso de las leucemias primarias; se obtienen supervivencias a los 3 años del 25%, frente al 45-60% en los procesos primarios. Esta menor supervivencia parece deberse a un aumento de la mortalidad por el mayor número de recaídas y la mayor toxicidad del trasplante14.
ConclusionesLa aparición de una LMA secundaria es una complicación grave que pueden presentar los supervivientes oncológicos de largo tratamiento. En el cáncer ginecológico se desconoce su incidencia real, pero debido al aumento en la supervivencia se hace necesario un seguimiento a largo plazo. El diagnóstico se basa en la sospecha clínica y en la presencia de alteraciones citogenéticas compatibles, aunque el pronóstico es desfavorable. A pesar del efecto leucemogénico de los platinos en el cáncer ginecológico, los beneficios de dicha quimioterapia en la supervivencia superan ampliamente el riesgo de emplearlo. Sin embargo, una preocupación para el futuro es que la incidencia vaya en aumento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.