Determinar la frecuencia, la evolución clínica, el tratamiento y el desenlace de la lesión renal aguda (LRA) en pacientes embarazadas con preeclampsia severa (PS) menores de 20años de edad.
Material y métodoEstudio observacional, transversal, retrospectivo y analítico en una serie de 23 pacientes embarazadas menores de 20años de edad con PS atendidas en la UCI de un hospital de alta especialidad de la ciudad de México durante los años 2018 y 2019. Se consultaron los expedientes para conocer la frecuencia de enfermas que desarrollaron LRA (creatinina sérica ≥1,1mg/dl), complicaciones, diuresis, tratamiento con fármacos, terapia de reemplazo, desenlace (recuperación, hemodiálisis) y mortalidad. Los resultados se compararon con los de enfermas de la serie que no presentaron LRA. Se utilizó estadística descriptiva, prueba U de Mann Whitney y prueba exacta de Fisher con el programa SPSS versión 20.
ResultadosVeintidós enfermas tenían riñones nativos y una portaba injerto renal. La frecuencia de pacientes con LRA fue del 43,47% (n=10) con media de la creatinina sérica de 1,59±0,63mg/dl (límites 1,1 a 3,2) y diuresis de 0,91±0,74ml/kg/h. Las 23 enfermas recibieron furosemida como fármaco individual intravenoso (60,87%; n=14) o posterior a la infusión de solución NaCl 0,9% (39,13%; n=9). La LRA se recuperó en el 39,13% (n=9) y se precisó hemodiálisis en la paciente trasplantada (4,34%), con muerte materna del 0%.
ConclusionesLa frecuencia de LRA fue elevada, con un solo caso que requirió hemodiálisis, sin mortalidad materna. El uso irrestricto de furosemida en todos los casos resultó relevante.
To determine the frequency, clinical course, treatment and outcome of acute kidney injury (AKI) in pregnant patients under 20years of age with severe preeclampsia (SP).
Material and methodObservational, cross-sectional, retrospective and analytical study in a series of 23 pregnant patients under 20years of age with SP attended in the Intensive Care Unit (ICU) of a high specialty hospital in Mexico City during the years 2018 and 2019. Records were consulted to determine the frequency of patients that developed AKI (serum creatinine ≥1.1mg/dL), complications, diuresis, drug treatment, replacement therapy, outcome (recovery, haemodialysis), and mortality. The results were compared with those of the patients in the series that did not present with an AKI. Descriptive statistics, Mann Whitney U test and Fisher's exact test, using SPSS version 20, were used.
ResultsTwenty-two patients had native kidneys and one had a kidney graft. The frequency of patients with AKI was 43.47% (n=10) with mean serum creatinine 1.59±0.63mg/dL (range 1.1 to 3.2) and urine volume 0.91±0.74ml/kg/hour. All 23 patients received furosemide, as an individual drug intravenously 60.87% (n=14), and 39.13% (n=9) after the infusion of 0.9% NaCl solution. AKI recovered in 39.13% (n=9), and haemodialysis was performed in the transplanted patient (4.34%), with 0% maternal death.
ConclusionsThe frequency of AKI was high with only one case requiring haemodialysis, and no maternal mortality. The unrestricted use of furosemide in all cases was relevant.
El embarazo en las mujeres jóvenes, principalmente adolescentes, es considerado de alto riesgo porque conlleva un alto porcentaje de complicaciones y mayores probabilidades de muerte materna, fetal o ambas1-5. En el contexto latinoamericano el número de mujeres con embarazo en la etapa temprana de la vida reproductiva se está incrementando. Esto es particularmente cierto en las zonas marginadas de nuestra nación y en los países en vías de desarrollo de otras regiones del mundo donde las carencias para la atención a la salud son la regla y los recursos para la orientación reproductiva no son los mejores6,7.
A su vez, la edad y la nuliparidad son factores predisponentes reconocidos para el desarrollo de la preeclampsia, el estado hipertensivo que con mayor frecuencia complica al embarazo. Las complicaciones maternas de la preeclampsia dependen del daño endotelial, de la severidad de la hipertensión arterial y de sus efectos sobre los órganos vitales, como los riñones. Durante el embarazo la función renal es particularmente difícil de evaluar con precisión porque los cambios gestacionales modifican sustancialmente las variables necesarias para calcularla8. Además, las fórmulas matemáticas que se aplican para la población abierta no son del todo útiles en las mujeres embarazadas porque han mostrado errores, imprecisiones e inconveniencias técnicas9,10. Las clasificaciones RIFLE (Risk, Injury, Failure, Long, End) y AKIN (Acute Kidney Injury Networth) también han mostrado inconsistencias cuando se aplican al grupo de pacientes embarazadas críticamente enfermas11,12. Los expertos de la preeclampsia en México, Estados Unidos de Norteamérica, Canadá y otros países han recomendado unánimemente el valor de la creatinina sérica con el punto de corte ≥1,1mg/dl como el criterio estándar de oro para identificar la LRA en las pacientes con preeclampsia. La diuresis, un parámetro esencial de las clasificaciones RIFLE y AKIN, no lo es en el contexto de la preeclampsia; los expertos la han incluido como uno de los hallazgos de severidad y no como criterio diagnóstico del compromiso renal1-5.
En la preeclampsia, como en otras entidades patológicas, la afectación renal se puede englobar en el concepto de lesión renal aguda (LRA), el cual se utiliza para referirse a los diferentes grados de alteración que van desde el mínimo deterioro prerrenal hasta la insuficiencia renal aguda irreversible13-16. La LRA cobra importancia porque incrementa la morbimortalidad materna, sobre todo cuando ocurre en el escenario del síndrome HELLP (Hemolysis, Elevated Liver enzymes, Low Platelet count)17. En el año 2017, Olaya-Garay et al.18 reportaron los resultados de un estudio que incluyó 171 mujeres embarazadas colombianas con preeclampsia severa (PS), síndrome HELLP y eclampsia. Encontraron un 26,9% (46 casos) de pacientes menores de 20años y un 73,1% (125 casos) que superaban ese límite de edad. En el grupo de mujeres jóvenes se encontraron diferencias en las cifras de la presión sanguínea y los hallazgos de severidad, pero no se estudió la función renal. En la literatura médica el tópico es poco o nulamente abordado, y en este contexto se realizó la presente investigación con el objetivo de determinar la frecuencia, la evolución clínica, el tratamiento y el desenlace de la LRA en pacientes embarazadas con PS menores de 20años de edad. Se trata de la experiencia 2018-2019 de un hospital de alta especialidad de la ciudad de México.
Material y métodoSe realizó un estudio observacional, transversal, retrospectivo y analítico. Se consultó el registro de las pacientes atendidas en la unidad de cuidados intensivos (UCI) del Hospital de Gineco-Obstetricia No. 3 del Instituto Mexicano del Seguro Social de la ciudad de México durante los años 2018 y 2019. Se seleccionaron las enfermas menores de 20años de edad con embarazo ≥20semanas y diagnóstico establecido de PS, con cualquier paridad y comorbilidades, con finalización gestacional en las instalaciones del mismo hospital y con su expediente y reportes del laboratorio disponibles. Se consultaron los expedientes, las notas de enfermería y los reportes del laboratorio clínico para identificar a las pacientes que tuvieron LRA. El único criterio para definir la LRA fue el valor sérico de la creatinina con punto de corte ≥1,1mg/dl en cualquier momento de su estancia en la UCI, porque así lo recomienda la literatura oficial mexicana y los expertos internacionales en el tema de la preeclampsia1-5.
Se estudió la frecuencia de pacientes con LRA y las complicaciones renales, los máximos valores de la creatinina sérica, la diuresis horaria, el tratamiento con fármacos, la terapia de reemplazo con diálisis, el desenlace (LRA recuperada, hemodiálisis) y la mortalidad. Como datos generales se registraron la edad, las comorbilidades, la presión sanguínea, la diuresis horaria, los valores sanguíneos del nitrógeno de la urea, ácido úrico, aspartato aminotransferasa, alanina aminotransferasa y deshidrogenasa láctica reportados por el laboratorio como «perfil toxémico», el tiempo de estancia en la UCI y la mortalidad. Los resultados obstétricos y perinatales incluyeron la paridad, las semanas gestacionales, la frecuencia de prematurez, el síndrome HELLP y la eclampsia, la finalización del embarazo con la operación cesárea o vía vaginal, el tipo de anestesia, la cantidad de la hemorragia intraparto, las complicaciones maternas, el tiempo transcurrido desde su admisión hasta el nacimiento, el número de recién nacidos y su peso, talla, calificación de Apgar al minuto1 y 5, la mortalidad fetal y la materna. Los resultados se compararon con los de enfermas de la serie que no presentaron LRA.
Para la realización del estudio se contó previamente con el dictamen de aprobación (Registro R-2019-3504-003) del Comité Local de Educación e Investigación en Salud (CLEIS) correspondiente al hospital sede. Para el análisis estadístico se utilizaron medidas de estadística descriptiva (media, mediana, desviación estándar, rango) e inferencial (prueba U de Mann Whitney y prueba exacta de Fisher) con el programa SPSS 20.
ResultadosDurante los años 2018 y 2019 se atendió a un total de 879 enfermas en la UCI, de las cuales 280 fueron pacientes embarazadas con PS, y de ellas se identificaron 23 menores de 20años de edad; todas se incluyeron en la investigación porque reunieron los criterios de selección. Las 23 mujeres del estudio representaron el 2,61% del total de ingresos a la UCI y el 8,21% del total de pacientes embarazadas con PS atendidas en el área de cuidados críticos. El tratamiento farmacológico general que recibieron las 23 pacientes estudiadas se muestra en la tabla 1.
Tratamiento farmacológico en la unidad de cuidados intensivos de las 23 pacientes del estudio
| Fármacos | Prescripción |
|---|---|
| Soluciones cristaloidesn=23 (100%) | Solución NaCl 0,9%1.000ml i.v. cada 8h |
| Agentes antihipertensivos oralesn=23 (100%) | Dos fármacos n=19 (82,61%)metildopa/hidralazina n=16metildopa/nifedipino n=3 |
| Tres fármacos n=4 (17,39%)metildopa-hidralazina-metoprolol n=1metildopa-hidralazina-nifedipino n=1metildopa-nifedipino-metoprolol n=1hidralazina-nifedipino-metoprolol n=1 | |
| Fármacos neuroprotectoresn=19 (82,61%)Ningunon=4 (17,39%) | fenitoína sódica i.v. n=13 (56,52%)sulfato de magnesio i.v. n=6 (26,09%) |
| Diurético de asan=23 (100%) | furosemida 40mg i.v. cada 8 h n=14 (60,86%)furosemida 40mg i.v. dosis única luego de una carga i.v. de 500ml de solución NaCl 0,9% n=9 (39,14%) |
| Hemodiálisis posparton=1 (4,34%) | Sesiones programadas de hemodiafiltración acorde a requerimientos |
i.v.: intravenosa.
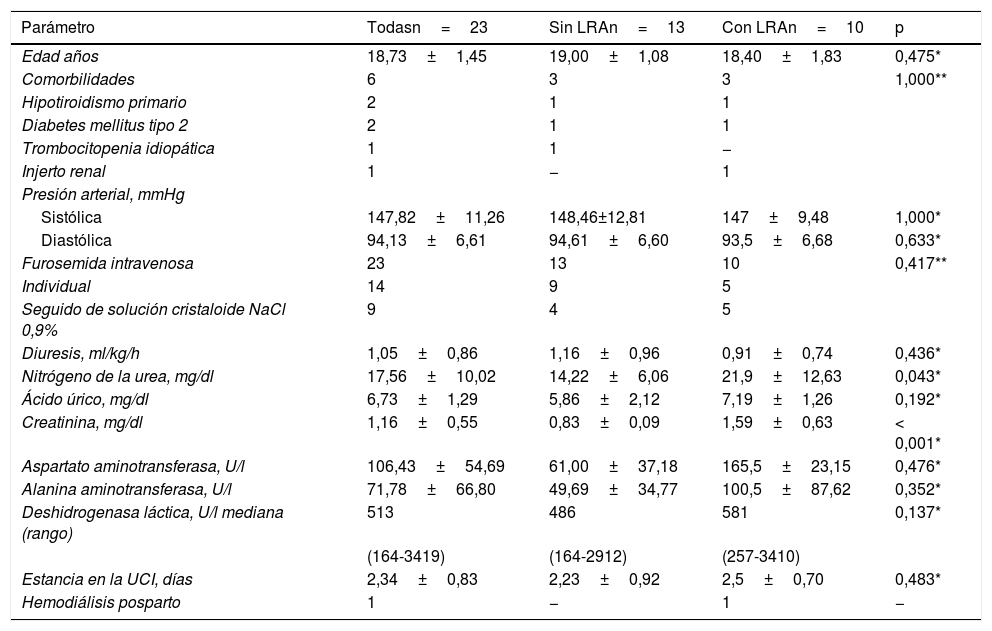
La frecuencia de pacientes con LRA fue del 43,48% (10 casos). Se documentaron riñones nativos en el 39,13% (9 casos) y con injerto renal en el 4,34% (un caso). La media de la creatinina sérica de las 10 enfermas fue de 1,59±0,63mg/dl (límites 1,1 a 3,2) y de la diuresis de 0,91±0,74ml/kg/h (límites 0,2 a 2,5). No hubo complicaciones de la LRA. Las 23 enfermas recibieron furosemida como fármaco individual intravenoso (60,87%; n=14, 9 casos sin LRA y 5 casos con LRA) o posterior a la infusión de solución NaCl en concentración de 0,9% (39,13%; n=9, 4 casos sin LRA y 5 casos con LRA); no hubo diferencia intergrupo (p=0,417) Las características generales y las variables de interés se muestran en la tabla 2.
Comparación de las características generales y variables de interés de las 23 pacientes del estudio
| Parámetro | Todasn=23 | Sin LRAn=13 | Con LRAn=10 | p |
|---|---|---|---|---|
| Edad años | 18,73±1,45 | 19,00±1,08 | 18,40±1,83 | 0,475* |
| Comorbilidades | 6 | 3 | 3 | 1,000** |
| Hipotiroidismo primario | 2 | 1 | 1 | |
| Diabetes mellitus tipo 2 | 2 | 1 | 1 | |
| Trombocitopenia idiopática | 1 | 1 | − | |
| Injerto renal | 1 | − | 1 | |
| Presión arterial, mmHg | ||||
| Sistólica | 147,82±11,26 | 148,46±12,81 | 147±9,48 | 1,000* |
| Diastólica | 94,13±6,61 | 94,61±6,60 | 93,5±6,68 | 0,633* |
| Furosemida intravenosa | 23 | 13 | 10 | 0,417** |
| Individual | 14 | 9 | 5 | |
| Seguido de solución cristaloide NaCl 0,9% | 9 | 4 | 5 | |
| Diuresis, ml/kg/h | 1,05±0,86 | 1,16±0,96 | 0,91±0,74 | 0,436* |
| Nitrógeno de la urea, mg/dl | 17,56±10,02 | 14,22±6,06 | 21,9±12,63 | 0,043* |
| Ácido úrico, mg/dl | 6,73±1,29 | 5,86±2,12 | 7,19±1,26 | 0,192* |
| Creatinina, mg/dl | 1,16±0,55 | 0,83±0,09 | 1,59±0,63 | < 0,001* |
| Aspartato aminotransferasa, U/l | 106,43±54,69 | 61,00±37,18 | 165,5±23,15 | 0,476* |
| Alanina aminotransferasa, U/l | 71,78±66,80 | 49,69±34,77 | 100,5±87,62 | 0,352* |
| Deshidrogenasa láctica, U/l mediana (rango) | 513 | 486 | 581 | 0,137* |
| (164-3419) | (164-2912) | (257-3410) | ||
| Estancia en la UCI, días | 2,34±0,83 | 2,23±0,92 | 2,5±0,70 | 0,483* |
| Hemodiálisis posparto | 1 | − | 1 | − |
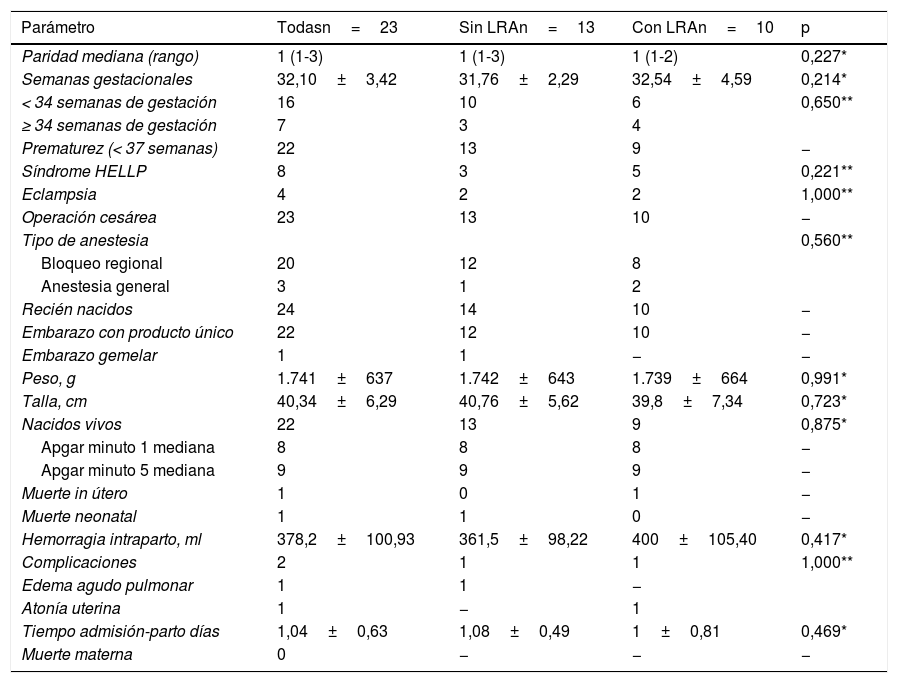
El desenlace de la LRA fue como sigue: recuperación 39,13% (9 casos) y hemodiálisis subsecuente 4,34% (un caso). La enferma que requirió de hemodiálisis tenía 19años de edad con injerto renal de 2años de evolución a partir de un donador vivo relacionado (padre) y tratada con medicación inmunosupresora a base de prednisona 5mg/día y azatioprina 100mg/día. Cursaba su primer embarazo con 21,3semanas y fue admitida a la UCI por la presencia de PS y LRA sobreagregada (concentración de la creatinina sérica 3,2mg/dl) con volúmenes urinarios normales. Luego de la finalización del embarazo fue trasladada a la unidad de trasplante renal para continuar con la terapia de reemplazo, seguimiento clínico y estudios especiales del injerto. Cuando se compararon los datos generales de las pacientes con LRA con los de las enfermas que no la presentaron no se documentaron diferencias significativas (tabla 2). Lo mismo ocurrió cuando se compararon los resultados obstétricos y perinatales (tabla 3).
Resultados obstétricos y perinatales
| Parámetro | Todasn=23 | Sin LRAn=13 | Con LRAn=10 | p |
|---|---|---|---|---|
| Paridad mediana (rango) | 1 (1-3) | 1 (1-3) | 1 (1-2) | 0,227* |
| Semanas gestacionales | 32,10±3,42 | 31,76±2,29 | 32,54±4,59 | 0,214* |
| < 34 semanas de gestación | 16 | 10 | 6 | 0,650** |
| ≥ 34 semanas de gestación | 7 | 3 | 4 | |
| Prematurez (< 37 semanas) | 22 | 13 | 9 | − |
| Síndrome HELLP | 8 | 3 | 5 | 0,221** |
| Eclampsia | 4 | 2 | 2 | 1,000** |
| Operación cesárea | 23 | 13 | 10 | − |
| Tipo de anestesia | 0,560** | |||
| Bloqueo regional | 20 | 12 | 8 | |
| Anestesia general | 3 | 1 | 2 | |
| Recién nacidos | 24 | 14 | 10 | − |
| Embarazo con producto único | 22 | 12 | 10 | − |
| Embarazo gemelar | 1 | 1 | − | − |
| Peso, g | 1.741±637 | 1.742±643 | 1.739±664 | 0,991* |
| Talla, cm | 40,34±6,29 | 40,76±5,62 | 39,8±7,34 | 0,723* |
| Nacidos vivos | 22 | 13 | 9 | 0,875* |
| Apgar minuto 1 mediana | 8 | 8 | 8 | − |
| Apgar minuto 5 mediana | 9 | 9 | 9 | − |
| Muerte in útero | 1 | 0 | 1 | − |
| Muerte neonatal | 1 | 1 | 0 | − |
| Hemorragia intraparto, ml | 378,2±100,93 | 361,5±98,22 | 400±105,40 | 0,417* |
| Complicaciones | 2 | 1 | 1 | 1,000** |
| Edema agudo pulmonar | 1 | 1 | − | |
| Atonía uterina | 1 | − | 1 | |
| Tiempo admisión-parto días | 1,04±0,63 | 1,08±0,49 | 1±0,81 | 0,469* |
| Muerte materna | 0 | − | − | − |
La incidencia de LRA en la preeclampsia se ha reportado del 4 al 60% en diferentes series y épocas, pero siempre relacionada con una evolución adversa y con incremento de las defunciones19-21. Se encontró que la frecuencia de la LRA fue del 43,47% (10 casos); se puede considerar como un porcentaje elevado porque en nuestro sitio de trabajo se han llevado a cabo investigaciones en pacientes con PS, síndrome HELLP, eclampsia, hemorragia intraparto o en mujeres críticamente enfermas por diversas causas, y en todas ellas se han reportado cifras menores de LRA22-28 (tabla 4).
Frecuencia de lesión renal aguda en pacientes obstétricas del Hospital de Gineco-Obstetricia No. 3 del IMSS, Ciudad de México
| Año del reporte | Tipo de pacientes | Frecuencia |
|---|---|---|
| 201122 | Síndrome HELLP | 5,26% |
| 201623 | Preeclampsia severa | 6,2% |
| 201724 | Mujeres en estado crítico de la unidad de cuidados intensivos | 4,82% |
| 201825 | Síndrome HELLP | 6,25% |
| 201826 | Preeclampsia severa con hiperuricemia | 14% |
| 202027 | Hemorragia intraparto y cesárea | 14,03% |
| 202028 | Eclampsia | 26,08% pre-ictal |
| 56,52% post-ictal | ||
| 2020 actual investigación | Preeclampsia severa <20años | 43,47% |
HELLP: Hemolysis, Elevated Liver enzymes, Low Platelet count; IMSS: Instituto Mexicano del Seguro Social.
Además de su frecuencia elevada, la LRA en las pacientes del estudio tuvo otros datos de interés. Puntualmente se trató de una complicación poco o nada severa, con la concentración sérica máxima de la creatinina en 3,2mg/dl y con la presentación más usual de tipo no oligúrico porque los volúmenes urinarios resultaron normales. Su evolución prácticamente no mostró complicaciones y la necesidad de la terapia de reemplazo con hemodiálisis ocurrió esporádicamente (4,34%, un caso) en una paciente con injerto renal. La LRA no tuvo efecto sobre el tiempo de espera para la finalización del embarazo ni de la estancia en la UCI y no resultó en una causa de muerte materna.
Ninguno de los datos generales, hallazgos de severidad de la preeclampsia, de la función renal, resultados obstétricos y perinatales distinguió a los casos con LRA de los que no la presentaron (tablas 2 y 3). En la gran mayoría de las enfermas se documentó una adecuada respuesta al tratamiento conservador de la LRA acorde a las recomendaciones de la literatura actual29.
El volumen de la diuresis horaria resultó normal probablemente porque el tratamiento parenteral con soluciones cristaloides corrigió la deshidratación-hipovolemia, un factor prerrenal que las enfermas con PS padecen en un inicio. También debe considerarse el efecto del diurético (tablas 1 y 2). Resultó relevante que todas las enfermas recibieron furosemida como fármaco individual o posterior a la infusión intravenosa de líquidos cristaloides con NaCl en concentración 0,9% con la intención de aumentar los volúmenes urinarios (tablas 1 y 2). Esta situación se debe considerar como una desviación grave porque la literatura no recomienda la administración liberal de los agentes diuréticos como parte del tratamiento de la preeclampsia y/o de la LRA durante el embarazo o el puerperio debido a que su efecto puede deteriorar la función renal30,31.
Otro aspecto destacable de la investigación fue que no se utilizó alguno de los biomarcadores que la literatura recomienda para el diagnóstico precoz del compromiso renal agudo32. Así, todos los casos complicados con LRA fueron identificados de manera tardía, esto es a partir del incremento de la concentración de la creatinina sérica detectado en sus exámenes de laboratorio rutinario.
La terapia de reemplazo con hemodiálisis resultó necesaria en el 4,34%, y fue el caso de una mujer con injerto renal de la que no se tuvo conocimiento del valor sérico de la creatinina pregestacional ni de las concentraciones sanguíneas de los fármacos inmunosupresores que recibió durante el embarazo, por lo que no se tuvo la oportunidad de documentar un rechazo del injerto como posible daño previo.
Drakeley et al.33 estudiaron 72 pacientes con PS y LRA admitidas en la UCI de un hospital de Sudáfrica y encontraron un elevado porcentaje de comorbilidades crónicas y de complicaciones graves del embarazo, como el síndrome HELLP (32%), con elevada tasa de muerte perinatal (38%), y la concentración máxima de la creatinina sérica de 3,85mg/dl, pero con bajos requerimientos de diálisis a corto plazo (10%), ningún caso con diálisis a largo plazo o con indicación de trasplante renal, y mortalidad materna del 0%. Los autores identificaron factores predisponentes de la LRA en sus pacientes con PS, pero con bajo impacto de esta complicación sobre el curso clínico materno y el desenlace renal. De manera similar, en este estudio se encontró a la LRA como una complicación materna acompañante de la PS cuya característica relevante fue su bajo impacto porque no mostró progresión a situaciones de extrema gravedad posiblemente debido a la finalización gestacional oportuna y los cuidados intensivos, un beneficio deseado desde hace tres décadas que se está alcanzando en los años recientes34,35.
ConclusionesLa frecuencia de LRA fue elevada pero sin efecto sobre la evolución clínica, con bajo porcentaje de requerimiento de hemodiálisis y sin casos de muerte materna. Se recomienda que la atención de las pacientes embarazadas con PS menores de 20años de edad se otorgue en un centro de alta especialidad que cuente con una UCI para mejorar los resultados maternos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos.Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación dedatos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.