Presentamos un caso de carcinosarcoma de cérvix asociado a un teratoma quístico maduro de ovario, en una mujer de 55 años con diabetes, HTA y depresión. Consultó por metrorragia y tumoración pélvica. Se practicó histerectomía total, doble anexectomía y linfadenectomía. Recibió radioterapia (RT), 45Gy, y quimioterapia, 3 ciclos de cis-diamminedichloroplatinum II (CDDP). Presentó recurrencia pélvica, y se remitió para RT paliativa.
Inmunohistoquimia del tumor: positividad para citoqueratinas, antígeno epitelial de membrana y antígeno carcinoembrionario en el componente epitelial, y vimentina en el componente mesenquimal. Positividad de las células tumorales al virus papiloma humano 16 (VPH-16).
We present a case of carcinosarcoma of the uterine cervix associated with an ovarian mature cystic teratoma in a 55-year-old woman with diabetes, hypertension and depression. The patient presented with metrorrhagia and a pelvic tumor. Total hysterectomy plus bilateral salpingo-oophorectomy and lymphadenectomy were performed. The patient received 45Gy radiotherapy, and chemotherapy, with three cycles of cisplatin but developed pelvic recurrence and was transferred for palliative radiotherapy.
Tumoral immunostaining was positive for cytokeratins, epithelial membrane antigen and carcino embrionary antigen in the epithelial component, and vimentin in the mesenchymal component. The tumoral cells were positive for HPV–16.
Los carcinosarcomas (CS) son tumores poco frecuentes. El lugar de presentación más común en el tracto genital femenino es el cuerpo uterino, y su localización en el cérvix es extremadamente rara, con sólo alrededor de cincuenta casos descritos1. El primero que lo describió en esta localización fue Ferreira en 1951.
Las más afectadas son las mujeres posmenopáusicas de entre 50 y 65 años. Histológicamente, son tumores bifásicos, es decir, con componentes malignos, epitelial (carcinoma) y mesenquimal (sarcoma). Si el componente sarcomatoso se diferencia en elementos propios del órgano en el que asienta se le denomina homólogo (tejido fibroso y músculo liso), o heterólogo, cuando lo hace en elementos diferentes (cartílago, grasa, hueso o músculo estriado).
Los CS de cérvix se dan entre los 30 y los 80 años, con una edad media de 65 años. Cursan con sangrado vaginal, metrorragia posmenopáusica, leucorrea o dolor abdominal. Masa sólida o polipoide que reemplaza al cérvix. Dan metástasis linfáticas y hematógenas en pelvis, paraaórticas, tejidos blandos, vagina, superficie peritoneal y pulmones. El pronóstico es según el estadio al diagnóstico. El diagnóstico diferencial es con otros sarcomas y con el cáncer de endometrio. El tratamiento es la histerectomía total con doble anexectomía y exéresis del tumor extrauterino. Luego, radioterapia (RT). La supervivencia a 5 años es del 18–39%, con una media de 15 meses.
En este trabajo presentamos el caso de una mujer de 55 años, con CS de cérvix asociado a un teratoma quístico maduro de ovario derecho (OD); se describe su perfil clínico, histopatológico e inmunohistoquímico. Luego, revisamos los CS de cérvix.
Caso clínicoMujer de 55 años, G2P2, con antecedentes de HTA, diabetes tipo 2 en tratamiento con antidiabéticos orales y depresión en tratamiento con antidepresivos. Consultó el 25-06-2007 por metrorragia y tumoración pélvica. Presentaba una masa dura que ocupaba el hemiabdomen inferior hasta el ombligo. En la ecografía abdominal: masa heterogénea mayor de 10cm de diámetro, desestructurada, compatible con mioma degenerado o sarcoma.
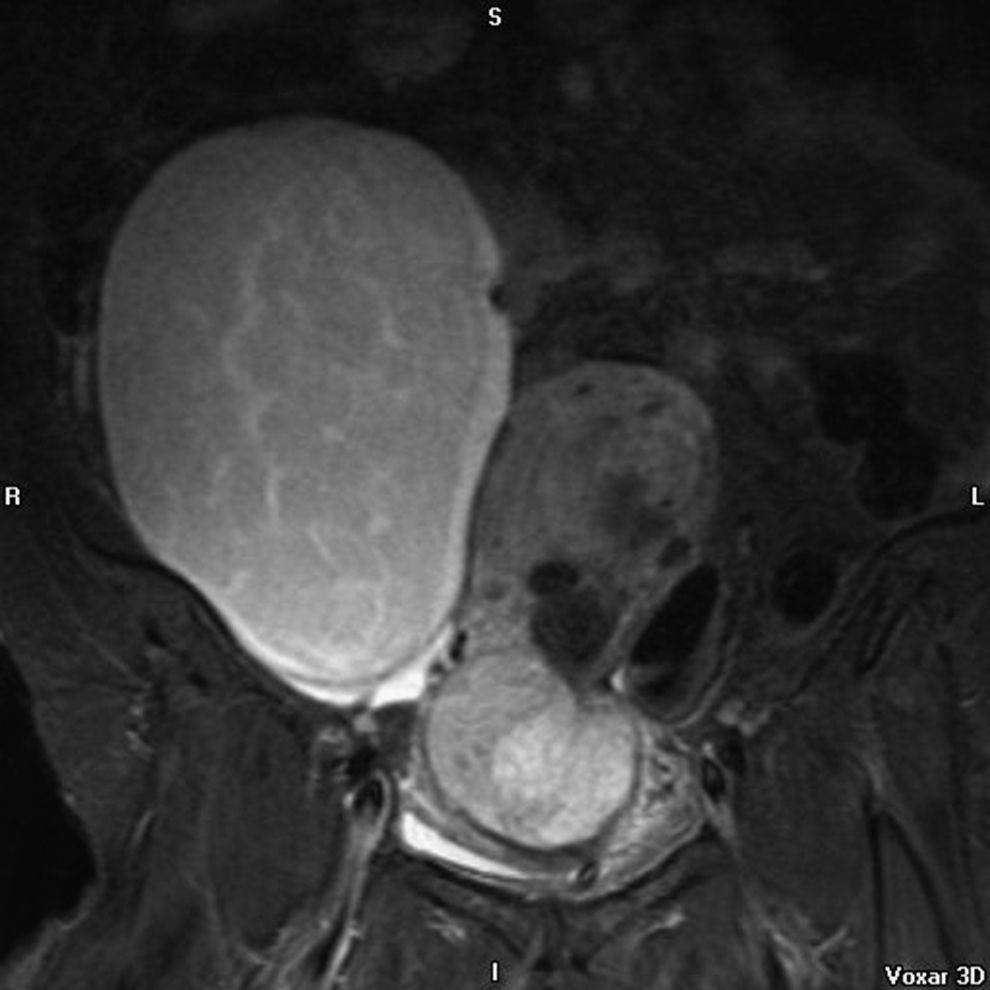
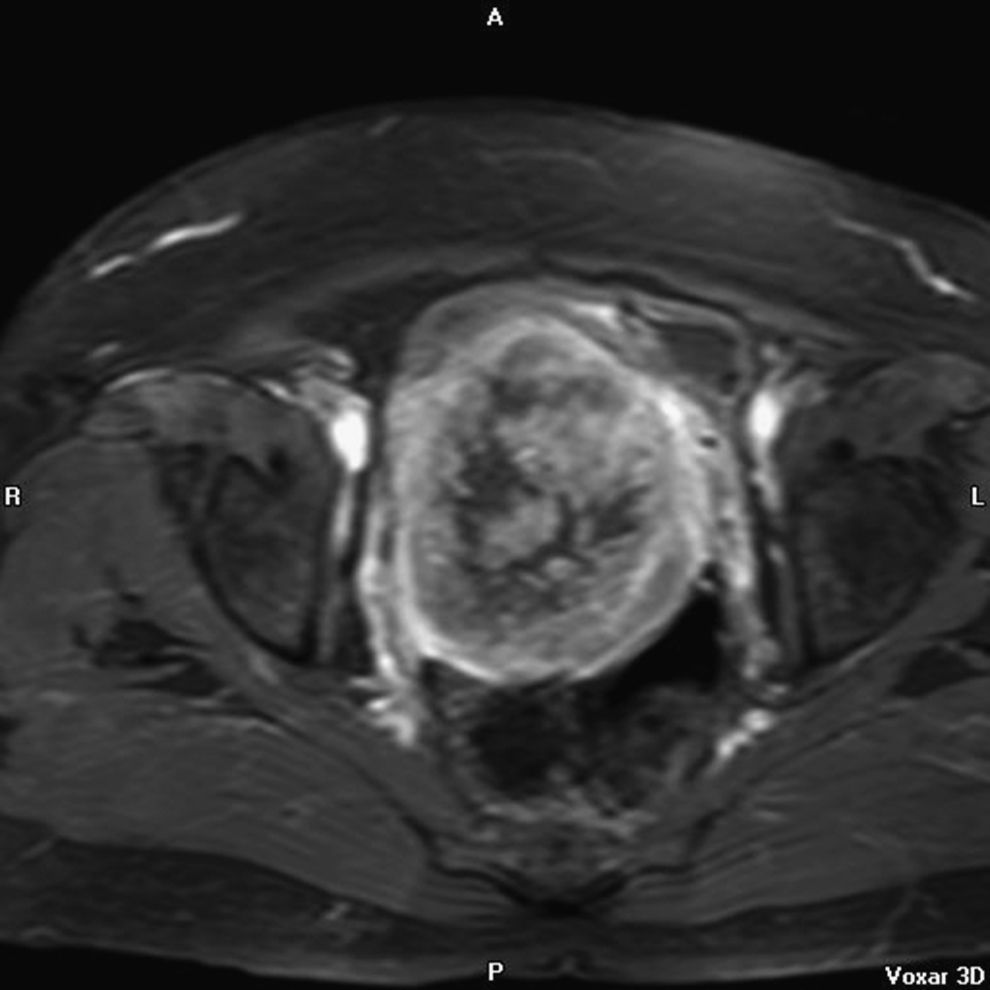
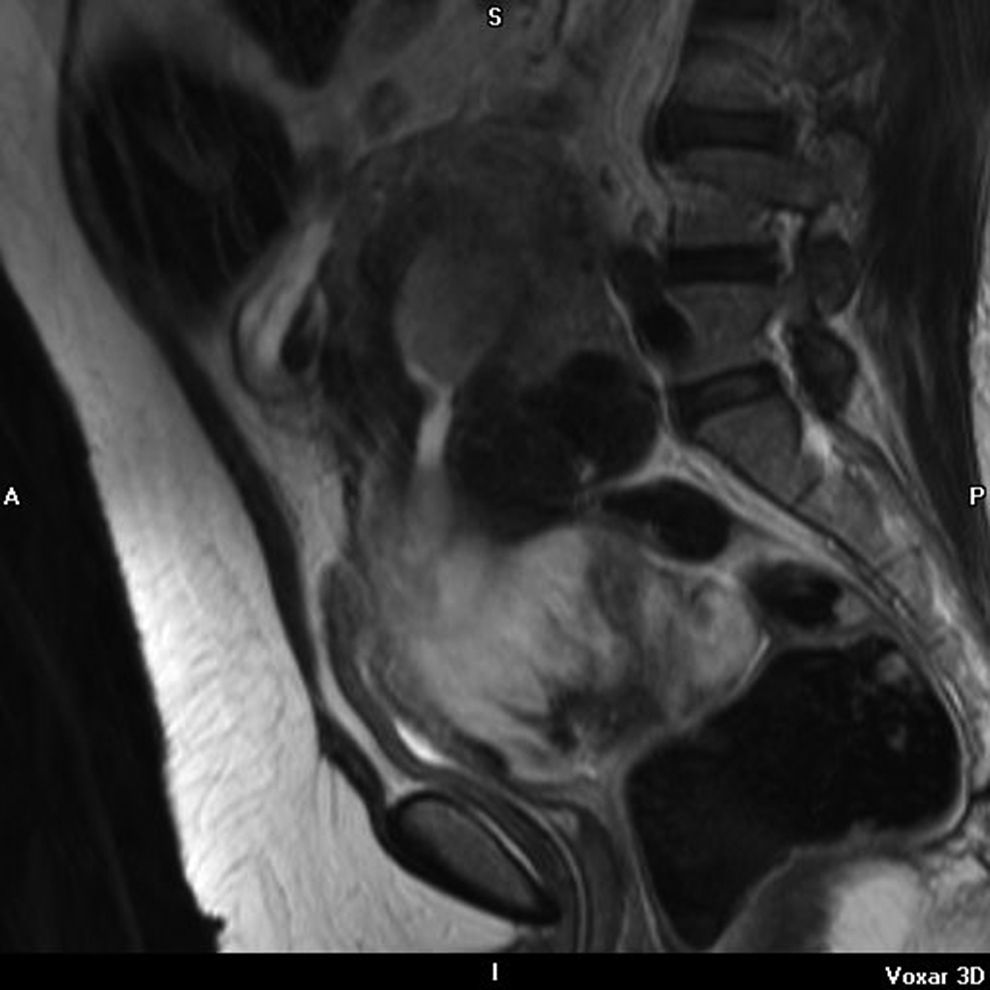
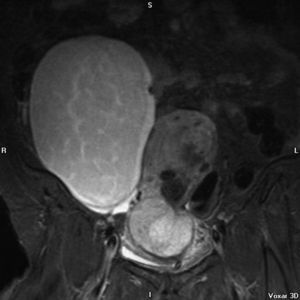
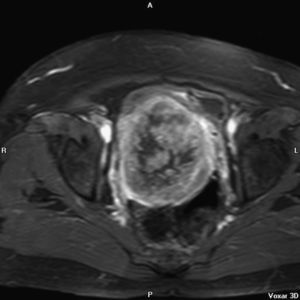
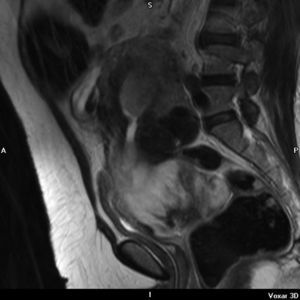
En la resonancia magnética nuclear (RMN) del 26-06-2007, el útero estaba aumentado con varios miomas y con una tumoración en cérvix de 10cm (figs. 1,2 y 3); comprimía y se extiendía a la vagina e infiltraba el parametrio izquierdo. Era sólida y con necrosis intratumoral; no infiltraba la vejiga ni el recto. La cavidad endometrial estaba dilatada por la masa e infiltraba el mioma. Sería la misma lesión tumoral y correspondería a un sarcoma uterino. Además, se veía una masa voluminosa parauterina derecha, intraperitoneal, de 18×12cm; ocupaba la fosa ilíaca derecha y el vacío derecho. Es una lesión quística heterogénea, de origen anexial o mesentérico. Existen adenopatías retroperitoneales, posiblemente tumorales, paraaórticas e interaortocava. No hay ureterohidronefrosis.
La biopsia del cérvix informó de tumor mesodérmico mixto maligno, CS de cérvix.
El 28-06-2007 se practicó laparotomía, y se encontró un tumor de OD de 20cm de diámetro (se practica anexectomía derecha), y un gran tumor cervical de 10cm de diámetro. Se practicó liberación del útero y del tumor de cérvix, y posteriormente histerectomía total+anexectomía izquierda. Se extirparon ganglios linfáticos ilíacos externos izquierdos. El postoperatorio fue de curso normal y se dio de alta al 4.o día.
El informe de Anatomía PatológicaMacroscópica: pieza de histerectomía y anexectomía izquierda con trompa derecha, con un peso de 655g. El cuerpo uterino mide 10×7,5×6,5cm. El cérvix está intensamente dilatado con un diámetro de 6,5cm por cuyo extremo distal aparece gran cantidad de material necrótico parduzco que dilata mucho el orificio cervical externo. Tras la apertura de la pieza, el cérvix aparece completamente ocupado por material necrótico. La tumoración se extendía en toda la longitud cervical, parecía respetar la cavidad endometrial e infiltraba 2/3 del grosor de la pared. La cavidad endometrial aparece desplazada por múltiples leiomiomas subserosos e intramurales en el miometrio, con tamaños comprendidos entre 0,3 y 4,5cm.
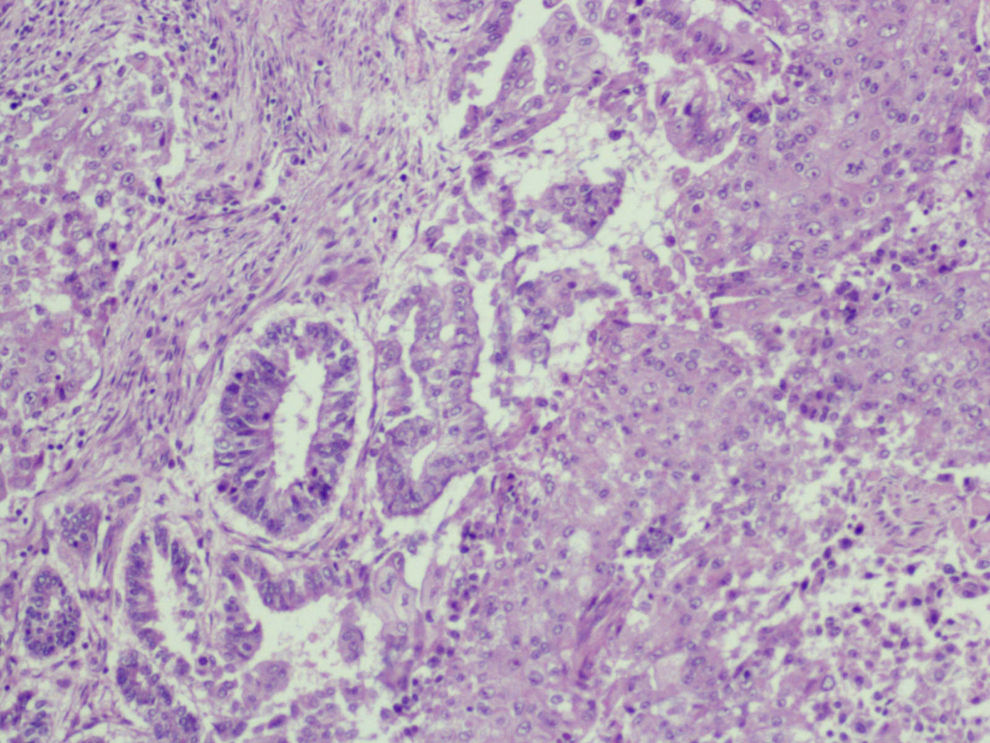
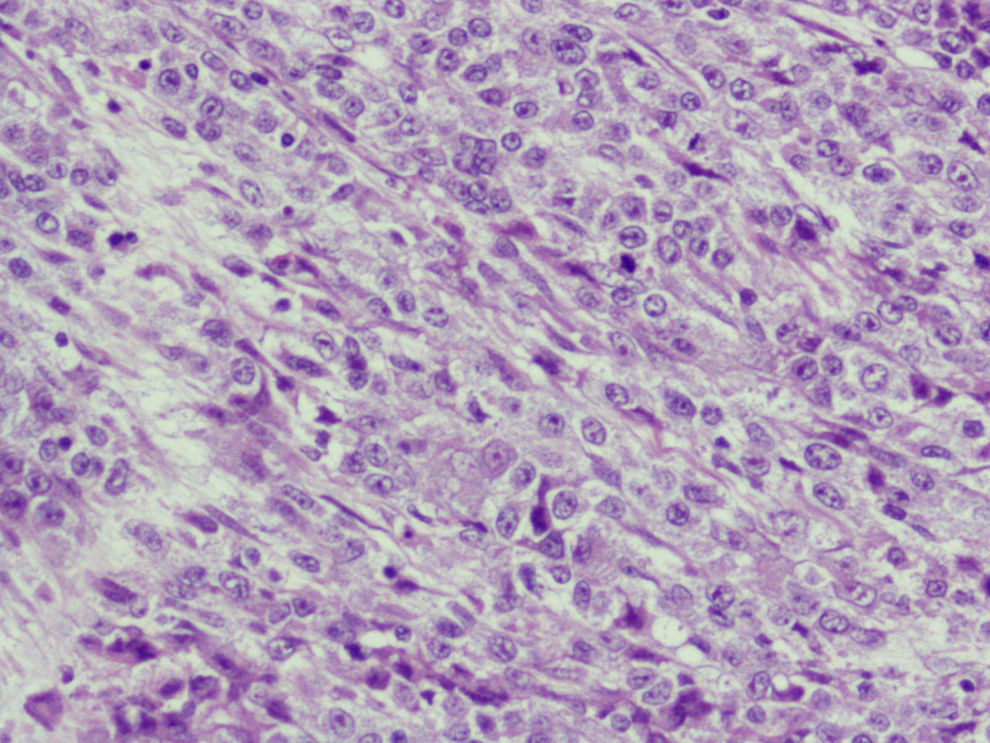
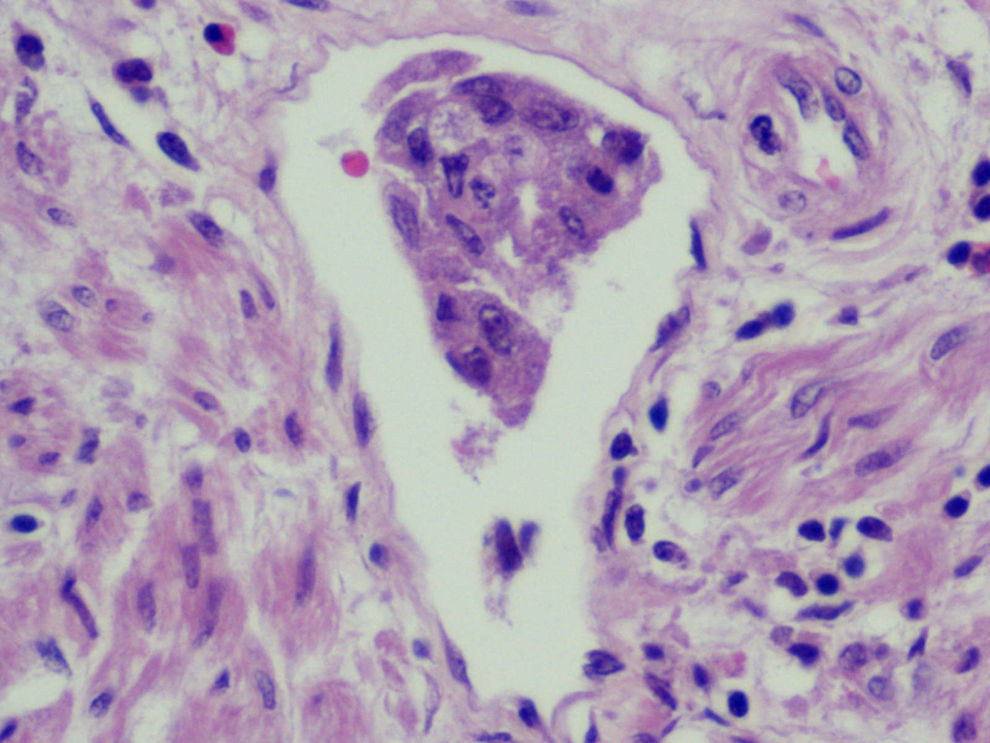
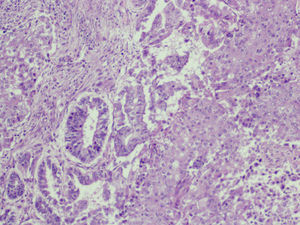
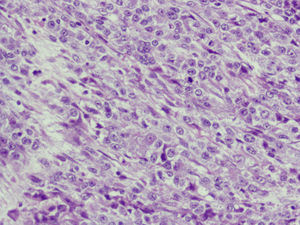
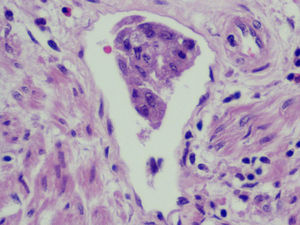
Microscópica: histológicamente el tumor se caracterizaba por un carcinoma de diferenciación escamosa, con escasa formación de glándulas y zonas poco diferenciadas (fig. 4). El componente mesenquimal, menos extenso que el anterior, consistía en un sarcoma estromal homólogo con células a veces de morfología fusiforme, y que en algunas zonas se disponían en haces con aspecto de fibrosarcoma. El pleomorfismo era marcado y las mitosis eran numerosas (fig. 5). La neoplasia se extendía al endometrio en la porción yuxtacervical con presencia de embolización en numerosos vasos del miometrio (fig. 6), y respetaba el borde de resección vaginal, así como el anexo izquierdo y la trompa derecha. El diagnóstico fue tumor mesodérmico mixto maligno (CS), que afectala al cérvix en toda su longitud y en más de 2/3 de su espesor, sin evidencia de alcanzar la serosa. Afectación del istmo uterino y del endometrio, con masiva embolización de los vasos miometriales. El borde de resección inferior, sin signos de infiltración tumoral. El parametrio derecho, sin infiltración tumoral focal. El parametrio izquierdo, libre. Múltiples leiomiomas en miometrio. El ganglio ilíaco externo, libre de infiltración.
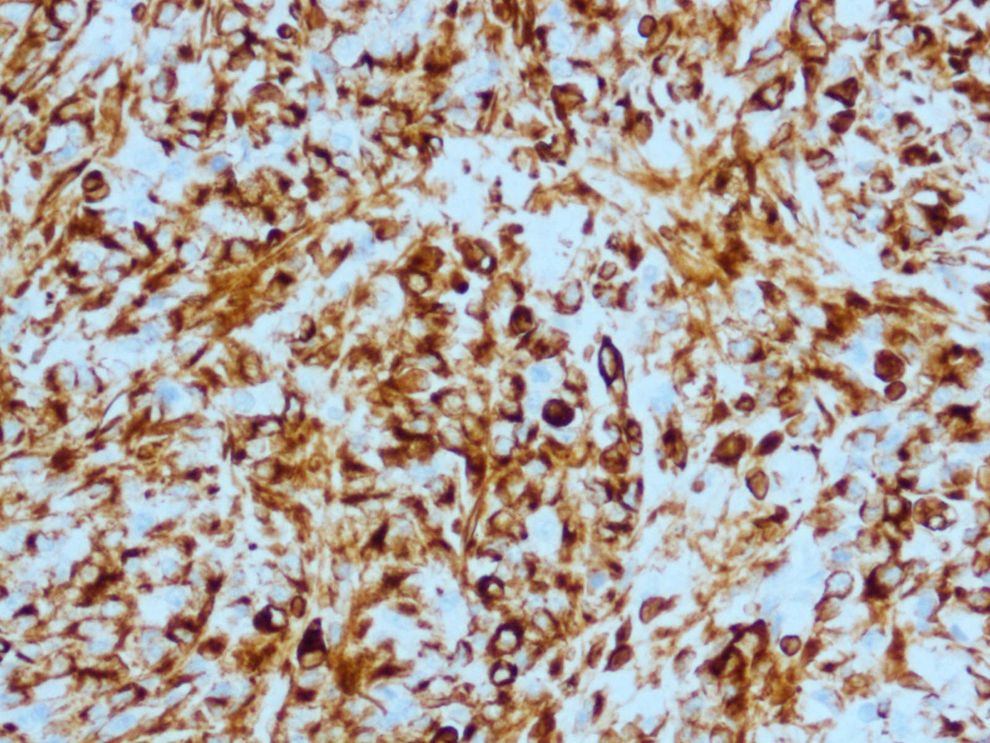
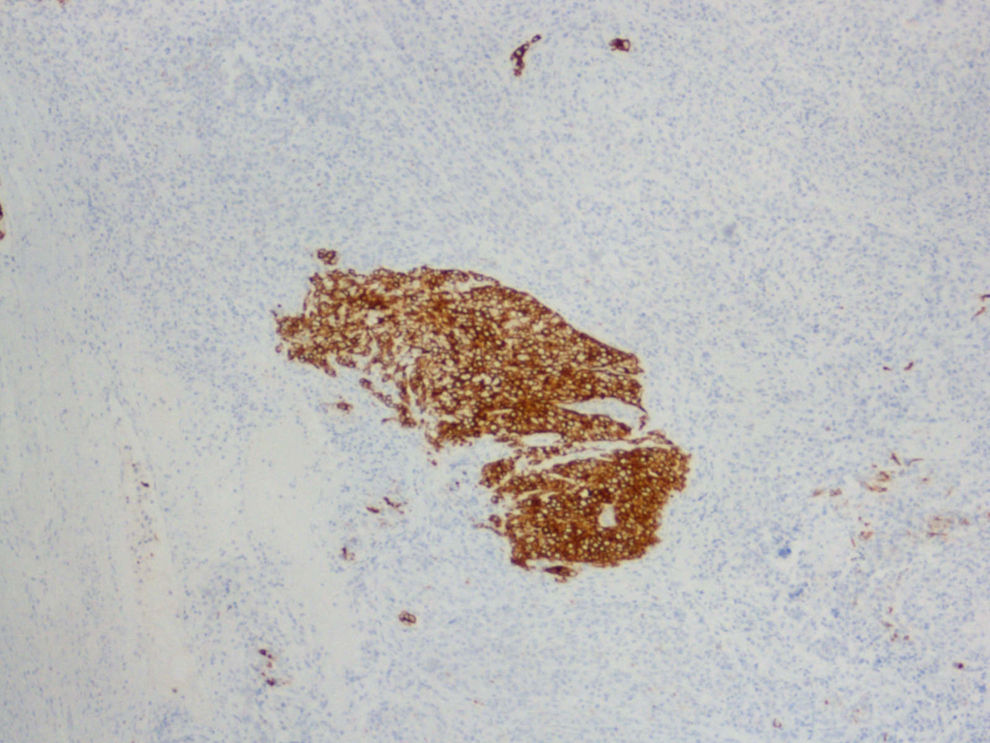
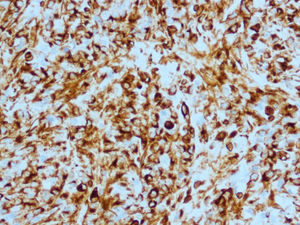
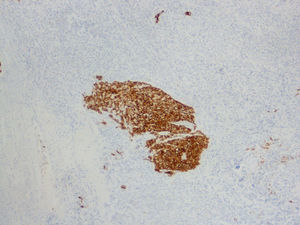
Inmunohistoquimia (IHQ): el resultado del estudio inmunohistoquímico fue positividad para la vimentina en todo el componente mesenquimal (fig. 7), y focalmente la actina músculo liso fue positiva en el sarcoma y negativa en el carcinoma. Positividad para las citoqueratinas de alto y bajo peso, así como al antígeno epitelial de membrana (EMA, epithelial membrane antigen) y antígeno carcinoembrionario (CEA, carcino embrionary antigen) en el componente epitelial (fig. 8). Receptores de estrógenos y progesterona, negativos. Positividad a p53 en el 5–10% de las células tumorales. Positividad a Ki 67 en el 60–70% de las células tumorales. Presencia de células tumorales con positividad al virus del papiloma humano (VPH), por técnica de hibridación in situ con sonda de papilomavirus y detección con sistema de visualización de amplificación de señal con tiramida (Dako). Y positividad al tipo 16.
La tumoración anexial derecha era un teratoma quístico maduro de OD.
La paciente recibió RT del 27-11-2007 al 08-01-2008 (45Gy). El 14-02-2008 consulta por leucorrea fétida. A la exploración, metástasis en 1/3 inferior de la vagina hasta cara interna del introito vaginal, lado derecho. Nódulos neoplásicos en cara anterior de la vagina, suburetrales. Sangraba por la vagina. Recibió quimioterapia (QT), 3 ciclos de CDDP. En RMN después de la cirugía no hubo signos de recidiva ni persistencia de la enfermedad. Posteriormente presentó dolor en fosa renal derecha. En la ecografía de abdomen en abril de 2008: masa por delante del área aortocava de 57×36mm, que puede corresponder a un mazacote adenopático en la pelvis por delante de los vasos ilíacos, y otras de 24×26 y 33×28mm.
En la RMN actual confirma unas adenopatías retroperitoneales interaortocava y paraaórticas con extensión a cadena ilíaca ganglionar con carácter bilateral y predominio derecho. Se decide remitir a la paciente a RT con intención paliativa, dada la progresión de la enfermedad.
DiscusiónLos CS son menos del 3% de las malignidades uterinas, la mayoría en el cuerpo uterino. En el cérvix es muy raro (<0,5% del cáncer de cérvix) y de mal pronóstico. El tratamiento óptimo todavía no está claro2, al haber tan pocos casos descritos.
Wrigth et al1, entre 1986 y 2003, tuvieron 1.583 casos de cáncer de cérvix y 8 sarcomas; de ellos, 5 CS, lo que representa el 0,005%. De los 5 casos, 2 eran homólogos y 3 heterólogos. Recomiendan con tumor en cérvix, la cirugía y terapia agresiva de inicio para curar y prolongar la vida.
Laterza et al2, entre 1996 y 2006, tuvieron 126 casos de cáncer de cérvix y 2 CS. Uno en una mujer de 42 años, G1P1, y el otro en una mujer de 74 años, G5P5. La 1.a recibió cirugía y QT. Sobrevivió 48 meses sin enfermedad. La 2.a, con antecedente de cáncer de mama tratado y sarcoidosis, recibió cirugía y RT. Tuvo recurrencia sistémica y murió. La terapia agresiva puede curar en estadio inicial, pero la enfermedad extracervical tiene mal pronóstico.
Grayson et al3 presentan 8 casos en Sudáfrica, las mujeres eran 7 negras y 1 asiática. Entre 32 y 93 años, edad media de 61 años. Hicieron IHQ y estudiaron el VPH. Es el primer estudio que implica al VPH en la evolución de la enfermedad y da soporte a la teoría metaplásica en la histogénesis. La reacción en cadena de la polimerasa detectó VPH en los 8 casos, y en 3 de ellos por el tipo 16. En esos 3 casos, el VPH−16 estaba integrado en el ADN de la célula epitelial y sarcomatosa. Da soporte a la teoría de la metaplasia carcinomatosa a partir de célula común, origen monoclonal. También hay mutación de la p53 en ambas células, epitelial y mesenquimal. La panqueratina MNF 116 era positiva, y la vimentina era positiva en 7 casos. La actina músculo liso era positiva en 7 casos en el componente sarcomatoso.
Los CS de cérvix se dan en la posmenopausia, con una media de entre 60–70 años, cursan con sangrado vaginal y masa polipoide en vagina. Puede haber antecedente de RT o QT previa. Tienen mejor pronóstico que los CS uterinos, al estar limitados al cérvix. Son poco glandulares en el componente epitelial (como en nuestro caso). El tratamiento es la cirugía.
En el estudio de Hall-Craggs et al4 se presenta el caso en una mujer de 57 años. El tumor era de consistencia firme, apariencia cribiforme y nodular. Al corte, patrón trabecular y cribiforme. Al microscopio óptico, microscópicamente, la célula epitelial con pleomorfismo y atipia. Núcleo hipercromático, con nucléolos. La célula del estroma, alargada, con pleomorfismo y mitosis, núcleo hipercromático y bizarro. Al microscopio electrónico, la célula epitelial con pequeños microvilli, desmosomas, vacuolas subapicales. El núcleo, grande, bizarro, con uno o varios nucléolos. El citoplasma con retículo endoplásmico (RE) rugoso, mitocondrias y polirribosomas. La célula estromal, en matriz colágena, célula alargada, de núcleo grande e irregular, con uno o más nucléolos. Miofilamentos en el citoplasma, vacuolas pinocíticas en el plasmalema, RE rugoso presente, pero ribosomas y mitocondrias en menor número.
Iida et al5 presentan un caso en una mujer de 61 años, G2P2, con menopausia a los 45 años. Era cáncer de células escamosas+osteosarcoma. Recibió cirugía y RT. Murió 17 meses después por fallo multiorgánico con metástasis en pulmón, hígado y bazo. Los tumores homólogos tienen mejor pronóstico que los heterólogos.
Alidi et al6 presentan un caso en una mujer de 68 años, G8P8. Recibió cirugía (histerectomía total+doble anexectomía+omentectomía+linfadenectomía pélvica y paraaórtica). No quiso QT, pero sí RT pélvica. A los 18 meses no había recurrencia o metástasis. La controlaban cada 3 meses, con citología, exploración y TAC pélvica y abdominal.
Después de una histerectomía subtotal puede ocurrir un CS de cérvix, como en el caso de Farley y Taylor7: una mujer de 63 años, G4P4. Tenía una histerectomía subtotal+anexectomía unilateral 30 años antes por dolor pélvico. Tenía antecedentes de adenocarcinoma de pulmón en lóbulo superior derecho, con lobectomía 12 años antes. Era gran fumadora. Ahora tenía masa cervical adherida a vejiga y vagina. Y metástasis en vasos ilíacos. Se practicó exéresis de la masa y biopsias. Murió a las 7 semanas de la operación. El riesgo de cáncer de cérvix tras histerectomía subtotal es del 0,3%, riesgo muy bajo. Pero hay que hacer citología cervical anual y examen ginecológico. El tiempo entre la histerectomía subtotal y el cáncer puede ser de 26,6 años.
Connor8 presenta un caso en una mujer de 64 años, G10P9A1, con un CS localmente avanzado. Era un tumor sólido con curso clínico agresivo, con producción de factor estimulante de colonias de granulocitos (G-CSF). Tenía 48.000 leucocitos/μl y no tenía causa infecciosa. Se trató con RT externa y cesio intracavitario vaginal, pero hizo metástasis subcutánea en el deltoides, en el cuello y en cuero cabelludo, un derrame pleural, metástasis vertebrales múltiples y compresión medular; a pesar de RT y esteroides, murió 2 semanas después. El CS puede producir nivel alto de G-CSF, y demuestra conducta agresiva que puede ser por estimulación autocrina.
A veces los CS se interpretan como un mioma naciente o como un sarcoma de alto grado.
En el caso de Young et al9, el CS se interpretó inicialmente como un sarcoma de alto grado en una mujer de 53 años, multigrávida. Se practicó cirugía y RT externa, 4.500 rads en 5 semanas. Vivió 9 meses. Tenía carcinoma in situ y carcinoma invasor, y áreas de sarcoma de alto grado sin componente epitelial. El área epitelial era queratina+, y el área sarcomatosa era queratina y vimentina negativas. Se veían áreas de transición, el componente epitelial era el que invadía. Vimentina+ sola no confirma sarcoma, hay que ver la morfología del tumor. Y es importante el diagnóstico de CS, por el curso más agresivo.
En el caso de Piura et al10, una mujer de 76 años, nuligrávida, con sangrado y masa polipoide en cérvix, se creyó mioma nascens. Era un CS con carcinoma seroso papilar y sarcoma de alto grado, heterólogo, con partes de condro, lipo, osteo y rabdomiosarcoma. No había invasión vascular ni necrosis celular. El componente carcinomatoso era citoqueratina+, y el componente sarcomatoso tenía vimentina+ difusa, proteína S-100+ local, y también positivas: desmina, mioglobina, CD10 y caldesmon. El tratamiento fue cirugía y RT pélvica+braquiterapia con cesio 137. El CS de cérvix tiene mejor pronóstico que el de cuerpo, por enfermedad limitada de entrada al cérvix. En principio, el manejo es cirugía (histerectomía total+doble anexectomía) y luego RT pélvica.
El CS de cérvix puede tener en la parte carcinomatosa un carcinoma adenoide quístico y cáncer escamoso focal, como en el caso de Manhoff et al11: una mujer de 80 años, nulípara, con sangrado vaginal y tumor cervical. El carcinoma adenoide quístico es raro en cérvix, se da en la posmenopausia y es agresivo. Se practicó cirugía y RT pélvica. A los 6 meses del tratamiento, vive. El pronóstico del CS es según el estadio al diagnóstico. La supervivencia media es de 15 meses.
En el caso de Yannacou et al12, una mujer de 76 años, G7P7, también con un carcinoma adenoide quístico+sarcoma del estroma homólogo. Se practicó cirugía y RT externa+braquiterapia con cesio 137. Murió por progresión de la enfermedad al año. La actina músculo liso era+ en ambos componentes.
Mohan et al13 presentan un caso de carcinoma sarcomatoide de cérvix; también es raro, hay menos de 20 casos. Una mujer de 75 años, multigrávida, tratada con RT. Sin recurrencias en 10 meses. Era un tumor epitelial con hallazgos sarcomatoides, pero no había componente mesenquimal maligno. Hubo que hacer el diagnóstico diferencial con él.
Finalmente, nuestro caso: un CS de cérvix asociado casualmente a un teratoma quístico maduro de ovario en una mujer de 55 años, con metrorragia y tumoración de cérvix. La RMN hace el diagnóstico de imagen de ambas tumoraciones, aunque a veces con la RMN no se puede determinar el lugar de origen o distinguir entre varios tipos de tumor. La RMN también sirve para el estadio de la enfermedad. En T2 hay intensidad variable. Hay imagen de contraste heterogéneo, y puede verse la porción polipoide14. En nuestro caso se ve muy bien el tumor de cérvix. Y la anatomía patológica identifica el tumor. En la IHQ: positividad de citoqueratinas, EMA (epithelial membrane antigen) y CEA (carcino embrionary antigen) en el componente epitelial, y la vimentina en el componente mesenquimal, y localmente la actina músculo liso, como se refiere en la literatura médica. En nuestro caso también fue positivo el VPH-16, como en el caso que presentan Grayson et al3.