A continuación se presenta un caso de cáncer seroso de ovario, intervenido y tratado con quimioterapia y que, tras 8 años, presenta recidiva como carcinosarcoma. La mujer fallece 3 años después debido a la progresión de la enfermedad.
We present a case of serous ovarian cancer, which was treated with surgery and chemotherapy. Eight years later the cancer recurred as carcinosarcoma. The patient died three years later due to disease progression.
El carcinosarcoma (CS) de ovario es un tumor raro: constituye menos del 1% de los cánceres de ovario. Es un tumor muy agresivo que se produce, sobre todo, en mujeres posmenopáusicas. El factor pronóstico más importante para la supervivencia es el estadio inicial al diagnóstico. El tratamiento es la cirugía radical, seguido de quimioterapia (QT). El riesgo de complicaciones es mayor que en el cáncer de ovario. La cirugía debe estar a cargo de expertos y en grandes centros1.
En este trabajo se expone un caso de cáncer de ovario que presenta recidiva como CS.
Caso clínicoMujer de 68 años, con 3 gestaciones, 2 partos y un aborto, y menopausia a los 50 años. Como antecedente, presentaba una histerectomía total, doble anexectomía y omentectomía (HT+DA+O) a los 60 años, que le practicó su ginecólogo privado en 1990 debido a un cistoadenocarcinoma seroso de ovario derecho (OD) en estadio ia . Según el informe del ginecólogo, era una tumoración abdominopélvica que llegaba al ombligo, procedía del OD, era quística, con cápsula lisa e íntegra, sin extensión extracapsular, y tenía una cantidad discreta de líquido ascítico. La tumoración estaba adherida al peritoneo posterior, al colon sigmoide y al recto, así como a la pared pélvica derecha. El anexo izquierdo estaba englobado por asas de intestino delgado. El epiplón era normal. El hígado, el bazo y la cápsula diafragmática estaban libres. El útero estaba atrófico. La anatomía patológica informó de cistoadenocarcinoma seroso con fenómenos intensos de necrosis tumoral. Se realizó embolización linfática intratumoral e infiltración parcial capsular. Se observó endometrio proliferativo; el miometrio no presentaba cambios. El anexo izquierdo tampoco presentaba cambios y el epiplón no se hallaba infiltrado.
En 1991, la mujer recibió 6 ciclos de QT con ciclofosfamida y cisplatino en este hospital. No recibió adriamicina por un problema cardíaco. Una vez considerada completa la remisión, siguió con controles periódicos. El 6 de agosto de 1998 se la examinó en Oncología; en la tomografía computarizada (TC) de control apareció una nefropatía obstructiva en el riñón izquierdo, con el uréter pélvico englobado por una masa sólida heterogénea de 59×47mm. Clínicamente, presentaba hipertensión arterial (HTA) tratada con captopril. Se solicitó interconsulta para realizar la intervención.
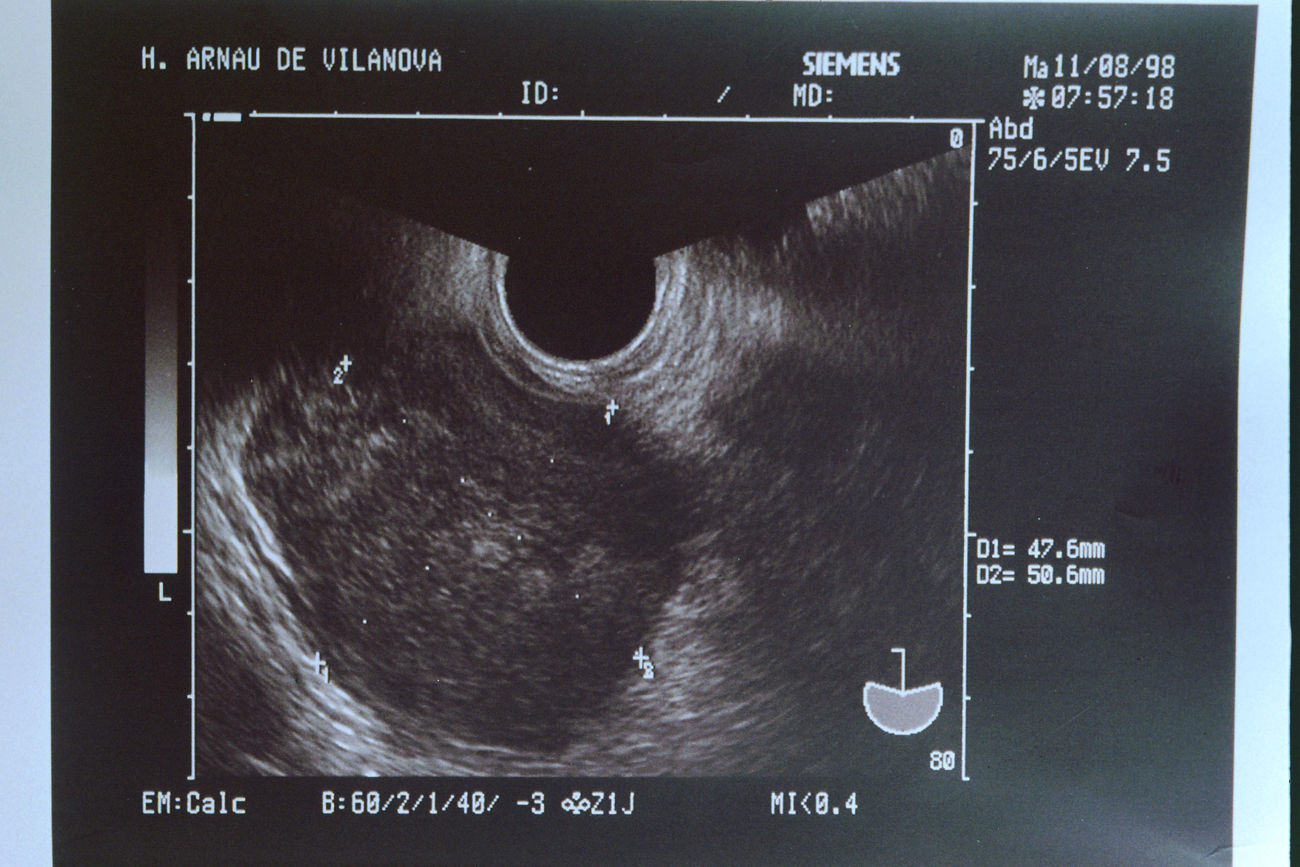
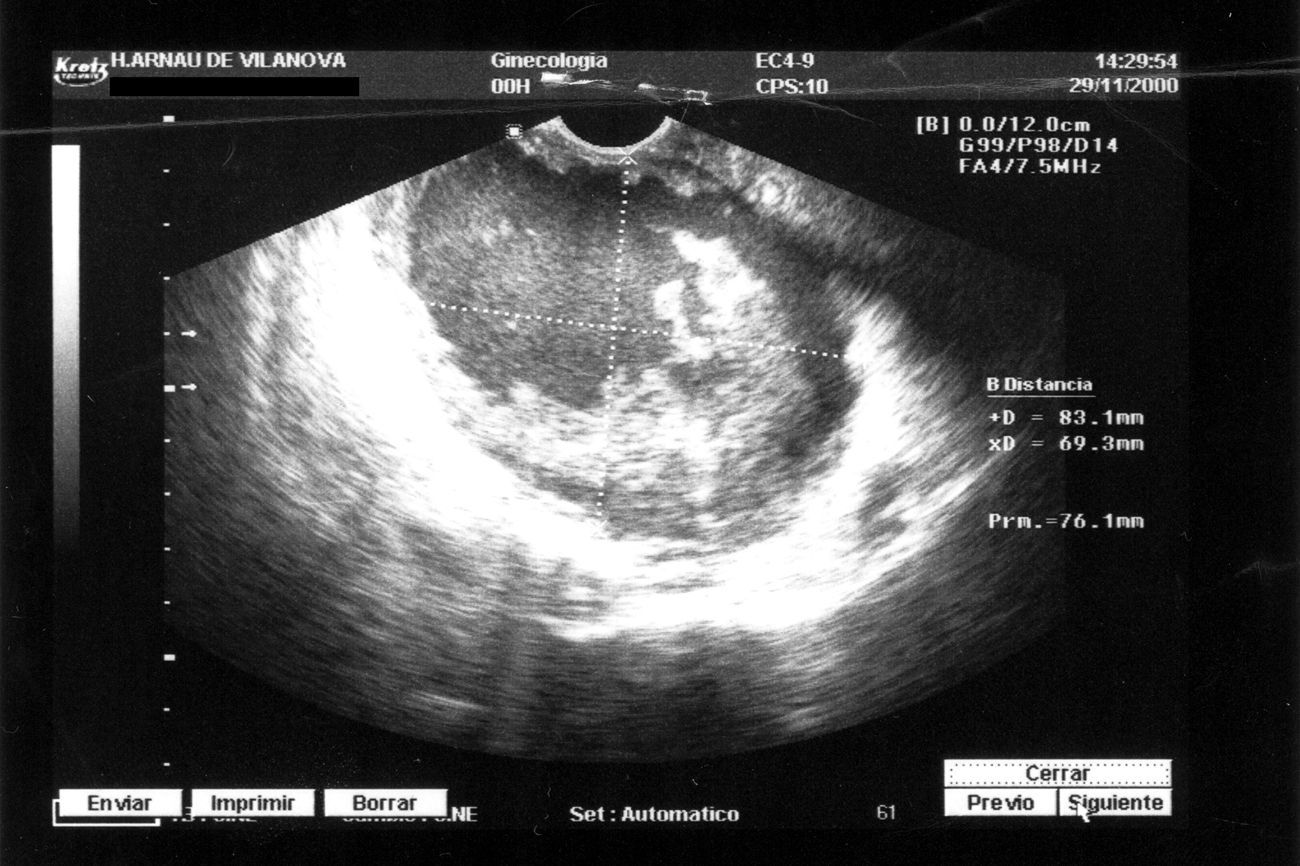
En la exploración, se observó una masa dura y poco móvil en el lado izquierdo de la pelvis. En la ecografía vaginal (fig. 1) se visualizó una tumoración sólida, heterogénea, de 50,6×47,6mm. Se solicitó el preoperatorio.
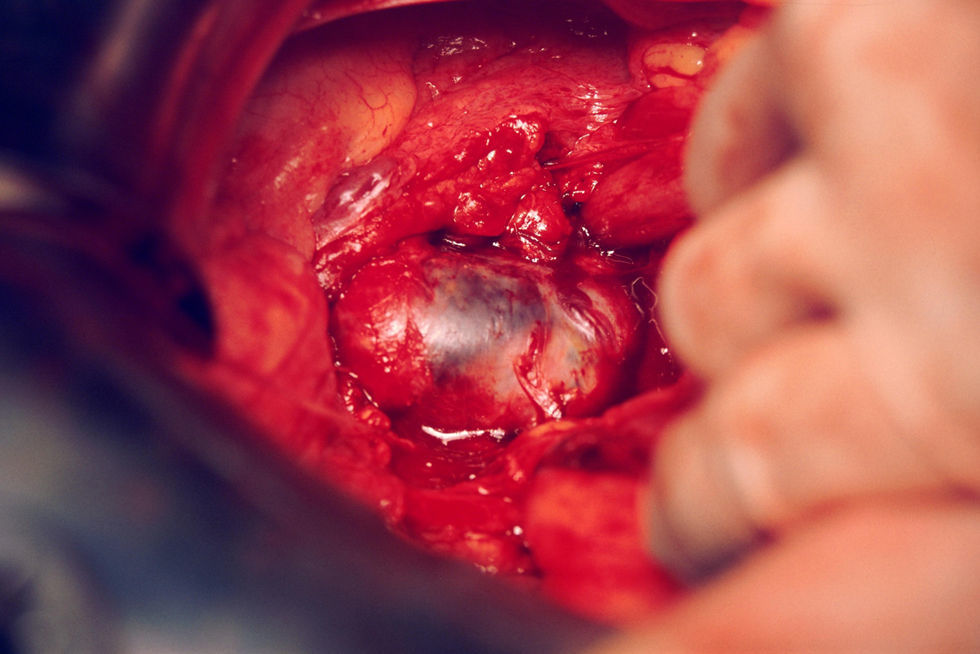
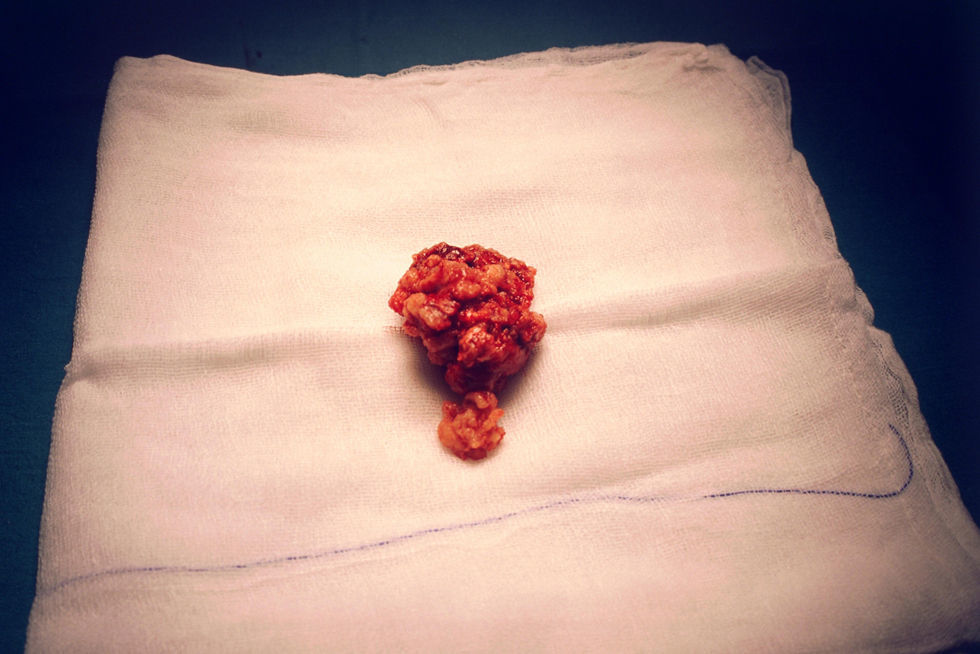
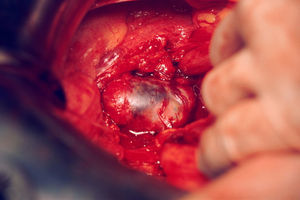
El 8 de septiembre de 1998, en un primer tiempo, el urólogo procedió a la cateterización del uréter derecho en 5 a 6cm de longitud; en el uréter izquierdo no se pudo conseguir lo mismo. En un segundo tiempo, se procedió a practicar laparotomía exploradora y se encontró una masa tumoral de 5×5cm (fig. 2), retroperitoneal, en la línea media y hacia el lado izquierdo, que parecía bien encapsulada. Se extirpó casi en su totalidad (fig. 3). Sangró en el despegamiento y quedaron restos tumorales en la pared. Al séptimo día del período postoperatorio (de curso normal), se le dio de alta.
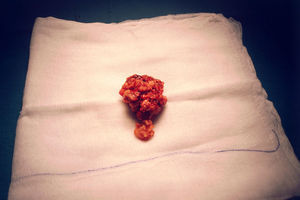
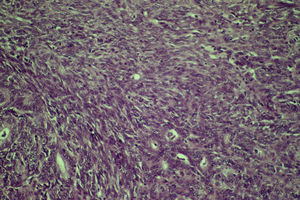
El informe de anatomía patológica reveló que, macroscópicamente, era una formación carnosa, dura, blancoamarillenta, de 5×4,5×2,5cm, con áreas friables de aspecto papilar. Al realizar la sección de la tumoración, la superficie de corte era sólida, blanquecina, con áreas de aspecto parduzco, hemorrágicas y de consistencia media.
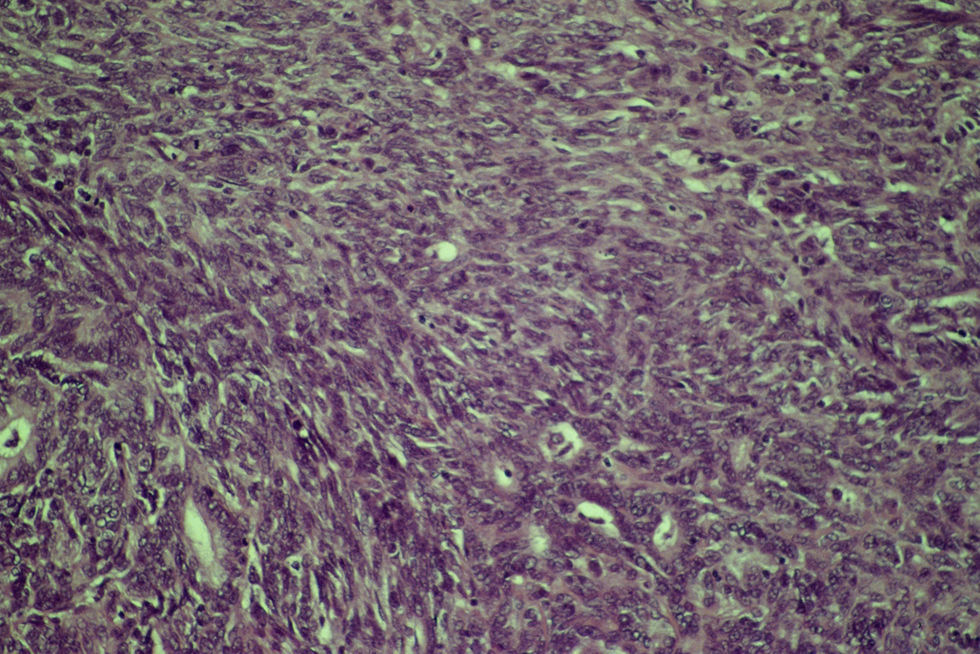
Microscópicamente, era una neoplasia maligna de estirpe epitelial, constituida por luces glandulares revestidas por células neoplásicas que exhibían moderado pleomorfismo y revestían esas luces con disposición ocasionalmente seudoestratificada. Las áreas interglandulares estaban constituidas por fascículos de células fusiformes orientadas en todas las direcciones del espacio, con atipia moderada e hipercromatismo nuclear así como con presencia de un índice mitótico que oscilaba entre una y 3 mitosis por campo de gran aumento. Focalmente, se observó tendencia a la necrosis tumoral.
El perfil inmunofenotípico mostró positividad para citoqueratinas en las áreas epiteliales y áreas vimentina positivas correspondientes a las zonas fasciculadas. La actina, la desmina y el antígeno carcinoembrionario fueron negativos. En el 100% de las células epiteliales había positividad para los receptores estrogénicos, con marcada intensidad nuclear. En algunas células fusiformes del componente sarcomatoso había positividad más ligera y aislada.
El diagnóstico fue infiltración en partes blandas por CS» (fig. 4).
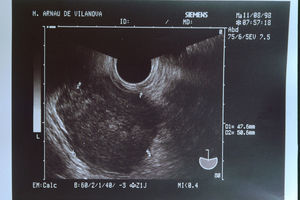
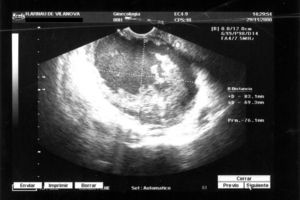
Durante el seguimiento en Oncología, la mujer recibió 6 ciclos de QT. El 28 de enero de 1999, en la TC de control se observó lo que parecía una remisión completa. A los 9 meses, la TC presentó ureterohidronefrosis izquierda y el marcador tumoral monoclonal del cáncer de ovario y ciertos linfomas (CA 125) fue de 13,10U/ml (normal). Doce meses después, el 20 de enero de 2000, la TC resultó normal. Sin embargo, tras 24 meses, el 14 de septiembre de 2000, en la TC se detectó una masa pétrea, quística, con polos sólidos, de 6×7cm. Además, se detectó hidronefrosis del riñón izquierdo, con atrofia del parénquima; el riñón derecho estaba normal. La ecografía vaginal (fig. 5) mostró una tumoración solidoquística de 83,1×69,3mm, con vegetaciones. El CA 125 aumentó a 285U/ml. Se trataba de una recidiva.
Hasta enero de 1999, la mujer había recibido 6 ciclos de QT de segunda línea con cisplatino y Taxol®. Con la nueva progresión de la enfermedad, recibió una tercera línea de tratamiento de 6 ciclos con carboplatino y su enfermedad era estable.
Pero en diciembre de 2000 tuvo fractura del escafoides (que se trató con inmovilización y heparina) y presentó hemorragia vaginal con infiltración de la cúpula vaginal; los valores de hemoglobina eran de 7,3g/dl. El 15 de marzo de 2001 (a los 2,5 años) recibió tratamiento con adriamicina liposomial. Presentó astenia, bradipsiquia y desorientación parcial. La insuficiencia renal se trató con eritropoyetina. El estado general de la mujer empeoró, tuvo signos progresivos de la enfermedad y pasó a tratamiento paliativo.
Experimentó una trombosis de la vena femoral profunda. El 5 de abril de 2001 ingresó con dolor en el miembro inferior derecho y desorientación (coma grado i). Falleció el 9 de abril de 2001, ya con 70 años, por la progresión de la enfermedad metastásica con fallo multiorgánico.
DiscusiónLos CS de ovario y de útero son cánceres similares. Ambos son agresivos y con poca supervivencia debido a recidivas frecuentes2. No hay diferencias entre ambos grupos en cuanto a datos demográficos: edad, índice de masa corporal, paridad, menopausia, historia familiar de cáncer, historia de radiaciones pélvicas, diabetes o HTA; tampoco hay diferencias en cuanto a la supervivencia. Hay diferencias significativas en el estadio al diagnóstico: los CS uterinos se ven más en estadios i y ii y los CS de ovario se ven más en estadios iii y iv. El CS uterino puede ocasionar hemorragia vaginal. En el ovario, el diagnóstico está retrasado y la enfermedad progresa.
Los CS de ovario son raros, en general representan entre el uno y el 2% de los cánceres de ovario3. Se necesitan muchos años para conseguir unos pocos casos; por eso hay controversias sobre el tratamiento de estos tumores. Interesa a centros especializados con un protocolo definido de QT, pero,antes debe recurrirse a la cirugía, con HT+DA+O y, de ser posible, no dejar tumor residual.
Clínicamente, los CS de ovario se manifiestan con tumor abdominopélvico, distensión abdominal, ascitis y síntomas intestinales4. Se dan más en mujeres posmenopáusicas de baja paridad5. El factor pronóstico es el estadio clínico al diagnóstico. La histología del tumor no tiene impacto en la supervivencia.
Entre los años 1984 y 2002 se compararon los CS de ovario con los adenocarcinomas serosos de ovario: 65 casos frente a 746 casos6 en un solo centro. Hubo diferencias estadísticamente significativas en la edad (66,6 años frente a 62 años: p<0,001); en la supervivencia media (8,2 meses frente a 20,7 meses: p<0,0001); en la supervivencia libre de enfermedad (6,4 meses frente a 12,1 meses: p<0,001); en la QT con platino y en la supervivencia (el 25% en CS frente al 60% en cáncer de ovario: p=0,02). En cuanto a los CS en estadio III, hubo diferencias en la supervivencia (14,8 meses con exéresis óptima frente a 3,1 meses con exéresis subóptima: p<0,001). En resumen, los CS de ovario son una entidad distinta, con peor pronóstico, mayor edad al comienzo, peor respuesta a la QT con platino y peor progresión.
Los CS de ovario proceden de células pluripotenciales del epitelio ovárico y del tejido conectivo (sería un cáncer metaplásico). La máxima citorreducción de este tumor sería cuestionable porque no tiene gran impacto en la supervivencia7. Como siempre que haya un componente epitelial en el tumor, la QT es adecuada y se recomienda en el CS tras realizar la cirugía radical. Los tumores responden a múltiples estrategias de tratamiento. Se necesitan estudios prospectivos para considerar el mejor tratamiento e identificar los factores pronósticos. Pero en los CS de ovario son difíciles debido a su escasa frecuencia8. Son tumores agresivos, precoces, con afectación linfática y hemática, por lo que se recomienda la cirugía radical. En los estadios i y ii se puede añadir radioterapia para tener un mejor control local. Pero si la enfermedad está avanzada, la QT (una primera línea de tratamiento fiable es platino y taxane)9 es adecuada.
Moritani et al10 exponen un caso de cáncer de ovario (adenocarcinoma endometrioide escasamente diferenciado, con diferenciación escamosa focal) que presenta recidiva como CS. El CS podría estar en la primera tumoración y no ser visto (o podría ser el crecimiento de un clon más agresivo del tumor primario). Aquí hubo diseminación peritoneal 9 meses después y era un CS heterólogo.
El presente caso es muy semejante al anterior: una mujer de 68 años que recibió tratamiento con cirugía radical (HT+DA+O) debido a un cistoadenocarcinoma seroso de ovario a lo que siguieron 6 ciclos de QT con ciclofosfamida y cisplatino. La supervivencia fue de 8 años. Se detectó entonces una recidiva tumoral que afectaba con nefropatía obstructiva: la masa tumoral englobaba al uréter izquierdo. En la laparotomía se resecó la masa tumoral pero de forma incompleta, dado el riesgo de lesión además del hecho de que son masas carnosas y muy sangrantes. El diagnóstico anatomopatológico fue infiltración en partes blandas por CS.
Durante el seguimiento oncológico, la mujer recibió 6 ciclos de QT con cisplatino y taxol como segunda línea de tratamiento. Con nueva progresión de la enfermedad, recibió una tercera línea de tratamiento de 6 ciclos de QT con carboplatino. Finalmente (3 años después), la enfermedad progresó, se agravó la insuficiencia renal y presentó trombosis venosa femoral profunda. La mujer entró en coma y falleció por fallo multiorgánico.