Presentamos un caso, raro, de cáncer de mama en una mujer de 25 años. Sin antecedentes familiares, con un retraso al diagnóstico de un año, y entonces ya en estadio avanzado (T4N3M1). Se practicó una mastectomía radical modificada y recibió radioterapia (RT), quimioterapia (QT) (6 ciclos de taxotero-adriamicina-ciclofosfamida) y hormonoterapia (tamoxifeno). A los 2 años permanece asintomática.
Se revisa el tema: incidencia, evolución, mortalidad, recurrencias con el tratamiento conservador, RT, QT, calidad de vida y otros factores, como toma de contraceptivos orales y cáncer de mama en la joven tras la enfermedad de Hodgkin.
We present a rare case of advanced stage (T4N3M1) breast cancer in a 25-year-old woman with no familial history of the disease and a diagnostic delay of 1 year. Treatment consisted of modified radical mastectomy, radiotherapy, chemotherapy (six cycles of taxotere, adriamycin and cyclophosphamide) and hormonotherapy (tamoxifen). At 2 years of follow-up the patient remains asymptomatic.
We review the following topics related to breast cancer: incidence, progression, mortality, recurrences with conservative treatment, radiotherapy, chemotherapy, and quality of life. Other factors are also discussed, such as the use of oral contraceptives, and breast cancer occurring in young women after treatment for Hodgkin's disease.
La incidencia de cáncer de mama en la mujer menor de 25 años es baja1. En la gráfica de tasas de cáncer y edad al diagnóstico puede verse cómo a partir de los 20 a 24 años se inicia el aumento de incidencia del cáncer de mama.
Globalmente, el pronóstico es más desfavorable en las mujeres menores de 25 años2, pero no hay diferencias especiales en la clínica y en la histología. Hay retraso en el diagnóstico por no pensar en cáncer (la sensibilidad de la mamografía es del 68% frente al 91% en las mayores de 50 años). Y hay dificultades de interpretación en las mamas densas.
Hay mutaciones genéticas, alto riesgo con BRCA 1 y BRCA 2; alto grado, son bilaterales o multifocales y no expresan receptores hormonales. En el tumor hay tamaño mayor, grado histológico mayor, cáncer de novo sin hiperplasia atípica e invasión ganglionar mayor. En los receptores hormonales, si los receptores de estrógenos (RE) son positivos, hay mayor diferenciación tumoral y mejor pronóstico; con RE negativos, menor supervivencia. Con el oncogén c-erb 2 hay mala diferenciación tumoral y riesgo de recidiva. Con Her-2, aumento del riesgo de cáncer de mama, mayor en jóvenes.
A veces, hay que hacer cirugía mutilante y luego reconstrucción tras la mastectomía.
Se da quimioterapia (QT), y con RE positivos, tamoxifeno (TMX) por 5 años. Respecto a la castración ovárica, son mejores los análogos de la hormona liberadora de hormona luteinizante que la ovariectomía o la radioterapia (RT) sobre el ovario. La menopausia avanza en el 80-100%. Con TMX, dar una anticoncepción eficaz en la joven, porque es teratógeno en el animal. Con cáncer de mama y anticoncepción, se recomienda el dispositivo intrauterino de Cu. Para el embarazo, conviene esperar 2–3 años con buen pronóstico, o 5 años con mal pronóstico.
En resumen, en el cáncer de mama en la joven de 25 años, hoy no hay diferencias de pronóstico, pero es peor globalmente. Hay que hacer un tratamiento agresivo, una cirugía más mutilante (para control local de la enfermedad), más QT adyuvante.
En este trabajo, presentamos un caso de cáncer de mama en una mujer de 25 años, con su iconografía, y hacemos una revisión de conjunto sobre el tema.
Caso clínicoMujer de 25 años, nuligesta, con menarquia a los 14 años y fórmula menstrual FM=6/30. Antecedentes médicos: escoliosis y pectum excavatum.
Consultó el 25-4-2006, de urgencia, por endurecimiento en la mama y telorragia. Había notado el nódulo hacía 1 año. En la ecografía mamaria no se vieron alteraciones entonces.
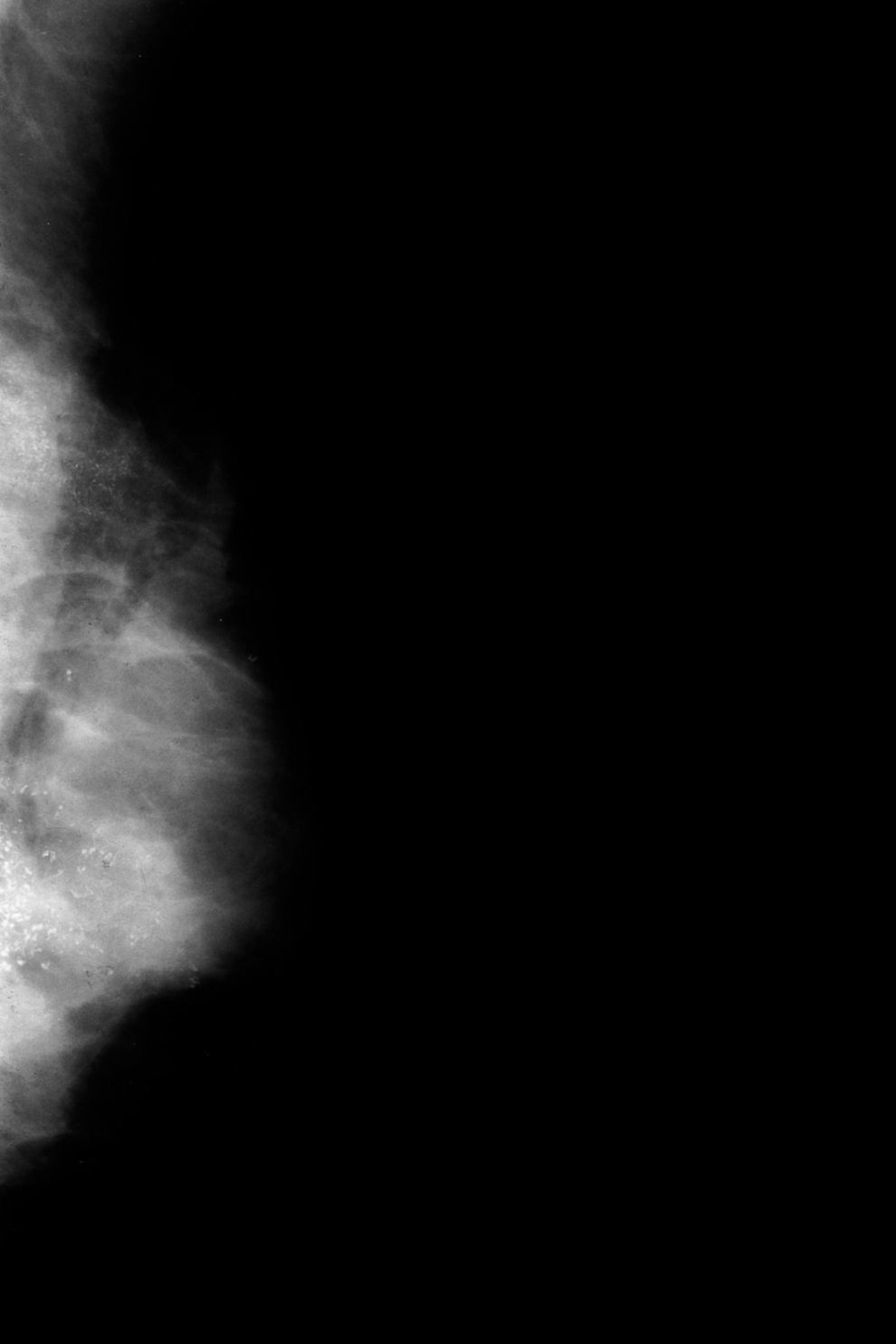
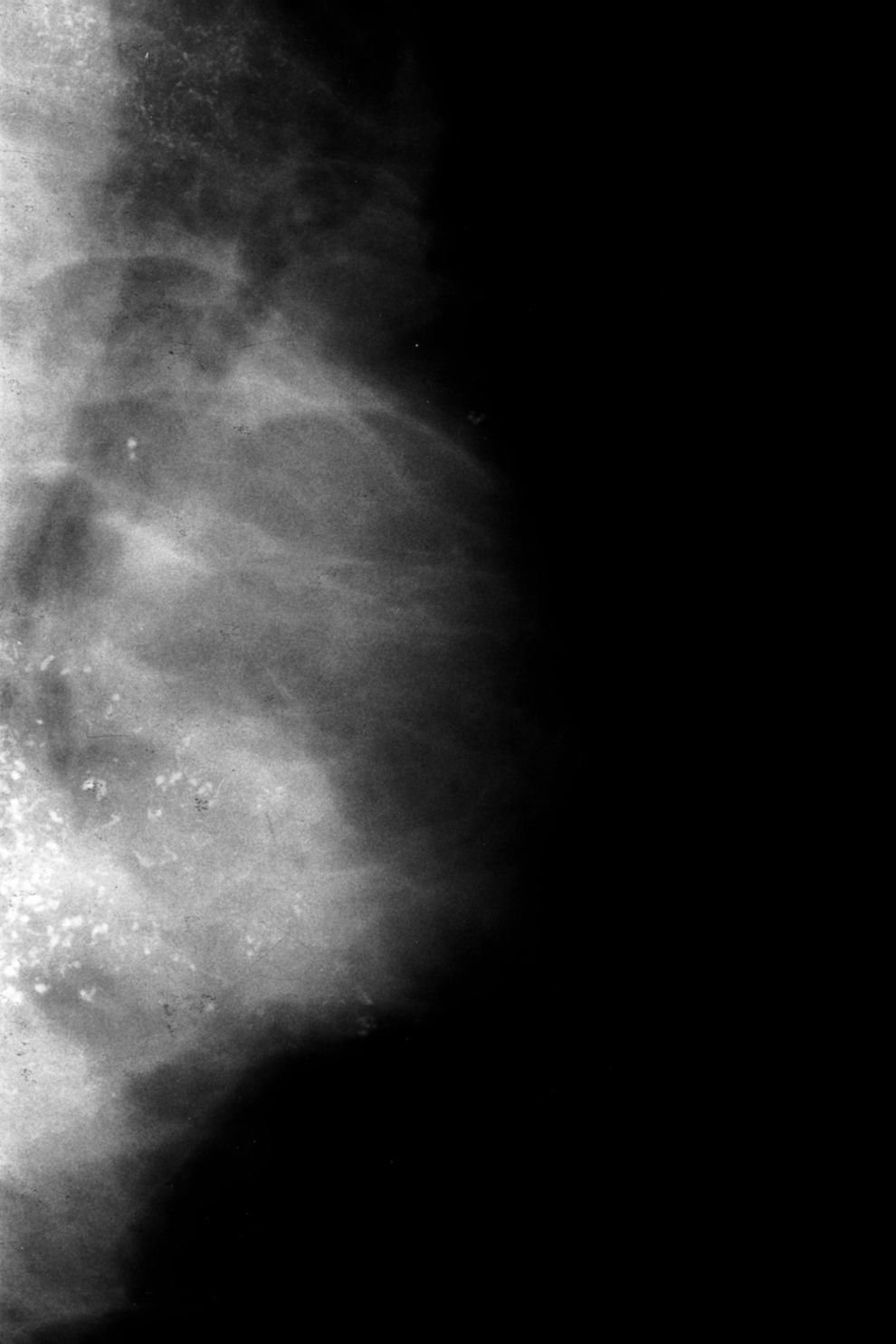
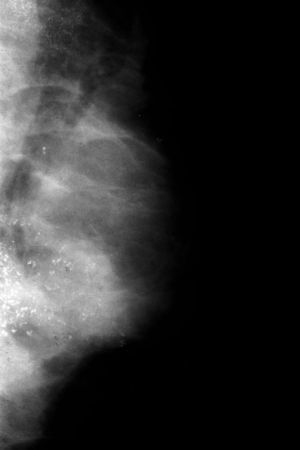
Ahora, en las mamografías, lesión en el cuadrante superoexterno (CSE) y en el cuadrante inferoexterno (CIE) de la mama izquierda (MI). No se identifican con claridad alteraciones a nivel de la lesión palpable. Adenopatía inespecífica en la axila. En las mamografías hay dos áreas extensas de microcalcificaciones, la 1.a en el CSE, que corresponde a la lesión más superficial y más fácil de palpar; y la 2.a en el CIE, más extensa (figs. 1 y 2). Las microcalcificaciones tienen una morfología típicamente maligna.
El 25-4-2006, tenía un nódulo de 1,5cm de diámetro en el CSE de la MI y una zona indurada periareolar. El 28-4-2006, se notaba un tumor que ocupaba toda la mama. Y en la axila, ganglios palpables.
En la ecografía: lesión compatible con cáncer de mama. La citología por punción aspiración con aguja fina (PAAF) de la lesión en el cuadrante externo de la mama izquierda es positiva para células malignas de hábito epitelial compatible con carcinoma. La citología PAAF de la adenopatía axilar izquierda fue positiva para células malignas de hábito epitelial compatibles con carcinoma.
En resumen: diagnosticada de un tumor que ocupa aproximadamente el 70% de la glándula mamaria, con adenopatías axilares palpables. En las mamografías, microcalcificaciones difusas que ocupan prácticamente toda la MI. En la ecografía: lesión compatible con cáncer de mama. En la biopsia: cáncer ductal infiltrante en los cuadrantes externos de la MI.
El 31-5-2006 se practica mastectomía radical modificada (MRM).
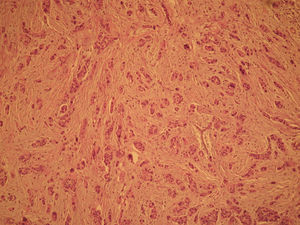
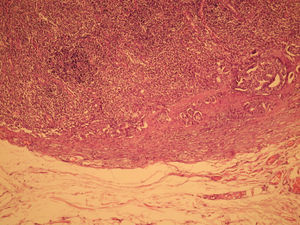
El informe de anatomía patológica es de un tumor multicéntrico. No se puede determinar el tamaño, pero hay 3 zonas de 3,5, 1 y 0,5cm; se extiende de forma multifocal tanto in situ como el infiltrante, en total es de 6,4 × 2,9cm (figs. 3 y 4). Es G3, con invasión de linfáticos dérmicos. También con componente intraductal G2 y con 12 adenopatías extirpadas, todas afectas por tumor (fig. 5). Es pT4N3 (12+/12). Receptores hormonales positivos para estrógenos y progesterona (RPg). La determinación de Her-2 es negativa. La p 53 es positiva en un 25%.
Previamente a la QT, se hizo preservación ovárica en otro hospital. En el estudio de extensión: gammagrafía ósea negativa (8-8-2006). En la tomografía axial computadorizada (TAC), se detectaron múltiples nódulos milimétricos en el pulmón, el mayor de 7mm, compatible con enfermedad metastásica (M1), (2-10-2006). Debido a su pequeño tamaño no fue posible la realización de biopsia. Recibió QT, con esquema TAC, 6 ciclos, que finalizaron en 10-2006. A continuación inicia tratamiento hormonal con TMX.
El 2-10-2006, la revisión ginecológica es normal, con ecografía vaginal.
La paciente está controlada sin evidencia de progresión de la enfermedad. Al 10-5-2007, la mamografía no detecta alteraciones significativas. En la TAC torácica y abdominal se visualiza una ligera pérdida de volumen en el hemitórax izquierdo y lesión en el parénquima pulmonar a nivel de la língula, de morfología tubular y pseudoanular, que parecen cicatriciales. No se detecta progresión de la enfermedad pulmonar. Al 3-10-2007 la paciente se encuentra asintomática.
RevisiónPaillocher et al2 tienen una serie de 13 casos de cáncer infiltrante en mujeres menores de 25 años, sobre 9.900 casos, entre los años 1977–2005, lo que representa el 0,14%. La edad media fue 23,3 años (19–25 años). Hubo retraso en el diagnóstico, media de 6,6 meses. En el 92,3% era un cáncer canalicular infiltrante, y en el 30% con componente in situ. En el 61,5%, receptores hormonales positivos (RE y RPg) (8 casos). Hubo 2 muertes, a los 35 y a los 85 meses. La supervivencia global a los 5 años fue del 91%; la supervivencia libre de enfermedad a los 5 años, 66,5%. Hubo 6 recidivas (46,2%).
El cáncer de mama es el cáncer más frecuente en la mujer. En el 0,8% se diagnostica antes de los 30 años.
Max y Klamer3 tienen una serie de 120 mujeres menores de 35 años con cáncer de mama, en 10 hospitales entre 1970 y 1980, sobre un millón de habitantes de población. En la joven, tanto el médico como la paciente retrasan el diagnóstico. En el 57% hubo atención por 6 semanas desde el primer síntoma; en el 34%, más de 6 semanas, y en 7%, por más de 2 meses hasta la biopsia por el médico. El primer síntoma es tumor no doloroso en el 61%. Hubo cáncer ductal en el 73%.
Sólo el 61% fueron mamografías preoperatorias. En el 37% fueron positivas y en el 11%, dudosas. El 52% de las mamografías fueron interpretadas como benignas o negativas. Se practicó mastectomía ± linfadenectomía en el 97%, y se dio QT+RT+ HT (hormonoterapia) en el 76%. El 12% eran cánceres bilaterales. En el 3% había metástasis a distancia al inicio. El 25% muere de la enfermedad, y en el 10% se pierde el seguimiento y se cree muerte. Metástasis a 5 años en el 45%. Supervivencia media de 34 meses.
Todo tumor en la joven debe tener un diagnóstico histológico si con la PAAF no desaparece. Las mamografías están infrautilizadas. Con mamografías negativas y masa palpable, hacer biopsia.
El cáncer de mama es raro antes de los 30 años. Para tener un caso de cáncer de mama se necesitan ver 83.000 mujeres entre 20 y 24 años4. Con screening, aumentan los falsos positivos, biopsias de mama innecesarias, riesgos de radiación e interpretación, además de posibilidades de embarazo. El screening en jóvenes es más perjudicial que útil y no es coste-efectivo.
En Canadá, con alta incidencia de cáncer de mama, es la primera causa de morbimortalidad en la mujer. Recomiendan, de 40 a 49 años, examen clínico anual, y de 50 a 59 años, mamografías anuales. A partir de los 20 años, examen clínico y autoexamen. Mamografías, a partir de los 40 años, con alto riesgo. Con bajo riesgo, a partir de los 50 años. Hay que obtener la cooperación de la paciente.
En una serie de 106 casos de cáncer de mama en la mujer afroamericana menor de 40 años, entre 1990 y 19995, el 98% eran premenopáusicas y en el 30% había historia familiar de cáncer de mama. Hubo fallo locorregional en el 6% y fallo sistémico (metástasis) en el 20%. Supervivencia a 5 años, 73%. El seguimiento medio: 35 meses (4-126). En los estadios iii–iv, hay peor pronóstico con la terapia standard. La mortalidad en las afroamericanas es un 28% mayor que en la mujer blanca. Los factores para la mortalidad son estadio al diagnóstico, características tumorales, enfermedad comórbida y factores socioeconómicos.
En una cohorte de mujeres canadienses, en Alberta, entre 1985 y 19876, la probabilidad en vida de cáncer de mama en el nacimiento fue del 10,17%, y aumentó al 10,34% a los 25 años. La probabilidad de cáncer de mama en el próximo año aumenta desde los 30 años hasta los 85 años (0,36%). Y la probabilidad de enfermedad en los próximos 10 años es del 2,97% a los 70 años y luego disminuye. En Canadá, 1/10 mujeres tiene cáncer de mama. En EE. UU., 1/8.
Estudiando el riesgo de cáncer de mama según los receptores hormonales en mujeres jóvenes7, de 20 a 44 años, hay 1.556 casos entre 1990 y 1992 y 1.397 controles. En conclusión, el riesgo difiere con los factores hormonales según sean E+Pg+ o E-Pg-, pero sólo modestamente. Tumores RE+RPg+: odds ratio (OR)=0,64 a 30–34 años y 0,89 a 40–44 años. En tumores RE-RPg-, 1,24 y 1,51, respectivamente. En los tumores positivos RE y RPg, la respuesta a la terapia hormonal y la supervivencia son mejores. Los RE+ se asocian a más edad, mujer blanca y nulípara.
En la mujer negra hay menor cáncer de mama (en 1985–1989, 92,5/100.000 frente a 110,8/100.000 en la blanca). Y en menores de 40 años, en la negra 10,7, en la blanca 8,78. En un estudio en 1980–1982 en mujeres de 20–54 años, se vieron los factores de riesgo para cáncer de mama en mujeres negras. Con entrevistas personales y al hacer regresión logística, el riesgo de cáncer de mama fue 3 veces mayor en las menores de 40 años, con anticoncepción hormonal oral (ACHO) mayor de 10 años frente a la falta de uso, OR=2,8; y 4 veces mayor en la obesa severa con índice de masa corporal (IMC) mayor de 32,30 respecto a IMC menor de 24,90.
Anderson et al9, en 2000–2003, en Polonia, tienen 2.386 casos de cáncer de mama y 2.502 controles, de 25–74 años, en 5 hospitales. Estiman la incidencia de cáncer de mama por edades y factores de riesgo. El riesgo aumenta con historia familiar, edad precoz a la menarquia, edad mayor al primer parto, nuliparidad, uso exógeno de hormonas y disminución de actividad física. La nuliparidad tiene mayor riesgo en los 40–74 años que en los 25–39 años. La ACHO y la terapia hormonal de sustitución aumentan el riesgo de cáncer de mama.
Lo cierto es que el cáncer de mama supone para la mujer un gran shock10. Se estudió la prevalencia y los factores de riesgo de depresión-ansiedad en la mujer con cáncer de mama precoz, en los 5 años del diagnóstico, en 170 mujeres menores de 60 años, con entrevista psiquiátrica a 5 meses tras el diagnóstico y cada 18 meses hasta los 5 años, y viendo los factores de stress de su experiencia vital. El 50% de las mujeres tiene depresión-ansiedad en el primer año del diagnóstico, el 25% al segundo año y el 15% en el resto de los años. Con recurrencias, hay un 45% de depresión-ansiedad a los 3 meses del diagnóstico. A largo plazo, la depresión-ansiedad está en relación con trastornos psicológicos previos, falta de relación íntima confidente (predice menos episodios), joven y con gran stress de la vida (no por el cáncer), y con episodio precoz de depresión-ansiedad tras el diagnóstico. Se necesitan servicios de consulta para intervención psicológica con cáncer de mama y necesidad de soporte social.
Revisando la supervivencia y mortalidad con cáncer de mama en Francia11, la incidencia fue 67/100.000 en 1975 y pasó a 110/100.000 en 1995, pero la mortalidad quedó estable. En 1990, sobre 1.564 casos de cáncer de mama, de 7 registros de cáncer franceses, las menores de 40 años fueron el 6,9%. La edad media, 60 años (23–102). Las más jóvenes tuvieron peor pronóstico; las más viejas, mejor.
En Europa, 1990–1992, en mujeres de 15–99 años con tumor invasivo se hace un análisis de regresión múltiple en la supervivencia del cáncer de mama12. Se comparan 13.172 mujeres del programa SEER de EE. UU. con 4.478 mujeres del programa EUROCARE de Europa. Hubo diferencias por el estadio de la enfermedad, y la necesidad de diagnóstico precoz en la mujer mayor en Europa. La supervivencia a 5 años fue del 89% en el SEER y del 79% en el EUROCARE. En EE. UU., hay mayor diagnóstico en estadios precoces menores de 6mm, T1a, y detección de tumores asintomáticos.
En EE. UU., en el programa SEER, 1990–2003, se estudió la mortalidad del cáncer de mama según receptores de estrógenos (RE) y edad del diagnóstico13. La mortalidad disminuyó en mujeres RE+ y RE-, y más con RE+. En mujeres menores de 70 años, las tasas disminuyeron el 38% con RE+ frente al 19% con RE-. En mayores de 70 años, disminuyeron el 14% con RE+ frente a no significativas con RE-. Sin embargo, en general, la mortalidad es inaceptablemente alta. Hay que mejorar en mayores de 70 años y en toda edad con RE-.
La mortalidad fue 33/100.000/año; en 2003, pasó a 25/100.000/año, disminuyó un 24% por mamografías y terapia sistémica adyuvante. Con RE- hay mayor riesgo de recurrencia y muerte en los primeros años tras el diagnóstico. El screening de mamografías reduce la mortalidad del cáncer en un 25%. Sin cáncer de mama, la mujer, a 70 años, puede vivir 16 años más, y a 85 años puede vivir 7 años más.
La obesidad posmenopáusica es un riesgo de cáncer de mama y de supervivencia peor14. Se investigó la obesidad general y abdominal en la supervivencia en una cohorte de mujeres jóvenes con cáncer de mama; 1.254 mujeres de 20–54 años, en 1990–1992. Se vio la estatura y peso a los 20 años y al año antes del diagnóstico y con 8–10 años de seguimiento. Hubo 290 muertes. Aumentó la mortalidad en obesas, con IMC mayor de 30 en el momento de la entrevista, respecto al peso ideal, riesgo: 1,48. Como conclusión: la supervivencia disminuye en la joven con obesidad general o abdominal. En la joven, hay más avanzada o agresiva enfermedad por retraso en el diagnóstico, falta de mamografías, difícil autoexamen o examen clínico. Y con más estrógenos hay mayor crecimiento tumoral.
El tratamiento conservador en el cáncer de mama inicial es la cirugía conservadora. Hay que evitar la cirugía axilar extensa y la RT axilar (procurar menos de 50Gy)15. El resultado cosmético es bueno en el 77% e inaceptable en el 6,7%. El edema de brazo se da en el 25% con disección axilar (y en el 3,4% sin cirugía axilar) y con RT, 60Gy o más; en la axila. Las secuelas son asimetría por la cirugía, induración subcutánea, cambios en la piel por la RT, parálisis del plexo braquial, etc. (con cirugía axilar y RT más de 60Gy).
Las recurrencias locales tras tratamiento conservador son más frecuentes en jóvenes16. En un estudio con 496 casos en estadios i–ii de cáncer ductal invasor, con cirugía conservadora (margen 1cm macro) + RT 50Gy, en 1973–1983, media de seguimiento: 71 meses. Hubo recurrencia local en 13/62 (21%) en menores de 40 años frente a 48/434 (11%) en mayores de 40 años (p< 0,025). En el estudio multivariante los factores de riesgo fueron reacción linfocítica en el estroma mayor (más importante), resección insatisfactoria en los márgenes, grado histológico aumentado y cáncer intraductal extenso sin el tumor primario (más importante).
La recurrencia local es el doble en las menores de 40 años que en las mayores por lo siguiente: a) aumento de cáncer residual después de la exéresis de la lesión primaria; b) propensión del tumor residual a persistir después de la QT, por cáncer intraductal extenso.
La reacción linfocítica del estroma es intensa, con RE-. Son células T, células supresoras. La relación tumor–huésped favorece el crecimiento del tumor. Hay que hacer reexcisión, si precisa. También hay mayor fallo local en la joven tras la mastectomía radical, el 46% frente al 16%. Añadir QT.
Con carcinoma ductal in situ y terapia conservadora: biopsia–excisión, ± reexcisión, y la RT con 45Gy de media, en un estudio con 146 casos en 1980–1993 y con un seguimiento medio de 7,2 años17, hubo 70 recurrencias locales ipsolaterales a 5 años (el 10,2%), y a 10 años (el 12,4%). En menores de 45 años, a 10 años las recurrencias fueron del 26,1% (en mayores, 8,6%; p=0,03). La edad joven se asocia a la recurrencia; a 10 años, invasión en el 19,9% (3,2% en mayores; p=0,03). En 95 casos, con reexcisión (siendo 25 menores de 45 años), a 5 años hubo recurrencia en el 33,3% (p=0,02), peor que en más mayores. El volumen de reexcisión es el factor del que depende el resultado.
Las jóvenes tienen gran riesgo de recurrencia local, independientemente de otros factores de riesgo. En estadio 0, Tis N0 M0, hacer la excisión inicial guiada radiológicamente por aguja; mamografías para excluir microcalcificaciones residuales, luego reexcisión. Hacer resección amplia.
La QT en la joven: el cáncer de mama en menores de 20 años es 0,1/100.000 mujeres; 1,4 de 20–24 años; 8 de 25–29 años y 24,8 de 30–34 años18. Hay presentaciones más agresivas al diagnóstico por alto grado, aumento de la expresión Ki 67, aumento de la invasión de vasos y menor expresión de RE y RPg. Por alto riesgo de recurrencia en los tumores de respuesta endocrina, dar QT. Las jóvenes se enfrentan a hechos personales, familiares, profesionales y de calidad de vida, y al deseo de embarazo.
El cáncer de mama es raro en jóvenes, en menores de 35 años hay un 2% de cáncer de mama. Hay mayor recurrencia y muerte que en las viejas. A los 10 años, la supervivencia es del 35% (del 74% en las viejas). Hay más afectación linfática, más enfermedad avanzada al diagnóstico y menos supervivencia a los 5 años. Hay más afectación axilar y alta incidencia de recurrencia local. Hay mayor frecuencia de tumores endocrinos no respondedores, con RE y RPg negativos. El riesgo de muerte en las menores de 35 años es 2,18. La QT suprime la producción de E2. La incidencia de amenorrea es proporcional a la duración de la QT. Sin amenorrea aumenta el riesgo de recurrencia.
Hay que considerar la función menstrual con la QT19. El 21% de los cánceres de mama son de mujeres premenopáusicas. La QT induce menopausia (amenorrea más de 12 meses). En el centro de cáncer Sloan-Kettering, en 1997–2003, en 166 mujeres, de media 36 años al diagnóstico (27–40), tratadas con QT de antraciclinas y taxanos (doxorrubicina y ciclofosfamida+paclitaxel) ± TMX luego, en 25 (15%) hubo amenorrea de 1 año y en 145 (85%), reglas menores, en cantidad y frecuencia. En 82 (49%), con TMX, hubo amenorrea en el 17%. El riesgo de menopausia con QT es del 21–71% en jóvenes, y del 49–100% en mayores de 40 años.
La mujer joven (menor de 35 años) con cáncer de mama es más vulnerable a distress físico y psicológico, y a peor calidad de vida20. La toxicidad de la QT da amenorrea en el 31–38% en 4–8 meses. Los agentes alquilantes de la QT causan destrucción de folículos primordiales y empeoran la maduración folicular; hay amenorrea reversible, menstruación irregular o menopausia precoz; con peor calidad de vida, disminución de la función sexual, síntomas de menopausia y distress, distress psicosocial e infertilidad.
La calidad de vida empeora. Por múltiples estresores por las necesidades y demandas de la enfermedad, necesitan apoyo psicológico. Con menopausia precoz, hay mayor distress emocional y peor calidad de vida; les faltan preparación y experiencia en los cambios múltiples que acontecen y las pérdidas. Tienen alta ansiedad, mayores necesidades en economía, trabajo y autoimagen, infertilidad y no puede tener hijos; cambios negativos en la sexualidad y disminuye su función sexual, dispareunia y sequedad vaginal, dificultad en el orgasmo, mayor insatisfacción sexual. Se perciben menos femeninas y atractivas sexualmente.
La fertilidad: menstruaciones irregulares, amenorrea. Pero puede haber ovulación (dar tratamiento anticonceptivo). No debe haber embarazo con TMX por efectos teratógenos, esperar al menos 3 meses después del tratamiento. Con deseo de embarazo, esperar 2–3 años para evitar riesgo de recurrencia. Pero cuando es incierto y falta evidencia, debe tomar ella su decisión. Con el embarazo, se normaliza su vida, hay más bienestar y mejora su calidad de vida.
En la preservación de la fertilidad, hay distintas opciones que deben discutirse:
- •
criopreservación de ovocitos (no viable)
- •
criopreservación de embriones tras fertilización in vitro (FIV), con letrozole
- •
donación de ovocitos con FIV
- •
criopreservación de tejido ovárico, con FIV (en investigación)
- •
Hormona liberadora de gonadotropina agonistas (goserelin, durante la QT)
Y la adopción o el embarazo subrogado.
Hay que hacer más screening en las jóvenes, examen clínico, mamografías+ecografía, incluso biopsia21.
Los estrógenos aceleran el desarrollo de la enfermedad, producen cáncer de mama en mujeres más jóvenes (media: 5 años)22. Pero son tumores más diferenciados y menos agresivos, menor grado tumoral, mayor RE+. Los estrógenos aceleran la patogénesis del cáncer de mama en la postmenopausia (diagnóstico antes). Y alteran el grado tumoral, y la positividad de RE para ciertos tipos histológicos de cáncer de mama.
Los contraceptivos orales y el riesgo de cáncer de mama: para Vessey et al23, en 1968–1974, en 17 centros de planificación familiar, con 17.032 mujeres de 25–39 años, el 50% en tratamiento con la píldora, hubo 189 cánceres de mama. La píldora no aumenta el riesgo de cáncer de mama en maduras, de 25–39 años.
Miller et al24, en 1983–1986, ven el riesgo de cáncer de mama y la píldora en 407 pacientes con cáncer de mama y 402 controles. El riesgo relativo (RR)=2 en más de 10 años de uso, y RR=4,1 (1,8–9,3) en más de 10 años de uso, p=0,3, no significativo. El RR está ajustado por edad, área geográfica y año de entrevista. En todos los subgrupos de edad no fue significativo. En resumen, la píldora mucho tiempo aumenta el riesgo de cáncer de mama (hay más vigilancia médica).
Rushton y Jones25 realizaron un metaanálisis de riesgo de cáncer de mama y píldora, con 27 estudios epidemiológicos, en 1980–1989, (21 casos-control y 6 de cohortes): el RR fue 1,16 (1,07–1,25) para menores de 45 años; 1,21 (0,99–1,47) en el subgrupo nulíparas y 1,27 (1,12–1,44) para duración de uso de más de 8 años. En resumen, el riesgo de cáncer de mama fue aproximadamente del 20% en jóvenes, nulíparas y con larga duración de uso, y más a más dosis. (En cambio, la píldora tiene efecto protector frente a cáncer de cérvix y a cáncer de ovario.)
Otro tema es en la mujer joven afecta de enfermedad de Hodgkin (EH) y riesgo de cáncer de mama.
Hay alta incidencia de cáncer de mama en las jóvenes con EH. Con menores de 30 años, y más en menores de 20 años con RT, se requiere un meticuloso seguimiento para cáncer de mama26. Sobre 111 mujeres menores de 60 años, en 1964–1984, estadios i–ii de la EH. Y se comparó con población de edad específica. El seguimiento medio fue de 18 años (10–30 años). La edad media a la terapia fue de 24 años, en casos irradiados a 14–25 años de edad. Hubo 14 casos de cáncer de mama, 8/33 en menores de 20 años, RR=56 (27,3–107); 5/48 en 20–29 años, RR=7 (2,3–16,4); y 1/30 en mayores de 30 años, RR=0,9 (0–5,3).
Hay más sensibilidad en adolescentes y mujeres jóvenes a la RT, período de latencia de 10 años. Hay una ventana de riesgo (de la menarquia al primer nacimiento o menopausia). El epitelio de la mama incompletamente diferenciado es más sensible a la acción carcinógena de la irradiación. Se aconsejan mamografías cada año, y en las jóvenes, reducir la radiación o combinar RT+QT.
Se estudió el cáncer de mama tras tratamiento de la EH, en 1978–1996, en 23 mujeres de 28–70 años (media 40 años), con RT previa de 35–40Gy27 y hubo 29 cánceres de mama: 22 infiltrantes, 5 in situ, 1 sarcoma y 1 inderteminado. En 5 casos (23%) hubo muerte por el cáncer de mama, con 12–40 meses de intervalo (media, 30 meses). El 75% de los cánceres de mama se dio dentro de los campos de radiación.
La RT torácica antes de los 30 años tiene alto riesgo de cáncer de mama. Hay que hacer controles mamográficos antes y, con cualquier anomalía, control histológico. Con 10 años de seguimiento de la enfermedad y menos de 30 años, hacer exploración y mamografías anuales. Con mama densa, hacer ecografía. Con anomalías, hacer citología y biopsia. Con benigno, hacer seguimiento. Con hiperplasia o maligno, hacer cirugía.
Un 2.° cáncer es causa de muerte en la EH, hay alto riesgo de cáncer de mama en la joven. Con 3.817 mujeres supervivientes 1 año a EH con menos de 30 años, en 1965–1994, se vio el riesgo con uso de RT y QT, la dosis de RT y la dosis acumulada de agentes alquilantes. Hubo 105 casos de cáncer de mama, como control, 266 casos de EH y sin cáncer de mama28.
Con 4 Gy en la mama, hay 3,2 veces más de cáncer de mama (1,4–8,2). Con 40Gy hay 8 veces más (2,6–26,4) (p< 0,001). El riesgo persiste 25 años o más tras la RT; RR=2,3 (0,5–16,5) (p=0,03). Con agentes alquilantes sólo, RR=0,6 (0,2–2). Con QT+RT, RR=1,4 (0,6–3,5). El riesgo de cáncer de mama disminuye con el aumento de agentes alquilantes y n.o de ciclos; p=0,003.
La RT da mutaciones por estimulación hormonal prolongada, aumenta el riesgo de cáncer de mama. La QT con agentes alquilantes (o la RT sobre el ovario) produce daño ovárico, induce menopausia precoz; la estimulación hormonal es menor, disminuye la función ovárica y disminuye el riesgo de cáncer de mama. Hay que hacer vigilancia de por vida, por el alto riesgo, y más con altas dosis de RT. Hoy, la supervivencia a 5 años es del 85%, pero hay secuelas de la EH, nuevos cánceres primarios, 6–15 veces más, en mujeres menores de 30 años.
En el estudio caso control de cáncer de mama tras tratamiento de EH en jóvenes, de los mismos autores anteriores29, el riesgo absoluto acumulado de cáncer de mama aumenta con la edad al final del seguimiento, el tiempo desde el diagnóstico de EH y la dosis de radiación. A 25 años del tratamiento con RT, 40Gy y sin QT, el riesgo de cáncer de mama fue a los 35 años del 1,4% (0,9–2,5); a los 45 años, 11,1% (7,4–16,3) y a los 55 años, 29% (20,2–40,1). La edad media al diagnóstico fue de 22 años y el 20% eran de 13–17 años. Hubo 105 casos de cáncer de mama, control 265 casos. La latencia media fue 18 años (7–30). Con RT aumenta el riesgo de cáncer de mama, con QT el riesgo es menor.
Finalmente, sobre nuestro caso: una mujer de 25 años, nuligesta, con retraso en el diagnóstico de 1 año y ya se encuentran microcalcificaciones malignas, y un tumor multicéntrico, ductal infiltrante, con adenopatías palpables axilares, T4N3. Se practica MRM, cirugía radical, criopreservación ovárica, RT, QT (TAC, 6 ciclos) y HT (TMX). Aparecen múltiples nódulos pulmonares compatibles con metástasis (M1), que tras QT revierten. A 2 años, la paciente se encuentra asintomática.





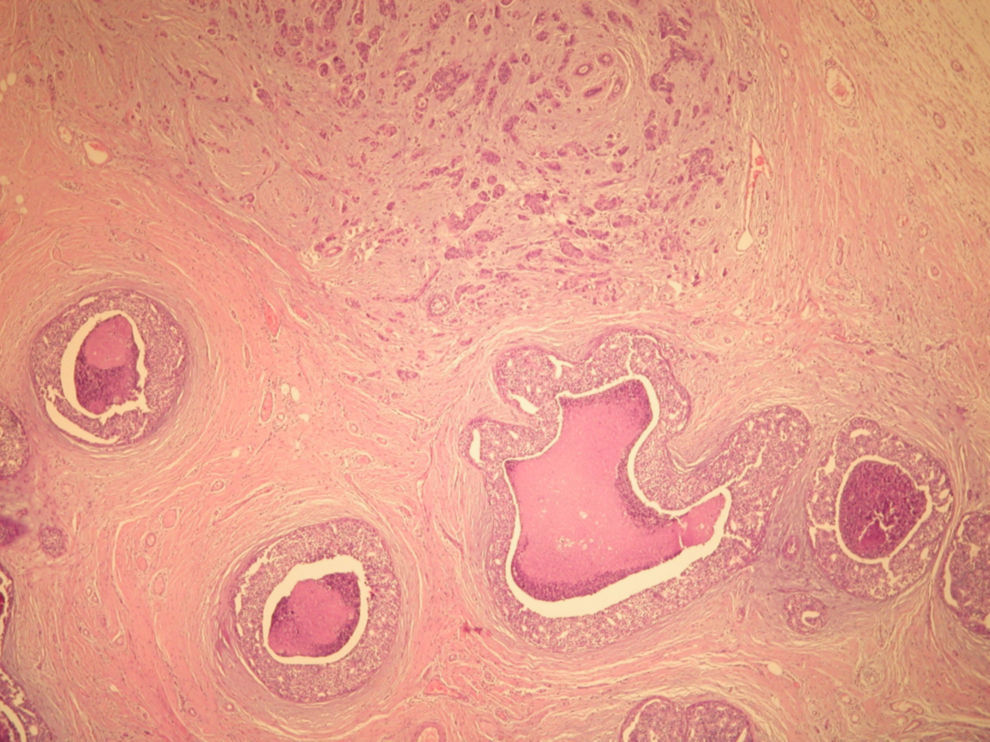
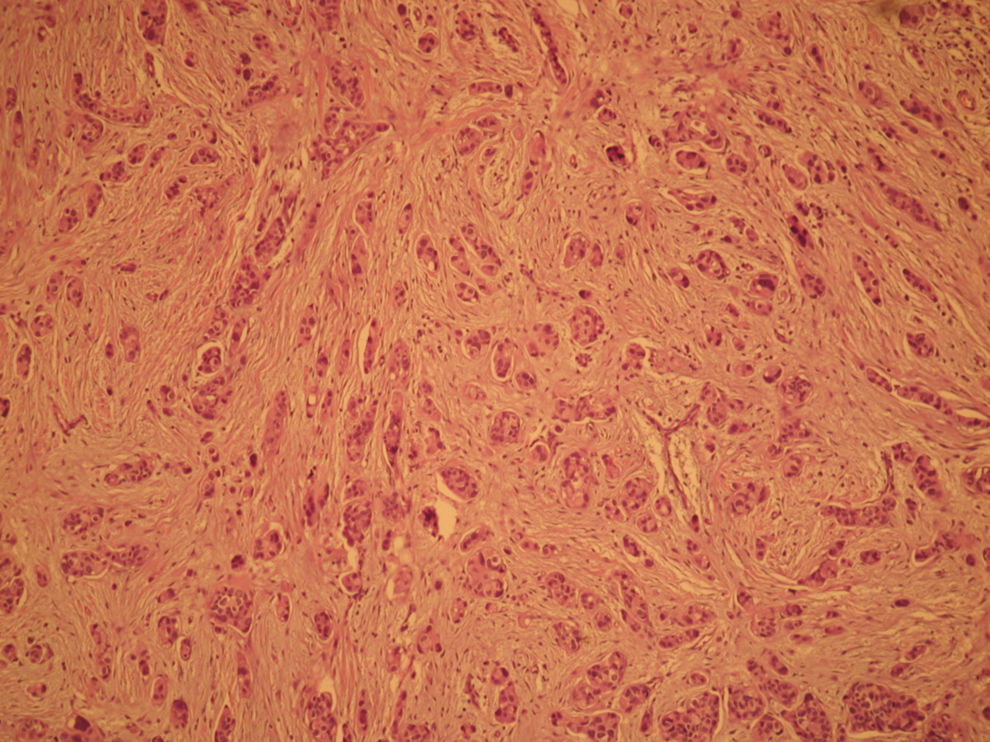
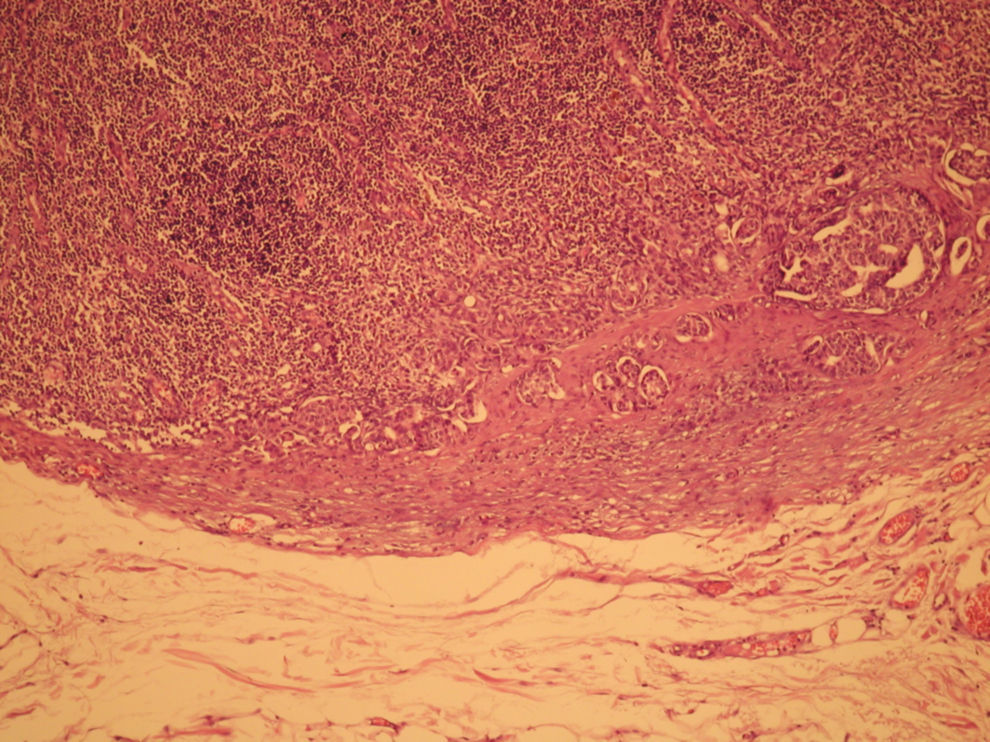
![Anatomía patológica microscópica (hematoxilina eosina [HE], 40×). Componente infiltrante (arriba) e in situ tipo comedo (abajo). Anatomía patológica microscópica (hematoxilina eosina [HE], 40×). Componente infiltrante (arriba) e in situ tipo comedo (abajo).](https://static.elsevier.es/multimedia/0210573X/0000003700000003/v1_201305030916/S0210573X09001117/v1_201305030916/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)