INTRODUCCION
En los últimos 10 o 15 años ha cambiado notablemente la perspectiva diagnóstico-terapéutica del carcinoma in situ de mama.
Dada la mayor sensibilización de las mujeres sobre la importancia del diagnóstico precoz de las lesiones mamarias y el mayor perfeccionamiento y difusión de las técnicas radiológicas destinadas a ello, no es de extrañar que en las sucesivas series publicadas cada vez sea más elevado el porcentaje de tumores in situ, con una frecuencia del 12 al 15% de todos los casos diagnosticados (25-40% en algunas series).
En España, el programa nacional de detección comenzó en la década de 1990, y, mediante exploración mamográfica, controla cada 2 años a las mujeres de 50 a 65 años, con una tasa de participación del 70% aproximadamente, una tasa de detección de 4-6/1.000 y un porcentaje in situ alrededor del 10%1.
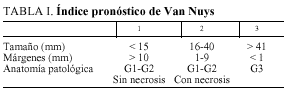
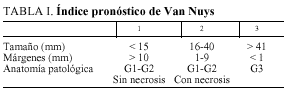
Este notable aumento de los casos diagnosticados ha permitido una mejor comprensión de la enfermedad y una mayor adecuación del tratamiento a cada caso, con una actitud quirúrgica menos agresiva. Un ejemplo de ello es el índice pronóstico de Van Nuys (VNPI) (tabla I), sistema de clasificación del carcinoma ductal in situ (DCIS) que intenta adaptar la propuesta terapéutica a los tres parámetros que más influencia parecen tener en la aparición de recidivas y supervivencia: el tamaño del tumor, el grado histológico- necrosis y el estado de los márgenes.
Nos proponemos evaluar el carcinoma in situ de mama en nuestro medio, sus características epidemiológicas, actuaciones terapéuticas y pronóstico. Analizaremos qué evolución sigue la incidencia de estas lesiones; cómo ha cambiado la valoración de los datos anatomopatológicos y, por tanto, la exigencia de que el patólogo realice un informe cada vez más exhaustivo y en qué medida los datos histológicos del tumor y el conocimiento de su biología condicionan el tratamiento.
MATERIAL Y MÉTODOS
Se revisaron retrospectivamente 162 casos de pacientes con lesiones premalignas y malignas no infiltrantes de mama, incluyendo hiperplasia ductal atípica (HDA), carcinoma lobulillar in situ (LCIS) y DCIS, diagnosticadas y tratadas en el Departamento de Obstetricia y Ginecología del Hospital 12 de Octubre desde 1984 hasta abril de 2001, para garantizar un seguimiento de al menos 12 meses.
De ellas, 127 presentaban carcinomas solos o asociados a otras patologías. Se excluyeron del estudio aquellas pacientes que presentaban microinvasión.
La media de seguimiento fue de 60 meses (entre 12 y 204).
Se evaluó la incidencia con relación al tiempo, la proporción con relación al carcinoma infiltrante de mama, la edad, el tamaño de las lesiones y sus características anatomopatológicas (grado, tipo histológico, presencia o no de necrosis y estado de los márgenes), así como la relación de dichos parámetros entre sí y con el pronóstico.
Así mismo, se examina el tipo de tratamiento y su posible evolución en el tiempo, ya que desde 1996 se adoptó el VNPI (tabla I), no de forma taxativa, pero sí como orientación junto con otras variables clínicas y personales (edad, deseo del paciente de conservar la mama, antecedentes, etc.).
Para el análisis estadístico se aplicó la t de Student en las variables cuantitativas y el test de ji cuadrado en las cualitativas.
RESULTADOS
La incidencia en el período de estudio osciló entre 16 casos (10%) entre 1984 y 1989 y 90 casos (55%) entre 1996 y 2001.
La edad media de nuestro grupo de estudio fue de 52,4 años (entre 24 y 84 años).
Al relacionar esta variable con las referidas a parámetros anatomopatológicos, observamos que no existe relación estadística con ninguno de ellos en nuestra población, con dos excepciones: el grado histológico (la edad media de las pacientes con bajo grado histológico [50 años] es significativamente menor que la de las pacientes con alto grado [55 años], con p < 0,05); y la enfermedad de Paget (el promedio de edad es de 59 años cuando hay enfermedad de Paget y de 51,8 sin ella, diferencia significativa con p < 0,05).
El tamaño medio de las lesiones fue de 23,9 mm. El 25% de los informes anatomopatológicos no informan del tamaño, y corresponden normalmente a los primeros años del estudio.
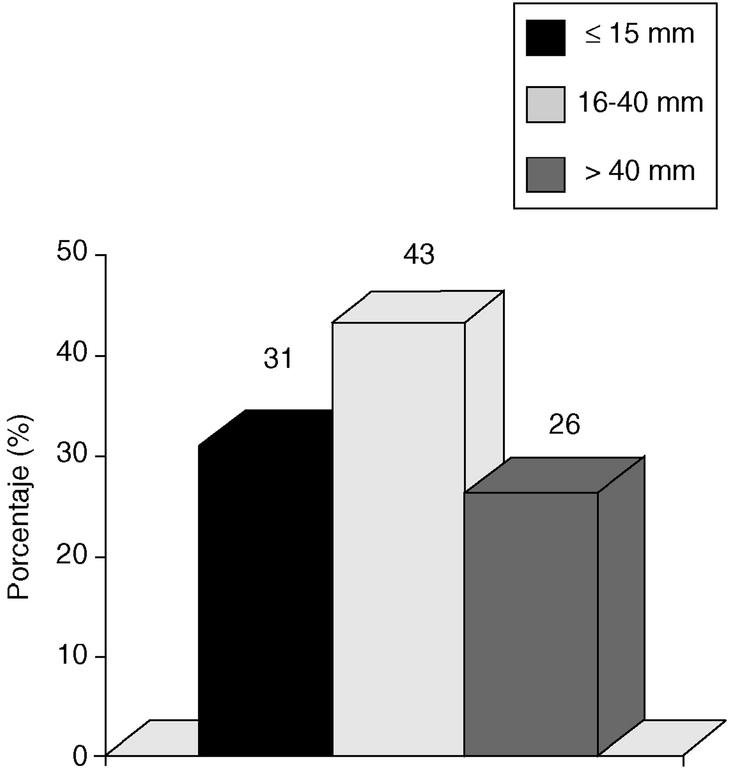
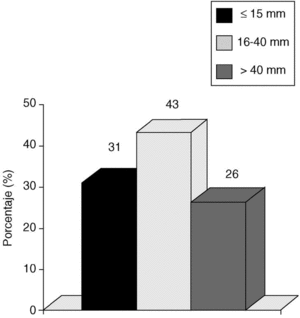
Si consideramos los tres intervalos que establece el VNPI, nuestra población se divide de la siguiente manera: con tumores < 15 mm, 38 pacientes (31%); entre 16 y 40 mm, 52 pacientes (43%), y > 40 mm, 32 pacientes (26%) (fig. 1).
Fig. 1. Carcinoma in situ de mama. Tamaño tumoral. Incidencia según índice pronóstico de Van Nuys.
No se aprecian diferencias significativas de tamaño en relación con la edad (27 mm en las menores de 36 años, frente a 24 mm en las mayores), ni tampoco es significativamente menor en el grupo etario en que se realiza sistemáticamente mamografía de detección (50 a 65 años).
Se ha valorado el tamaño en relación con la fecha del diagnóstico, y se ha comprobado que, aunque existen diferencias esperables (debido al uso más extendido de la mamografía, especialmente a partir de la década de 1990), éstas rozan la significación sin alcanzarla. Así, la media de las lesiones antes de 1990 era de 30 mm y después de 23 mm (p < 0,1 no significativa).
Sí existe relación estadísticamente significativa entre las dimensiones del tumor y el estado de los márgenes quirúrgicos (el tamaño medio de las lesiones con márgenes afectados: 27 mm frente a 21 mm de las que tienen márgenes libres, significativo con p < 0,05).
Por último, al relacionar el tamaño de pieza con las características anatomopatológicas, se puede observar que los carcinomas de alto grado histológico presentan mayor tamaño que los mejor diferenciados, sin que, no obstante, la diferencia alcance significación estadística (tamaño medio de grado I = 20 mm, frente a tamaño medio de grado III = 25 mm).
Los diagnósticos histológicos de nuestra muestra se distribuyen de la siguiente manera: HDA, 74 (46%); LCIS, 21 (13%); DCIS, 106 (85%); otros, 2 (1%). Dentro de los DCIS el tipo histológico más frecuente en nuestra casuística fue el comedocarcinoma (38%).
Respecto al grado histológico, en el 20% de los casos las lesiones se catalogaron como grado I, en el 10% como grado II y en el 40% como grado III. En los tumores DCIS el 50% presentaban necrosis, el 32% no y el 18% no aportaba información sobre ésta.
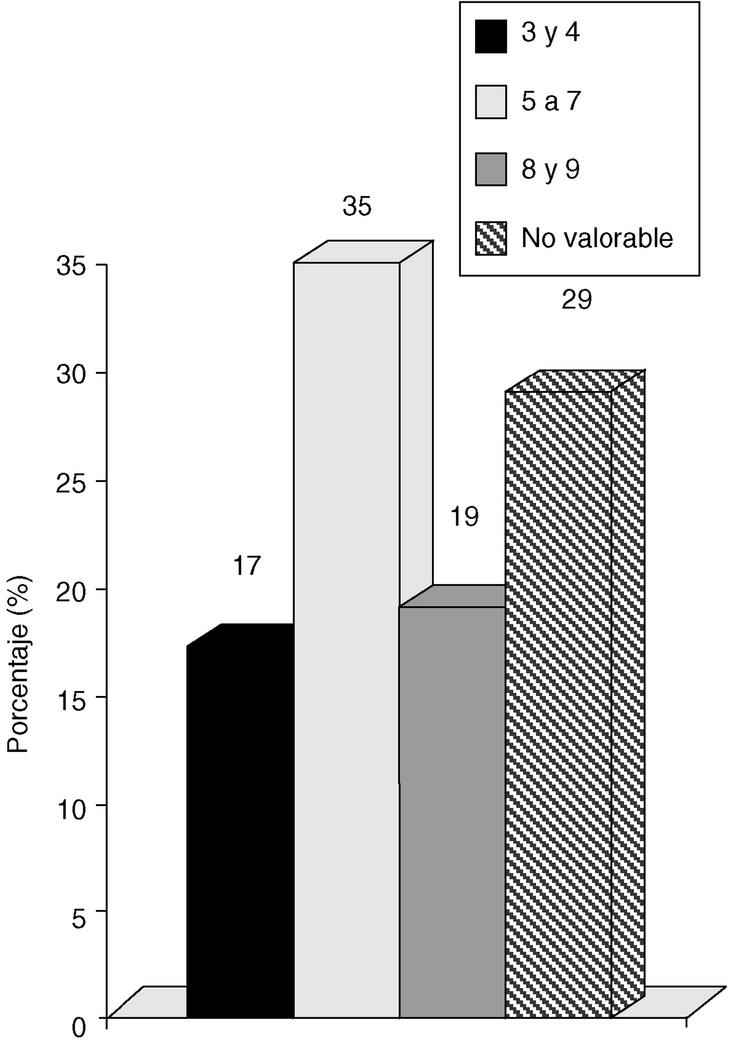
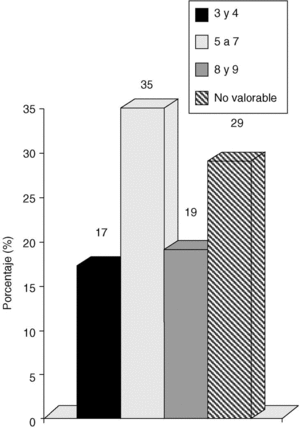
La valoración de los carcinomas en función del VNPI fue la siguiente: VN 3 o 4 en 16 casos (17%); VN 5,6 o 7 en 34 casos (35%); VN 8 o 9 en 18 casos (19%) y VN no valorable en 28 casos (29%) (fig. 2).
Fig. 2. Carcinoma in situ de mama: índice pronóstico de Van Nuys.
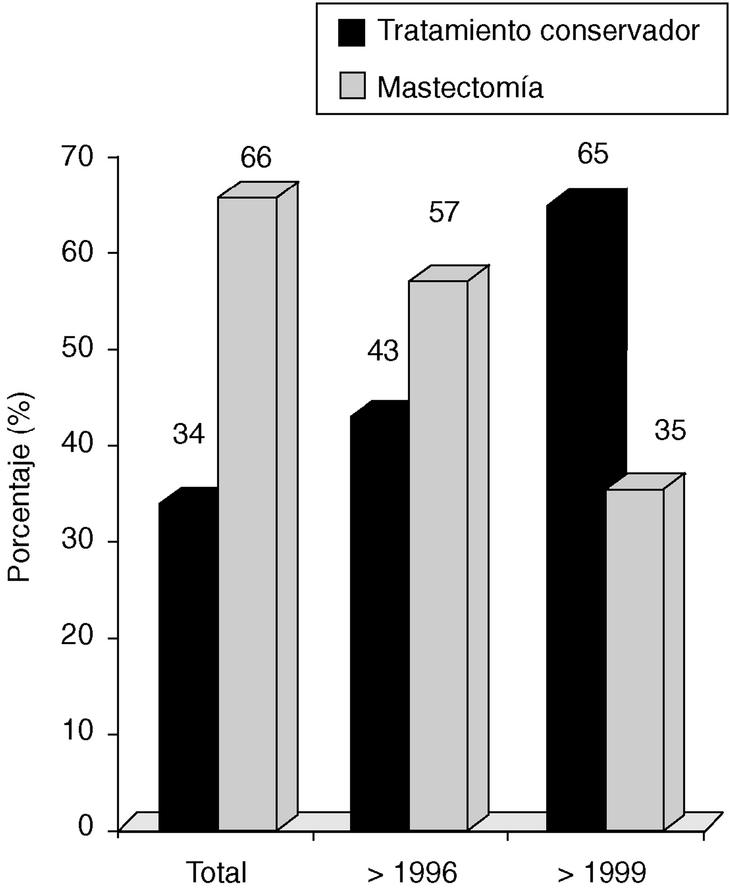
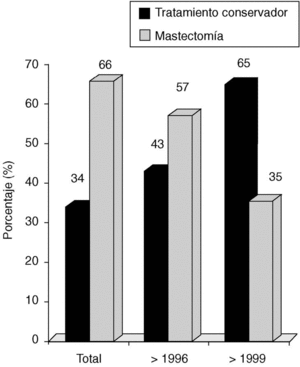
Desde 1996-1997 empleamos el VNPI, junto con otros parámetros (edad, deseo de la paciente de conservar la mama, antecedentes familiares y personales, etc.), para decidir el tipo de cirugía. En la figura 3 se presenta el tipo de tratamiento quirúrgico en los diferentes períodos de estudio (tratamiento conservador de la mama frente a mastectomía).
Fig. 3. Carcinoma in situ de mama: tratamiento del carcinoma ductal in situ.
Si realizamos una evaluación retrospectiva de cómo han sido nuestros tratamientos en relación con cómo habrían sido si nos hubiésemos regido exclusivamente por dicho índice, observamos lo siguiente:
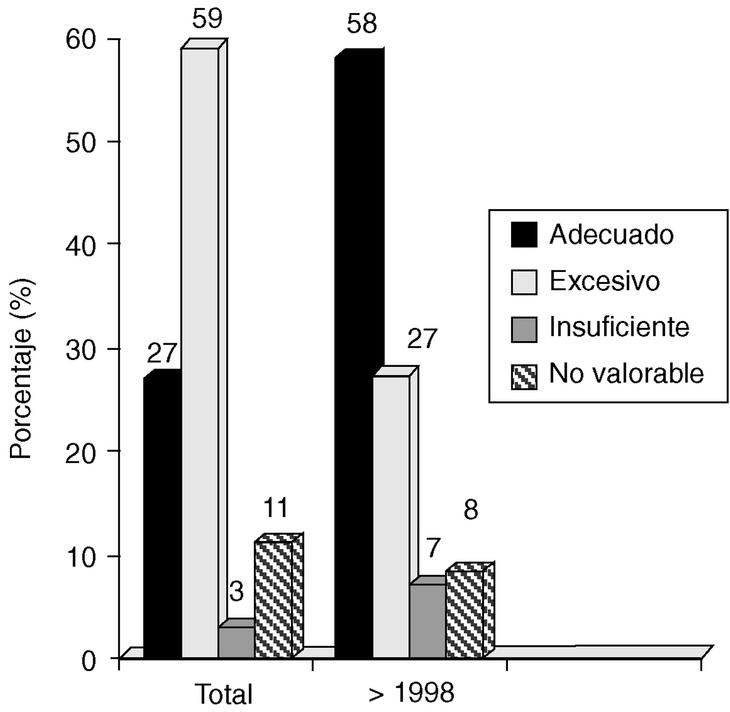
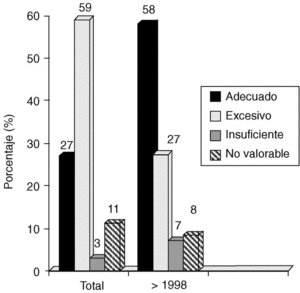
1. En general, el 27% de los tratamientos quirúrgicos fueron adecuados (coinciden con las recomendaciones de Van Nuys), el 59% fueron excesivos, el 3% insuficientes y el 11% no valorables.
2. A partir de 1997, el 50% de los tratamientos fueron adecuados, el 37% excesivos, el 6% insuficientes y el 7% no valorables (fig. 4).
Fig. 4. Carcinoma in situ de mama: evaluación del nivel de tratamiento en función del período de estudio.
Se practicó linfadenectomía sistemáticamente hasta 1998, actualmente sólo en casos de lesiones agresivas en su fenotipo y difusas, donde sólo tras la mastectomía se tendrá la certeza de que no existe infiltración. Los datos de las linfadenectomías realizadas fueron los siguientes:
1. En general, se realizó linfadenectomía en el 59% de las pacientes.
2. Después de 1998, se realizó linfadenectomía al 14% de las pacientes.
Sólo hubo un caso de linfadenectomía positiva (1,5%), en una paciente con lesión mixta comedo más papilar de 30 mm.
Con respecto al pronóstico: viven sin evidencia de enfermedad (see) 148 pacientes (93%); viven con evidencia de enfermedad (cee) 0 pacientes (0%); perdidas see, 8 pacientes (5%); perdidas cee, 1 paciente (0,7%); muertas see, 2 pacientes (1,3%), y cee, 0 pacientes (0%).
Hubo 5 recidivas (el 4% de las lesiones, excluyendo las que presentan sólo HDA). De ellas, dos fueron en pacientes con LCIS (una recidiva local in situ y otra infiltrante) y tres en pacientes con DCIS (todas infiltrantes, una de ellas con metástasis ganglionar). De las 5 pacientes, dos se trataron con mastectomía y las tres restantes con tratamiento conservador de la mama sin radioterapia (dos eran LCIS).
Actualmente, tres están vivas see, una perdida cee y otra perdida see.
El tiempo medio de recidiva fue de 46 meses (entre 6 y 90 meses). La edad media de las pacientes era de 43 años (24-61 años), 10 años inferior a la edad media sin recidivas, aunque no se alcanza significación estadística, posiblemente por el insuficiente tamaño muestral (p < 0,1).
El tamaño medio de las lesiones que recidivaron fue de 38,75 mm, y paralelamente a lo comentado para la edad, es 10 mm superior al tamaño medio sin recidiva, sin alcanzarse significación estadística.
DISCUSION
El avance en los programas de salud y su seguimiento por parte de la mujer ha hecho que en los últimos años haya cambiado notablemente la perspectiva diagnóstico-terapéutica del carcinoma de mama en general y del carcinoma in situ en particular. En este estudio se aprecia un aumento considerable de los casos de carcinoma in situ, tanto en números absolutos como en relación con el total de los cánceres de mama. Suponen actualmente un 33% del total frente al 4-5% que representaban en la década de 1980. Estos datos se superponen con lo referido en la literatura2, y se deben a la difusión de la mamografía gracias a los programas nacionales de detección mamaria3.
Distinguimos dos entidades histológicas de características absolutamente distintas. Por un lado, el LCIS. Clínicamente no suele ofrecer manifestación alguna, y también suele ser silente desde el punto de vista radiológico, aunque a veces se acompaña de microcalcificaciones. En la mayoría de los casos es un hallazgo casual.
Desde el punto de vista anatomopatológico, para su diagnóstico se precisa una buena fijación del material y una depurada técnica histológica, lo que implica la casi imposibilidad del diagnóstico en una biopsia intraoperatoria.
Entre los más amplios estudios encontrados figura el de Bodian4, realizado en 236 casos, con una media de seguimiento de 18 años, que señala un riesgo relativo de estas pacientes de desarrollar un carcinoma invasivo de 5,3 respecto a la población general.
El tratamiento más adecuado para esta lesión es muy discutido. Por un lado, es menos agresivo que el intraductal, con menor índice de recidivas. Por otro lado, es con frecuencia multicéntrico y bilateral, y se asocia a la aparición futura de un tumor invasivo en una o ambas mamas5.
La gran mayoría de autores con series amplias sobre éste están de acuerdo en que esta lesión no es preinvasiva, sino que representa un factor de riesgo de desarrollar un posible cáncer de mama futuro6,7. La mayoría de ellas no presentarán nunca un tumor invasivo, y si lo hace, será en un período de tiempo largo. Por todo ello, la actitud recomendada es la observación detenida del paciente. Diversos estudios documentan la utilidad de tamoxifeno para reducir la probabilidad de desarrollar lesiones infiltrantes en estas pacientes.
La otra entidad que hay que comentar es el DCIS. Clínicamente no suele detectarse (aunque en algunos casos aparece un nódulo palpable, o bien telorragias o enfermedad de Paget), y el diagnóstico en general suele ser radiológico, sobre todo por la presencia de microcalcificaciones.
Desde el punto de vista anatomopatológico, su rasgo principal es la limitación del tumor a los canalículos, sin invadir el estroma. Existen diversos tipos histológicos, siendo el cribiforme y el comedocarcinoma los de comportamiento más agresivo, sobre todo éste último, que suele presentar mayor tamaño, grado nuclear, tasa de recidiva e invasión.
Es imprescindible hacer el estudio de múltiples bloques para descartar una posible invasión. Es por ello que no es adecuado el estudio intraoperatorio, y se ha encontrado hasta un 20% de carcinoma invasor en el estudio posterior de diagnósticos intraoperatorios de carcinoma intraductal. Esta dificultad para detectar la invasión se revela también en el hallazgo de un 1 a un 2% de metástasis ganglionares positivas en pacientes diagnosticadas de intraductal (¿posible invasor oculto?). Es preceptivo que el informe anatomopatológico del tumor in situ contenga la siguiente información: tipo histológico, grado histológico, tamaño, extensión del tumor y estado de los márgenes (positivos, o si son negativos especificar la distancia del tumor al margen), además del estado de los receptores hormonales, porque éstos son datos pronósticos fundamentales a la hora de elegir el tratamiento correcto.
Evidentemente, para que esto sea posible, la pieza quirúrgica debe ser adecuadamente orientada y marcada por el cirujano8.
Resulta esencial para el correcto diagnóstico y tratamiento la nada fácil tarea para el patólogo de diferenciar el DCIS de la HDA de mama y del carcinoma infiltrante, cuando los focos de invasión no son muy evidentes.
También es conveniente tener información de los receptores hormonales y los marcadores moleculares (c-erb 2, p53, etc.). Estos últimos aún no determinan la terapia en la práctica clínica habitual, pero ya hay muchos estudios que los relacionan con el riesgo de recidiva y probablemente en el futuro sí la determinen.
En nuestro estudio, con respecto a las características del tumor en el informe anatomopatológico (tamaño, grado y tipo histológico, presencia o no de necrosis y estado de los márgenes), la primera observación importante es que se aprecia una notable mejora en la descripción de las lesiones.
Entre los informes de los primeros años existe un alto porcentaje en el que no se especifican una o varias de las características mencionadas, lo que se ha ido corrigiendo con el tiempo al llegarse al convencimiento, tanto por parte de los patólogos como por la de los clínicos, de que tal información es fundamental en el pronóstico de la enfermedad y condiciona decisivamente el tratamiento. Desde 1996-1997 utilizamos el VNPI como dato importante en la elección del tratamiento, por lo que el conocimiento de estos parámetros nos resulta imprescindible.
El tamaño medio del tumor era de 23,9 mm, similar a lo publicado por otros autores, y, aunque los hallazgos sugieren que los tumores diagnosticados son cada vez menores, no se alcanzó significación estadística. Similares resultados encontramos en la relación tamaño/grado histológico. No encontrar diferencias significativas en estos casos podría deberse a que el tamaño muestral es todavía pequeño.
En las grandes lesiones, al ser más difícil su extirpación completa, sí existe relación estadística entre tamaño del tumor y estado de los márgenes. Por tanto, hay un mayor riesgo de recidiva si realizamos tratamiento conservador. En nuestro material la afectación de los márgenes es del 25%, cifras algo superiores a las publicadas en la literatura9.
El tratamiento más adecuado del DCIS es la cuestión más controvertida. La discusión gira, sobre todo, en torno a dos cuestiones:
1. ¿Mastectomía o lumpectomía + radioterapia?
2. ¿Linfadenectomía sí o no?
Una vez existe un acuerdo acerca del carcinoma invasor, ¿en qué se basan las controversias que afectan al tratamiento del carcinoma in situ? Hay tres puntos fundamentales que las fundamentan:
1. Por un lado, el DCIS es multicéntrico y bilateral, con mayor frecuencia que el invasor.
2. Por otro, no es una enfermedad sistémica, ya que por definición no atraviesa la membrana basal, con lo que es una enfermedad limitada a la mama. Aun así, se han descrito hasta un 1-2% de pacientes con adenopatías positivas, probablemente por focos de microinvasión no diagnosticados.
3. Finalmente, cuando se produce una recidiva local ésta puede ser un nuevo DCIS o un carcinoma invasor, lo que sucederá si se trató sólo con escisión simple, en un 50% de los casos.
Existen opiniones dispares, desde las que defienden la realización de mastectomía y linfadenectomía por considerarla más segura10, hasta las que prefieren la lumpectomía + radioterapia, siempre que sea posible, y opinan que la disección axilar, generalmente, no se produce11,12. Estos últimos son la mayoría.
De acuerdo con los datos del Summary Staging Guide for the Cancer Surveillance, Epidemiology, and Results Reporting de 1995, en EE.UU. alrededor del 37% de las mujeres con DCIS se trataron con mastectomía, el 31% con escisión local + radioterapia y el 30% sólo con escisión local13. Se han producido distintos intentos de establecer subgrupos de pacientes con DCIS en función de diversos factores pronósticos, que permitan estandarizar el tratamiento más correcto en cada caso, ya que el DCIS es un grupo heterogéneo en el que no todos los individuos precisan la misma agresividad en el tratamiento para conseguir óptimos resultados en supervivencia libre de enfermedad.
Wood14 encontró que en series con detenida evaluación de los márgenes, la recurrencia postincisión es del 20% a los 10 años (en series previas se hablaba de un 50%). Con radioterapia asociada, la tasa de recurrencias desciende a un 10%, y esta disminución afecta, especialmente, a las que son en forma invasora (el 7,5% de recidivas como DCIS y el 2,5% como carcinoma invasor). Los factores relacionados con esta tasa son especialmente el grado y tipo histológico (comedo-no comedo) y el estado de los márgenes. Con mastectomía se producen menos de un 1% de recidivas, aunque la supervivencia respecto a la lumpectomía + radioterapia no muestra diferencias significativas.
En nuestra opinión, un considerable avance terapéutico supuso la introducción del VNPI en 1996 para seleccionar pacientes de distintos riesgos de recidiva y aplicarles así el tratamiento quirúrgico más adecuado (tabla I).
Fue propuesto por Silverstein et al15, quienes observaron que el subgrupo de pacientes con VNPI de 3 o 4 presentaban igual tasa de recurrencia local sólo con escisión o con ésta + radioterapia. En el subgrupo de puntuación entre 5 y 7, la asociación de radioterapia a la escisión quirúrgica reducía la tasa de recurrencias en un 17%, lo que supone una diferencia estadísticamente significativa. Por último, en las pacientes con puntuación de 8 o 9, la tasa de recurrencias en 8 años es tan alta (60%) que aunque se benefician de la radioterapia resulta preferible optar por la mastectomía.
No obstante, el VNPI no es universalmente aceptado como norma de tratamiento del DCIS, habiendo sido criticado por investigadores como Fisher16, para quien el VNPI «no ha sido suficientemente validado, y presenta defectos que excluyen su uso como parte de la estrategia para el tratamiento del DCIS».
Este autor, basándose en los resultados del estudio NSABP B-17, en que se evaluó el uso de radioterapia en tumores de pequeño tamaño, propone la asociación de ésta al tratamiento conservador de la mama en todos los casos de DCIS en que se opte por no realizar mastectomía. Además, afirma que todavía es remota la probabilidad de identificar uno o varios marcadores biológicos que identifiquen con precisión el subgrupo de pacientes con lesiones de pequeño tamaño que desarrollarán un carcinoma invasivo después de la lumpectomía sin radioterapia (13%), y cuáles de ellas, pese a la radioterapia, sufrirán una recidiva infiltrante (4%).
No obstante, el estudio NSABP B-17 ha sido también discutido por varias razones, la más importante es la falta de subgrupos patológicos en el informe inicial. Ha contestado categóricamente de modo afirmativo a la cuestión: ¿beneficia la radioterapia a las pacientes con DCIS tratadas con cirugía conservadora?, pero no a otras preguntas como: ¿qué subgrupo se beneficia de la radioterapia y en qué medida?17.
Otro intento de estandarizar el tratamiento ha sido la Conferencia de Consenso sobre DCIS de Filadelfia (1999)18, que recomienda la realización de mastectomía simple en pacientes que presenten grandes áreas de DCIS, de un tamaño que no permite compatibilizar una escisión oncológicamente aceptable con unos resultados cosméticos adecuados, en tumores multicéntricos, o en pacientes que tengan contraindicación para el tratamiento radioterápico y en los que la escisión sola no sea apropiada.
Las pacientes que requieran mastectomía de acuerdo con las condiciones anteriores no deberían superar el 25% de las diagnosticadas de DCIS. A todas ellas se les debería ofertar reconstrucción inmediata. En cuanto al tratamiento conservador de la mama, deberá consistir en una escisión amplia con márgenes libres y se realizará una mamografía de control posterior a la cirugía (en torno a 2 o 3 meses). Es muy controvertido seleccionar qué pacientes precisarán radioterapia posterior y cuáles no.
Se podrán tratar con escisión sólo las que reúnan las siguientes características: la lesión medirá menos de 2 o 3 cm; los márgenes serán de 10 mm o más; el grado nuclear será I o II (aunque algunos participantes piensan que también en el III con márgenes suficientes); el resultado cosmético deberá ser adecuado, sino es preferible la mastectomía con reconstrucción.
Las pacientes que no cumplan tales características recibirán radioterapia tras la escisión amplia, que se realizará en sesiones diarias de 1,8-2 Gy, con una dosis total de 45-50 Gy. Respecto a la sobreimpresión sobre la zona de tumor primaria, algunos radioterapeutas la realizan siempre con 10-20 Gy, y otros sólo si la dosis total es menor de 50 Gy. Debe evistarse la radiación sobre la axila.
Algunos autores enfatizan el alto riesgo de recurrencia local (50% invasiva) en pacientes tratadas sólo con escisión, especialmente si asocian alto grado nuclear, subtipo comedo o márgenes positivos19.
Tratando de adecuar el tratamiento a las características del tumor, Bordeleau20 establece un modelo de análisis de decisión que sobrepesa la reducción del riesgo de recurrencia en cada tratamiento con los riesgos y toxicidades de éstos y la calidad de vida de la paciente. Concluye, por ejemplo, que la mastectomía es preferible al tratamiento conservador cuando el riesgo de recurrencia local es de más del 15% en 10 años.
Las perspectivas futuras nos permiten ser optimistas. Técnicas recientemente desarrolladas, como los microensayos de DNA y el análisis seriado de expresión génica (SAGE), hacen posible obtener perfiles génicos que en combinación con la secuencia completa del genoma humano y extensos estudios mo leculares epidemiológicos podrán acercarnos a la comprensión de las bases moleculares de la tumorogenia mamaria y a la identificación de marcadores para predicción de riesgo, prevención y tratamiento21.
En cuanto a la linfadenectomía, no procede si se ha realizado un detenido examen para asegurar que no había ningún punto donde se sobrepasase la membrana basal. Sobre este punto parece haber acuerdo general.
Sin embargo, en pacientes con lesiones difusas que sólo se evaluarán adecuadamente tras la mastectomía, y, por tanto, con riesgo real de presentar focos invasivos, en opinión de algunos expertos, sí podría plan tearse la linfadenectomía en el tiempo de la mastectomía22-24.
Siguiendo las mismas corrientes que estamos analizando, en nuestro departamento hemos realizado un esfuerzo por reducir la agresividad de las cirugías y adecuarlas más a cada tipo de paciente. Frente a unas cifras globales del 66% de mastectomías, hemos conseguido una notable reducción al 35% en los últimos años.
Uno de los instrumentos que hemos utlilizado para conseguirlo ha sido la incorporación del VNPI en nuestros árboles de decisión terapéutica, aunque también consideramos otros parámetros (edad, deseo de la paciente, etc.).
En general, nuestra actitud quirúrgica es más agresiva que la propuesta por el VNPI. Así, por ejemplo, en pacientes con VNI entre 5 y 7 (en que el tratamiento recomendado sería escisión amplia + radioterapia) realizamos 3 escisiones solas (8%); 9 escisiones + radioterapia (24%), y 25 mastectomías (68%). Considerando los últimos 5 años, todavía un 27% de los casos siguen recibiendo un tratamiento excesivo en relación con el VNPI, pero son muchos menos de los que lo recibían con anterioridad (59%).
También ha influido mucho en el cambio la actitud frente a la linfadenectomía en el DCIS: hace 15-20 años era parte del protocolo habitual de tratamiento, para después pasar a realizarse sólo en aquellas pacientes de lesiones difusas en las que únicamente después de la mastectomía es posible tener certeza de si existe o no invasión. Respecto al 41% de linfadenectomías realizadas considerando el total de las pacientes, después de 1998 la cifra se ha reducido ostensiblemente (14%).
Respecto al pronóstico los datos publicados señalan una probabilidad del 30 al 50% de desarrollar carcinoma invasor en 10 años. Con tratamiento, las tasas de supervivencia son elevadas (entre el 95 y el 98%, según las series en 8 años).
Nuestros datos son también esperanzadores. Hemos presentado un 99,3% de supervivencia libre de enfermedad, y nuestra tasa de recidivas locales se ha reducido (3,3%).
La mortalidad específica por cáncer de mama de nuestro grupo es del 0%. Sólo una paciente (0,7%) tenía evidencia de enfermedad al finalizar la observación.
RESUMEN
En la práctica diaria y por el advenimiento de los programas de detección mamaria, el diagnóstico de carcinoma in situ de mama es cada vez más frecuente. En nuestro material del 10% en el primer período analizado (1984-1989), hemos pasado al 55% en el período 1996-2001.
La valoración de los carcinomas en función del VNPI fue la siguiente: VN 3 o 4 en 16 casos (17%); VN 5,6 o 7 en 34 casos (35%); VN 8 o 9 en 18 casos (19%) y VN no valorable en 28 casos (29%).
El empleo de puntuación (en este caso el VNPI) nos permite individualizar el tratamiento adecuando nuestro árbol de decisión al tamaño de la lesión, márgenes de seguridad y el grado de diferenciación histológica, unida a la presencia o no de necrosis tumoral. Por tanto, en nuestra casuística la progresión del tratamiento conservador ha pasado del 43 al 65% en los períodos estudiados.