La concentración de lipoproteína (a) [Lp(a)] influye en los niveles séricos de colesterol unido a lipoproteínas de baja densidad (C-LDL). Cómo influye en la consecución de objetivos de C-LDL establecidos en las guías no está bien estudiado. Nuestro objetivo fue conocer la prevalencia de niveles elevados de Lp(a) en pacientes con enfermedad arterial coronaria, y evaluar su influencia en la consecución de objetivos de C-LDL.
MétodoRealizamos un estudio transversal en un servicio de cardiología en España. A un total de 870 pacientes con enfermedad arterial coronaria estable les determinamos el perfil lipídico, incluida Lp(a). Los pacientes se estratificaron en 2 grupos según Lp(a)>50mg/dl y Lp(a)≤50mg/dl. La asociación de Lp(a)>50mg/dl con la consecución de objetivos de C-LDL se evaluó mediante análisis de regresión logística.
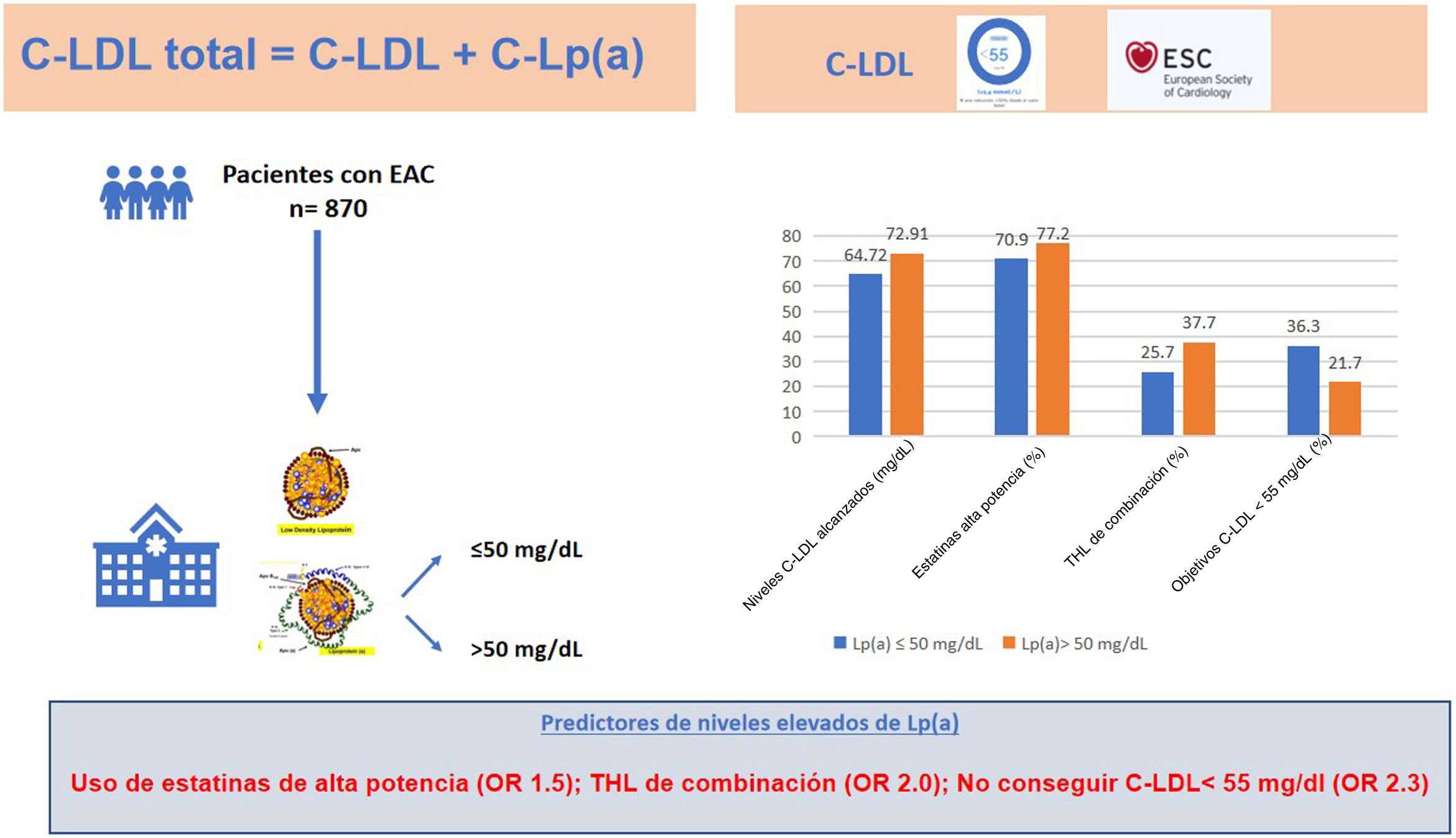
ResultadosLa prevalencia de Lp(a)>50mg/dl fue del 30,8%. Los pacientes con Lp(a)>50mg/dl tenían un C-LDL más elevado, tanto basal (142,30±47,54 vs. 130,47±40,75mg/dl; p=0,0001) como actual (72,91±26,44 vs. 64,72±25,30mg/dl; p=0,0001), a pesar de que estaban tratados con más estatinas de alta potencia (77,2 vs. 70,9%; p=0,058) y más tratamiento hipolipidemiante de combinación (37,7 vs. 25,7%; p=0,001). La proporción de pacientes que alcanzaron el objetivo de C-LDL fue menor en aquellos con Lp(a)>50mg/dl. Fueron predictores independientes de tener niveles elevados de Lp(a)>50mg/dl la utilización de estatinas de alta potencia (OR 1,5; IC 95% 1,08-2,14), el tratamiento hipolipidemiante de combinación con ezetimiba (OR 2,0; IC 95% 1,45-2,73) y la no consecución de un C-LDL≤55mg/dl (OR 2,3; IC 95% 1,63-3,23).
ConclusionesLos niveles elevados de Lp(a) influyen en los niveles de C-LDL y dificultan la consecución de objetivos en pacientes de muy alto riesgo cardiovascular. En estos pacientes son necesarios nuevos fármacos que actúen directamente sobre Lp(a).
Lipoprotein (a) [Lp(a)] concentration influences serum low-density lipoprotein cholesterol (LDL-C) levels. How it influences the achievement of LDL-C targets established in the guidelines is not well studied. Our aim was to know the prevalence of elevated Lp(a) levels in patients with coronary artery disease, and to assess its influence on the achievement of LDL-C targets.
MethodWe conducted a cross-sectional study in a cardiology department in Spain. A total of 870 patients with stable coronary artery disease had their lipid profile determined, including Lp(a). Patients were stratified into 2 groups according to Lp(a)>50mg/dL and Lp(a)≤50mg/dL. The association of Lp(a)>50mg/dL with achievement of LDL-C targets was assessed by logistic regression analysis.
ResultsThe prevalence of Lp(a)>50mg/dL was 30.8%. Patients with Lp(a)>50mg/dL had higher baseline (142.30±47.54 vs. 130.47±40.75mg/dL; p=0.0001) and current (72.91±26.44 vs. 64.72±25.30mg/dL; p=0.0001), despite the fact that they were treated with more high-potency statins (77.2 vs. 70.9%; p=0.058) and more combination lipid-lowering therapy (37.7 vs. 25.7%; p=0.001). The proportion of patients achieving target LDL-C was lower in those with Lp(a)>50mg/dL. Independent predictors of having elevated Lp(a) levels>50mg/dL were the use of high-potency statins (OR 1.5; 95% CI 1.08-2.14), combination lipid-lowering therapy with ezetimibe (OR 2.0; 95% CI 1.45-2.73) and failure to achieve a LDL-C ≤55mg/dL (OR 2.3; 95% CI 1.63-3.23).
ConclusionsElevated Lp(a) levels influence LDL-C levels and hinder the achievement of targets in patients at very high cardiovascular risk. New drugs that act directly on Lp(a) are needed in these patients.
La lipoproteína (a) [Lp(a)] es una molécula similar a una lipoproteína de baja densidad (LDL) unida covalentemente por un enlace disulfuro de la apolipoproteína B100 a la apolipoproteína (a)1,2.
Lp(a) tiene propiedades proaterogénicas, proinflamatorias y protrombóticas, y diversos estudios han demostrado que interviene en el proceso fisiopatológico de la aterosclerosis coronaria y de otros territorios vasculares3,4. Existe una amplia evidencia científica, tanto en estudios epidemiológicos como genéticos, de la asociación entre el riesgo cardiovascular y los niveles elevados de Lp(a)5–8 que demuestra que es un factor de riesgo continuo e independiente de enfermedad arterial coronaria (EAC) y que los niveles elevados de Lp(a) predicen la aparición de eventos cardiovasculares9.
Los niveles plasmáticos de Lp(a) están en más de un 90% determinados genéticamente, con escasa influencia de los factores ambientales10,11, y en la población general tienen una distribución sesgada hacia la izquierda, con un 35% de la población con valores>30mg/dl12. Otras dislipidemias genéticas, como la hipercolesterolemia familiar, están asociadas a una mayor prevalencia de Lp(a) elevada13.
Aunque la mortalidad por EAC ha disminuido en los últimos años, existe un porcentaje de pacientes que no cumplen con los objetivos de reducción de colesterol unido a lipoproteínas de baja densidad (C-LDL) recomendados por las guías14,15, incluso con estrategias de tratamiento intensivas16, y esos pacientes que no logran cumplir con los objetivos recomendados siguen teniendo un alto riesgo de morbimortalidad cardiovascular.
Existe poca evidencia sobre cómo los niveles altos de Lp(a) influyen en la no consecución de esos objetivos estrictos de C-LDL de las últimas guías17–19, y dado que los niveles de Lp(a) con frecuencia no se determinan en la población de pacientes con EAC, la asociación entre Lp(a) y el logro de objetivos de C-LDL en estos pacientes ha sido poco estudiada.
El objetivo del presente estudio fue estudiar la prevalencia de niveles elevados de Lp(a) en una población de pacientes con EAC y cómo estos influyen en los niveles de C-LDL y en la consecución de los objetivos de C-LDL establecidos en las guías para pacientes de muy alto riesgo con EAC.
Pacientes y métodoPoblación de estudioLa población de estudio consistió en 870 pacientes consecutivos con EAC atendidos en una consulta de cardiología de un hospital de tercer nivel español desde septiembre de 2016 hasta marzo de 2020.
Se establecieron 2 categorías de Lp(a) basadas en el umbral propuesto por la Sociedad Europea de Arteriosclerosis (EAS) para Lp(a)20, con el límite establecido en 50mg/dl, dividiendo así a las personas en grupos con niveles de Lp(a)≤50 y >50mg/dl.
Mediante el sistema de analíticas informatizado de nuestro centro, recabamos los valores máximos de C-LDL registrados en dicho sistema (C-LDL basal), el 72,5% antes de iniciar el tratamiento hipolipidemiante (THL), y distribuimos a los pacientes según su C-LDL basal fuera ≤ o > de 130mg/dl.
En los pacientes que ya estaban en THL antes de la implementación del registro de análisis informatizado de nuestro hospital (240 pacientes), inferimos los niveles de C-LDL previos al THL usando los factores de conversión publicados17.
Todos los participantes firmaron un consentimiento informado que fue aprobado previamente por el comité ético local.
Determinaciones clínicas y bioquímicasEl diagnóstico de EAC se estableció demostrando en una coronariografía al menos una estenosis coronaria del 50% o más en una arteria coronaria epicárdica.
Se determinaron los parámetros clínicos relacionados con la presencia de hiperlipidemia y el uso de THL.
La concentración de Lp(a) (en mg/dl) se determinó mediante inmunoturbidimetría en el analizador Hitachi 917 (Roche Diagnostics, Indianápolis, IN, EE. UU.), empleando calibradores, controles y reactivos de la misma marca.
Se determinaron los niveles de colesterol total, colesterol unido a lipoproteínas de alta densidad (C-HDL) y triglicéridos en laboratorio, y se calculó el C-LDL mediante la fórmula de Friedewald cuando los triglicéridos fueron inferiores a 200mg/dl, y mediante método directo con niveles superiores21. El C-LDL corregido por su contenido de colesterol de la Lp(a) [C-Lp(a)] se calculó mediante la ecuación de Dahlen (C-LDL corregido=C-LDL−Lp(a) masa×0,3)22.
Se consideraron estatinas de alta potencia la rosuvastatina a dosis de 20-40mg/día o la atorvastatina a dosis de 40-80mg/día.
Análisis estadísticoTodos los análisis estadísticos se realizaron utilizando el software SPSS 25.0 (IBM Corporation, Armonk, NY, EE. UU.) para Windows.
Se utilizó el test de Kolmogorov-Smirnov para determinar que las concentraciones de Lp(a) no tenían una distribución normal (p<0,0001).
Las variables categóricas se presentan como frecuencias con porcentaje y se compararon mediante la prueba de Chi-cuadrado. Las variables continuas se muestran como media y desviación estándar, a excepción de los niveles de Lp(a), que se expresan como mediana y rango intercuartílico (RIQ), y se compararon mediante el test de la t-Student de muestras independientes si se distribuía normalmente, o a través de la prueba de la U de Mann-Whitney si no lo hacían.
Los cocientes de probabilidades (OR) y los intervalos de confianza del 95% se calcularon mediante análisis de regresión logística multivariable.
Un valor p<0,05 se consideró estadísticamente significativo.
ResultadosCaracterísticas basales de la poblaciónSe incluyeron 870 pacientes ambulatorios con EAC. El 43,2% (376) tenían niveles de Lp(a)>30mg/dl y el 30,8% (268) tenían>50mg/dl. La mediana de Lp(a) fue de 22,10mg/dl (RIQ 8,28-60,70).
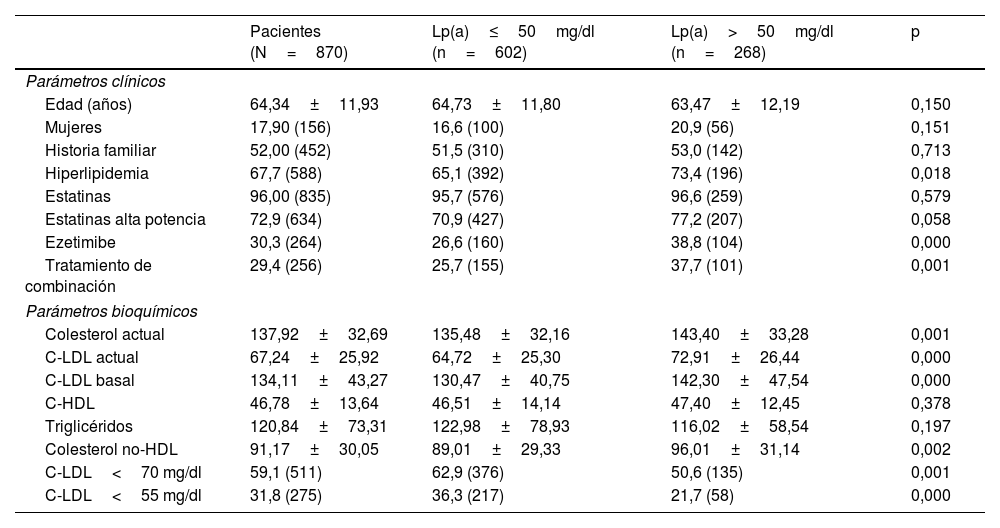
Dividimos la población de estudio en 2 grupos según tuvieran valores de Lp(a)≤50mg/dl y Lp(a)>50mg/dl. Las principales características clínicas y bioquímicas de los 2 grupos se muestran en la tabla 1.
Características basales de los sujetos del estudio
| Pacientes (N=870) | Lp(a)≤50mg/dl (n=602) | Lp(a)>50mg/dl (n=268) | p | |
|---|---|---|---|---|
| Parámetros clínicos | ||||
| Edad (años) | 64,34±11,93 | 64,73±11,80 | 63,47±12,19 | 0,150 |
| Mujeres | 17,90 (156) | 16,6 (100) | 20,9 (56) | 0,151 |
| Historia familiar | 52,00 (452) | 51,5 (310) | 53,0 (142) | 0,713 |
| Hiperlipidemia | 67,7 (588) | 65,1 (392) | 73,4 (196) | 0,018 |
| Estatinas | 96,00 (835) | 95,7 (576) | 96,6 (259) | 0,579 |
| Estatinas alta potencia | 72,9 (634) | 70,9 (427) | 77,2 (207) | 0,058 |
| Ezetimibe | 30,3 (264) | 26,6 (160) | 38,8 (104) | 0,000 |
| Tratamiento de combinación | 29,4 (256) | 25,7 (155) | 37,7 (101) | 0,001 |
| Parámetros bioquímicos | ||||
| Colesterol actual | 137,92±32,69 | 135,48±32,16 | 143,40±33,28 | 0,001 |
| C-LDL actual | 67,24±25,92 | 64,72±25,30 | 72,91±26,44 | 0,000 |
| C-LDL basal | 134,11±43,27 | 130,47±40,75 | 142,30±47,54 | 0,000 |
| C-HDL | 46,78±13,64 | 46,51±14,14 | 47,40±12,45 | 0,378 |
| Triglicéridos | 120,84±73,31 | 122,98±78,93 | 116,02±58,54 | 0,197 |
| Colesterol no-HDL | 91,17±30,05 | 89,01±29,33 | 96,01±31,14 | 0,002 |
| C-LDL<70 mg/dl | 59,1 (511) | 62,9 (376) | 50,6 (135) | 0,001 |
| C-LDL<55 mg/dl | 31,8 (275) | 36,3 (217) | 21,7 (58) | 0,000 |
Las variables cuantitativas están expresadas como media±desviación estándar. Las variables cualitativas están expresadas en porcentaje (n).
C-HDL: colesterol unido a lipoproteínas de alta densidad; C-LDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína (a).
No hubo diferencias en la edad y el sexo en pacientes con niveles de Lp(a)> y ≤50mg/dl, ni en la presencia de historia familiar de EAC prematura.
Los pacientes con Lp(a)>50mg/dl refirieron hiperlipidemia con mayor frecuencia. El THL fue similar en ambos grupos, aunque el uso de estatinas de alta potencia fue mayor en los que tenían niveles de Lp(a)>50mg/dl; los pacientes en tratamiento con estatinas de alta potencia tenían niveles significativamente más elevados de Lp(a) que los que no las tomaban: 24,35mg/dl (RIQ 8,63-62,55) vs. 18,55mg/dl (RIQ 7,40-52,38) (p=0,019 por U de Mann-Whitney).
El THL de combinación con ezetimiba fue más frecuente en los que tenían niveles de Lp(a)>50mg/dl, y los pacientes que tomaban ezetimiba tenían niveles de Lp(a) significativamente más elevados que los que no la tomaban: 31,80mg/dl (RIQ 10,90-76,85) vs. 18,15mg/dl (RIQ 7,50-54,13) (p=0,0001 por U de Mann-Whitney).
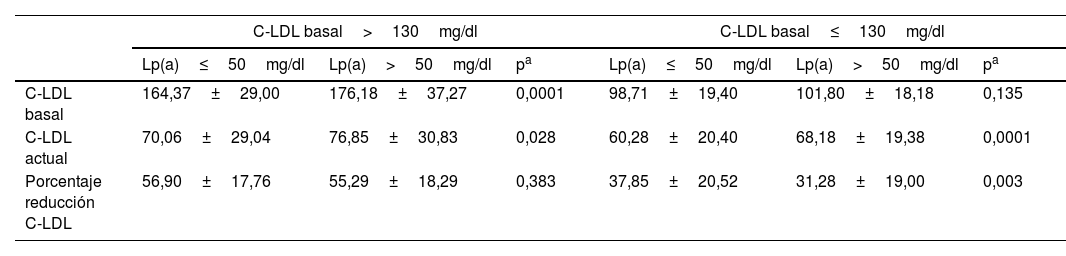
Asociación de Lp(a) y C-LDLHemos analizado 2 grupos de pacientes: aquellos con un C-LDL basal≤130mg/dl y los que partían de un C-LDL basal>130mg/dl (tabla 2).
Niveles de C-LDL basal y actual en individuos con C-LDL basal> y ≤130mg/dl, según los niveles de Lp(a)
| C-LDL basal>130mg/dl | C-LDL basal≤130mg/dl | |||||
|---|---|---|---|---|---|---|
| Lp(a)≤50mg/dl | Lp(a)>50mg/dl | pa | Lp(a)≤50mg/dl | Lp(a)>50mg/dl | pa | |
| C-LDL basal | 164,37±29,00 | 176,18±37,27 | 0,0001 | 98,71±19,40 | 101,80±18,18 | 0,135 |
| C-LDL actual | 70,06±29,04 | 76,85±30,83 | 0,028 | 60,28±20,40 | 68,18±19,38 | 0,0001 |
| Porcentaje reducción C-LDL | 56,90±17,76 | 55,29±18,29 | 0,383 | 37,85±20,52 | 31,28±19,00 | 0,003 |
C-LDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína (a).
Los pacientes con niveles de C-LDL basal>130mg/dl y Lp(a)>50mg/dl tenían valores significativamente más elevados de C-LDL basal y C-LDL actual, en comparación con los que tenían una Lp(a)≤50mg/dl.
Los pacientes con niveles de C-LDL basal≤130mg/dl tenían valores similares de C-LDL basal, independientemente de que la Lp(a) fuera> o ≤50mg/dl, sin embargo tenían valores de C-LDL actual significativamente más elevados cuando Lp(a) era>50mg/dl.
El porcentaje de reducción de C-LDL es similar en pacientes con C-LDL basal>130mg/dl, independientemente del valor de Lp(a); en los individuos con C-LDL basal≤130mg/dl, los que tenían una Lp(a)>50mg/dl mostraron una reducción significativamente menor que los que tenían una Lp(a)≤50mg/dl.
Niveles de Lp(a) y valores objetivo de C-LDL alcanzadosEl porcentaje de pacientes que alcanzaron niveles objetivo de C-LDL establecidos en las guías europeas de dislipidemias23 (tanto inferiores a 70mg/dl como a 55mg/dl) fue menor en pacientes con Lp(a)>50mg/dl, a pesar del mayor uso de estatinas de alta potencia y THL de combinación con ezetimibe en ellos (tabla 1).
Cuando corregimos el C-LDL según niveles de Lp(a) por la fórmula de Dahlen, la consecución de objetivos de C-LDL mejora con respecto al C-LDL calculado. Alcanzan un C-LDL<70mg/dl el 76,1 vs. el 59,1% (p=0,0001) de pacientes y un C-LDL<55mg/dl el 54,4 vs. el 31,8% (p=0,0001).
El objetivo de C-LDL<70mg/dl se mejora considerando el C-LDL corregido tanto en pacientes con Lp(a)≤50mg/dl (71,6 vs. 62,9%; p=0,0001) como con Lp(a)>50mg/dl (86,3 vs. 50,6%; p=0,0001), aunque la magnitud es mayor en estos últimos. También se mejora el objetivo de C-LDL<55mg/dl en pacientes con Lp(a)≤50mg/dl (46,9 vs. 36,3%; p=0,0001), pero, sobre todo, en aquellos con Lp(a)>50mg/dl (71,4 vs. 21,7%; p=0,0001).
Las medianas de Lp(a) son diferentes según el nivel de C-LDL alcanzado: los individuos en los que se consiguió un C-LDL≤55mg/dl tenían valores de Lp(a) significativamente más bajos que los que alcanzaron valores del C-LDL entre 55-70mg/dl y >70mg/dl. Por lo tanto, los niveles de Lp(a) elevados parece que dificultan la consecución de los objetivos establecidos en las guías de práctica clínica (tabla 3).
Valores de Lp(a) según objetivo de C-LDL alcanzado
| Niveles de C-LDL alcanzados | <55mg/dl | 55-69,9mg/dl | >70mg/dl |
|---|---|---|---|
| Mediana Lp(a) (RIQ) | 15,9 (6,0-40,9) (1) | 23,8 (8,1-62,9) (2) | 30,1 (10,62-67,3) (3) |
U de Mann-Whitney.
C-LDL: colesterol unido a lipoproteínas de baja densidad; Lp(a): lipoproteína (a); RIQ: rango intercuartílico.
1 y 2=0,0001; 1 y 3=0,000; 2 y 3=0,160.
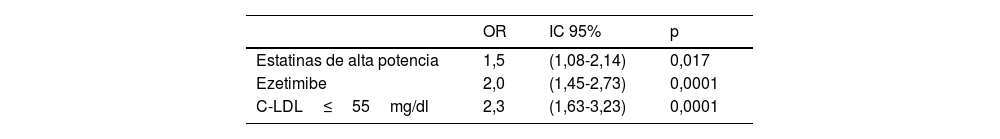
En el análisis multivariado fueron variables clínicas asociadas de forma independiente con tener una Lp(a) elevada (>50mg/dl) el THL con estatinas de alta potencia (OR 1,5; IC 95% 1,1-2,1; p=0,017), el THL de combinación con ezetimibe (OR 2,0; IC 95% 1,5-2,7; p=0,0001), y la no consecución del objetivo de C-LDL<55mg/dl establecido en las guías ESC/EAS 2019 de dislipidemias23 para pacientes de muy alto riesgo cardiovascular (OR 2,3; IC 95% 1,6-3,2; p=0,0001) (tabla 4).
Predictores clínicos de Lp(a)>50mg/dl en el análisis multivariado
| OR | IC 95% | p | |
|---|---|---|---|
| Estatinas de alta potencia | 1,5 | (1,08-2,14) | 0,017 |
| Ezetimibe | 2,0 | (1,45-2,73) | 0,0001 |
| C-LDL≤55mg/dl | 2,3 | (1,63-3,23) | 0,0001 |
C-LDL: colesterol unido a lipoproteínas de baja densidad; IC 95%: intervalo de confianza del 95%; OR: odds ratio.
Los resultados de este estudio muestran que los pacientes con EAC y niveles elevados de Lp(a) tienen menos probabilidades de alcanzar los objetivos de lípidos recomendados en las guías a pesar del uso de THL intensivo con estatinas de alta potencia o THL de combinación con ezetimibe, en un elevado porcentaje de casos.
La EAS propuso<50mg/dl como nivel de Lp(a) óptimo, que se correspondería con el percentil 80 de la población caucásica, lo que representa el 20% de la población con niveles más altos20. En el presente estudio, en pacientes con EAC encontramos una prevalencia de niveles elevados (>50mg/dl) de Lp(a) del 30,8%; esta prevalencia es similar a la descrita en otros estudios de pacientes con EAC y superior a la descrita en población general, lo que muestra que la Lp(a) elevada es un factor de riesgo importante para el desarrollo de EAC. También demostramos que la Lp(a) parece estar fuertemente asociada positivamente con la hiperlipidemia. Los participantes del estudio PRAXY, de pacientes con síndrome coronario agudo prematuro, tuvieron una mayor prevalencia de Lp(a) alta en comparación con la población general (20 vs. 31%; p<0,001), similar a la de nuestro estudio. En comparación con los pacientes con Lp(a) más baja (≤50mg/dl), los pacientes con niveles altos de Lp(a) (>50mg/dl) tuvieron una mayor prevalencia de hiperlipidemia24. En nuestro país, en el registro de Arrobas Velilla et al.25 el 29,58% de las muestras analizadas presentaron Lp(a)>50mg/dl y el 1,52%>180mg/dl.
La medición del C-LDL incluye el C-Lp(a), que puede contribuir aproximadamente entre un 30 y un 45% al C-LDL medido26. Por tanto, cuando la masa total de Lp(a) es alta, la contribución de C-Lp(a) al C-LDL es significativa26,27. Y así, los niveles altos de Lp(a) generados genéticamente aumentan falsamente el C-LDL calculado y, de forma independiente, el riesgo de EAC28. Por lo tanto, el colesterol calculado debe modificarse para tener en cuenta el colesterol asociado a la Lp(a) mediante la fórmula de Dalhen22.
El THL usado de forma habitual en el tratamiento de la hipercolesterolemia (estatinas y ezetimiba) no disminuye los niveles de Lp(a), por lo que en pacientes con enfermedad cardiovascular con niveles elevados de Lp(a) puede ser más complicada la reducción a los niveles de C-LDL que establecen las guías ESC/EAS actuales (<55mg/dl).
En nuestro estudio, los sujetos con niveles de Lp(a)>50mg/dl presentaban un perfil lipídico más desfavorable que aquellos con Lp(a)≤50mg/dl; los niveles de colesterol total y C-LDL eran más elevados en los primeros. Esto refleja que el C-LDL calculado también mide la Lp(a). Ninguno de los métodos utilizados para determinar el C-LDL nos permiten discernir entre el colesterol de las partículas de LDL y Lp(a), por lo que deben informarse juntos como C-LDL, el cual incluye «C-LDL+C-Lp(a)»26. En casos donde Lp(a) es muy baja, esta limitación no es clínicamente importante, sin embargo, a medida que aumenta Lp(a) también aumenta su contribución al C-LDL, y limita la correcta interpretación de la contribución de cada uno. Los estudios bioquímicos han evidenciado que el contenido de C-Lp(a) como porcentaje de la masa de Lp(a) varía de 20 a 45% dependiendo del individuo y el nivel basal de Lp(a)26,29, de tal manera que en pacientes con elevaciones extremas de Lp(a) y un C-LDL controlado, C-LDL puede ser predominantemente o casi completamente C-Lp(a). Así, en pacientes tratados con dosis altas de estatinas y en los que no conseguimos una reducción «esperada» de C-LDL, su verdadero C-LDL puede ser muy bajo y son menos sensibles a una mayor reducción de C-LDL debido a que tienen una significativa proporción de su C-LDL en partículas Lp(a). En estos individuos con Lp(a) elevada, una fracción importante de C-LDL, tanto actual como basal, puede ser transportada por partículas de Lp(a) y contribuir de forma sustancial al C-LDL calculado, y en ellos las estatinas y ezetimibe sólo reducen el C-LDL, no el C-Lp(a).
En un reciente estudio30 se observó una fuerte correlación positiva entre la concentración sérica de Lp(a) y el porcentaje de sobreestimación de C-LDL, y que a medida que aumentaba la concentración de Lp(a) no había una variación significativa en el porcentaje de disminución del C-LDL corregido durante el tratamiento con atorvastatina.
Nosotros observamos que en el subgrupo de pacientes con niveles de C-LDL basal>130mg/dl, y que además tienen niveles de Lp(a)>50mg/dl, conseguimos menores reducciones de C-LDL que en aquellos con Lp(a)≤50mg/dl, a pesar de un uso de THL más intensivo. Estas observaciones pueden tener implicaciones terapéuticas y en los objetivos de tratamiento de C-LDL. En nuestro estudio, el uso de THL de combinación fue significativamente superior en individuos con niveles más elevados de Lp(a). A pesar de ello, los niveles de C-LDL alcanzados en individuos con Lp(a)>50mg/dl fueron significativamente más elevados que en los que tenían Lp(a)≤50mg/dl, lo que refleja una cierta «resistencia» en la consecución de objetivos en pacientes con valores elevados de Lp(a). Esa «resistencia» al THL de alta intensidad que hemos comprobado en nuestro estudio ya fue mostrada en el ensayo FOURIER, donde los pacientes con los niveles más altos de Lp(a) basales no pudieron alcanzar niveles muy bajos de C-LDL (<20mg/dl)31. En el estudio de Verbeek et al. se destaca la trascendencia clínica de este hecho32, ya que para un mismo nivel dado de C-LDL, el riesgo de EAC aumentó en un 40-50% cuando los valores de Lp(a) fueron≥50mg/dl, y además constatan que los niveles altos de Lp(a) también están estrechamente asociados con resultados clínicos adversos en sujetos con valores bajos de C-LDL.
Esto es indicativo de que con los actuales THL será muy difícil conseguir los objetivos en pacientes con Lp(a) elevada y EAC, y serán necesarios nuevos fármacos que además reduzcan los niveles de Lp(a).
En nuestro estudio, a pesar de que un porcentaje mayor de pacientes con niveles elevados de Lp(a) (>50mg/dl) estaban tratados con estatinas de alta potencia y THL de combinación con ezetimibe, no conseguimos una reducción hasta niveles objetivo de C-LDL con respecto a los que tenían niveles menores de Lp(a) (≤50mg/dl). Esto nos lleva a promover el uso de fármacos que puedan disminuir la Lp(a).
En la figura 1 se presenta un resumen de las principales conclusiones del estudio.
Resumen del estudio que incluye los resultados más relevantes del mismo en pacientes con Lp(a)>50mg/dl y Lp(a)≤50mg/dl.
C-LDL: colesterol unido a lipoproteínas de baja densidad; C-Lp(a): colesterol unido a lipoproteína (a); EAC: enfermedad arterial coronaria; OR: odds ratio; THL: tratamiento hipolipidemiante.
La prevalencia de niveles elevados de Lp(a) (>50mg/dl) es mayor en individuos con EAC que lo descrito en la población general.
Las concentraciones elevadas de Lp(a) se asocian con niveles más altos de C-LDL y en estos pacientes existe una dificultad para conseguir unos niveles de C-LDL óptimos según establecen las guías de práctica clínica.
En el contexto de riesgo cardiovascular muy alto y extremadamente alto y niveles de Lp(a) elevados es necesario el uso de otros fármacos dirigidos específicamente a Lp(a), ya que la terapia con estatinas de alta potencia y ezetimiba es ineficaz para reducir la Lp(a) y, por lo tanto, conseguir los niveles de C-LDL que se establecen en las guías de práctica clínica es muy difícil.
Fortalezas y limitaciones del estudioUna de las principales fortalezas del estudio es la población de estudio bien caracterizada, con evidencia angiográfica de EAC y perfiles lipídicos completos. Una limitación es la ausencia de niveles basales de C-LDL antes del inicio del tratamiento hipolipidemiante en un 27,5% de los individuos, en los que se tuvo que calcular sin tratamiento previo utilizando los factores de conversión publicados.
- •
La determinación del C-LDL incluye el colesterol transportado por las LDL y el de Lp(a).
- •
La concentración de Lp(a) influye en los niveles de C-LDL.
- •
Se sabe poco sobre cómo los niveles de Lp(a) influyen en la consecución de objetivos de C-LDL en pacientes de alto riesgo establecidos por las guías de práctica clínica actuales.
- •
Los pacientes con Lp(a)>50mg/dl presentan niveles de C-LDL más elevados.
- •
En los pacientes con enfermedad arterial coronaria con niveles de Lp(a)>50mg/dl es más difícil alcanzar el objetivo de C-LDL<55mg/dl establecidos en las guías.
- •
Estos pacientes con Lp(a) elevada tienen un THL más potente, con más estatinas de alta potencia y tratamiento de combinación con ezetimiba.
- •
Para conseguir alcanzar los objetivos de C-LDL<55mg/dl en pacientes con Lp(a)>50mg/dl son necesarios nuevos fármacos, como inhibidores de PCSK9 o anti-ARN.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.