Un grupo de expertos convocado por la Sociedad Española de Arteriosclerosis (SEA) se ha encargado de actualizar el documento de la SEA sobre las indicaciones de los inhibidores de PCSK9 (iPCSK9) en la práctica clínica publicadas en 2016. Esta actualización es necesaria porque en el periodo transcurrido hasta la actualidad se han publicado los resultados de los ensayos clínicos realizados a gran escala con iPCSK9 que demuestran que, además de su alta potencia para disminuir el colesterol aterogénico, disminuyen el riesgo de presentar episodios de enfermedad cardiovascular aterosclerótica en los pacientes con enfermedad tanto estable como reciente, y con un alto grado de seguridad. La presente actualización aporta las recomendaciones y el nivel de evidencia para la prescripción de los iPCSK9 en los pacientes con hipercolesterolemia familiar homo y heterocigota, con enfermedad cardiovascular aterosclerótica y en prevención primaria en los pacientes de muy alto riesgo cardiovascular. Dichas recomendaciones se han establecido teniendo en cuenta la concentración de c-LDL, la situación clínica del paciente, los condicionantes de riesgo adicionales y la relación coste-efectividad de su utilización.
A group of experts convened by the Spanish Society of Arteriosclerosis (SEA) has been in charge of updating the SEA document on the indications of PCSK9 inhibitors (PCSK9i) in clinical practice that was published in 2016. This update is justified by the fact that the data from clinical trials carried out on a large scale with PCSK9i have shown that in addition to their high potency to lower atherogenic cholesterol, they reduce the risk of atherosclerotic cardiovascular disease, both in patients with stable disease, and with recent disease, and with a high degree of security. This update provides the recommendations and level of evidence for the prescription of iPCSK9 in patients with homozygous and heterozygous familial hypercholesterolemia, with atherosclerotic cardiovascular disease, and in primary prevention in patients with very high cardiovascular risk. These recommendations have been established taking into account the concentration of LDL-C, the clinical situation of the patient, the additional risk factors and the cost-effectiveness of their use.
Los inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (iPCSK9) han supuesto un cambio sustancial en el manejo clínico de la hipercolesterolemia debido a su alta eficacia hipolipemiante y a sus efectos preventivos en la enfermedad isquémica de origen aterotrombótico1,2.
Los iPCSK9 han sido estudiados en un amplio programa de ensayos clínicos que han incluido a poblaciones con enfermedad cardiovascular (ECV), hipercolesterolemia familiar (HF) heterocigota y homocigota, dislipemia mixta y pacientes con intolerancia a estatinas. En todos ellos los iPCSK9 han demostrado un marcado efecto reductor del colesterol de las lipoproteínas de baja densidad (c-LDL), incluso superior al 60%, lo que ha permitido que la mayoría de los pacientes alcancen los objetivos terapéuticos. Dicho efecto hipocolesterolemiante se ha observado con independencia de la intensidad del tratamiento de base3. La Food and Drug Administration (FDA) y la European Medicines Agency (EMA) autorizaron en 2015 Praluent® y Repatha®, nombres registrados de alirocumab y evolocumab, respectivamente, los dos anticuerpos monoclonales dirigidos a inhibir PCSK9 disponibles en la actualidad.
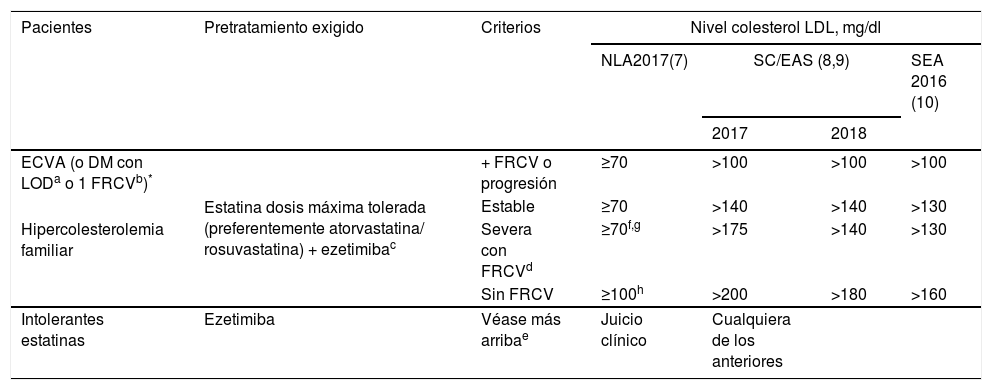
En sus informes de posicionamiento terapéutico la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) establece que evolocumab y alirocumab se financiarán en pacientes con HF heterocigota y en pacientes con ECV establecida (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica), en ambos casos con concentraciones de c-LDL>100mg/dl y en tratamiento con la máxima dosis tolerada de estatina. Asimismo, están incluidos cualquiera de los pacientes de los grupos anteriores que presenten contraindicación o sean intolerantes a las estatinas, y cuyo c-LDL sea >100mg/dl. Además, evolocumab está financiado en pacientes con HF homocigota. Dadas las transferencias del Sistema Nacional de Salud a las comunidades autónomas, algunas de estas han añadido limitaciones a las indicadas por la AEMPS. Las más frecuentes son: comprobar los criterios en informes clínicos detallados, especialmente en la tipificación de la intolerancia a las estatinas, e incluir la administración de ezetimiba antes de autorizar la prescripción del iPCSK9. Después de la aprobación por las agencias reguladoras, las principales sociedades científicas implicadas en el tratamiento y control de las dislipemias establecieron las primeras indicaciones de uso de los iPCSK9. En la tabla 1 se muestran las recomendaciones del Expert Panel of the National Lipid Association4, de la guía conjunta de la European Society of Cardiology y la European Atherosclerosis Society5,6, y la promovida por la Sociedad Española de Arteriosclerosis (SEA) en 20167.
Recomendaciones actuales de uso de iPCSK9 según las principales sociedades científicas de Estados Unidos de América, de Europa y de la Sociedad Española de Arteriosclerosis
| Pacientes | Pretratamiento exigido | Criterios | Nivel colesterol LDL, mg/dl | |||
|---|---|---|---|---|---|---|
| NLA2017(7) | SC/EAS (8,9) | SEA 2016 (10) | ||||
| 2017 | 2018 | |||||
| ECVA (o DM con LODa o 1 FRCVb)* | Estatina dosis máxima tolerada (preferentemente atorvastatina/ rosuvastatina) + ezetimibac | + FRCV o progresión | ≥70 | >100 | >100 | >100 |
| Estable | ≥70 | >140 | >140 | >130 | ||
| Hipercolesterolemia familiar | Severa con FRCVd | ≥70f,g | >175 | >140 | >130 | |
| Sin FRCV | ≥100h | >200 | >180 | >160 | ||
| Intolerantes estatinas | Ezetimiba | Véase más arribae | Juicio clínico | Cualquiera de los anteriores | ||
DM, diabetes mellitus; ECVA, enfermedad cardiovascular aterosclerótica; ESC/EAS, European Society of Cardiology/European Atherosclerosis Society; FRCV, factor de riesgo cardiovascular; LOD, lesión de órgano diana; NLA, National Lipid Association; SEA, Sociedad Española de Arteriosclerosis.
En las primeras valoraciones no se disponía de los estudios de intervención con objetivos finales clínicos y las recomendaciones se establecieron en base a supuestos teóricos sobre la eficacia hipolipemiante y la esperable repercusión en la prevención cardiovascular de estos fármacos8,9. Los resultados de los estudios FOURIER con evolocumab1, Spire con bococizumab10 y ODYSSEY OUTCOMES con alirocumab2 han aportado una evidencia científica robusta sobre el papel de los iPCSK9 en la prevención cardiovascular, recogida en las indicaciones aprobadas por la European Medicines Agency11,12
Estudios de prevención cardiovascular con IPCSK9En el estudio FOURIER1 se incluyeron pacientes con ECV y factores de riesgo cardiovascular (FRCV) asociados, que mantenían un c-LDL>70mg/dl a pesar del tratamiento con estatinas de alta intensidad en combinación, o no, con ezetimiba. Los pacientes fueron aleatorizados a evolocumab (140mg cada 2semanas o 420mg mensuales) o placebo, con una mediana de seguimiento de 2,2años. El 9,8% de los pacientes tratados con evolocumab y el 11,3% de los tratados con placebo presentaron una recurrencia isquémica (muerte por ECV, infarto agudo de miocardio [IAM], ictus, hospitalización por angina de pecho o revascularización coronaria) (hazard ratio [HR] 0,85; IC95%: 0,79-0,92; p<0,001). Dicho efecto preventivo se observó con independencia de la intensidad de la estatina basal y del valor inicial del c-LDL13. También se observó que cuanto más bajo era el c-LDL obtenido con el tratamiento, menor era la incidencia de ECV14. En el ODYSSEY OUTCOMES se incluyeron pacientes que habían presentado un síndrome coronario agudo en los 12meses previos a su inclusión y que mantenían un c-LDL>70mg/dl, o un colesterol ligado a las lipoproteínas que no son de alta densidad (c-NoHDL)>100mg/dl, o una apolipoproteínaB >80mg/dl) a pesar de un tratamiento con la dosis máxima tolerada de estatinas, asociadas o no a ezetimiba. Los pacientes fueron aleatorizados a alirocumab o placebo y seguidos durante una mediana de 2,8años, titulando las dosis de alirocumab (75 o 150mg/dl cada 2semanas) para alcanzar un objetivo terapéutico de c-LDL entre 25 y 50mg/dl. El 9,5% de los pacientes tratados con alirocumab y el 11,1% de los tratados con placebo presentaron una recurrencia isquémica (muerte por ECV, IAM, ictus u hospitalización por angina de pecho) (HR: 0,85; IC95%: 0,78-0,93; p<0,001). El efecto de alirocumab fue más acusado en el subgrupo preespecificado con un c-LDL ≥100mg/dl (HR: 0,76; IC95%: 0,65-0,87). Así mismo, el tratamiento con alirocumab se asoció a una menor incidencia de muerte por cualquier causa que el placebo (3,5% vs 4,1%; HR: 0,85; IC95%: 0,73-0,98; p nominal=0,026)2,15. Tanto el estudio FOURIER como el estudio ODYSSEY OUTCOMES demostraron que un descenso del c-LDL por debajo de 70mg/dl, tanto a dosis fija como modulada para alcanzar objetivos lipídicos, permitía una reducción de las complicaciones cardiovasculares con un alto grado de seguridad. Los efectos beneficiosos fueron los esperados para el descenso del c-LDL alcanzado y la duración de los estudios. Un tercer iPCSK9, bococizumab, mostró un beneficio cardiovascular consistente con los resultados previos, pero su desarrollo fue interrumpido prematuramente al atenuarse la eficacia hipolipemiante por el desarrollo de anticuerpos neutralizantes del fármaco al tratarse de un anticuerpo monoclonal «humanizado»10.
Disminución del c-LDL y prevención cardiovascularEn los últimos lustros, de forma previa a la llegada de los iPCSK9, un gran número de ensayos clínicos aleatorizados habían demostrado la eficacia del tratamiento hipolipemiante con estatinas para reducir la tasa de complicaciones cardiovasculares. Ello se resume en los metaanálisis de los Cholesterol Treatment Trialists’ (CTT)16,17. En los dos metaanálisis principales de este grupo se establece de modo consistente que el tratamiento con estatinas se asocia a una reducción de la morbilidad cardiovascular entre el 20 y el 25% por cada reducción del c-LDL de 1mmol/l (38,7mg/dl)16,17. Asimismo, se muestra que el tratamiento intensivo con estatinas se asocia a un efecto similar, manteniendo la relación antedicha de reducción de c-LDL y reducción de morbilidad cardiovascular. Del mismo modo, el estudio IMPROVE-IT demostró, por primera vez para un fármaco distinto a las estatinas, que ezetimiba inducía una reducción adicional del riesgo, consistente con lo predicho por el CTT18. Los análisis de la relación entre los niveles de colesterol alcanzados durante el tratamiento y la tasa de complicaciones cardiovasculares en los estudios con estatinas, ezetimiba e iPCSK9 muestran un beneficio que continúa progresivamente para descensos del c-LDL al menos hasta 30-40mg/dl, sin que se haya detectado un umbral a partir del cual desaparezca el efecto beneficioso o se asista a un aumento de efectos secundarios13,19–21. Análisis recientes sugieren que el 70% de los pacientes con ECV establecida alcanzarían el objetivo de c-LDL<70mg/dl con estatinas a altas dosis, y esa cifra llegaría al 86% con la adición de ezetimiba22. No obstante, para algunos autores sería razonable considerar directamente la asociación de iPCSK9 en los pacientes tratados con estatinas cuyos niveles de c-LDL requieran descensos adicionales superiores al 20-25%23,24.
Atendiendo a los resultados de los estudios FOURIER y ODYSSEY OUTCOMES, parecería razonable tratar con iPCSK9 a todos los pacientes con ECV ateromatosa que no alcanzan el objetivo de c-LDL<70mg/dl con los tratamientos habituales. Sin embargo, es necesario seleccionar a los candidatos que tienen una mayor probabilidad de beneficiarse de este tratamiento para mejorar la eficiencia terapéutica. En base a estas premisas, presentamos unas recomendaciones actualizadas sobre el uso de los iPCSK9 que han sido elaboradas por un grupo de expertos de la SEA.
Hipercolesterolemia familiarLa disminución del c-LDL es una prioridad en la HF. Sin embargo, como en otras poblaciones, la intensidad de la reducción debe establecerse teniendo en cuenta los beneficios de la intervención, los efectos secundarios de la misma y los costes de dicha reducción25. Dado que los efectos secundarios de los iPCSK9 son muy escasos, los beneficios de la intervención los podemos deducir en base a la reducción del c-LDL y el riesgo cardiovascular (RCV) basal. El número de sujetos a tratar para evitar un evento, es decir, el beneficio neto de la intervención, es el parámetro que hemos considerado fundamental para establecer la indicación de estos fármacos.
El presente documento aborda dos aspectos que a juicio del panel son claves: a)la definición de HF heterocigota (HFhe) en sujetos con y sin tratamiento hipolipemiante, y b)los factores de riesgo de desarrollar un evento cardiovascular en sujetos con HFhe en tratamiento con estatinas.
Definición de hipercolesterolemia familiar heterocigota a efectos de la indicación de iPCSK9La definición más frecuentemente recomendada para el diagnóstico de HFhe es la propuesta por la Dutch Lipid Clinics Network (DLCN) y adoptada por la Sociedades Europeas de Arteriosclerosis y de Cardiología26. Sin embargo, esta definición es muy dependiente de la información clínica familiar, no siempre disponible, de criterios clínicos subjetivos como la presencia de xantomas tendinosos, y de información sobre los genes candidatos causantes de HFhe. Ya que el estudio genético no está a disposición de muchos pacientes, resulta discriminatorio utilizar unos criterios que ponen en situación de inferioridad a los pacientes sin esa información.
Recomendamos el diagnóstico clínico de HFhe para la indicación de iPCSK9 en base a cualquiera de las siguientes situaciones:
- •
Hipercolesterolemia familiar heterocigota con confirmación genética.
- •
Puntuación del sistema propuesto por la DLCN ≥6 puntos.
- •
Hipercolesterolemia primaria con un c-LDL ≥220mg/dl (o c-LDL ≥130mg/dl si está en tratamiento hipolipemiante de alta intensidad) e historia de hipercolesterolemia en familiar de primer grado27,28.
La prevalencia de ECV en los pacientes con HFhe es entre 3 y 8 veces superior al de la población general29. Sin embargo, existen pocos estudios para determinar la incidencia de ECV y los factores de riesgo que la modulan en pacientes con HFhe en tratamiento prolongado con estatinas. El estudio Montreal se basa en la asociación de variables clínicas y la prevalencia de eventos30. El estudio Safeheart ha mostrado en pacientes de nuestro medio la importancia de la presencia de factores de riesgo clásicos en los pacientes con HFhe a la hora de evaluar su riesgo y a partir de él se ha desarrollado una ecuación para el cálculo de riesgo en paciente con HF, aunque basado en un número escaso de eventos cardiovasculares31. Por otro lado, datos obtenidos de bases de datos muy amplias a partir de registros electrónicos permiten la estimación del riesgo de pacientes con fenotipo de HF con la fortaleza de basar sus cálculos en un amplio número de pacientes (Ramos et al., 2019, remitido para su publicación).
El Registro de Dislipemias de la SEA, con más de 3.000 pacientes con HFhe, es la fuente de información que hemos aplicado de forma preferencial en este documento. Este estudio analiza de forma prospectiva la aparición de eventos cardiovasculares en los pacientes con HFhe en tratamiento con estatinas. En la tabla 2 se describen los factores de riesgo identificados en el Registro32. De los datos procedentes de este y otros estudios se demuestra que los pacientes con HFhe sin enfermedad vascular establecida y con al menos cuatro factores de riesgo asociados tienen un riesgo de complicaciones cardiovasculares futuras superior al 20%.
Factores de riesgo de enfermedad cardiovascular en sujetos con hipercolesterolemia familiar en tratamiento estable con estatinas de alta potencia a computar para la indicación de iPCSK9
| Factores detectados en el Registro de la SEA32 |
| Sexo masculino |
| Colesterol LDL>250 mg/dl sin tratamiento |
| Hipertensión arterial |
| Diabetes |
| Tratamiento con estatinas inferior a 5 añosa |
| Inicio de tratamiento con estatinas por encima de los 30 añosa |
| Estudio genético positivo para HF |
| Obesidad (IMC>30 kg/m2) |
| Otros factores30,31 |
| Tabaquismo activo |
| Concentración plasmática de Lp(a)>50 mg/dl |
Finalmente, la prevalencia de diabetes está reducida en pacientes con HF33. No obstante, la coexistencia de DM e HF hace que el riesgo vascular se triplique (un aumento explicado, al menos en parte, por la concurrencia de otros factores de riesgo vascular)34.
Hipercolesterolemia familiar homocigotaLa forma homocigota de HF (HFho) es un trastorno infrecuente, y su prevalencia se calcula en 1/450.000 individuos. Las cifras de c-LDL son extremadamente elevadas y la afectación cardiovascular, muy precoz. La reducción de c-LDL es una prioridad absoluta, pero los tratamientos actuales son muy poco eficaces, requiriéndose medidas extraordinarias como la aféresis de LDL. Evolocumab ha demostrado una capacidad de reducción del c-LDL en los pacientes con HFho de alrededor del 20%35. Aunque no disponemos, ni dispondremos, de estudios sobre el impacto de evolocumab en las complicaciones cardiovasculares, su uso está indicado en todos los pacientes con HFho a partir de los 14años, excepto en los que tienen una doble mutación nula del receptor LDL.
Prevención secundaria en los pacientes con enfermedad cardiovascular establecida. Estratificación del riesgoLos pacientes con enfermedad vascular ateromatosa establecida presentan un elevado riesgo de recurrencia. Por este motivo está indicado que todos ellos reciban tratamiento hipolipemiante intensivo, habitualmente con estatinas de alta potencia o combinaciones terapéuticas, con el objetivo de disminuir al menos un 50% su concentración de c-LDL y alcanzar un valor inferior a 70mg/dl36. A pesar de ello, muchos pacientes mantienen cifras de c-LDL por encima de las recomendables y podrían beneficiarse del tratamiento con iPCSK9, fundamentalmente aquellos cuyo riesgo vascular persista extraordinariamente elevado y tengan niveles de c-LDL lejos del objetivo terapéutico.
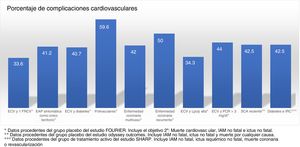
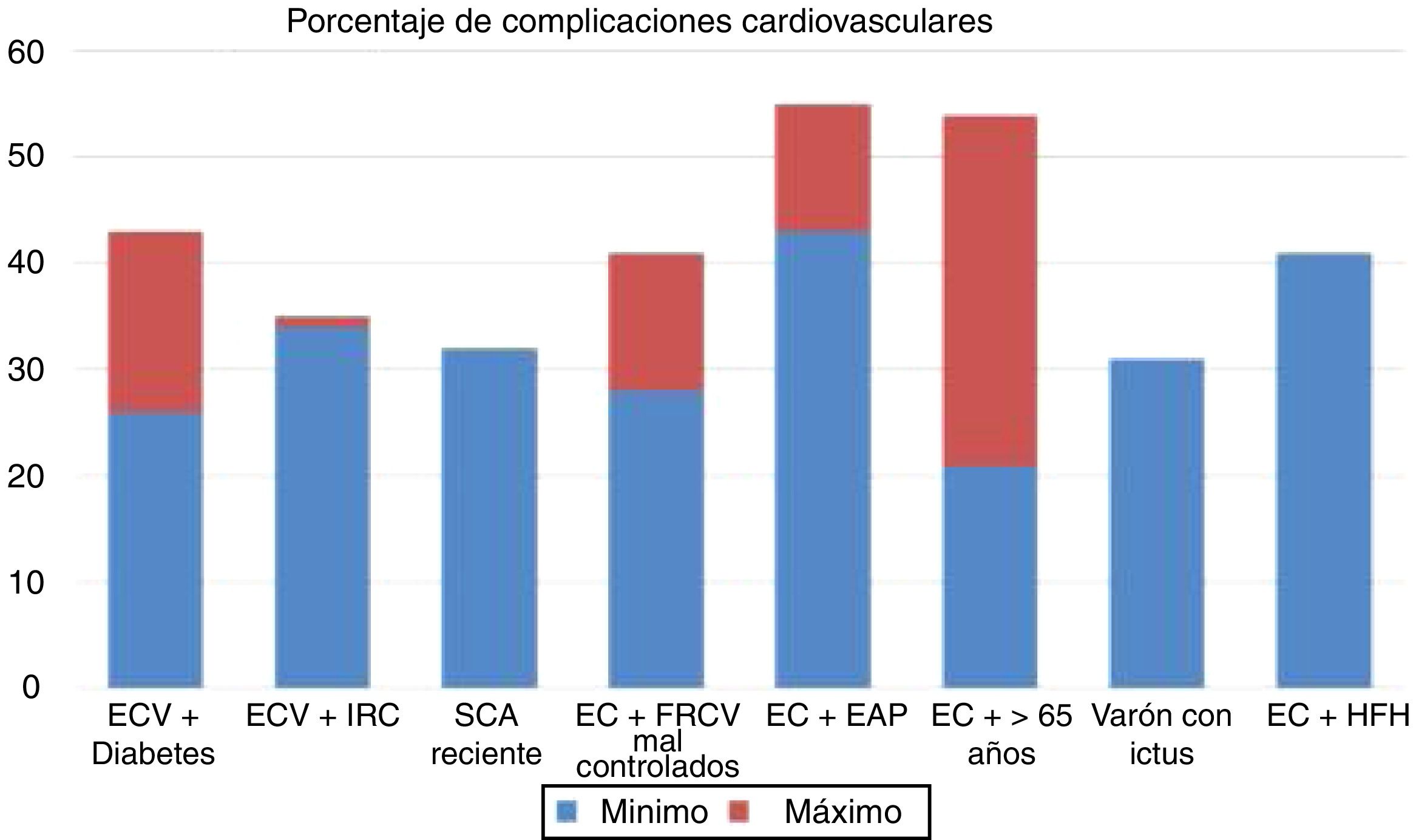
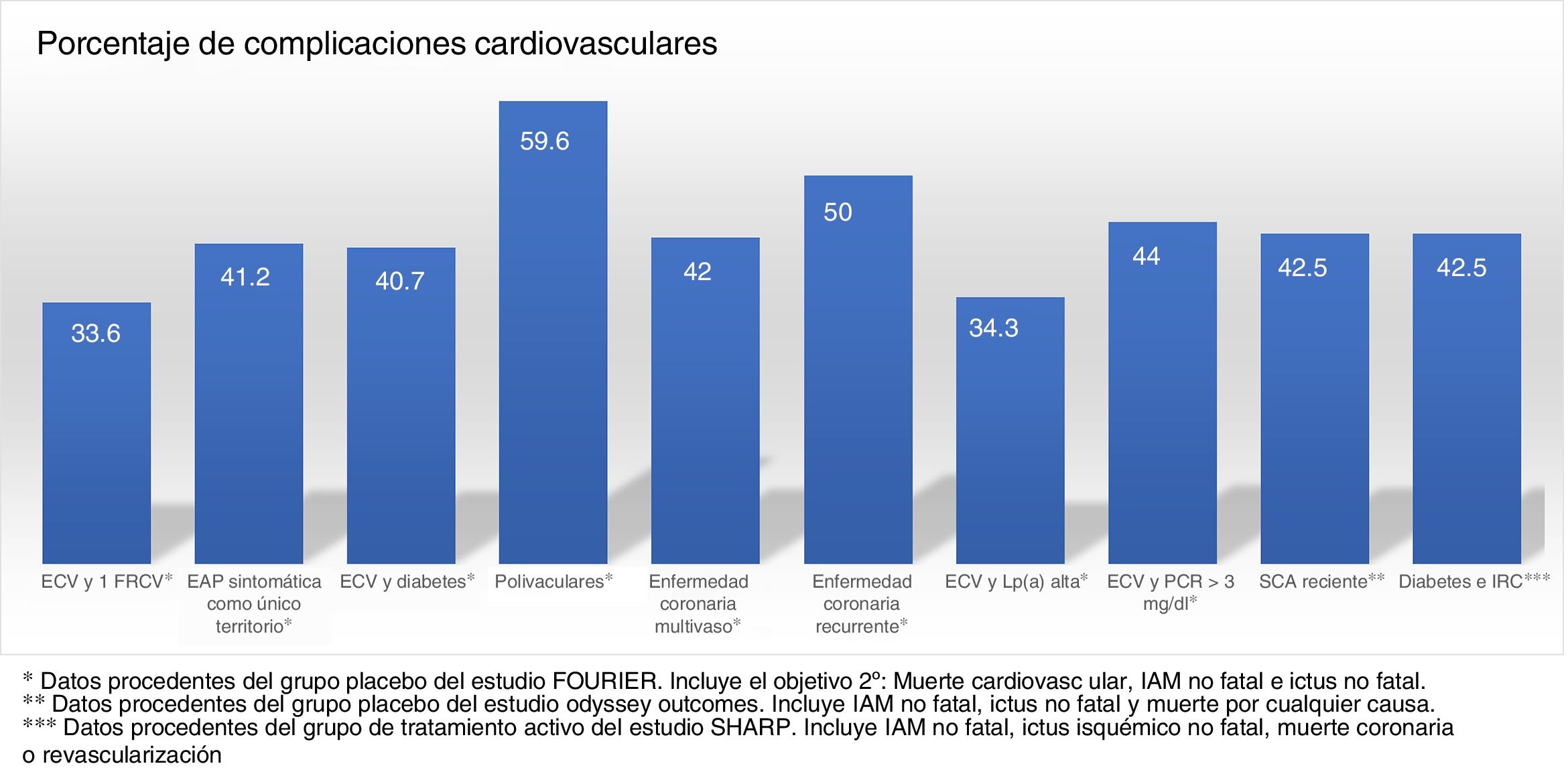
Los ensayos clínicos aleatorizados y controlados indican que, a pesar del tratamiento con estatinas, algunos subgrupos de pacientes muestran una tasa estimada de eventos superior al 30 y al 40% a los 10años (fig. 1)37. Del mismo modo, algunos subgrupos de pacientes del grupo placebo de los estudios FOURIER y ODYSSEY OUTCOMES, a pesar del tratamiento con altas dosis de estatinas y algunos casos con ezetimiba, mantuvieron una alta tasa de complicaciones cardiovasculares, por lo que siguen siendo pacientes de muy alto riesgo (fig. 2).
Tasa de complicaciones vasculares (infarto agudo de miocardio [IAM] no fatal +ictus no fatal +muerte cardiovascular) extrapolada a 10años del grupo de tratamiento con estatinas en diversos estudios de intervención. EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; HFH: hipercolesterolemia familiar hetarocigota; IRC: insuficiencia renal crónica; SCA: síndrome coronario agudo.
Fuente: Robinson et al.37.
Tasa de complicaciones cardiovasculares extrapolada a 10 años en los grupos y subgrupos placebo del estudio FOURIER, en el grupo placebo del Odyssey Outcomes y en el grupo de tratamiento activo del estudio SHARP. ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; EAP: enfermedad arterial periférica; Lp(a): lipoproteína (a); PCR: proteína C reactiva; SCA: síndrome coronario agudo; IRC: insuficiencia renal crónica.
El riesgo de episodios isquémicos en los pacientes con diabetes mellitus tipo2 (DM2) es 4-8 veces superior al encontrado en la población no diabética. Este riesgo tan elevado se mantiene tras ajustar por edad, sexo y otros factores clásicos de RCV. A su vez, las lesiones ateromatosas en la DM2 son más extensas, distales y precoces. Por ello se ha considerado a la DM2 como una situación de alto o muy alto RCV38, especialmente cuando se asocia a factores clásicos de RCV, si hay lesión de órgano diana (albuminuria, afectación retiniana o hipertrofia ventricular), si existe insuficiencia renal, si se observan placas de ateroma por cualquier método diagnóstico, y especialmente si existe ECV clínica en cualquier territorio.
En el paciente diabético se ha demostrado también una relación directa entre el descenso de los niveles de c-LDL y la reducción del riesgo de desarrollar ECV39,40.
El estudio FOURIER muestra, asimismo, un beneficio adicional en la reducción absoluta de eventos cardiovasculares en pacientes diabéticos (2,7 vs 1,6% a 3años)41. No obstante, este beneficio se restringió a una menor necesidad de revascularizaciones, no existiendo diferencias en la variable combinada de IAM, ictus o muerte cardiovascular (reducción del riesgo absoluto [RRA] 2%)41. Así mismo, resultados preliminares del estudio ODYSSEY muestran que el tratamiento con alirocumab en pacientes diabéticos aporta un mayor beneficio que en la población global, dado su mayor riesgo basal (RRA en diabéticos 2,3% vs 1,6% en el conjunto del estudio), pudiéndose justificar su empleo con niveles de c-LDL inferiores a 100mg/dl42. No obstante, esta recomendación deberá ser matizada con un análisis más detallado de este grupo de pacientes, ya que al analizar el subgrupo de pacientes del ODYSSEY con un c-LDL<100mg/dl no se demostró un beneficio en prevención cardiovascular2. En conjunto, ambos estudios, junto con la evidencia acumulada del riesgo de los diabéticos, apoyan un tratamiento más intensivo en pacientes diabéticos, si bien la evidencia directa es limitada.
Elevación de la lipoproteína (a)La elevación de la lipoproteína (a) [Lp(a)] es un factor de riesgo vascular independiente, tanto en la población general como en la población con dislipemia, en especial con HF43, y en los pacientes con ECV establecida44. Existen formas de cardiopatía isquémica precoz con agregación familiar en las que la elevación de Lp(a) es el único factor de riesgo identificable. Una concentración de Lp(a) >50mg/dl (>125nmol/l) se asocia a un RCV elevado45. Los iPCSK9 han mostrado reducir los niveles de Lp(a) de forma significativa, alrededor del 25-30%46,47. Se desconoce si esta reducción de la Lp(a) contribuye a reducir eventos isquémicos. Sin embargo, el mayor riesgo basal de los pacientes con Lp(a) elevada hace que estos se beneficien de una reducción adicional de su concentración de c-LDL. En el estudio FOURIER la reducción absoluta del riesgo de complicaciones cardiovasculares en los pacientes con una Lp(a) por encima de la mediana (>37mg/dl) fue del 2,9% (NNT a 3años de 40; extrapolada a 5años, de 24)44. Una concentración de Lp(a) situada en los cuartiles 3 y 4 de Lp(a) se asociaron a un aumento del riesgo del 17 y del 22% respecto al cuartil inferior, tras ajustar por otros factores de riesgo. Un subanálisis preliminar del estudio ODYSSEY OUTCOMES ha mostrado que el efecto reductor de alirocumab sobre las concentraciones de Lp(a) se asoció a un descenso de los eventos cardiovasculares de forma independiente a su acción sobre el c-LDL48.
Insuficiencia renal crónicaLa insuficiencia renal crónica en estadios avanzados es una condición de muy alto riesgo vascular. La prescripción de estatinas en monoterapia o asociadas a ezetimiba en pacientes con enfermedad renal crónica en estadios3 y4 tiene un efecto preventivo frente a la ECV, mientras que este no se ha observado en pacientes ya en diálisis49.
En los estudios FOURIER y ODISSEY OUTCOMES se excluyeron los pacientes con filtrado glomerular estimado <20ml/min/1,73m2 y <30ml/min/1,73m2, respectivamente. Por ello, los pacientes con insuficiencia renal estadio3 o menores de KDIGO50 no tienen contraindicaciones para recibir estos fármacos. El empleo de iPCSK9 se ha mostrado seguro en formas leves de insuficiencia renal. Además, resultados preliminares del estudio FOURIER indican que evolocumab es eficaz en prevención cardiovascular en los pacientes con insuficiencia renal leve o moderada (estadios3 o inferiores), resultando en una mayor reducción del riesgo absoluto que en pacientes sin insuficiencia renal51. Si las complicaciones cardiovasculares son frecuentes en los pacientes con insuficiencia renal, aún lo son más en los pacientes diabéticos con insuficiencia renal. En el estudio SHARP52, la tasa de complicaciones cardiovasculares mayores (IAM no fatal, ictus isquémico no fatal, muerte coronaria o revascularización) en el grupo de tratamiento con simvastatina y ezetimiba fue del 11,3% (estimada a 10años del 23,1%). Esta tasa en pacientes que además tenían DM2, se incrementó al 18,3% (estimada a 10años del 37,3%). El efecto del alirocumab es similar en pacientes con insuficiencia renal moderada (estadioIIIa), sin aumento de efectos secundarios, pero no existen datos en relación con pacientes con IRC avanzada53.
Indicaciones de utilización de los iPCSK9Los iPCSK9 han demostrado su eficacia en la reducción de la morbimortalidad cardiovascular en los pacientes con ECV ateromatosa y valores de c-LDL superiores a 70mg/dl. Sin embargo, dado que son terapias costosas que se deben mantener a largo plazo, creemos útil indicar dicho tratamiento a los pacientes que tienen una mayor probabilidad de beneficiarse, para limitar al máximo los tratamientos no eficaces y adecuar su coste a los recursos sanitarios.
En este sentido, los estudios coste-beneficio son muy dependientes de las asunciones de los modelos teóricos en que se basan54, lo que ha dado lugar a resultados controvertidos55–57. Adicionalmente, el coste de los iPCSK9 está siendo sometido a descuentos o revisiones a la baja, por lo que las estimaciones económicas actuales tienen un valor transitorio. Por otro lado, no se ha establecido en nuestro sistema nacional de salud un indicador de referencia para considerar coste-efectivo el uso de iPCSK9 por años de vida ajustados por discapacidad.
Diversos trabajos sugieren que serían necesarias reducciones de riesgo absoluto superiores al 1% anual (>10% a 10años, NNT<20 a 5años) para poder justificar el tratamiento con iPCSK958–60. En este documento hemos utilizado un NNT a 5 años < 25 como referencia para las presentes recomendaciones.
Nuestras recomendaciones sobre el uso de los iPCSK9 buscan obtener el máximo beneficio tratando al menor número de pacientes, es decir, seleccionar las poblaciones donde el NNT para evitar un evento sea menor. En otros términos, elegir a los pacientes cuya reducción de riesgo absoluto sea máxima con el tratamiento. Ello es sinónimo de tratar a los pacientes con mayores concentraciones de c-LDL y con un riesgo basal más elevado, en especial si se unen ambas circunstancias.
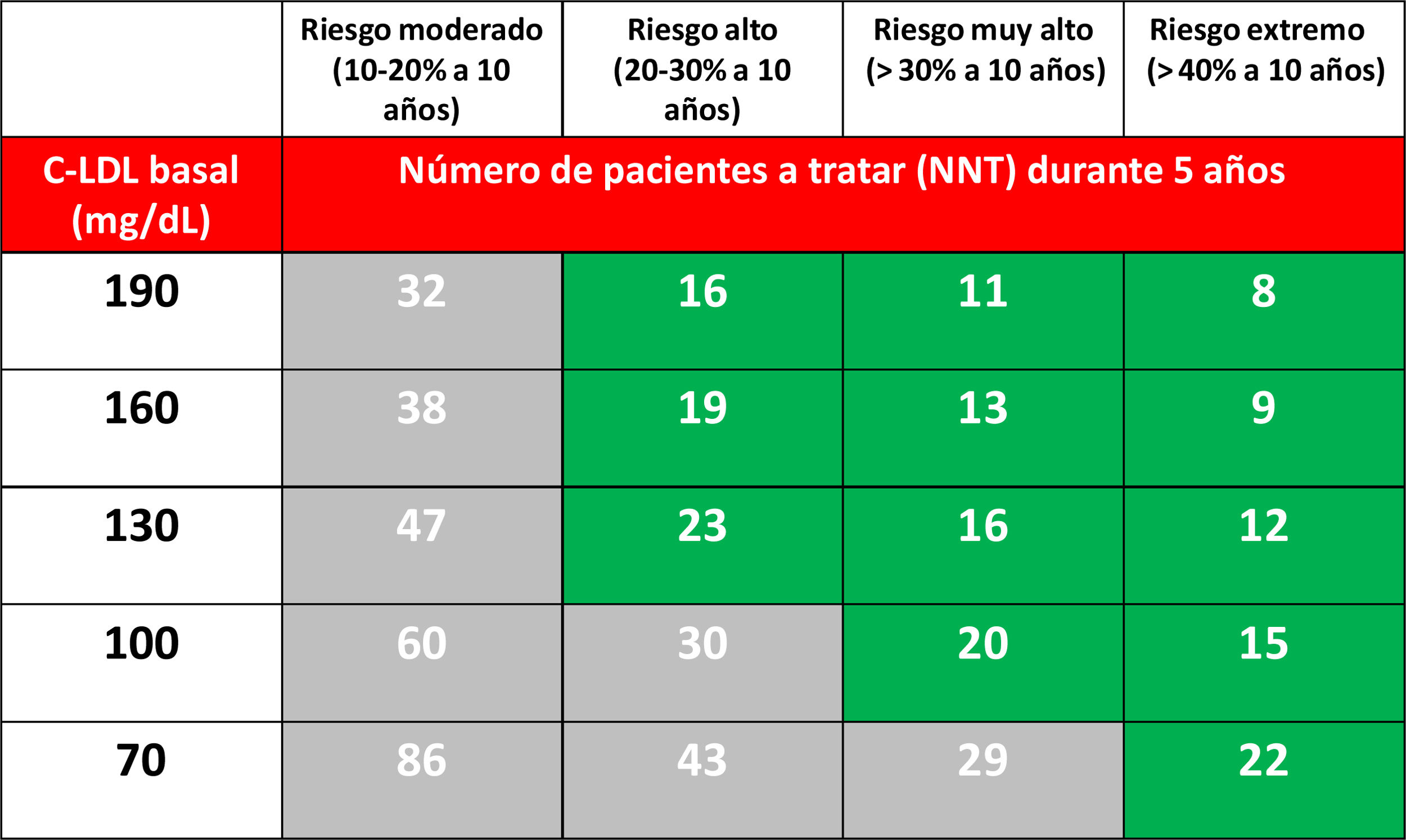
Desde un punto teórico, si aceptamos que los iPCSK9 a su dosis máxima reducen el c-LDL un 60%, el NNT predicho a 5años para evitar un evento cardiovascular mayor en función del RCV y del nivel de c-LDL en tratamiento hipolipemiante optimizado queda reflejado en la tabla 3.
Número de pacientes que se necesita tratar (NNT) con iPCSK9 durante 5 años (asumiendo una reducción adicional del c-LDL del 60%) para evitar un evento cardiovascular mayor (IAM no fatal, ictus no fatal o muerte cardiovascular) en pacientes ya tratados con estatinas, en función del riesgo estimado a 10 años y de la cifra de c-LDL37
Las poblaciones con un riesgo de eventos >30% a pesar del tratamiento hipolipemiante optimizado, en este caso mediante el uso de estatinas, han sido extraídas a partir del grupo de tratamiento activo en ensayos clínicos con estos fármacos37 y se resumen en la figura 1. En estos mismos estudios se ha observado que existen grupos de pacientes con un riesgo extrapolado a 10años incluso >40%. Del mismo modo, datos del estudio ODYSSEY OUTCOMES y de subgrupos del estudio FOURIER1,61–63 han validado estos hallazgos, indicando que existen subgrupos de pacientes con un riesgo de complicaciones cardiovasculares >40% extrapolado a 10años (fig. 2).
Respecto al tratamiento previo a la indicación de iPCSK9, los estudios FOURIER y ODYSSEY OUTCOMES incluyeron pacientes en tratamiento con estatinas a dosis altas, en porcentajes diversos, y con una escasa proporción en tratamiento combinado con ezetimiba. La SEA recomienda que los pacientes candidatos a tratamiento con iPCSK9 estén previamente tratados con terapia hipolipemiante optimizada64, salvo en los pacientes con intolerancia a las estatinas. La diferencia en la eficacia de reducción adicional del c-LDL sobre el valor basal de una estatina a dosis máxima o en combinación con ezetimiba va del 50 al 60%65. Para este documento definimos como tratamiento hipolipemiante optimizado aquel que teóricamente produce una reducción de al menos un 50% del c-LDL y con una adherencia del 80%. El número de pacientes a tratar con iPCSK9 si siguieran un tratamiento optimizado se reduce a una tercera parte66.
Metodología empleada para definir las recomendaciones de uso de iPCSK9Para las recomendaciones hemos tomado como referencia directa de modo prioritario los resultados de los ensayos clínicos con iPCSK9 con objetivos de prevención de eventos cardiovasculares. A partir de estos ensayos hemos estratificado los beneficios basados en los análisis de subgrupos y aproximado los potenciales beneficios para diferentes niveles de c-LDL de partida.
En ausencia de ensayos clínicos que demuestren el beneficio real del tratamiento, hemos desarrollado recomendaciones a partir de las estimaciones de riesgo y el beneficio esperable de la reducción del c-LDL con el uso de iPCSK9.
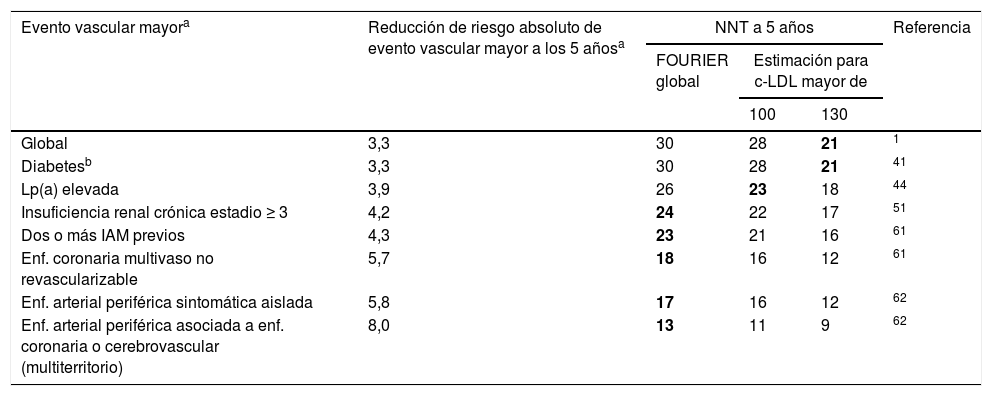
La tabla 4 ofrece la reducción real del riesgo absoluto de eventos vasculares mayores y el NNT estimado a 5años para los principales subgrupos del estudio FOURIER.
Reducción real del riesgo absoluto de eventos vasculares mayores y el número de pacientes que se necesita tratar (NNT) estimado a 5 años para los principales subgrupos del estudio FOURIER
| Evento vascular mayora | Reducción de riesgo absoluto de evento vascular mayor a los 5 añosa | NNT a 5 años | Referencia | ||
|---|---|---|---|---|---|
| FOURIER global | Estimación para c-LDL mayor de | ||||
| 100 | 130 | ||||
| Global | 3,3 | 30 | 28 | 21 | 1 |
| Diabetesb | 3,3 | 30 | 28 | 21 | 41 |
| Lp(a) elevada | 3,9 | 26 | 23 | 18 | 44 |
| Insuficiencia renal crónica estadio ≥ 3 | 4,2 | 24 | 22 | 17 | 51 |
| Dos o más IAM previos | 4,3 | 23 | 21 | 16 | 61 |
| Enf. coronaria multivaso no revascularizable | 5,7 | 18 | 16 | 12 | 61 |
| Enf. arterial periférica sintomática aislada | 5,8 | 17 | 16 | 12 | 62 |
| Enf. arterial periférica asociada a enf. coronaria o cerebrovascular (multiterritorio) | 8,0 | 13 | 11 | 9 | 62 |
c-LDL: colesterol ligado a las lipoproteínas de baja densidad; NNT: number needed to treat (número de pacientes que es necesario tratar para evitar un evento vascular).
Evento vascular mayor definido como la variable secundaria clave: IAM, ictus o muerte cardiovascular. Las estimaciones de beneficio para distintas concentraciones de c-LDL se han realizado a partir de las diferentes reducciones del c-LDL, asumiendo una reducción del ≈55% y que el beneficio clínico es proporcional a la reducción absoluta del c-LDL. Se resaltan en negrita las combinaciones de grupos clínicos con los niveles de c-LDL a partir de los cuales el NNT a 5años es inferior a 25.
Para modular el posible beneficio del tratamiento según los niveles de c-LDL basales, se ha estimado el beneficio potencial asumiendo que el beneficio clínico se relaciona linealmente con la reducción absoluta del c-LDL cuando los resultados del estudio no permiten una estimación directa de un NNT<25 a 5años. De este modo, la combinación de los efectos beneficiosos en los subgrupos de alto riesgo relacionada con diferentes niveles de c-LDL de partida ofrece una estimación de los pacientes que alcanzan una mayor RRA y que, por tanto, serían prioritarios para el tratamiento con iPCSK9.
En algunos casos, como ocurre ante un mal control de otros factores de riesgo o ante una enfermedad recurrente a pesar de mantener un c-LDL controlado, ofrecemos una recomendación débil basada en beneficios potenciales, en ausencia de una evidencia directa o de un análisis específico de subgrupos.
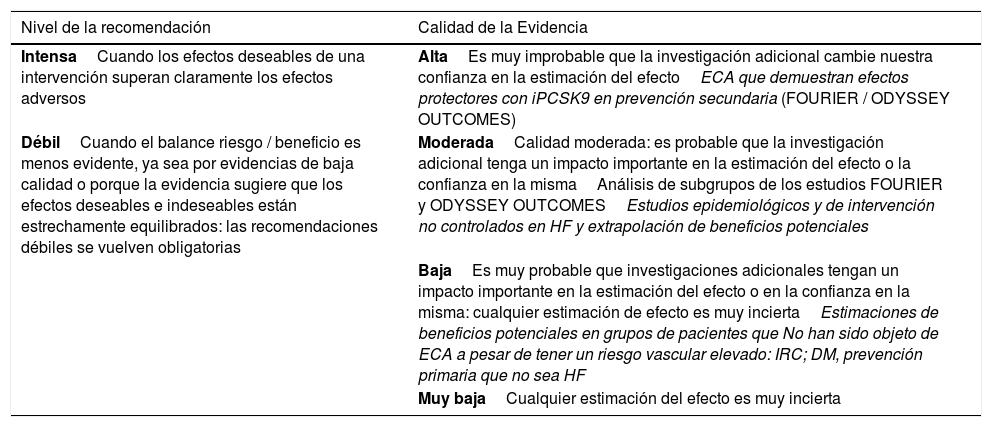
Para calificar las recomendaciones hemos tomado como referencia el consenso GRADE54,67. Las recomendaciones se identifican como fuertes si se considera poco probable que nuevos estudios cambien de modo apreciable el efecto del tratamiento con iPCSK9. Las recomendaciones débiles son aquellas en que se considera que el balance riesgo/beneficio está menos establecido y puede modificarse de modo apreciable con nuevos estudios (tabla 5). Hemos considerado la calidad de la evidencia como alta en las evaluaciones directas de los ensayos clínicos FOURIER y ODYSSEY, moderadas para los análisis de subgrupos de estos ensayos y baja en caso de estimaciones de riesgo potencial no evaluadas directamente en los estudios. Para la HF hemos considerado la evidencia como moderada en los estudios epidemiológicos o de cohortes amplios con estos pacientes.
Clasificación’GRADE’ de las recomendaciones
| Nivel de la recomendación | Calidad de la Evidencia |
|---|---|
| IntensaCuando los efectos deseables de una intervención superan claramente los efectos adversos | AltaEs muy improbable que la investigación adicional cambie nuestra confianza en la estimación del efectoECA que demuestran efectos protectores con iPCSK9 en prevención secundaria (FOURIER / ODYSSEY OUTCOMES) |
| DébilCuando el balance riesgo / beneficio es menos evidente, ya sea por evidencias de baja calidad o porque la evidencia sugiere que los efectos deseables e indeseables están estrechamente equilibrados: las recomendaciones débiles se vuelven obligatorias | ModeradaCalidad moderada: es probable que la investigación adicional tenga un impacto importante en la estimación del efecto o la confianza en la mismaAnálisis de subgrupos de los estudios FOURIER y ODYSSEY OUTCOMESEstudios epidemiológicos y de intervención no controlados en HF y extrapolación de beneficios potenciales |
| BajaEs muy probable que investigaciones adicionales tengan un impacto importante en la estimación del efecto o en la confianza en la misma: cualquier estimación de efecto es muy inciertaEstimaciones de beneficios potenciales en grupos de pacientes que No han sido objeto de ECA a pesar de tener un riesgo vascular elevado: IRC; DM, prevención primaria que no sea HF | |
| Muy bajaCualquier estimación del efecto es muy incierta |
DM: diabetes mellitus; ECA: ensayos clínicos aleatorizados; HF: hipercolesterolemia familiar; IRC: insuficiencia renal crónica.
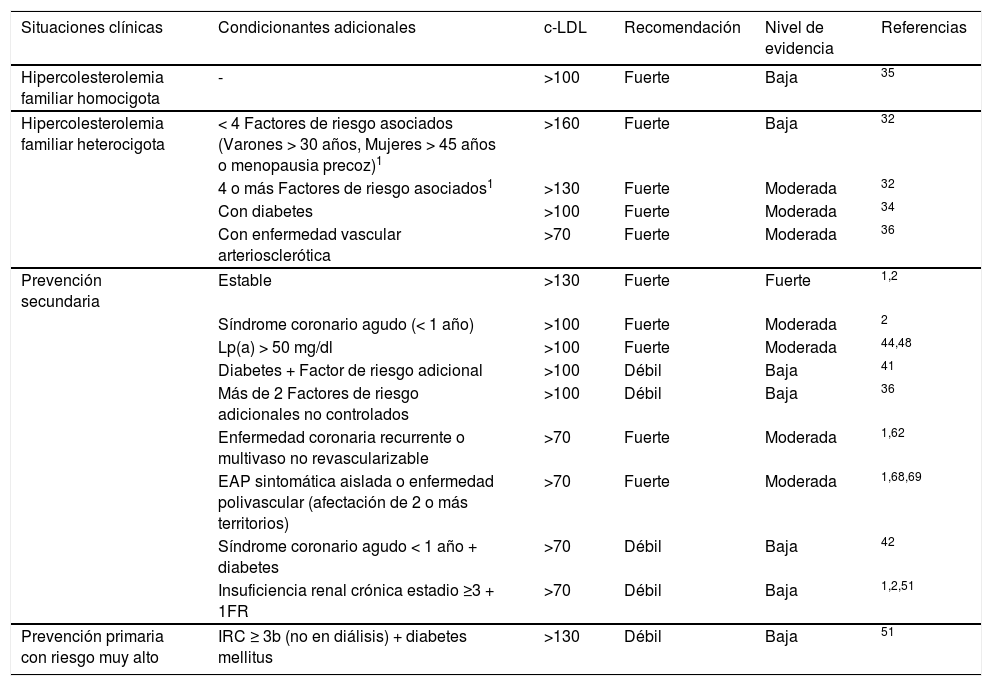
Las indicaciones que propone la SEA para la utilización de los iPCSK9, tomando en consideración un NNT a 5años <25, quedan resumidas en la tabla 6.
Recomendaciones y nivel de evidencia para la prescripción de iPCSK9 en relación con la situación clínica del paciente y las concentraciones de c-LDL
| Situaciones clínicas | Condicionantes adicionales | c-LDL | Recomendación | Nivel de evidencia | Referencias |
|---|---|---|---|---|---|
| Hipercolesterolemia familiar homocigota | - | >100 | Fuerte | Baja | 35 |
| Hipercolesterolemia familiar heterocigota | < 4 Factores de riesgo asociados (Varones > 30 años, Mujeres > 45 años o menopausia precoz)1 | >160 | Fuerte | Baja | 32 |
| 4 o más Factores de riesgo asociados1 | >130 | Fuerte | Moderada | 32 | |
| Con diabetes | >100 | Fuerte | Moderada | 34 | |
| Con enfermedad vascular arteriosclerótica | >70 | Fuerte | Moderada | 36 | |
| Prevención secundaria | Estable | >130 | Fuerte | Fuerte | 1,2 |
| Síndrome coronario agudo (< 1 año) | >100 | Fuerte | Moderada | 2 | |
| Lp(a) > 50 mg/dl | >100 | Fuerte | Moderada | 44,48 | |
| Diabetes + Factor de riesgo adicional | >100 | Débil | Baja | 41 | |
| Más de 2 Factores de riesgo adicionales no controlados | >100 | Débil | Baja | 36 | |
| Enfermedad coronaria recurrente o multivaso no revascularizable | >70 | Fuerte | Moderada | 1,62 | |
| EAP sintomática aislada o enfermedad polivascular (afectación de 2 o más territorios) | >70 | Fuerte | Moderada | 1,68,69 | |
| Síndrome coronario agudo < 1 año + diabetes | >70 | Débil | Baja | 42 | |
| Insuficiencia renal crónica estadio ≥3 + 1FR | >70 | Débil | Baja | 1,2,51 | |
| Prevención primaria con riesgo muy alto | IRC ≥ 3b (no en diálisis) + diabetes mellitus | >130 | Débil | Baja | 51 |
EAP: enfermedad arterial periférica; IRC; insuficiencia renal crónica
En resumen, los iPCSK9 son un nuevo grupo de fármacos con una acción hipolipemiante intensa que se ha traducido en una reducción de las complicaciones cardiovasculares en prevención secundaria, que ha sido demostrada en ensayos clínicos controlados. Sin embargo, su alto coste y la ausencia de estudios a largo plazo aconsejan dirigir el uso de estos fármacos a los pacientes que pueden obtener un mayor beneficio, es decir, los pacientes de alto riesgo vascular que mantienen un c-LDL elevado a pesar de un tratamiento hipolipemiante de alta intensidad. Las presentes recomendaciones quieren ser una referencia a la hora de identificar a los pacientes a los que el tratamiento con iPCSK9 les aporte un mayor beneficio potencial.
Conflicto de interesesJuan Francisco Ascaso ha recibido honorarios por conferencias o participación en comités científicos de Astra-Zeneca, MSD, Lilly, Novartis, Recordati, Esteve, Ferrer, Novonordisk, Danone, Praxis, Amgen, Sanofi y Mylan.
Fernando Civeira ha recibido honorarios por ponencias, formación o asesoría de los laboratorios AMGEN, Ferrer, Merck y Sanofi.
Carlos Guijarro ha recibido honorarios por ponencias, formación o asesoría de los laboratorios AMGEN, Ferrer, MSD, Rubió y Sanofi.
Jose López Miranda ha recibido honorarios por conferencias o participación en comités científicos de Astra-Zeneca, Esteve, Ferrer, Amgen y Sanofi.
Luis Masana ha recibido honorarios por conferencias y participación como consejero de Amgen, Sanofi, MSD, Mylan y Daichii.
José María Mostaza ha recibido honorarios por conferencias o participación en comités científicos de Ferrer, Pfizer, Amgen y Sanofi.
Juan Pedro-Botet ha recibido honorarios por conferencias o participación en comités científicos de Amgen, Astra-Zeneca, Esteve, Ferrer, MSD, Mylan, Rovi, Sanofi y Servier.
Xavier Pintó ha recibido honorarios por conferencias o participación en comités científicos de Esteve, Ferrer, Rubió, Amgen, Sanofi y Mylan.
Pedro Valdivielso ha recibido honorarios por asesoramiento o participación en comités científicos y conferencias de AMGEN, Sanofi, MSD, Ferrer y Almirall. Ha recibido ayudas para investigación de Ferrer.






![Tasa de complicaciones vasculares (infarto agudo de miocardio [IAM] no fatal +ictus no fatal +muerte cardiovascular) extrapolada a 10años del grupo de tratamiento con estatinas en diversos estudios de intervención. EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; HFH: hipercolesterolemia familiar hetarocigota; IRC: insuficiencia renal crónica; SCA: síndrome coronario agudo. Fuente: Robinson et al.37. Tasa de complicaciones vasculares (infarto agudo de miocardio [IAM] no fatal +ictus no fatal +muerte cardiovascular) extrapolada a 10años del grupo de tratamiento con estatinas en diversos estudios de intervención. EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; HFH: hipercolesterolemia familiar hetarocigota; IRC: insuficiencia renal crónica; SCA: síndrome coronario agudo. Fuente: Robinson et al.37.](https://static.elsevier.es/multimedia/02149168/0000003100000003/v2_201912162029/S0214916819300518/v2_201912162029/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)