El presente documento es una actualización de las recomendaciones de práctica clínica para el manejo de los factores de riesgo cardiovascular en la diabetes mellitus. Este consenso está elaborado por los miembros del Grupo de Riesgo Cardiovascular de la Sociedad Española de Diabetes (SED). Se han propuesto y actualizado las intervenciones sobre el estilo de vida, tratamiento farmacológico indicado para alcanzar los objetivos terapéuticos según los niveles de HbA1c, grado de obesidad, hipertensión arterial, hiperlipemia, insuficiencia cardiaca, antiagregación plaquetaria, insuficiencia renal y diabetes en el anciano, así como nuevos biomarcadores de interés en la evaluación del riesgo cardiovascular. El trabajo es una actualización de las intervenciones y objetivos terapéuticos; además, se señala la necesidad de la inclusión de los especialistas en Endocrinología, Metabolismo y Nutrición en las Unidades de Rehabilitación Cardiaca para el control y seguimiento de esta población.
This document is an update to the clinical practice recommendations for the management of cardiovascular risk factors in diabetes mellitus. The consensus is made by members of the Cardiovascular Risk Group of the Spanish Diabetes Society. We have proposed and updated interventions on lifestyle, pharmacological treatment indicated to achieve therapeutic objectives according to the levels of HbA1c, degree of obesity, hypertension, hyperlipidemia, heart failure, platelet antiagregation, renal insufficiency, and diabetes in the elderly, as well as new biomarkers of interest in the evaluation of cardiovascular risk in individuals with diabetes mellitus. The work is an update of the interventions and therapeutic objectives in addition, it is noted the need for the inclusion of specialists in Endocrinology, Metabolism and Nutrition in Cardiac Rehabilitation Units for the control and monitoring of this population.
La enfermedad cardiovascular (ECV) aterosclerótica incluye el síndrome coronario agudo (SCA), la cardiopatía isquémica crónica establecida (infarto agudo de miocardio [IAM], angina estable o inestable y revascularización coronaria), el accidente cerebrovascular (ACV) isquémico, accidente isquémico transitorio y la enfermedad arterial periférica. La ECV es la principal causa de morbimortalidad en las personas con diabetes y la que más contribuye a los costes directos e indirectos de la diabetes1,2. Se entiende como factor de riesgo cardiovascular (FRCV) aquella característica biológica, condición y/o modificación del estilo de vida que aumenta la probabilidad de padecer o de fallecer por cualquier causa de una ECV en individuos que lo presentan a medio y largo plazo3. Para la evaluación de este riesgo se han elaborado tablas/ecuaciones de probabilidades basadas en estudios prospectivos poblacionales. Se consideran como FRCV clásicos la edad, el sexo, el tabaquismo, la diabetes, el colesterol total, el colesterol LDL (cLDL), el colesterol HDL (cHDL) y la presión arterial (PA). Otros FRCV llamados no clásicos (historia familiar, obesidad, distribución de la grasa, nivel de triglicéridos, estrés y nivel socioeconómico) pueden servir para modular el riesgo calculado4.
Los documentos de consenso/recomendaciones/guías clínicas en medicina son importantes elementos para orientar las estrategias de prevención, diagnóstico y tratamiento de diferentes enfermedades; sirven de referencia para profesionales y sociedades médicas, y deben actualizarse de forma periódica1,5,6. Las recomendaciones intentan proporcionar homogeneidad en la práctica diaria asistencial. En el presente trabajo revisamos los aspectos más relevantes de los últimos dos años en relación con los FRCV en la diabetes y, tal y como se venía haciendo regularmente5,7-9, actualizamos las recomendaciones del Grupo de Trabajo de Diabetes y Riesgo Cardiovascular de la Sociedad Española de Diabetes (SED), destacando fundamentalmente la nueva clasificación de riesgo cardiovascular (RCV) de la población con diabetes, así como la aparición de nuevos tratamientos que ayudan no solo a mejorar el control de la HBA1c sino a tener un efecto protector cardiovascular (CV)1. El objetivo prioritario lipídico en la prevención es el descenso del cLDL con estatinas. Estos fármacos siguen siendo los de primera elección para la prevención CV y de mortalidad CV en el paciente diabético. Se comentan las indicaciones del primer fármaco biológico con importante potencia hipolipemiante sobre los niveles plasmáticos del cLDL y de la lipoproteína a [Lp(a)] con elevación de cHDL y disminución de triglicéridos sin alteración del metabolismo de la glucosa, ni asociado a miopatía. También se actualiza el empleo de las estatinas en la insuficiencia renal. Finalmente, se incide en la importancia del especialista en Endocrinología y Nutrición en las Unidades de Rehabilitación Cardiaca.
Modificación del estilo de vidaDietaLa mejora y la adaptación del estilo de vida en los pacientes con diabetes son esenciales para facilitar el control de la enfermedad y reducir su riesgo CV1. Sin embargo, tales esfuerzos no deben retrasar el tratamiento farmacológico, que debe iniciarse simultáneamente y ajustarse en base a la respuesta a la modificación del estilo de vida, teniendo siempre presente que la intervención sobre la modificación del estilo de vida es más coste-efectiva que los tratamientos farmacológicos. Uno de los estudios de mayor relevancia por su diseño, duración y población estudiada que preconizaba la importancia de intervenir sobre el estilo de vida fue el Look AHEAD10-12. La modificación del estilo de vida es importante, especialmente en los individuos con mayor índice de masa corporal (IMC), circunferencia de cintura e índice cintura/cadera por su efecto beneficioso, entre otros factores, sobre la insulinorresistencia. También es importante la detección precoz de la desnutrición y/o del riesgo de padecerla, especialmente en el anciano con diabetes, por el mayor riesgo de presentar sarcopenia y fragilidad asociada13,14. Es esencial conocer la ingesta calórica del paciente y recomendar una dieta que facilite una pérdida del 5-10% de peso corporal. La dieta mediterránea se debe considerar como el paradigma de dieta cardioprotectora y, por tanto, es la recomendada, en especial en nuestro medio15. La dieta mediterránea se caracteriza por un alto consumo en frutas y verduras, cereales y legumbres, frutos secos y aceite de oliva, todos de óptima calidad, consumo moderado de pescado, aves y huevos, y una baja ingesta de productos lácteos, carnes rojas, carnes procesadas y dulces, además del consumo moderado de vino en las comidas. En líneas generales, esta se ha demostrado efectiva no solo en la prevención CV, sino también en el control de las complicaciones asociadas a la diabetes16,17. Es importante el consumo de fibra en la dieta (14g/1.000kcal) y de alimentos con granos integrales (la mitad de la ingesta de granos), fibra entre 30-45g/día. Se recomienda no aconsejar el consumo de bebidas azucaradas, reducir el consumo de grasas saturadas a <7% del total de las calorías ingeridas y evitar la ingesta de grasas trans18. Se debe sustituir parte de la grasa saturada por ácidos grasos poliinsaturados y monoinsaturados, destacando que lo importante no es la cantidad de grasa que se consume —siempre que no sea superior al 35% de las calorías totales—, sino su calidad. Es aconsejable sustituir grasa saturada por monoinsaturada, especialmente la derivada del aceite de oliva virgen. Es muy importante una correcta hidratación, siendo el agua y las infusiones las mejores fuentes para conseguirlo, sin olvidar que las bebidas edulcorantes «no reemplazan» al agua y deben limitarse.
No se recomienda la suplementación sistemática de antioxidantes (vitaminasE, C, selenio, magnesio, cromo y carotenos, entre otros) debido a la falta de pruebas de su eficacia clínica y a la preocupación de su seguridad a largo plazo. Sin embargo, es importante planificar las comidas (elección de alimentos y porciones/intercambios) para incluir la cantidad diaria recomendada de todos los micronutrientes. Se puede tener en cuenta la carga glucémica y/o el índice glucémico de los hidratos de carbono de la dieta y evitar los de alto índice glucémico19,20. Es primordial controlar el aporte calórico y su distribución a lo largo del día para evitar el sobrepeso y la hiperglucemia posprandial.
Cada día es más necesario valorar y conocer los diferentes productos dietéticos y los alimentos funcionales, por su crecimiento exponencial en el mercado, el creciente interés de la población por su consumo y la presión comercial, dada su posible interacción con fármacos. Hay evidencia de que ciertos productos dietéticos reducen la concentración de colesterol, especialmente los fitosteroles (2g diarios reducen el cLDL un 7-10%) o algunos de inspiración oriental, como la levadura roja de arroz (que posee una acción similar a las estatinas por su contenido en monocolinaK21-25, pero sabemos que los fitoesteroles interactúan con la ezetimiba, disminuyendo su eficacia, y la monoclinaK con las estatinas, incrementando sus efectos secundarios.
Recomendaciones- •
Realizar una dieta cardiosaludable.
- •
Realizar una dieta mediterránea baja en hidratos de carbono.
- •
Fomentar el consumo de aceite de oliva virgen extra y de frutos secos.
La importancia del ejercicio físico ya fue señalada en 1992 por la American Heart Association (AHA), que incluyó la inactividad física como un FRCV, asociándose también con un riesgo aumentado de diabetes mellitus (DM) tipo2 (DM2)26,27. Hoy en día, el estilo de vida sedentario está considerado como uno de los principales FRCV. El ejercicio físico regular aumenta la captación de glucosa, disminuye el riesgo de DM2 y previene la hipertensión arterial (HTA). De hecho, el ejercicio físico se asocia a una disminución media de 6-7mmHg en los pacientes hipertensos en la PA sistólica y diastólica. Otro de sus beneficios es el aumento del cHDL. La actividad física regular es una medida muy eficaz para prevenir la DM2 y mejorar las alteraciones metabólicas, incluidos el perfil lipídico y la resistencia a la insulina28,29.
Es importante valorar el tipo de actividad y ejercicio físico, la frecuencia, duración e intensidad del mismo, especialmente en el anciano30,31. El riesgo de complicaciones CV durante el ejercicio es extremadamente bajo (5-17 fallecimientos/millón/año, según la intensidad del mismo) en adultos aparentemente sanos. Por ello, en los pacientes diabéticos de bajo riesgo no sería necesario un estudio cardiológico previo. Sería pertinente un estudio cardiológico y ergométrico previo en diabéticos con vida sedentaria que pretenden iniciar un plan de entrenamiento exigente. Se recomienda que los pacientes con diabetes realicen al menos 150min/semana de actividad física aeróbica de intensidad moderada (50-70% de la frecuencia cardíaca máxima), repartidos en al menos 3días de la semana, evitando estar más de 2días consecutivos sin actividad27-32. Se debe advertir a los pacientes con diabetes y tratados con insulina/antidiabéticos orales del tipo sulfonilureas con antecedentes de hipoglucemias no reconocidas y episodios previos de hipoglucemias graves, que controlen las glucemias capilares no solo antes y durante el ejercicio sino también tras el mismo, con la finalidad de evitar y reconocer las hipoglucemias tardías asociadas a la actividad física.
Recomendaciones- •
Realizar ejercicio físico aeróbico regular (>150min/semana).
- •
Actividad física aeróbica moderada (50-70% de frecuencia cardiaca máxima repartidas en al menos 3días a la semana).
- •
Evitar más de 2 días consecutivos sin ejercicio físico.
En los últimos años se ha puesto de manifiesto la asociación de la diabetes con altas tasas de ansiedad y depresión, lo que puede afectar adversamente a la adherencia al tratamiento, así como favorecer el desarrollo de complicaciones secundarias a la enfermedad32. No solo es importante evaluar el estado de ánimo, la salud mental y el bienestar psicológico del paciente, sino también conocer el entorno sociocultural, cada día más importante en la valoración integral del diabético, y poder realizar un correcto tratamiento individualizado. Hoy se considera el nivel sociocultural como otro FRCV al que cada día se le concede más peso en el desarrollo de la diabetes y del RCV.
Los factores psicosociales, así como el bajo nivel socioeconómico, el aislamiento social, la depresión u hostilidad y el estrés laboral o familiar, además de asociarse a un mayor RCV, empeoran el pronóstico de los pacientes con cardiopatía isquémica establecida y dificultan significativamente el control de los FRCV clásicos33-35. La falta de adherencia terapéutica representa una importante barrera en la prevención secundaria de la ECV. La consecuencia de la escasa adherencia terapéutica sería un incremento de las complicaciones CV graves, al no conseguirse los objetivos terapéuticos con el consiguiente incremento de la mortalidad, la reducción de la calidad de vida de los pacientes supervivientes, una mayor carga asistencial y un incremento de los costes sanitarios derivados de las complicaciones y de los ingresos hospitalarios. La reducción del copago, los recordatorios automáticos, las farmacias de pedidos por correo, el asesoramiento de un profesional de la salud y las terapias de combinación de dosis fija son medidas que mejoran el cumplimiento terapéutico35. El policomprimido (del inglés polypill) para la prevención secundaria de la ECV es la primera terapia combinada en dosis fija aprobada en Europa como tratamiento de sustitución para pacientes adultos controlados adecuadamente con los monocomponentes administrados por separado a dosis terapéuticas equivalentes36-38.
Recomendaciones- •
Análisis de la capacidad para realizar las actividades de la vida diaria.
- •
Valoración del entorno sociocultural.
- •
Utilización del policomprimido una vez establecido el tratamiento.
Dentro de los hábitos y del estilo de vida, cada día es más importante analizar el papel de los ritmos circadianos, conocer el sueño del paciente, así como la valoración y/o el análisis del sueño. En la actualidad se aconseja dormir al menos 7h1. Es importante descartar la existencia de patología del sueño, como la apnea del sueño, y en su caso, tratarla con el fin de mejorar la calidad de vida del paciente y poder controlar los FRCV39,40.
Recomendaciones- •
Sueño de 7 h diarias.
El tabaco es el FRCV modificable con más impacto en la prevención CV. Los pacientes con DM2 fumadores tienen un incremento significativo del RCV total, mortalidad, ACV e IAM comparado con los no fumadores41,42. En la práctica clínica debemos aconsejar a todos los pacientes que dejen de fumar. Asimismo, se recomienda evitar la exposición al humo del tabaco (fumador pasivo), ya que eleva de forma significativa el riesgo de ECV. Se debe recurrir, siempre con la aceptación del paciente para dejar de fumar, a unidades específicas de deshabituación tabáquica y/o prescribir tratamiento para ello como componente rutinario en la atención integral del paciente diabético. Los productos de tabaco de riesgo modificado son una opción no libre de riesgo en esta estrategia. La evidencia sobre este riesgo hipotéticamente reducido es muy escasa1. Aunque en menor grado que el cigarrillo convencional, los vapores del cigarrillo electrónico contienen sustancias potencialmente tóxicas que son subproductos del disolvente (generados por el calor) liberados en el vapor y/o los constituyentes traza de los aditivos aromatizantes, existiendo trabajos que señalan un efecto nocivo vascular43,44
Recomendaciones- •
Abandono del hábito tabáquico.
Numerosos estudios han demostrado que un incremento de grasa corporal conlleva un aumento del RCV. El riesgo relativo de diabetes en los varones con un IMC de 35kg/m2 es 40 veces superior al de aquellos con un IMC de 23kg/m2. Pequeñas pérdidas de peso, entre el 5-10%, se corresponden con un mejor control no solo de parámetros clínicos y metabólicos sino también psicológicos, y todo ello sin necesidad de apoyo farmacológico, solo mediante cambios en el estilo de vida y modificaciones dietéticas45,46.
La cirugía bariátrica (CB), como ya se señalaba en 20092, puede considerarse en adultos con DM2 e IMC ≥35kg/m2, especialmente si la DM2 o las comorbilidades asociadas son difíciles de controlar con un estilo de vida cardiosaludable y/o tratamiento farmacológico. Es primordial tener en cuenta, al valorar los costes, que los individuos con DM2 que se someten a CB necesitan adicionalmente modificaciones del «estilo de vida» de por vida y monitorización médica continuada y estricta47. La CB ha demostrado la casi o completa normalización de la glucemia en el 40-95% de los pacientes con DM2, dependiendo del tiempo de evolución de la diabetes, del procedimiento quirúrgico elegido, de los niveles de péptidoC y de los criterios utilizados de remisión48-50. La CB mejora los FRCV y, a largo plazo, los episodios CV en la DM2, así como la remisión de la DM50-52. En pacientes con DM2 e IMC de 30-35kg/m2, la CB sigue presentando beneficios glucémicos; así, recientemente la cirugía metabólica se debe considerar en los adultos con DM2 con un IMC entre 30,0-34,9kg/m2. Si la hiperglucemia no se controla de forma adecuada a pesar del tratamiento farmacológico adecuado con antidiabéticos orales o inyectables e insulina en monoterapia o en tratamiento combinado1, esta indicación podría valorarse en pacientes con sobrepeso grado2 (IMC de 27-30kg/m2).
Recomendaciones- •
Sobrepeso u obesidad grado 1: dieta y ejercicio, pérdida 5-10%.
- •
Fármacos con indicación en obesidad y diabetes: metformina y la asociación de GLP-1 con inhibidores de la SGLT2 (aprobada la apagliflozina).
- •
Indicada la cirugía bariátrica en adultos con DM2 e IMC>35kg/m2.
- •
Se puede valorar en obesos grado 1 y sobrepeso grado 2 en DM2 con mal control asociado de FRCV.
Se han establecido niveles de HbA1c ≥6,5% como criterio diagnóstico de DM, siempre y cuando se realice en un laboratorio que utilice un método estandarizado según el National Glycohemoglobin Standarization Program (NGSP), certificado y estandarizado para el Diabetes Control and Complications Trial (DCCT), la International Diabetes Federation (IDF) y la European Association for the Study of Diabetes (EASD) y el paciente no tenga anemia o hemoglobinopatía que alteren los niveles de HbA1c53,54.
Diferentes estudios han confirmado la importancia del control glucémico en la DM55,56. Sabemos que una disminución de la HbA1c del 0,9% reduce los episodios CV en torno al 10-15%. La disminución de la HbA1c a cifras cercanas al 7% reduce las complicaciones micro y macroangiopáticas55. El objetivo de HbA1c debe ser individualizado en base a factores como la edad, la esperanza de vida, la comorbilidad, la duración de la diabetes, el riesgo de hipoglucemia o las consecuencias adversas de la hipoglucemia, la motivación del paciente y la adherencia al tratamiento. Un nivel de HbA1c ≤6,5% se considera óptimo si se puede lograr de una manera segura y asequible; una meta razonable sería una HbA1c ∼7%. Se aconseja individualizar el grado de control glucémico; así, en el paciente joven sin otros FRCV y sin complicaciones se deben considerar unos objetivos de HbA1c más estrictos, utilizando fármacos más potentes para alcanzar niveles más bajos de HbA1c (∼6,5%), siempre que se consiga sin hipoglucemias significativas u otros efectos adversos. En pacientes con ECV —especialmente los de edad avanzada, antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada o complicaciones macrovasculares— con diabetes de larga duración, el objetivo de la HbA1c debe ser menos exigente, entre el 7 y el 8%, o incluso superior1,57.
Los pacientes con DM tipo1 (DM1) deben tratarse con insulinoterapia intensiva, bien con múltiples dosis de insulina (3-4dosis diarias) o bien con infusión subcutánea continua de insulina, fundamentalmente con análogos de insulina, que se asocian a un menor riesgo de hipoglucemia; en los pacientes con DM2 se debe valorar el coste-efectividad de estos, teniendo en cuenta la edad y los factores relacionados con el riesgo y la severidad de la hipoglucemia. Los análogos de insulina de acción retardada más recientemente introducidos —glargina U300 y degludec U100 y U200— poseen características farmacocinéticas y farmacodinámicas más prolongadas y estables que la glargina U100 y detemir58. Hay evidencia de que los análogos (glargina y detemir) consiguen un similar grado de control y número de hipoglucemias, y se asocian a menor tasa de hipoglucemias que la insulina intermedia NPH. También debemos destacar que la Glar U300 se asocia a menor tasa de hipoglucemia que Glar U100, y que el análogo prolongado degludec provoca menos hipoglucemias que el análogo Glar U10058,59. Entre los pacientes con DM2 con alto riesgo de eventos CV, degludec no fue inferior a la glargina con respecto a la incidencia de eventos CV mayores59.
Hay que tener presente que las insulinas premezcladas proporcionan menor flexibilidad de dosificación y se han asociado con una mayor frecuencia de eventos hipoglucémicos si se las compara con los regímenes basal y bolo-basal1. Es necesario optimizar el tratamiento hipoglucemiante en los pacientes con DM1 y DM2 de forma precoz para conseguir prevención CV a medio-largo plazo.
Hasta hace poco la metformina era el único hipoglucemiante oral en el que se había demostrado una asociación a un menor riesgo de ECV. Los resultados del estudio Empagliflozin Cardiovascular Event Trial (EMPA-REG) en pacientes con DM2 con alto RCV demostraron que el inhibidor del cotransportador de sodio-glucosa tipo2 (SGLT2) empagliflozina se asocia a una disminución significativa de los episodios CV60-62. Los inhibidores de SGLT2 bloquean el transportador de sodio-glucosa en la nefrona proximal, y con ello aumentan la glucosuria renal y reducen la glucemia y, por tanto, la HbA1c63. También se asocian a pérdida ponderal (∼2kg) y a una reducción de la PA (alrededor de 2-4mmHg), sin aumentar el riesgo de hipoglucemia. Los inhibidores de SGLT2 se han convertido en una indicación reciente en pacientes de alto riesgo con DM2 y complicaciones macrovasculares establecidas; sin embargo, no todos los inhibidores SGLT2 tienen los mismos efectos, ni está recogida esta indicación64-66. Si bien los inhibidores SGLT2 son fármacos referentes en pacientes con insuficiencia cardíaca (IC) y DM2, queda por esclarecer los mecanismos de este efecto cardioprotector y debemos controlar sus efectos secundarios, especialmente el riesgo de cetoacidosis, así como el aumento del riesgo de amputaciones no traumáticas de miembros inferiores asociadas a la canagliflozina66-68.
Posteriormente, el estudio Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results (LEADER) también demostró que los pacientes con DM2 y alto RCV pueden beneficiarse de añadir liraglutida a su tratamiento habitual68. Los resultados se asemejan a los aportados por la empagliflozina en el EMPA-REG OUTCOME, pero en el EMPA-REG los beneficios se mostraron desde del inicio del ensayo clínico. En base a los resultados CV del EMPA-REG OUTCOME y LEADER, se recomienda valorar la utilización de estos fármacos en los pacientes de alto RCV, si bien la metformina sigue siendo el fármaco inicial de elección en los pacientes con DM21.
Más recientemente, el Trial to Evaluate Cardiovascular and Other Long-term Outcomes With Semaglutide in Subjects With Type2 Diabetes (SUSTAIN-6) mostró también la superioridad de semaglutide frente al placebo en la protección de episodios CV69-72. Es recomendable conocer las indicaciones en ficha técnica de la asociación de fármacos. Recientemente se ha aceptado la asociación de inhibidores SGLT2 (dapagliflozina) con el péptido agonista similar al glucagón tipo1 (GLP1)73.
En general, los estudios con saxagliptina (SAVOR-TIMI), sitagliptina (TECOS), lixisenatide (ELIXA), alogliptina (EXAMINE) y el reciente Exenatide Study of Cardiovascular Event Lowering Trial (EXSCEL) señalan que el objetivo compuesto primario no difiere del grupo placebo, confirmando la no inferioridad CV de estos tratamientos y de su seguridad74-80.
RecomendacionesUn nivel de HbA1c ≤6,5% es óptimo si se puede lograr de una manera segura y asequible.HbA1c 7-8%, o incluso >8%, en pacientes con ECV, especialmente los de edad avanzada, antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada o complicaciones macrovasculares, con diabetes de larga duración.
Primera opción farmacológica como tratamiento metformina; se puede valorar la utilización de los inhibidores de la SGLT2, especialmente empagliflozina, o inhibidores GLP-1, liraglutide, en pacientes con ECV establecida y un control subóptimo como segunda opción farmacológica y/o asociado a metformina desde su inicio.
Presión arterial: control de la hipertensión arterial en la DM2Las Guías Europeas de Prevención Cardiovascular81 siguen sin aportar ningún dato novedoso relevante. Se recomienda medir la PA del paciente diabético en cada visita. Si se detectan cifras elevadas se debe realizar el cribado pertinente mediante AMPA o MAPA. El objetivo de control debe individualizarse, aconsejando de forma global una PA sistólica (PAS) <140mmHg. Cifras más bajas de PAS, por debajo de 130mmHg, pueden ser apropiadas en individuos más jóvenes y en pacientes con microalbuminuria. El objetivo de la PA diastólica (PAD) en los pacientes con diabetes es <90mmHg, si bien el límite no está bien establecido, aceptándose entre 80-90mmHg según la edad y las comorbilidades asociadas.
En los pacientes con PA confirmada ≥140/90mmHg, además de los cambios en el estilo de vida, y pérdida de peso cuando hay sobrepeso, se aconseja la Dietary Approaches Stop Hypertension (DASH)82, que recomienda la reducción del sodio menos de 2,3g/día (100mmol/día) y el aumento de la ingesta de potasio ≈4,7g/día (120mmol/día) siempre y cuando no presente una excreción urinaria de potasio alterada, debiéndose disminuir la ingesta de potasio <4;7g/día (120mmol/día) para evitar efectos cardíacos adversos (arritmias) por hiperpotasemia83,84; tras la reducción del consumo de alcohol y el aumento de la actividad física, debe iniciarse una terapia farmacológica si no se logran los objetivos de PA.
Los inhibidores de la enzima convertidora de la angiotensina (IECA), los bloqueadores de los receptores de la angiotensinaii (ARA II), los betabloqueantes, los antagonistas de los canales de calcio y los diuréticos tiazídicos son las opciones preferidas para el tratamiento de primera línea83-85. La selección de medicamentos debe basarse en factores como la presencia de albuminuria, ECV, IC o estado del infarto posmiocárdico, así como la raza/etnia del paciente, los posibles efectos secundarios metabólicos, la adherencia al tratamiento y el coste.
Los pacientes con diabetes e HTA deben ser tratados farmacológicamente con un IECA o un ARAII, por su mayor efecto protector contra la aparición o la progresión de nefropatía. Los IECA y los ARAII pueden retardar la progresión de la nefropatía y la retinopatía diabéticas, por eso están especialmente indicados en los pacientes con DM86-88. Ante la intolerancia a uno de ellos, puede sustituirse uno por el otro. Para alcanzar los objetivos de la PA generalmente se requiere la combinación de dos o más fármacos en su dosis máxima. Es importante administrar uno o más antihipertensivos antes de acostarse, con el fin de evitar la HTA nocturna, al constituir la PA nocturna un predictor de episodio CV más potente que la PA diurna89. No se recomienda el uso de la terapia combinada de IECA con ARAII, en particular en pacientes con nefropatía diabética, por el riesgo de agravar la insuficiencia renal y facilitar la hiperpotasemia. En los casos en que se considere imprescindible, debe llevarse a cabo bajo una estrecha monitorización de la función renal, balance hidroelectrolítico y PA. La combinación de aliskiren con IECA o ARAII en pacientes con alteración de la función renal o diabetes está contraindicada. El candesartán y el valsartán se mantienen autorizados para el tratamiento de la IC en combinación con un IECA únicamente en los pacientes que no pueden utilizar antagonistas de los mineralcorticoides.
Si se utilizan IECA, ARAII o diuréticos, hay que monitorizar la función renal y el nivel de potasio sérico. Cuando la PA es >140/90mmHg podrá añadirse a los IECA o ARAII un diurético y, si persiste elevada, valorar un antagonista del calcio y, de seguir el mal control, valorar añadir un betabloqueante.
El control de la PA y la prevención de la morbilidad y la mortalidad relacionada es claramente mejorable1,90,91. Sin embargo, el conocimiento, el tratamiento y el control de la HTA son persistentemente bajos en todo el mundo92,93. Uno de los grandes desafíos es evitar la inercia terapéutica (dejando a los pacientes diabéticos con valores de PA ≥140/90mmHg), ya que esto daría lugar a una carga inaceptable en términos de vidas humanas, secuelas y costos socioeconómicos. En pacientes con PA>140/90mmHg, a la vez que se insiste en los cambios en los estilos de vida, debe iniciarse tratamiento farmacológico (puede empezarse con dos fármacos en una misma presentación si >150/100mmHg) y reajustarlo si es necesario, evitando la inercia terapéutica, además de las medidas de estilo de vida1,94.
Recientemente, la guía conjunta del American College of Cardiology (ACC), la AHA y sociedades afines (Whelton PK, Carey RM, Aronow WS, Casey DE Jr, Collins KJ, Dennison Himmelfarb C, et al., 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: A report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice. Hypertension 2017 November 13) ha modificado los criterios diagnósticos de HTA (>130 y/o 80mmHg) y objetivos de control, y recomienda modificaciones del estilo de vida para todos los sujetos a partir de estas cifras y tratamiento farmacológico antihipertensivo para cifras ≥140 y/o 90mmHg o niveles ≥130 y/o 80mmHg si el RCV >10% en 10años, según la ecuación de riesgo de dicha guía. Dicha estimación del riesgo tiene en cuenta componentes como la diabetes, por lo que los pacientes diabéticos serían candidatos a recibir tratamiento farmacológico con niveles de PA ≥130 y/o 80mmHg95. En espera del posicionamiento de sociedades europeas implicadas en la prevención CV, este grupo de trabajo de la SED recomienda mantener las vigentes recomendaciones europeas de prevención CV.
Recomendaciones- •
PA < 140/90mmHg.
- •
Si existe nefropatía: IECA/ARAII como primera elección.
- •
Valorar añadir como hipoglucemiante oral inhibidores de la SGLT2.
La hipercolesterolemia es un factor patogénico clave en el desarrollo y en la progresión de la lesión vascular95. Es importante conocer el perfil lipídico de los pacientes con DM2 desde su diagnóstico y de forma anual, con el fin de valorar y plantear objetivos terapéuticos con mayor precisión1. Para mejorar el perfil lipídico de los pacientes con diabetes se recomienda modificar el estilo de vida, reducir el consumo de grasas saturadas, grasas trans y colesterol, aumentar el consumo de ácidos grasos omega-3 (sobre todo en personas que no ingieren habitualmente pescado), fibra viscosa y estanoles/esteroles vegetales; la pérdida ponderal (si procede) y aumentar la actividad física96,97.
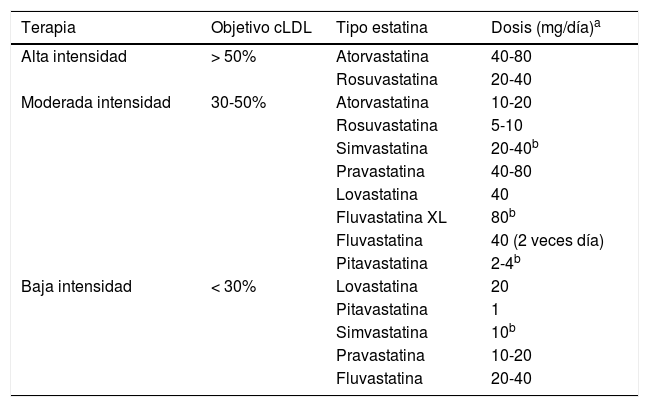
En las recomendaciones de los diferentes National Cholesterol Education Program - Adult Treatment Panel (NCEP-ATP), el objetivo terapéutico eran las concentraciones de cLDL. Posteriormente, la guía del American College of Cardiology/American Heart Association (ACC/AHA), publicada en 201398,99, dio lugar a múltiples consideraciones con diferentes puntos de vista de distintas sociedades científicas por el nuevo paradigma de tratamiento con estatinas, abandonando los objetivos terapéuticos en cLDL100. La guía de la ACC/AHA señala que los diabéticos con niveles de cLDL entre 70-190mg/dl deberían iniciar terapia con estatinas de moderada intensidad, basándose no en los niveles de cLDL como objetivo, sino en la tolerancia a las estatinas y efecto a dosis fijas según el RCV (tabla 1). Recientemente la guía de la American Association of Clinical Endocrinologists (AACE) y del American College of Endocrinology (ACE) sobre el manejo de la dislipemia y prevención CV101 clasifican los niveles de cLDL, según el RCV, basados en los estudios que señalaban que el mayor beneficio CV se obtiene con los niveles más bajos de cLDL. La baja incidencia de enfermedad coronaria en sujetos con cifras bajas de cLDL, sujetos con defectos genéticos de la proteína inhibida por ezetimiba (proteína Niemann-Pick C1 Like 1 [NPC1L1]), junto con los resultados del estudio IMPROVE-IT respaldan la indicación de la ezetimiba en combinación con estatinas cuando estas no logran el objetivo de cLDL101,102.
Terapia con estatinas según el objetivo de reducción porcentual de cLDL
| Terapia | Objetivo cLDL | Tipo estatina | Dosis (mg/día)a |
|---|---|---|---|
| Alta intensidad | > 50% | Atorvastatina | 40-80 |
| Rosuvastatina | 20-40 | ||
| Moderada intensidad | 30-50% | Atorvastatina | 10-20 |
| Rosuvastatina | 5-10 | ||
| Simvastatina | 20-40b | ||
| Pravastatina | 40-80 | ||
| Lovastatina | 40 | ||
| Fluvastatina XL | 80b | ||
| Fluvastatina | 40 (2 veces día) | ||
| Pitavastatina | 2-4b | ||
| Baja intensidad | < 30% | Lovastatina | 20 |
| Pitavastatina | 1 | ||
| Simvastatina | 10b | ||
| Pravastatina | 10-20 | ||
| Fluvastatina | 20-40 |
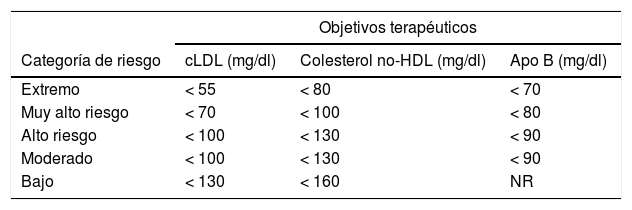
Los pacientes con DM, según la AACE/ACE 2017, pueden clasificarse como de alto riesgo, riesgo muy alto o riesgo extremo101 (tablas 2 y 3). Actualmente la DM es considerada de alto riesgo1, pero si además de DM existe uno o más de los demás FRCV clásicos, el valor óptimo de cLDL debe ser <70mg al ser un paciente de riesgo muy alto; si además la DM tiene clínica establecida de ECV, entonces es considerado de riesgo extremo, debiendo tener niveles de cLDL menores de 55mg/dl101.
Nueva clasificación de riesgo según la American Association of Clinical Endocrinologists y la American College of Endocrinology Guidelines for Management of Dyslipidemia and Prevention of Cardiovascular Disease, 2017
| Bajo riesgo: sin factores de riesgo |
| Riesgo moderado: presenta 2 o menos factores de riesgo y un riesgo calculado de 10años de menos del 10% |
| Riesgo alto: presenta un equivalente ASCVD incluyendo diabetes o estadio3 o 4 CKD sin otros factores de riesgo, o individuos con 2 o más factores de riesgo y un riesgo de 10años del 10-20% |
| Riesgo muy alto: ha tenido o tiene hospitalización reciente para ACS; enfermedad vascular coronaria, carotídea o periférica; diabetes o estadio3 o 4 CKD con uno o más factores de riesgo; un riesgo calculado de 10años superior al 20%; o HeFH |
| Riesgo extremoa: presenta ASCVD progresiva, incluyendo la angina inestable que persiste después de alcanzar un cLDL menos de 70mg/dl, o ASCVD clínico establecido con diabetes, la etapa 3 o 4 CKD, y/o HeFH, o pacientes con una historia de ASCVD prematura (<55años de edad para los varones o <65años de edad para las mujeres) |
Esta nueva categoría fue incluida basándose en la evidencia de ensayos clínicos y fue apoyada por los metanálisis que ponen de manifiesto que la disminución adicional de cLDL produce mejores resultados en individuos con ACS. El IMPROVE-IT demostró que los índices más bajos de acontecimientos cardiovasculares en pacientes con ACS se conseguían cuando los niveles de cLDL fueron bajados a 53mg/dl mediante la combinación de ezetimiba con estatinas
Nuevos objetivos terapéuticos según criterios de la American Association of Clinical Endocrinologists y la American College of Endocrinology Guidelines for Management of Dyslipidemia and Prevention of Cardiovascular Disease, 2017
| Objetivos terapéuticos | |||
|---|---|---|---|
| Categoría de riesgo | cLDL (mg/dl) | Colesterol no-HDL (mg/dl) | Apo B (mg/dl) |
| Extremo | < 55 | < 80 | < 70 |
| Muy alto riesgo | < 70 | < 100 | < 80 |
| Alto riesgo | < 100 | < 130 | < 90 |
| Moderado | < 100 | < 130 | < 90 |
| Bajo | < 130 | < 160 | NR |
Las estatinas siguen siendo la piedra angular de la terapia hipolipemiante para la reducción de episodios CV1,103-105, y su uso está contraindicado en el embarazo. Tras estatinas a la máxima dosis tolerada, si no se alcanza el objetivo primario de cLDL puede considerarse ezetimiba. Aunque estudios recientes señalan que las estatinas confieren un riesgo de desarrollar diabetes106,107, salvo la pitavastatina, el modesto incremento en el riesgo de DM2, incidencia que aumenta con la edad, con la duración del tratamiento hipolipemiante y con la presencia de componentes del síndrome metabólico1,106. La terapia con dosis altas puede estar asociada a riesgos más elevados de DM que la terapia con dosis bajas o moderadas. El estudio JUPITER en prevención primaria puso de manifiesto que los beneficios CV y de la disminución de la mortalidad tras el tratamiento con estatinas fueron superiores al riesgo de desarrollar diabetes108,109; si bien la mayoría de las estatinas a dosis elevadas se asocian a mayor incidencia de diabetes y pueden empeorar mínimamente el control glucémico, el efecto de prevención CV y de mortalidad CV lo compensa.
En todos los pacientes con ECV, si no se alcanzan los objetivos de cLDL debe asociarse ezetimiba. En el caso de no conseguir los objetivos señalados con dosis máximas toleradas de estatinas más ezetimiba, o bien con intolerancia a las estatinas, se debería contemplar el tratamiento con inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (PCSK9). Los inhibidores de la PCSK9 se administran por vía subcutánea cada 14 o 28días, y en la actualidad tenemos el evolocumab y el alirocumab110. Los inhibidores de la PCSK9 tienen una elevada capacidad de reducción de cLDL, que puede situarse entre el 50% y más del 70%, independientemente de que se utilice en monoterapia o como tratamiento combinado con estatinas u otros hipolipemiantes111,112. Además, tienen una baja incidencia de efectos adversos, reducen los triglicéridos y los niveles de lipoproteína(a) y elevan los niveles de cHDL. Además de disminuir el RCV, han revertido la placa de ateroma111-115. En estos momentos, la utilización financiada de los inhibidores de PCSK9 en pacientes con diabetes se contemplaría solo en pacientes con ECV (cardiopatía isquémica, enfermedad cerebrovascular isquémica y enfermedad arterial periférica) establecida cuyo cLDL sea superior a 100mg/dl a pesar de dosis máximas toleradas de estatinas y ezetimiba.
El colesterol remanente, determinado como colesterol total −(cHDL +cLDL), se considera como uno de los principales factores de riesgo de arterioesclerosis y episodios CV y un marcador indirecto de hipertrigliceridemia. Los fibratos pueden ayudar a mejorar los niveles elevados de triglicéridos, y se ha señalado un papel protector de la retinopatía diabética y de otras complicaciones microangiopáticas116. Sin embargo, no debemos olvidar que el objetivo primario de la prevención CV es el cLDL, y que la evidencia de un potencial beneficio CV del tratamiento con fibratos tras estatinas proviene de análisis post-hoc de estudios aleatorizados117. Existen estudios en marcha para testar directamente esta hipótesis. Cuando el paciente con DM2 precisa tratamiento de combinación de una estatina asociada a un fibrato para reducir el riesgo residual atribuible a la dislipemia aterogénica, el único fibrato recomendable es el fenofibrato, estando contraindicado el gemfibrozilo118-120.
Recomendaciones- •
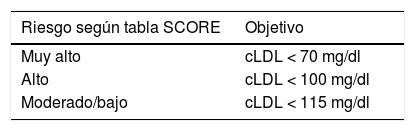
Primera opción terapéutica: estatinas (ver tabla 4).
Tabla 4.Objetivo terapéutico de colesterol LDL (cLDL) del tratamiento con estatinas según riesgo cardiovascular en la población diabética
Riesgo según tabla SCORE Objetivo Muy alto cLDL < 70 mg/dl Alto cLDL < 100 mg/dl Moderado/bajo cLDL < 115 mg/dl Diabéticos con vLDL 70-190: iniciar terapia de moderada intensidad.
Se debe iniciar el tratamiento con estatinas de alta intensidad según el riesgo cardiovascular determinado por la tabla SCORE y calibrado en nuestro medio REGICOR.
En diabéticos tipo 2 con < 40 o > 75 años, evaluar el riesgo-beneficio y las preferencias del paciente.
- •
Si no conseguimos objetivos, añadir ezetimiba.
- •
En caso de intolerancia a estatinas y/o no alcanzar objetivos con estatinas a dosis máxima tolerada y ezetimiba, iniciar tratamiento con inhibidores PCSK9.
Tanto en la DM1 como en la DM2 con RCV elevado (>10% a 10años), el beneficio del tratamiento con ácido acetilsalicílico (AAS) (75-162mg/día) como estrategia de prevención primaria no está claramente demostrado. Se recomienda en varones diabéticos >50años o mujeres >60años que tienen al menos un FRCV mayor como historia familiar de ECV, HTA, tabaquismo, dislipemia o microalbuminuria. No se debe recomendar AAS para la prevención primaria de la ECV en los adultos con diabetes y riesgo bajo de ECV (riesgo a los 10años <5%) como varones <50años y las mujeres <60años sin otros FRCV, ya que los efectos potenciales de sangrado probablemente contrarresten el beneficio121-123. Se aconseja el uso de AAS en prevención secundaria (75-162mg/día)1.
Para los pacientes con ECV y alergia documentada al AAS se debe utilizar el clopidogrel (75mg/día). Las guías de práctica clínica establecen el tratamiento con doble antiagregación durante un período de un año para los pacientes con SCA que han sufrido un IAM124,125. Una vez superado ese período de tiempo, el paciente sigue el tratamiento con un único antiagregante, habitualmente AAS. Hasta un año después de un SCA es razonable el tratamiento combinado de AAS (75-162mg/día) y clopidogrel (75mg/día). Se recomienda usar durante un año un inhibidor del receptor P2Y12 para pacientes con DM y SCA y para los sometidos a intervención coronaria percutánea (ICP), la duración depende del tipo de stent. Para los pacientes con ICP por SCA se debe administrar preferiblemente prasugrel o ticagrelor125-128.
En los pacientes con ECV conocida hay que tener en cuenta el tratamiento con IECA, estatinas (si no están contraindicadas) para reducir el riesgo de episodios CV y AAS. En los pacientes con un IAM previo, los betabloqueantes se deben continuar por lo menos 2años después del episodio agudo. El uso de betabloqueantes en el postinfarto es muy importante para prevenir la muerte súbita129. Se recomienda el uso de IECA y de betabloqueantes durante al menos 2años tras un IAM. En la actualidad, la cirugía cardíaca debe ser la opción terapéutica para la mayoría de DM2 con enfermedad multivaso conocida130,131. En la DM con IC estabilizada puede usarse la metformina si la función renal >30ml/min/1,73m2 pero debe suspenderse en pacientes inestables u hospitalizados1, y debemos valorar, si no hay contraindicación, la utilización de los de inhibidores selectivos de la SGLT2 por sus efectos beneficiosos sobre el RCV y sobre la mortalidad CV132.
Recomendaciones- •
Ácido acetilsalicílico (AAS) en prevención primaria: dosis bajas (100mg/día) si RCV >10% a los 10años.
- •
AAS en prevención secundaria: dosis bajas (100mg/día).
- •
Se recomienda el uso de IECA y el uso de betabloqueantes durante al menos 2años tras un IAM.
- •
Inhibidores selectivos de SGLT2 por sus efectos beneficiosos sobre el RCV y sobre la mortalidad CV.
La nefropatía diabética es la afectación renal que se produce como consecuencia del mal control crónico de la enfermedad, y la microalbuminuria (cociente albúmina/creatinina >30mg/g) es su manifestación clínica inicial (nefropatía incipiente). El estadio de la nefropatía no solo se relaciona con la progresión de la nefropatía sino con el riesgo CV de los pacientes. Por tanto, la detección precoz de los pacientes con enfermedad renal crónica (ERC) y su tratamiento son importantes al disminuir la morbilidad CV y la velocidad de progresión de la enfermedad renal, disminuyendo los costes para el sistema sanitario133,134. La nefropatía diabética se acompaña muy frecuentemente de HTA y de disminución de la función renal87.
La metformina es la primera indicación en diabéticos, y en los últimos años ha aumentado de forma considerable la experiencia en su utilización, de tal forma que, basándose en estudios observacionales, su empleo se considera razonablemente seguro en pacientes con filtrado glomerular (FG) mayor de 30ml/min/1,73m2. El uso en pacientes con FG <30ml/min sigue estando contraindicado por el riesgo de acidosis láctica. La tasa de FG debe evaluarse antes del inicio del tratamiento y al menos una vez al año. Cuando se utilizan fármacos en combinación de dosis fija que contienen metformina en pacientes con función renal reducida, las restricciones y la eficacia con respecto a la otra sustancia activa utilizada en la combinación deben ser consideradas también; en general no se recomienda en pacientes con insuficiencia renal moderada.
En relación con las glinidas, la repaglinida es clásicamente el secretagogo indicado en ERC, pudiéndose utilizar en diálisis. Los inhibidores de DPP-4 han demostrado efectos beneficiosos y seguros en el control glucémico para pacientes diabéticos con ERC sin causar ningún efecto adverso adicional, aunque requieren ajuste de dosis según el grado de ERC, salvo la linagliptina134-138. La pioglitazona también puede ser utilizada en pacientes con ERC que no tengan alguna contraindicación al fármaco; se debe prestar atención a la posible retención hidrosalina, que puede ser un inconveniente en fases avanzadas de la enfermedad134. Los agonistas de GLP-1 pueden usarse sin alteraciones de la dosis en la ERC de la categoría G2, G3a o G3b, pero todos están contraindicados en las categorías G4 y G5 (FG estimada inferior a 30ml/min/1,73m2)139.
Si bien se debe mantener la PA a cifras menores de 140/90mmHg, se sugiere PA menor de 130/80mmHg cuando existe albuminuria (cociente albúmina creatinina CAC >30mg/g), debiéndose individualizar el tratamiento con el fin de evitar cuadros de hipotensión. Se debe disminuir la albuminuria a <300mg/g mediante la utilización de inhibidores del sistema renina-angiotensina-aldosterona (IECA, ARAII), al ser considerada la microalbuminuria como un marcador de RCV independiente, así como de nefropatía diabética, con el fin de enlentecer la progresión de la nefropatía137. Mantener niveles de hemoglobina de 11g/dl o mayores utilizando eritropoyetina para controlar la anemia139.
En general, en prevención primaria se recomienda tratar a los pacientes con ERC (estadios G3-G5 no en diálisis) con estatinas o estatina más ezetimiba. Al haber sido demostrado que la disminución farmacológica de la hiperlipemia reduce de forma segura los episodios CV en la ERC140-143, las directrices de KDIGO aconsejan una terapia de intensidad moderada, con dosis fija y sin medidas adicionales. Es importante recordar, con el fin de individualizar el tratamiento, que existen estatinas que no requieran ajuste, como atorvastatina, en ningún estadio de la IR. Se debe considerar el grado de insuficiencia renal 4-5 en la fluvastatina (dosis a utilizar entre 20-40mg), lovastataina (10-20mg), pravastatina (10-20mg), simvastatina (5-20mg), pitavastatina (1-2mg). En estadio 3, la dosis de rosuvastatina a utilizar es de 5-20mg/día, y en estadio 4-5, la dosis máxima de rosuvastatina es de 10mg8,134,136.
La ezetimiba no requiere ajuste de dosis, y su eficacia terapéutica está demostrada. En caso de intolerancia a estatinas y/o no alcanzar objetivos con dosis máxima tolerada, los inhibidores de la PCKS9 no requieren ajuste en IRC moderada-severa. Las guías KDIGO recomiendan las estatinas en estos pacientes, pero dado el riesgo de interacciones, sugieren utilizar dosis bajas e incrementarlas con cautela, sobre todo cuando se administre ciclosporina. Si se cambia de tacrolimus a ciclosporina, la dosis de estatinas debe disminuirse.
El tratamiento de la hipertrigliceridemia en la ERC debe basarse en cambios en el estilo de vida. No se recomiendan fibratos para disminuir el RCV y se desaconseja su uso si el filtrado glomerular <15ml/min134. Los fibratos y los ácidos grasos omega-3 podrían ser considerados en los pacientes con niveles marcadamente elevados de triglicéridos en ayunas (>500mg/dl) para evitar el riesgo de pancreatitis144,145. Por lo que respecta a los ácidos omega-3, hay evidencia de la reducción de los triglicéridos, pero no de los episodios CV y la mortalidad. Los ácidos omega-3, en general, son seguros, aunque pueden incrementar el sangrado en sujetos tratados con AAS/clopidogrel. Si los triglicéridos no se controlan con estatinas o fibratos, se puede añadir omega-3, una combinación segura y bien tolerada. Por último, recordar que la guía KDIGO aconseja el uso de antiagregantes en la ERC142,144
Recomendaciones- •
La metformina se considera razonablemente segura en pacientes con FG mayor de 30ml/min/1,73 m2.
- •
En general, en prevención primaria se recomienda tratar a los pacientes con ERC (estadios G3-G5, no en diálisis) con estatinas o estatina más ezetimiba.
- •
La PA a cifras menores de 140/90mmHg; se sugiere PA menor de 130/80mmHg cuando existe albuminuria
- •
Fibratos y los ácidos grasos omega-3 con niveles marcadamente elevados de los niveles de triglicéridos en ayunas (>500mg/dl).
- •
No se recomiendan fibratos para disminuir el RCV, y se desaconsejan si el filtrado glomerular <15ml/min.
- •
Antiagregantes en la ERC.
La diabetes en el anciano suele seguir un curso asintomático y, por otro lado, la expresión clínica en el anciano es a menudo insidiosa y atípica. Las características del paciente anciano con diabetes presentan ciertas particularidades, como la presencia de una elevada heterogeneidad clínica, deterioro cognitivo, depresión o caídas y un mayor riesgo de morbimortalidad, entre otras, lo que condiciona el diagnóstico y el abordaje de la patología. Los ancianos con diabetes tienen más carga de comorbilidad que los no diabéticos, y también presentan más riesgo de depresión y de incapacidad funcional146-148. En pacientes con DM mayores de 65años debemos hacer un cribado anual para la detección temprana de deterioro cognitivo leve o demencia.
No existe acuerdo entre las diferentes guías en cuanto al objetivo de HbA1c en los pacientes ancianos, y los niveles de HbA1c oscilan entre el 7 y el 9%146. Así, el European Diabetes Working Party for Older People 2011149 aconseja un objetivo de HbA1c del 7-7,5% para pacientes ancianos sin complicaciones y del 7,6-8,5% para pacientes ancianos frágiles. Recientemente, la ADA/EASD recomienda que los objetivos glucémicos sean menos ambiciosos en ancianos con expectativa de vida corta, elevada morbilidad, polimedicación o alto riesgo de hipoglucemias, considerando aceptable una HbA1c entre el 7,6 y el 8,5%146. Es importante la valoración nutricional con el fin de descartar riesgo de desnutrición que favorece el desarrollo de la sarcopenia, una condición que se asocia a deterioro funcional, riesgo de caídas y de institucionalización en ancianos, con especial cuidado en el paciente anciano con DM por riesgo de hipoglucemia y caída.
La metformina en el anciano sigue siendo la primera opción terapéutica, y las sulfonilureas son fármacos baratos y con amplia experiencia de uso. Su mayor inconveniente son las hipoglucemias, especialmente con glibenclamida, cuyo uso está desaconsejado en el anciano, y en caso de precisar la indicación de sulfonilureas, es preferible el empleo de gliclazida o glimepirida150. Los inhibidores de la DPP-4 son bien tolerados y no favorecen la hipoglucemia en pacientes de riesgo, y algunos autores los señalan como segunda opción. Los análogos de insulina tienen menos riesgo de hipoglucemia que la insulina humana, como señalamos previamente. Los inhibidores de SGLT2 muestran una indicación en pacientes de alto riesgo con DM2 e IC, pero no se recomiendan en ancianos con enfermedad renal avanzada, y tampoco los agonistas de GLP1 en IR avanzada.
El control global de los FRCV es importante en los pacientes ancianos con diabetes, y de hecho proporciona una mayor reducción de la morbimortalidad que el propio control glucémico. El tratamiento antihipertensivo produce beneficios, incluso en ancianos de edad muy avanzada. En ancianos frágiles se acepta una PA de 150/90mmHg, debiéndose evitar niveles <120/70mmHg151-153. Se incrementa el peso de la evidencia a favor del uso de estatinas, de la misma forma que para pacientes más jóvenes en prevención secundaria. En el anciano, los antiagregantes están indicados en prevención secundaria, mientras que en prevención primaria su uso es más controvertido y debería individualizarse. En síntesis, las recomendaciones de la ADA para adultos mayores con diabetes son consistentes con las pautas desarrolladas por la American Geriatrics Society (AGS). Ambas organizaciones recomiendan que los adultos mayores funcionales y cognitivamente intactos que tienen una expectativa de vida significativa reciban estrategias similares de reducción de riesgo de ECV como adultos más jóvenes1.
Recomendaciones- •
Objetivo de HbA1c en los pacientes ancianos: los niveles de HA1c oscilan entre el 7 y el 9%.
- •
En ancianos frágiles se acepta una PA de 150/90mmHg, debiéndose evitar niveles <120/70mmHg.
- •
Los adultos mayores funcionales y cognitivamente intactos que tienen una expectativa de vida significativa deben recibir estrategias de reducción de riesgo de ECV similares a las de adultos más jóvenes
La DM y la cardiopatía isquémica son los más importantes factores de riesgo de generar IC. En el paciente con DM, los factores de riesgo independiente de desarrollar IC más comunes en los diabéticos son la cardiopatía isquémica y la HTA. La incidencia de IC es 2,5 veces mayor en pacientes diabéticos que en la población general. La presencia de IC en la población diabética tiene peor pronóstico y duplica el riesgo de sufrir un ingreso o fallecimiento por IC frente a la población general.
Se ha señalado que por cada reducción del 1% de la HbA1c disminuye un 16% el riesgo de desarrollar IC. Recientemente se han establecido tres categorías de IC en base a la fracción de eyección del ventrículo izquierdo (FEVI): «FE reducida», FEVI <40%; «FE moderada», FEVI 40-49%, y «FE preservada», FEVI ≥50%. Para prevenir y/o retrasar la IC, así como para mejorar la supervivencia en los DM con IC, se aconseja el tratamiento de la HTA, el uso de estatinas en pacientes con alto riesgo de enfermedad coronaria, el uso de IECA en pacientes con disfunción VI asintomática y de betabloqueantes en disfunción VI asintomática e historia de IAM154. El tratamiento de la IC clásicamente ha sido modificar el estilo de vida, y como tratamiento farmacológico de la IC con fracción de eyección reducida (IC-FER) se utilizan IECA o bien ARAII, si los primeros no son tolerados, betabloqueantes y antagonistas del receptor mineralocorticoideo, siempre que no exista contraindicación. Si el paciente persiste sintomático, se recomienda sustituir el IECA por sacubitril/valsartán154. Los diuréticos se usan para mejorar síntomas y para mejorar la capacidad de ejercicio, y también si hay signos y/o síntomas de IC. Hoy día tenemos datos prometedores para un mejor manejo de la diabetes con hipoglucemiantes orales; así, los inhibidores SGLT2 están siendo la primera clase de agentes para mejorar la mortalidad CV y los resultados de la IC en individuos diabéticos con y sin IC establecida155. Los análogos de GLP-1, como liraglutide y semaglutide, han mostrado una reducción de los eventos CV sin alterar la hospitalización. Además, se debe valorar el efecto diferencial de cada inhibidor DPP-4 sobre el riesgo de IC156-159.
Recomendaciones- •
Los inhibidores de SGLT2 están siendo la primera clase de agentes para mejorar la mortalidad CV y de la IC en individuos diabéticos con y sin IC establecida.
- •
Se debe valorar el efecto diferencial de cada inhibidor de DPP-4 y los análogos de GLP-1
Por todo lo expuesto, y dada la complejidad que está adquiriendo la valoración diagnóstica y terapéutica de las alteraciones metabólicas que constituyen la base patogénica de la ECV, es fundamental la inclusión de los especialistas en Endocrinología, Metabolismo y Nutrición en las unidades de rehabilitación cardíaca y unidades de patología vascular para el seguimiento de los pacientes con DM y cardiopatía isquémica, así como otras patologías macrovasculares asociadas. El tratamiento integral de la diabetes lo puso de manifiesto la estrategia del STENO-2, que destacó la importancia de la intervención multifactorial en la DM2 para conseguir una reducción marcada y duradera de la morbilidad y de la mortalidad asociadas. Desde entonces el enfoque de la diabetes es multifactorial, destacando el papel de este enfoque multidisciplinar con una mejor prevención CV en los pacientes con diabetes56. La participación del especialista en Endocrinología, con especial conocimiento del metabolismo hidrocarbonado, lipídico y nutrición, de la educación dietética, reducción de peso, ejercicio físico, tabaquismo, reducción de los niveles de HbA1c, elección del tratamiento para la HTA, obesidad, estudio del metabolismo hidrocarbonado, lipídico y proteico, antiagregación plaquetaria y valoración de la insulinorresistencia, contribuirá a mejorar el tratamiento global de DM con elevado riesgo CV y comorbilidades asociadas y a enriquecer con sus conocimientos específicos de la especialidad estas unidades de patología vascular160,161, no solo participando en la actividad asistencial sino también colaborando con la docencia y la investigación en campo del riesgo CV.
Recomendaciones- •
La integración del especialista en Endocrinología, Metabolismo (diabetes-lípidos) y Nutrición en las unidades de rehabilitación cardiaca y unidades de patología vascular es fundamental para el seguimiento de los pacientes con DM y cardiopatía, con la utilización de los inhibidores selectivos de la SGLT2 por sus efectos beneficiosos.
La alteración del sueño reparador, las alteraciones de los genes reguladores del ritmo circadiano, así como la esteatosis hepática, se están asociando cada vez más con el riesgo de ECV y con la DM. El nivel sociocultural es otro FRCV al que cada día se le concede más peso en el desarrollo de la diabetes y el RCV. Es de destacar el papel de la vitaminaD: se ha señalado la disminución de la PA en mujeres suplementadas con vitaminaD, así con la insulinorresistencia caracterizada por el hiperinsulinismo; en los pacientes obesos con deficiencia de vitaminaD y mayor riesgo de DM2 es importante destacar el papel de la microbiota intestinal, tanto en el desarrollo de la DM como de su RCV161-163. Debemos mencionar el papel de la hiperhomocisteinemia por su efecto trombogénico, sin olvidar que el uso de metformina puede disminuir los niveles de vitaminaB12 y reducir la reciclación de la homocisteína a metionina y, por tanto, elevar los niveles plasmáticos de homocisteína164. Es importante definir el papel de los marcadores no tradicionales, es decir, el papel de la lipoproteína(a) sin tratamiento específico, aunque los inhibidores de la PCKS9 disminuyen un 20% sus niveles, así como la proteína C reactiva como marcador inflamatorio de RCV, pero también es necesaria la confirmación y definir nuevos biomarcadores de RCV101,165, así como futuras asociaciones terapéuticas SGLT2 e IECA o ARAII para el retraso y enlentecimiento de la progresión de la IR en el diabético.
Recomendaciones- •
Vitamina D > 30 ng/ml (valorar tratamiento farmacológico por debajo de 30 según la edad, la época de año y los niveles previos).
- •
Tratar con suplementación farmacológica con niveles por debajo de 20ng/ml. Monitorizar al inicio y anualmente la vitaminaB12 y el ácido fólico en los DM, especialmente si están en tratamiento con metformina.
El control de los FRCV previene el desarrollo de la ECV y/o lo retrasa en el tiempo. Sin embargo, los estudios epidemiológicos demuestran de forma contundente un deficiente control de estos en los pacientes con DM2. Es aconsejable utilizar el procediendo diagnóstico más asequible para cada paciente, así como planificar la estrategia terapéutica de forma individualizada. La dieta mediterránea y el ejercicio aeróbico son beneficiosos en el diabético, facilitando el control de los FRCV y la consecución de los objetivos terapéuticos. En base a las evidencias disponibles, no son necesarios los suplementos de antioxidantes ni vitaminas si no existen deficiencias. La CB parece ser cada vez más eficiente, disminuyendo a corto y a largo plazo las comorbilidades y complicaciones de la DM y revirtiendo la enfermedad en un número significativo de pacientes con DM2 y obesidad. Se debe intentar conseguir la mayor adherencia terapéutica de los pacientes, así como una mayor implicación y objetivos más realistas de las guías, individualizando el tratamiento y sus objetivos para adaptarlos a las características del paciente. Un nivel de HbA1c en torno a 6,5% puede individualizarse según la edad y el riesgo de hipoglucemia, pudiéndose aceptar niveles de HbA1c del 8,5%. La metformina es el primer fármaco, y los SGLT2 y los agonistas de los receptores del péptido similar al glucagón tipo1 pueden valorarse como segunda opción en pacientes con RCV, e incluso como primera opción según el RCV. La PA debe ser menor de 140/90mmHg, con niveles de cLDL según el RCV; las estatinas son la primera opción, añadiendo ezetimiba para alcanzar objetivos de cLDL según el RCV; si no se alcanzan por dosis máximas toleradas y/o por intolerancia a las estatinas, utilizar los inhibidores de PCKS9. Se aconseja el uso de AAS en prevención secundaria (75-162mg/día). En el paciente diabético con riesgo de IC se hace hincapié en el uso del tratamiento con un inhibidor del SGLT2. La edad no es contraindicación para el tratamiento de los FRCV, debiéndose individualizar en cada caso. En los pacientes con DM mayores de 65años debemos hacer un cribado anual para la detección temprana de deterioro cognitivo leve o demencia y facilitar la adherencia al tratamiento. Es fundamental valorar la incorporación de un especialista en Endocrinología y Nutrición en las unidades de rehabilitación cardiaca: la complejidad de la correcta valoración diagnóstica y terapéutica de las alteraciones metabólicas que constituyen la base patogénica de la ECV hace que el papel de un profesional con avanzadas competencias en el manejo de tales alteraciones sea cada vez más necesario para mejorar el control cardiometabólico de los pacientes con DM2 y alcanzar los objetivos terapéuticos del mayor número posible de FRCV.