Los sujetos con apnea obstructiva del sueño (AOS) sufren episodios repetidos de obstrucción de la vía aérea superior durante el sueño, debido a su colapso recurrente, que condicionan fenómenos de hipoxia intermitente. Esta, a través de mecanismos fisiopatológicos complejos, desencadena una hiperactivación simpática, disfunción endotelial, estado de hipercoagulabilidad y desregulación metabólica. Como resultado, se ve facilitada la aparición de otros factores de riesgo cardiovascular, como la hipertensión, el síndrome metabólico o la diabetes, se ve potenciada la lesión de órganos diana en corazón, arterias y riñones, así como un mayor riesgo de eventos y morbilidad cardiovascular. De entre las medidas terapéuticas de la AOS, la más estudiada respecto a su potencial en reducción del riesgo cardiovascular es el tratamiento con presión positiva continua sobre la vía aérea, la CPAP. Hasta la fecha, esta ha demostrado beneficios muy moderados en reducción de presión arterial, más evidentes en sujetos con hipertensión resistente, así como beneficios en reducción de eventos, tanto en prevención primaria como secundaria, aunque restringidos a aquellos sujetos con buena adherencia al tratamiento (uso ≥4h/noche). Las nuevas vías de investigación sobre la AOS parecen centrase en buscar nuevos medios que permitan identificar a aquellos sujetos, en los que esta enfermedad, es más determinante en el riesgo cardiovascular, y que más se podrían beneficiar con su tratamiento, en términos reducción del mismo.
Patients with obstructive sleep apnea (OSA) experience repetitive episodes of upper airway obstruction due to recurrent collapse during sleep. This leads to intermittent hypoxia episodes, which, through complex pathophysiological mechanisms, trigger sympathetic overactivation, endothelial dysfunction, hypercoagulation, and metabolic dysregulation. Consequently, other cardiovascular risk factors such as hypertension, metabolic syndrome, and diabetes are induced. Furthermore, this enhances target organ damage, affecting the heart, arteries, and kidneys, leading to an increased risk of cardiovascular morbidity and mortality. Among the various treatments for OSA, Continuous Positive Airway Pressure (CPAP) has been extensively studied. To date, this treatment has shown mild benefits in reducing blood pressure, particularly noticeable in patients with resistant hypertension. Furthermore, CPAP treatment appears to reduce cardiovascular events, both in primary and secondary prevention, though this benefit is limited to individuals with good compliance (CPAP use ≥4h/night). Future research perspectives in OSA seem to focus on identifying patients in whom the condition significantly influences cardiovascular risk, thus determining those who would benefit the most from treatment in the reduction of cardiovascular risk.
La apnea obstructiva del sueño (AOS) consiste en episodios repetidos de obstrucción de la vía aérea superior debido a su colapso durante el sueño. Como consecuencia, el sujeto sufre episodios recurrentes de hipoxemia y reoxigenación que producen microdespertares nocturnos (arousals), fragmentación del sueño e hiperactivación simpática. El resultado de todo ello es un sueño no reparador que se asocia a somnolencia diurna, deterioro de la calidad de vida y enfermedad metabólica y cardiovascular1. El síndrome tiene una prevalencia significativa, especialmente en la población adulta de mediana edad. En este sentido, estudios previos, han reportado que entre el 34% de varones y el 17% de mujeres de estos rangos de edad cumplen criterios para el diagnóstico de AOS2. El hecho de que el riesgo de sufrir AOS se relacione de forma estrecha con la obesidad, cuya prevalencia no hace más que aumentar en los países desarrollados, hace estimar que cada vez más sujetos sufrirán esta enfermedad3.
El diagnóstico y el manejo de la AOS se lleva a cabo en unidades del sueño siguiendo las guías establecidas4. En estas unidades, tras una valoración clínica que incluye, evaluación del grado de somnolencia a través de escalas validadas como la Epwoth Sleep Scale (ESS) y comorbilidades, especialmente factores de riesgo cardiovascular, se realiza un estudio de sueño, polisomnografía o poligrafía. A través de este, se obtiene el índice apnea-hipopnea (IAH), que es la suma de apneas e hipopneas por hora de sueño, definiendo apnea, como la ausencia o reducción del flujo aéreo de 10 o más segundos de duración e, hipopnea, como la reducción del flujo aéreo del 30-90% también de 10 o más segundos, asociada a arousal o caída de la saturación de O2≥4%. De acuerdo con el valor del IAH se establece la gravedad del síndrome. De este modo, este puede ser ligero (IAH: 5-14 eventos/h), moderado (IAH: 15-29 eventos/h) o grave (IAH: ≥30 eventos/h)5. La indicación del tratamiento y sus opciones, esencialmente viene condicionada por la gravedad de la enfermedad y los síntomas asociados4.
Hecho este preámbulo, en la presente revisión, nos centraremos en aquellos aspectos que relacionan a la AOS con el riesgo cardiovascular, ya sea desde el punto de vista fisiopatológico o del clínico, como precursor de otros factores de riesgo, de lesión de órganos diana o de morbimortalidad cardiovascular. Más allá de esto, nos centraremos en la evidencia que existe acerca de si el tratamiento de esta condición reporta beneficios en la prevención cardiovascular.
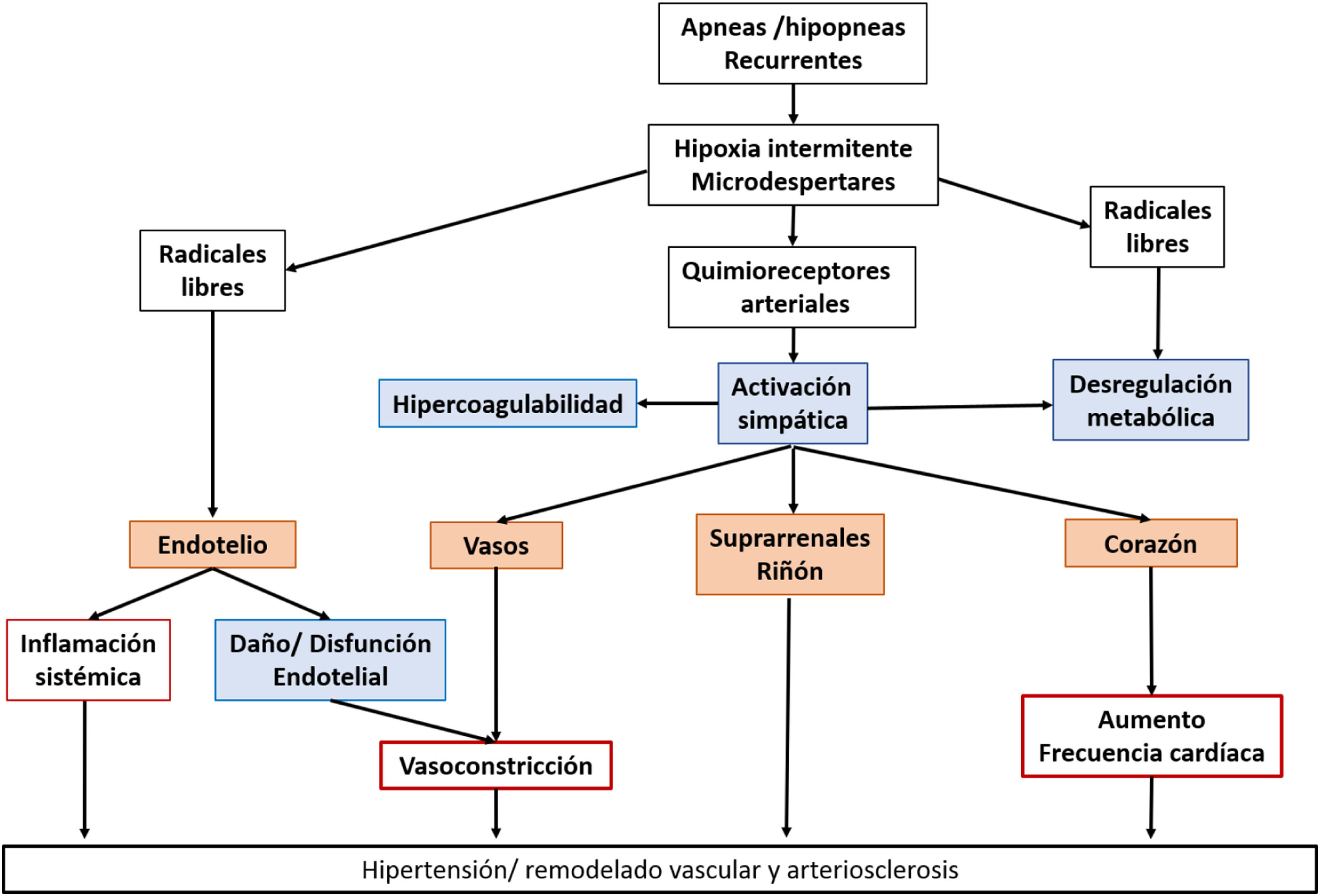
Aspectos fisiopatológicosEn los pacientes con AOS, los repetidos episodios de hipoxia y arousals conducen a toda una cascada de fenómenos fisiopatológicos con efectos finales desfavorables (fig. 1). Por un lado, vía activación de quimiorreceptores arteriales, se produce una hiperactivación simpática6,7 que genera vasoconstricción periférica y remodelado vascular, facilitando el desarrollo de hipertensión8. Asimismo, este aumento de la activación simpática a nivel suprarrenal y renal, determina un incremento de la actividad del sistema renina-angiotensina-aldosterona9. Las consecuencias de ello son más efecto presor, por acción de la angiotensina II, y retención hidrosalina por efecto de la aldosterona. En segundo lugar, fruto de la hipoxia intermitente, se generan una gran cantidad de radicales libres que activan fenómenos inflamatorios que lesionan el endotelio vascular, produciendo su disfunción10,11. Como consecuencia, disminuye la producción de óxido nítrico (NO)12, atenuándose su efecto vasodilatador, y se ve incrementada la producción de endotelina-113, potente vasoconstrictora. Paralelamente, se ve promovida la oxidación de lipoproteínas, expresión de moléculas de adhesión, así como la adherencia de monocitos a las células endoteliales y la proliferación de las células musculares lisas de los vasos. Todo ello facilita el desarrollo de arterioesclerosis. Un tercer eje es el estado de hipercoagulabilidad, la hipoxia intermitente y el aumento de catecolaminas circulantes producen un estado de hipercoagulabilidad14, debido a una mayor activación plaquetaria15 y un estado de hiperviscosidad sanguínea debido un aumento del hematocrito16.
Finalmente, cabe mencionar la desregulación metabólica que se asocia al síndrome. En la AOS, el aumento de la actividad simpática baja la secreción de insulina, y por otra parte induce insulinorresistencia. A esto último, parece contribuir la fragmentación del sueño, que provoca un incremento de IL-6 y TNF alfa y el descenso de niveles de adiponectina, así como la hipoxia intermitente17. Todo ello produce un estado metabólico proclive al desarrollo de síndrome metabólico y de diabetes que ha sido evidenciado en estudios clínicos18,19. En el caso de la diabetes, esta asociación parece ser incluso independientemente de la concurrencia de obesidad19. La desregulación metabólica también parece implicar la tendencia a presentar un perfil lipídico desfavorable20,21 con aumento de colesterol total, lipoproteínas de baja densidad y triglicéridos, así como niveles más bajos de lipoproteínas de alta densidad21.
Al lado de todo esto y de forma paralela, tienen lugar unos efectos hemodinámicos también desfavorables. Por una parte, la distensión de la caja torácica con la vía aérea superior cerrada genera una presión negativa intratorácica que incrementa el retorno venoso al ventrículo derecho, aumentando las presiones de llenado y el estrés sobre el tabique interventricular. Este hecho, sumado al aumento de la poscarga por la hipertensión asociada, facilita el desarrollo de hipertrofia ventricular22. Por otro lado, de forma añadida, el decúbito nocturno y la presión negativa en el hemicuerpo superior durante las apneas, facilita la migración de fluido a este desde las extremidades. Este fenómeno puede favorecer el edema de tejidos parafaríngeos y el colapso de la vía superior23, facilitando más las apneas.
Apnea obstructiva del sueño e hipertensiónLa evidencia disponible que han aportado los estudios epidemiológicos parece dibujar una relación estrecha entre la AOS y la hipertensión. De un 30-50% de los pacientes con hipertensión presentan AOS24, elevándose esta prevalencia a un 71-90% en el caso de pacientes con hipertensión resistente2,25. En un sentido inverso, hasta de un 35-80% de los pacientes con AOS presentan hipertensión26 (fig. 2).
Peppard et al.27, en un famoso estudio prospectivo establecieron de manera definitiva la relación causal entre la AOS y la hipertensión, en principio independiente de la concurrencia de otros factores de confusión como la obesidad. Otros estudios han aportado datos sobre como se comporta esta relación. Por una parte, la relación es más evidente cuanto más grave es el síndrome (mayor IAH del estudio de sueño)28, en pacientes con somnolencia asociada29, en varones30 y en aquellos que concentran más episodios apnéicos en la fase REM del sueño31. Por otra parte, la fuerza de la asociación parece atenuarse con la edad, sobre todo a partir de los 60 años32, siendo cuestionada en base a los resultados de 2 estudios. En el Sleep Heart Health Study (SHH), el riesgo de desarrollar hipertensión a 5 años no se relacionó con la AOS33. Asimismo, en la cohorte de Vitoria, en la que 1.180 sujetos fueron seguidos durante un tiempo medio de 7,5 años, tras un estudio basal de sueño, no se halló asociación entre la AOS e hipertensión tras ajustar por edad, sexo e índice de masa corporal (IMC)34.
Más allá de esto, está el potencial de la AOS de alterar de forma desfavorable el patrón circadiano de la presión arterial, esencialmente a expensas de inducir un incremento de la presión nocturna35, hecho que sin duda podría impactar en un mayor riesgo cardiovascular en los sujetos afectados.
Apnea obstructiva del sueño y lesión orgánica subclínicaLa relación de la AOS con el riego cardiovascular no solo se restringe a facilitar otros factores de riesgo si no a inducir directamente lesión orgánica subclínica, el que podría considerarse el estadio previo a la presentación eventos. Un subestudio del SHHS realizado con 2.058 sujetos de mediana edad, constató que el índice de masa ventricular, principal parámetro para valorar la hipertrofia ventricular izquierda (HVI), se relacionaba significativamente con el IAH y el grado de hipoxemia en el estudio de sueño. Todo ello después de ajustar por múltiples factores de confusión como el IMC, hábitos tóxicos (tabaco y consumo de alcohol), presión arterial sistólica (PAS), tratamiento antihipertensivo, diabetes y antecedentes de infarto de miocardio36. Un metaanálisis posterior confirmó la relación entre la HVI con la gravedad de la enfermedad37.
Respecto a arteriosclerosis subclínica, 2 metaanálisis, uno con 16 estudios y 1.415 pacientes38 y otro que incluyó 18 estudios con un total de 1.896 pacientes39, evidenciaron una relación significativa entre la AOS y un incremento del índice intima media, cuando se compararon sujetos con la enfermedad con poblaciones control. Más allá de esto, parece existir también un efecto dosis respuesta39 y aditivo a los efectos de la hipertensión al mismo nivel40. Más recientemente, esta relación se ha constatado en placa (engrosamiento carotídeo focal >1,5mm) y modulada por edad, esencialmente evidente en sujetos de menos de 68 años41.
Finalmente, la AOS también se ha relacionado con daño renal subclínico, tanto con una mayor excreción urinaria de albumina42, como con una tasa anual de caída del filtrado glomerular mayor que en controles43. Sin embargo, otro estudio longitudinal de seguimiento a largo plazo, también de una cohorte amplia de sujetos, no han replicado estos resultados en lo que respecta a caída de tasa de filtrado glomerular44. Estas discrepancias se han relacionado con diferencias en las poblaciones estudiadas, mucho más sana, con menos prevalencia de AOS y menos comórbida en el estudio de Canales et al., por lo que quizá, para que la acción lesiva de la AOS sobre el riñón sea evidente, es necesaria la concurrencia de otras comorbilidades o una prevalencia alta de la enfermedad en la población estudiada.
Apnea obstructiva del sueño y riesgo de eventos cardiovascularesApnea obstructive del sueño y enfermedad cardiovascular (enfermedad coronaria, insuficiencia cardíaca y arritmias)Varios estudios han sugerido que la AOS es un factor de riego de cardiopatía isquémica. En el SHHS, 1.927 varones y 2.495 mujeres de edades iguales o superiores a 40 años, fueron seguidos tras una polisomnografía basal durante un periodo medio de tiempo de 8,7 años. Después de ajustar múltiples factores de confusión, la AOS fue un predictor significativo de enfermedad coronaria en varones de edades <70 años (hazard ratio ajustado: 1,10; IC del 95%: 1,00-1,21) por cada aumento de 10 unidades en el índice de apnea-hipopnea (IAH)45. De manera similar, en un subestudio del Wisconsin Sleep Cohort Study, el seguimiento durante un tiempo medio de 24 años de pacientes con AOS grave (IAH>30 eventos/h) reveló que estos sujetos tenían 2,6 veces más riesgo de sufrir enfermedad coronaria o insuficiencia cardíaca46. No solo la AOS es un factor de riesgo de enfermedad coronaria, sino que también lo es de recurrencia de eventos coronarios en pacientes que ya tenían este diagnóstico47. Asimismo, también parece condicionar la hora a la que los pacientes sufren el infarto, siendo más frecuente por la noche en pacientes con AOS48, incluso cuando la forma de presentación es una muerte súbita49. Para esta última, la AOS también parece tener un valor predictivo, independiente de la concurrencia de otros de factores de riesgo bien establecidos50.
Aunque datos del SHHS parecen demostrar que, la AOS, sería un factor de riesgo independiente de fibrilación auricular en pacientes sin cardiopatía subyacente conocida51, y que parece aumentar el riesgo recurrencia de esta tras su tratamiento52, todavía no se considera probado definitivamente que la enfermedad cause fibrilación auricular53. Finalmente, la AOS podría ser un factor de riesgo para el desarrollo de insuficiencia cardiaca en todas las edades54, suponiendo además un factor de mal pronóstico evolutivo de esta enfermedad cuando concurre con ella.
Apnea obstructiva del sueño e ictusLa AOS se ha identificado como potencial factor de riesgo de ictus. Loke et al., en un metaanálisis de 5 estudios que incluyó 8.435 pacientes, evidenciaron que el síndrome era un factor de riesgo independiente para la incidencia de ictus (OR: 2,24; IC 95%: 1,57-3,19; p<0,001), sobre todo en varones55. Además, se observó que el riesgo se incrementa con la gravedad del síndrome56.
A parte de ser un factor de riesgo, también es frecuente en pacientes con ictus establecido, ya sea isquémico, hemorrágico o transitorio, en el que la apnea del sueño parece alcanzar una prevalencia ente el 71-72%57,58, siendo predominantemente por apneas obstructivas, ya que solo un 7% de los pacientes presentaban apneas centrales58. Para acabar de culminar esta relación, el síndrome como comorbilidad, parece empeorar el pronóstico del ictus59.
Metaanálisis de estudios prospectivos observacionalesA lo largo de los años, diferentes metaanálisis55,60,61, con un número creciente de estudios y de pacientes, han permitido relacionar la AOS, tanto moderado como grave, con un mayor riesgo de enfermedad cardiovascular total, eventos cardiovasculares mayores (MACE)61, enfermedad coronaria60,61 e ictus55,60,61, con una de asociación comparable a la de otros factores de riesgo, habiéndose relacionado solo la AOS grave con muerte cardiovascular (RR: 2,96; IC 95%: 1,45-6,01; p=0,003) y muerte de cualquier causa (RR: 1,54; IC 95%: 1,21-1,97; p<0,001)61.
Tratamiento de la apnea obstructiva del sueño y sus efectos en la presión arterial y riesgo cardiovascularEl tratamiento de la AOS consiste en medidas generales que implican por un lado medidas higiénico/dietéticas (cese del consumo de alcohol, evitar uso de sedantes, ejercicio físico y dormir un número regular y suficiente de horas) y, por otro, perder peso. A ello, puede añadirse el tratamiento gold standard de la AOS, la presión positiva continua en la vía aérea continuous positive airway pressure (CPAP) y, alternativamente, dispositivos de avance mandibular (DAM) o cirugía4. De todas estas opciones terapéuticas, la más estudiada, en términos de reducción de presión arterial y de riesgo de eventos, es el tratamiento con CPAP.
Tratamiento de la apnea obstructiva del sueño e hipertensiónEl efecto sobre la presión arterial del tratamiento de la AOS con CPAP, evaluado con el método más fiable, la monitorización ambulatoria de la presión arterial (MAPA) de 24h, puede considerase moderado. A nivel general, un descenso de entre 2 a 2,5mmHg para la presión arterial sistólica (PAS) y de entre 1,5 y 2mmHg para la presión arterial diastólica (PAD)62,63. No obstante, este efecto, es más evidente en sujetos con hipertensión resistente, alcanzando de 4,7 a 7,2mmHg para la PAS y de 2,95 a 4,99mmHg para la PAD64–66. Además, estos beneficios en reducción de presión arterial al tratar la AOS con CPAP, parecen resultar más significativos en relación a la presión arterial nocturna. Atribuir el potencial descenso del riesgo de eventos cardiovasculares con el tratamiento con CPAP solo a sus efectos sobre la presión arterial podría ser un error, atendiendo a todo lo anteriormente explicado respecto a la fisiopatología de la enfermedad. Por tanto, no es descartable una protección de órgano con el tratamiento con CPAP, que vaya más allá del mero descenso de la presión arterial.
Tratamiento de la apnea obstructiva del sueño con CPAP y reducción de eventos cardiovascularesEn términos generales, la reducción de eventos cardiovasculares en pacientes con AOS con el tratamiento con CPAP viene condicionada por el cumplimiento terapéutico, tanto en prevención primaria como secundaria. Se ha estimado un cumplimiento necesario del tratamiento con CPAP ≥4h/noche para obtener beneficios a este nivel.
Prevención primariaEl estudio más significativo es el de Barbé et al.67. que aleatorizaron a 723 pacientes, sin historia de enfermedad cardiovascular previa, con AOS moderado y grave (IAH>20), sin somnolencia diurna excesiva (ESS<10) a tratamiento con CPAP (366) o no intervención (357). En un seguimiento medio de 4 años (IQR: 2,7-4,4), el tratamiento con CPAP no redujo la incidencia de hipertensión o de eventos cardiovasculares (infarto de miocardio no fatal, ictus no fatal, accidente isquémico transitorio, hospitalización por angina inestable, arritmia, insuficiencia cardiaca o muerte cardiovascular). Sin embargo, un análisis post hoc, sugirió que una adherencia al tratamiento con CPAP≥4h/noche podría reducir la incidencia de hipertensión o desarrollo de evento cardiovascular (tabla 1).
Efecto del tratamiento con CPAP de la AOS sobre el riesgo cardiovascular. Estudios clínicos prospectivos aleatorizados y metaanálisis
| Prevención primaria | N.° de pacientes incluidos | Perfil del paciente | Seguimiento medio | AOS y clínica | Resultado |
|---|---|---|---|---|---|
| Barbe F et al.(2012) | Total: 723- CPAP (366)- No intervención (357) | No antecedentesEnf. cardiovascular | 4 años(IQR: 2,7-4,4) | IAH>20ESS<10 | - General: No beneficio- CPAP≥4h: Reducción HTA o eventos |
| Prevención secundaria | N.° de pacientes incluidos | Tipo de paciente | Seguimiento medio | AOS | Resultado |
| McEvoy RD et al.(2016). Estudio SAVE | Total: 2.687- CPAP (1.346)- Tratamiento estándar (1.341) | Enf. coronaria ocerebrovascular previa | 3,7 años | IAH>12ESS<15 | - General: No beneficio- CPAP≥4h: Reducción eventoscerebrovasculares |
| Peker Y et al.(2016). Estudio RICCADSA | Total: 244- CPAP (122)- No intervención (122) | Enf. coronariarevascularizada | 57 meses(Rango: 6,5-90,2) | IAH≥15ESS<10 | - General: No beneficio- CPAP≥4h: Reducción de eventos |
| Sánchez de la Torre et al.(2020). Estudio ISAACC | Total: 2.834- AOS: CPAP (633)/no CPAP (631)- No AOS: (603) | SCA | 3,35 años(IQR: 1,5-5,31) | IAH≥15ESS<10 | No beneficio |
| Sánchez-de-la-Torre et al.(2023). Metaanálisis | Total: 4.186- CPAP (2.097)- No CPAP (2.089) | Enf. coronaria ocerebrovascularEnf. coronaria revascularizadaSCA | 3,25 (1,8) años | IAH medio:31,2 (17) | General: No beneficioCPAP≥4h: Reducción de eventos (MACCE) |
AOS: apnea obstructiva del sueño; CPAP: Continuous positive airway pressure; ESS: Epworth Sleep Scale; HTA: hipertensión arterial; IAH: índice apnea; IQR: rango intercuartílico; MACCE: Major adverse cardiac and cerebrovascular events/eventos adversos mayores cardiacos y cerebrovasculares); SCA síndrome coronario agudo.
A este nivel, el número de estudios es mayor, siendo su común denominador el bajo cumplimiento terapéutico medio del tratamiento con el dispositivo, que siempre estuvo por debajo de 4h/noche, hecho atribuido a haber sido realizados con individuos no somnolientos. En el estudio SAVE68, 2.717 sujetos con enfermedad coronaria o cerebrovascular previa, con AOS (IAH>12) y (ESS<15), que fueron aleatorizados a tratamiento con medidas generales solas o medidas generales y CPAP, fueron seguidos durante 3,7 años. Los resultados no evidenciaron beneficios, en términos de prevención de eventos cardiovasculares, con el tratamiento con CPAP. A pesar de esto, un análisis apareado a través de propensity score entre buenos cumplidores del tratamiento con CPAP (uso CPAP≥4h/noche) comparados con el grupo de tratamiento estándar, parece sugerir que los primeros tenían menos riesgo de ictus y en general de eventos cerebrovasculares.
En el estudio RICCADSA, 244 sujetos con enfermedad coronaria revascularizada con AOS (IAH>15h y ESS<10), fueron aleatorizados a tratamiento con CPAP o no tratamiento y seguidos un tiempo medio de 57 meses. Una vez más, no se objetivaron beneficios en reducción de eventos (repetir revascularización, infarto de miocardio ictus y mortalidad cardiovascular). Sin embargo, nuevamente aquellos sujetos buenos cumplidores, uso CPAP≥4h/noche, obtuvieron una reducción significativa del riesgo cardiovascular cuando se comparaban con no cumplidores <4h/noche o sujetos sin tratamiento (HR: 0,29; IC 95%: 0,10-0,86; p=0,026)69.
Otra vez resultados negativos en el estudio ISAACC70, realizado con 2.834 pacientes con síndrome coronario agudo sin somnolencia (ESS<10). De estos, de los 1.264 que presentaron AOS en la poligrafía (IAH≥15), 633 fueron aleatorizados a recibir CPAP y 631 a recibir tratamiento estándar. De los 1.287 que no tenían AOS (IAH<15) se seleccionaron 603 como grupo control. Tras un tiempo de seguimiento medio de 3,35 años, ni la presencia de AOS se asoció a un incremento de prevalencia eventos cardiovasculares, ni el tratamiento con CPAP redujo esta prevalencia en los sujetos con AOS. Esta vez, no llegaron a encontrarse beneficios significativos asociados a una buena adherencia al dispositivo (≥4h/noche).
Finamente, un reciente metaanálisis de estos 3 estudios71 con los datos de 4.186 sujetos, asentó definitivamente que pese a no haber diferencias significativas respecto a riesgo de eventos mayores cardiacos y cerebrovasculares, entre tratados y no tratados con CPAP, una buena adherencia a la CPAP, sí se asoció a una reducción del riesgo del 31% de este tipo de eventos, confirmando que este era un factor crítico (tabla 1).
Conclusiones y perspectiva futuraLa AOS es una enfermedad prevalente a nivel poblacional, sobre todo en adultos de edad media. Hasta la fecha, se han descrito diferentes mecanismos mediante los cuales el síndrome podría inducir un estado mayor de riesgo cardiovascular, como son la hiperactivación simpática, la disfunción endotelial, la inflamación sistémica e inducir hipercoagulabilidad y desregulación metabólica. Todos estos mecanismos, parecen explicar su relación independiente con otros factores de riesgo, como la hipertensión riesgo de diabetes o síndrome metabólico, así como con un mayor riesgo de eventos, ya sea a nivel cardiológico como cerebrovascular. A pesar de todo ello, el tratamiento más implementado en esta patología, la CPAP, solo parece tener un efecto moderado en términos de reducción de la presión arterial, solo de magnitud considerable en pacientes con hipertensión resistente. Al lado de esto, su eficacia, en términos de reducción del riesgo de eventos, parece quedar restringida a pacientes con buena adherencia terapéutica, uso de ≥4h/noche, tanto en prevención primaria como secundaria.
Los conocimientos adquiridos hasta la fecha parecen conducir a desarrollar 2 estrategias que ya están en marcha. Por un lado, identificar a los sujetos con AOS, en los que la entidad tiene un papel determinante, ya sea para inducir hipertensión nocturna de determinante valor pronóstico o en términos generales, de un mayor riesgo cardiovascular. En este sentido, el hecho de que un gran número de estudios hayan reportado que las variables relacionadas con la hipoxia, su intensidad y duración, correlacionen mejor con este riesgo que el IAH, ha motivado a buscar nuevas variables derivadas del estudio de sueño que estimen mejor el riesgo. Este es el caso de la llamada carga hipóxica (hypoxic burden), que se define como el área bajo la curva de desaturación asociada con eventos respiratorios. Los pacientes con una alta carga hipóxica parecen tener un riesgo más alto de eventos cardiovasculares y de mortalidad por cualquier causa72. Además, los sujetos en esta situación, podrían ser los mejores respondedores al tratamiento con CPAP73. Por otro lado, esta complementar esta estrategia con la búsqueda de nuevos biomarcadores, metabólicos, genéticos o epigenéticos, e información de nuevos instrumentos tecnológicos que permitan monitorizar el sueño a largo plazo, para que, más allá de identificar los sujetos en los que la AOS implica más riesgo, identificar a aquellos fenotipos de la enfermedad que más podrían beneficiarse de su tratamiento, en lo que respecta a una reducción del riesgo cardiovascular.
FinanciaciónFinanciado por el Instituto de salud Carlos III (ISCIII) (PI21/00337, PI22/00636), co-financiado por la Unión Europea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses