La epistasia es un tipo de interacción genética que podría explicar gran parte de la variabilidad fenotípica que muestran las enfermedades complejas. En este trabajo se determinó el efecto de la epistasia de genes metabólicos y los factores de riesgo cardiovascular en la susceptibilidad al desarrollo de cardiopatía isquémica en Yucatán.
MétodosEstudio de casos y controles en 79 pacientes yucatecos con cardiopatía isquémica y 101 controles sanos pareados por edad y origen con los casos. Se genotipificaron los polimorfismos -108CT, Q192R, L55M (paraoxonasa 1, PON1), C677T, A1298C (5,10 metilentetrahidrofolato reductasa, MTHFR) y la presencia/ausencia del gen glutatión S-transferasa T1 (GSTT1). El análisis de epistasia se realizó con el método de reducción dimensional multifactorial (MDR). El mejor modelo de predicción de riesgo se seleccionó con base en la precisión (%), la significación estadística (p < 0,05) y la consistencia de la validación cruzada.
ResultadosSe encontró asociación independiente del genotipo nulo GSTT1*0/0 (OR = 3,39; IC: 1,29-8,87; p = 0,017) y el alelo nulo (OR = 1,86; IC: 1,19-2,91; p = 0,007) con la cardiopatía isquémica. La deleción GSTT1*0 y el genotipo 677TT (MTHFR) se identificaron de alto riesgo cardiovascular, mientras que el genotipo silvestre GSTT1*1 y la variante CC677 se clasificaron de bajo riesgo. La interacción gen-ambiente identificó al gen GSTT1, al polimorfismo C677T (MTHFR) y a la hipertensión arterial como los factores que mejor explican la cardiopatía isquémica en la población estudiada.
ConclusionesLa interacción de los genes GSTT1 y MTHFR conjuntamente con la hipertensión arterial puede constituir un modelo de predicción de riesgo para el inicio temprano de cardiopatía isquémica en la población de Yucatán.
Epistasis is a type of genetic interaction that could explain much of the phenotypic variability of complex diseases. In this work, the effect of epistasis of metabolic genes and cardiovascular risk on the susceptibility to the development of ischemic heart disease in Yucatan was determined.
MethodsCase-control study in 79 Yucatecan patients with ischemic heart disease and 101 healthy controls matched by age and origin with cases. The polymorphisms -108CT, Q192R, L55M (paraoxonase 1; PON1), C677T, A1298C (methylenetetrahydrofolate reductase; MTHFR), and the presence/absence of the glutathione S-transferase T1 (GSTT1) gene were genotyped. Epistasis analysis was performed using the multifactorial dimensional reduction method. The best risk prediction model was selected based on precision (%), statistical significance (P<0.05), and cross-validation consistency.
ResultsWe found an independent association of the null genotype GSTT1*0/0 (OR=3.39, CI: 1.29-8.87, P=0.017) and the null allele (OR=1.86, CI: 1.19-2.91, P=0.007) with ischemic heart disease. The GSTT1*0 deletion and the 677TT genotype (MTHFR) were identified as being at a high cardiovascular risk, whereas the GSTT1*1 wild type genotype and the CC677 variant were at low risk. The gene-environment interaction identified the GSTT1 gene, C677T polymorphism (MTHFR), and hypertension as the factors that best explain ischemic heart disease in the study population.
ConclusionsThe interaction of the MTHFR, GSTT1 and hypertension may constitute a predictive model of risk for early onset ischemic heart disease in the population of Yucatan.
La cardiopatía isquémica (CI) es una enfermedad compleja con patrones de herencia formados por combinaciones de genes pertenecientes a múltiples loci en interacción con factores de riesgo ambientales. Tradicionalmente, los estudios de asociación genéticos se han centrado en polimorfismos aislados de un solo nucleótido o SNP (del inglés simple nucleotide polymorphisms), y es difícil establecer una asociación real con la enfermedad, al ser de naturaleza poligénica1,2. Para la CI, una de las estrategias actuales consiste en identificar grupos de polimorfismos funcionales en genes candidatos involucrados en la homeostasia cardiovascular que puedan definir con mayor precisión la propensión a un determinado fenotipo aterotrombótico3.
La epistasia es un tipo de interacción genética que podría explicar gran parte de la variabilidad fenotípica que muestra la enfermedad coronaria. El método de reducción dimensional multifactorial (MDR), diseñado para estudios de asociación de casos y controles con pequeños tamaños de muestra, es una estrategia novedosa para la identificación de efectos epistáticos predictores de una situación clínica determinada4,5. El MDR es un método no paramétrico que reduce la dimensión multifactorial agrupando los diferentes genotipos en 2grupos: alto y bajo riesgo. El MDR no asume un modelo de herencia específico sino que, una vez que selecciona los polimorfismos de mayor relevancia, examina la proporción de casos y controles de cada una de las combinaciones genotípicas entre 2o más loci para obtener un modelo de clasificación final para alto y bajo riesgo. Estas interacciones se representan en una tabla de contingencia donde para cada casilla se estima la proporción casos/controles. Las casillas con una proporción casos/controles igual o mayor que la proporción caso/control global de la población se clasifican como de alto riesgo y aquellas con una proporción menor que la global, como de bajo riesgo. De esa forma, se obtiene un modelo de clasificación en el que los sujetos de riesgo alto se clasifican como casos y los de riesgo bajo, como controles. El programa genera diferentes modelos de interacción entre los loci evaluados, identificando el mejor de ellos con relación a la sensibilidad y especificidad, denominado precisión equilibrada. Una validación cruzada cuenta el número de veces que una determinada interacción es elegida como sobresaliente e identifica así el mejor modelo. Una prueba de permutación evalúa si dicho modelo es estadísticamente significativo6,7. El mejor modelo será el de mayor precisión y valor de significación (p < 0,05).
Para este estudio se seleccionaron 6polimorfismos de un solo nucleótido de los genes candidatos glutatión S-transferasa T1 (GSTT1), paraoxonasa 1 (PON1) y 5,10 metilentetrahidrofolato reductasa (MTHFR), relacionados con el metabolismo antioxidante y de folatos, procesos implicados en la fisiopatología de la enfermedad coronaria de causa aterosclerótica.
El gen GSTT1 codifica para enzimas que intervienen en la detoxificación celular. La variante silvestre GSTT1*1 es funcional mientras que la variante nula GSTT1*0 implica la deleción del gen8. Los sujetos portadores de la deleción homocigota GSTT1*0/*0 carecen de la enzima mientras que los heterocigotos GSTT1*1/*0 poseen actividad intermedia por el efecto del alelo funcional9,10.
El gen PON1 codifica para una glicoproteína con actividad antioxidante que se asocia con las moléculas HDL (lipoproteínas de alta densidad) y cuya concentración aumenta en respuesta al estrés oxidativo11. Las variantes objeto de este estudio se localizan en la región promotora (-108CT [rs705379]) y en la codificante (T260A [rs854560] y A672G [rs662]), estas últimas conocidas en la literatura como L55M y Q192R, respectivamente. Estas isoformas poseen diferente capacidad para proteger las LDL de la oxidación lipídica: los genotipos 192QQ y 55MM confieren a las HDL mayor actividad antioxidante, con un efecto ateroprotector, a diferencia de los genotipos aterogénicos 192RR y 55LL12,13. Mientras, la isoforma codificada por el alelo -108C se ha asociado con mayor concentración enzimática en comparación con la variante -108T14.
Por su parte, la homocisteína (Hcy) es un producto intermedio del metabolismo de la metionina, cuyo aumento se relaciona inversamente con los niveles plasmáticos de folato y se considera un factor de riesgo aterogénico por propiciar la disfunción endotelial15,16. Los polimorfismos más estudiados del gen MTHFR son C677T y A1298C. Los homocigotos para el alelo T (C677T) poseen una menor actividad enzimática, asociada con bajos niveles de folato y altos niveles de Hcy17,18, mientras que la variante A1298C se ha relacionado con baja actividad enzimática in vitro e in vivo19.
El objetivo de este estudio fue determinar el efecto de epistasia de 6polimorfismos de genes metabólicos y su interacción con factores de riesgo cardiovascular, e identificar un modelo de predicción de riesgo para CI en pacientes yucatecos.
MétodosTipo de estudio y muestrasSe diseñó un estudio de asociación de casos y controles con pareamiento por edad y lugar de nacimiento. Se reclutaron 79 pacientes, hombres y mujeres, de ascendencia yucateca y con diagnóstico de CI, procedentes de los servicios de cardiología del Hospital Regional del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE) y del Hospital General Dr. Agustín O’Horan en Mérida (Yucatán). Los criterios diagnósticos de CI (ACCF/AHA)20,21 fueron dolor precordial en reposo o al ejercicio mayor de 20 min, con o sin cambios en el electrocardiograma basal en reposo, con o sin alteraciones de marcadores enzimáticos y cuyo diagnóstico fuese confirmado por cateterismo cardiaco. Los controles fueron 101 donantes aparentemente sanos, no relacionados, sin manifestaciones clínicas de CI, con prueba de esfuerzo negativa para isquemia miocárdica y sin historia familiar de enfermedad coronaria prematura (evento coronario en familiares de primer o segundo grado antes de los 55 años en varones y antes de los 65 en mujeres), procedentes del Centro Estatal de la Transfusión Sanguínea y del Hospital Regional Mérida del ISSSTE.
Se registraron datos demográficos e historia personal de los factores de riesgo cardiovascular obesidad, hipertensión arterial (HTA), diabetes mellitus (DM), colesterol HDL (lipoproteínas de baja densidad), colesterol LDL y dislipidemia mixta, así como la presencia de arco corneal y xantelasmas. El índice de masa corporal (IMC) se calculó como peso en kilogramos dividido por la estatura en metros cuadrados y se categorizó en bajo peso (<18,5), normopeso (de 18,5 a 24,9), sobrepeso (de 25,0 a <30,0) y obesidad (>30,0). La HTA se definió de acuerdo con las recomendaciones de la American Heart Association con cifras de presión arterial sistólica/diastólica ≥140/90mmHg22. Se consideró dislipidemia mixta cuando el valor del colesterol total plasmático y los triglicéridos fueron superiores a 200mg/dl23. El colesterol LDL se calculó utilizando la fórmula de Friedewald. La DM se definió según la American Diabetes Association como glucemia plasmática en ayunas ≥ a 126mg/dl, más síntomas clásicos de diabetes o glucemia ≥ a 200mg/dl a las 2h de la prueba de tolerancia oral a la glucosa24. El tabaquismo se definió como fumador y no fumador. Se consideró fumador cuando el sujeto dijo que consumía al menos un cigarrillo diario durante el último año o más, o que convivía diariamente con fumadores. No fumador cuando no había fumado nunca ni había convivido con fumadores. En los casos, cada categoría se definió a partir del diagnóstico de CI.
Todos los individuos se definieron étnicamente como mestizos y declararon haber nacido en Yucatán y ser descendientes de padres y abuelos yucatecos. Previamente, se determinó la ausencia de subestructura genética o estratificación entre los grupos de estudio, utilizando 4polimorfismos ancestrales que caracterizan al locus sanguíneo ABO*O. El estudio fue aprobado por los Comité de Ética de la Investigación de las instituciones participantes. Se obtuvo el consentimiento informado de todos los sujetos.
Obtención de ADN y genotipificaciónEl ADN genómico se obtuvo a partir de 2ml de sangre periférica por un método de precipitación salina descrito por Bunce25 y se conservó a −20°C hasta su procesamiento.
Los polimorfismos C677T y A1298C (MTHFR) se determinaron por reacción en cadena de la polimerasa con análisis de la longitud de los fragmentos de restricción (PCR-RFLP). Para C677T (rs1801133) se utilizaron los oligonucleótidos 5¿CGAAGCAGGGAGCTTTGAGGCTG3¿ (sentido) y 5¿AGGACGGTGCGGTGAGAGTG3¿ (antisentido). Las condiciones de PCR fueron: desnaturalización inicial a 94°C por 5 min, seguido de 35 ciclos, 30 s a 94°C, 45 s a 62°C y 30 s a 72°C, con extensión final a 72°C por 5 min. El amplificado de 233 pb se trató con la enzima de restricción TaqI (Thermo Scientific) durante una hora a 37°C. Los productos de la restricción se separaron por electroforesis en gel de poliacrilamida al 12% con nitrato de plata. La enzima produce un único sitio de corte y genera un fragmento de 171 pb correspondiente al alelo T. Para A1298C (rs1801131) se utilizaron los oligonucleótidos (sentido) 5¿CTTTGGGGAGCTGAAGGACTACTA¿3 y (antisentido) 5¿CACTTTGTG ACCATTCCGGTTTG¿3. Las condiciones de amplificación fueron: desnaturalización inicial por 10 min a 95°C seguida por 35 ciclos de un minuto a 95°C, 30 s de alineación a 62°C, 72°C por un minuto y una extensión final a 72°C, 7 min. El amplificado de 163 pb se sometió a digestión con la enzima de restricción MboII (Thermo Scientific). Los productos obtenidos se separaron por electroforesis en gel de poliacrilamida al 12% con nitrato de plata. La enzima MboII genera fragmentos de 56 pb y 30/31 pb para el alelo A, y de 84 pb y 30/31 pb para el alelo C.
La genotipificación del gen GSTT1 se realizó por PCR múltiple según el protocolo descrito por Buchard et al.26. Se utilizaron 2pares de cebadores: uno reconoce una secuencia dentro del gen de 969 pb y el segundo se encuentra flanqueando sus extremos. Si hay deleción se obtendrá un fragmento de 3.106 pb. Las condiciones de amplificación fueron 94°C por 3 min, seguido de 35 ciclos, 30 s a 94°C, 7 min a 68°C y extensión a 69°C por 10 min. Los amplificados se visualizaron en un gel de agarosa al 1,5% con SYBR safe DNA (Invitrogen) por electroforesis.
La genotipificación de los polimorfismos de PON1 se realizó por PCR en tiempo real mediante ensayo de discriminación alélica con sondas TaqMan (Applied Biosystems) -108CT (C_11708905_10), Q192R (C_2548962_20) y L55M (C_2259750_20).
Análisis estadísticoLas variables continuas se expresaron como media ± desviación estándar y las discretas en porcentajes. Para cada polimorfismo se estimaron las frecuencias genotípicas por conteo directo y las alélicas a partir de los genotipos, expresadas en porcentajes. Se utilizó la prueba de Chi cuadrada para comparar las variables categóricas y para evaluar el equilibrio de Hardy-Weinberg. Se estimaron los odds ratio (OR) y sus intervalos de confianza (IC) del 95% para determinar la asociación de cada polimorfismo independiente con la enfermedad, tomando como referencia el genotipo y el alelo silvestre (modelo de herencia codominante) de cada variante, utilizando Stata/SE 12.0. El desequilibrio de ligamiento (LD¿) entre pares de SNP y el coeficiente de correlación de Pearson (r2) se evaluaron con el programa SNPstat (https://www.snpstats.net/snpstats/start.htm). El análisis de epistasia se realizó con el programa MDR 3.0.2 (http://epistasis.org), analizando los 6polimorfismos juntos. De igual forma, se aplicó MDR para determinar la interacción gen-ambiente e identificar el peso de cada una de las variables independientes (polimorfismos, HTA, dislipidemia mixta, colesterol LDL, colesterol HDL, obesidad [IMC > 30] y tabaquismo) en relación con la enfermedad. Para todos los análisis se consideró un nivel de significación de p < 0,05.
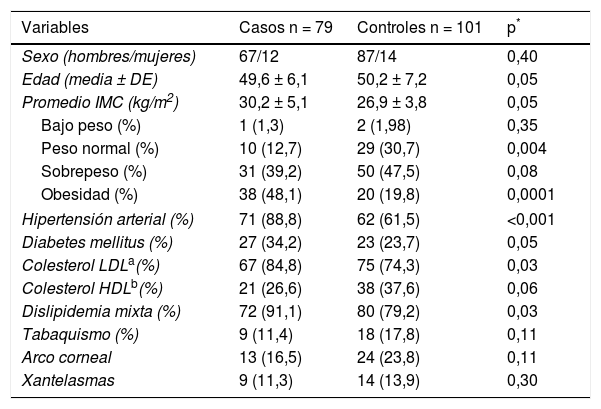
ResultadosLas características demográficas y clínicas en pacientes y controles se resumen en la tabla 1. La proporción de hombres y mujeres y el promedio de edad global y por sexos (hombres casos 49,9 ± 6,5 vs. controles 46,2 ± 7,3; p = 0,29; mujeres casos 50,5 ± 6,5 vs. controles 46,0 ± 8,4; p = 0,29) fueron similares en ambos grupos. Los factores de riesgo cardiovascular HTA (p < 0,001) y dislipidemia mixta (p = 0,01) fueron significativamente más prevalentes en el grupo de pacientes. Al estratificar el IMC, se observó un mayor porcentaje de controles con peso normal (30,7 vs. 12,7%; p = 0,004) y de pacientes con obesidad (48,1 vs. 19,8%; p = 0,0001). El sobrepeso fue el factor de mayor prevalencia en la población general, con un ligero aumento en los sujetos controles (casos 39,2% y controles 47,5%; p = 0,07). La presencia de arco corneal y xantelasmas fue similar en ambos grupos (p > 0,05).
Características antropométricas y clínicas
| Variables | Casos n = 79 | Controles n = 101 | p* |
|---|---|---|---|
| Sexo (hombres/mujeres) | 67/12 | 87/14 | 0,40 |
| Edad (media ± DE) | 49,6 ± 6,1 | 50,2 ± 7,2 | 0,05 |
| Promedio IMC (kg/m2) | 30,2 ± 5,1 | 26,9 ± 3,8 | 0,05 |
| Bajo peso (%) | 1 (1,3) | 2 (1,98) | 0,35 |
| Peso normal (%) | 10 (12,7) | 29 (30,7) | 0,004 |
| Sobrepeso (%) | 31 (39,2) | 50 (47,5) | 0,08 |
| Obesidad (%) | 38 (48,1) | 20 (19,8) | 0,0001 |
| Hipertensión arterial (%) | 71 (88,8) | 62 (61,5) | <0,001 |
| Diabetes mellitus (%) | 27 (34,2) | 23 (23,7) | 0,05 |
| Colesterol LDLa(%) | 67 (84,8) | 75 (74,3) | 0,03 |
| Colesterol HDLb(%) | 21 (26,6) | 38 (37,6) | 0,06 |
| Dislipidemia mixta (%) | 72 (91,1) | 80 (79,2) | 0,03 |
| Tabaquismo (%) | 9 (11,4) | 18 (17,8) | 0,11 |
| Arco corneal | 13 (16,5) | 24 (23,8) | 0,11 |
| Xantelasmas | 9 (11,3) | 14 (13,9) | 0,30 |
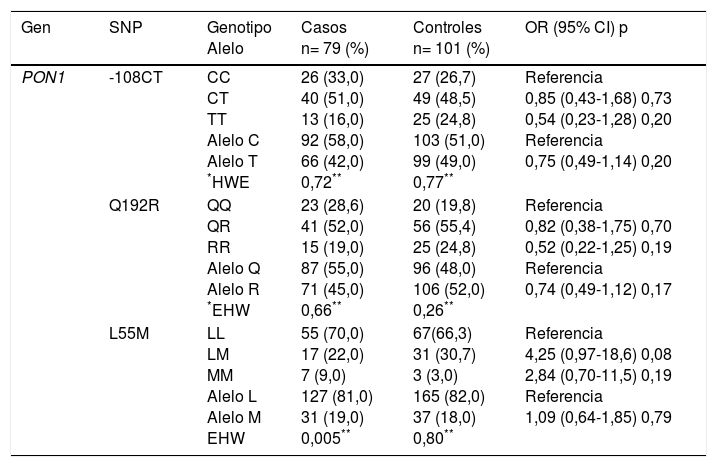
La tabla 2 muestra la comparación de frecuencias genotípicas y alélicas de los polimorfismos estudiados en casos y controles, el equilibrio de Hardy-Weinberg y la asociación con la CI de acuerdo con el modelo de herencia codominante. Con excepción de GSTT1, para el cual se detectó mayor prevalencia de enfermos con la deleción homocigota del gen (GSTT1*0/0), el resto de los polimorfismos no mostraron diferencias significativas en las frecuencias genotípicas y alélicas entre ambos grupos (p>0,05). Para todas las variantes, las frecuencias observadas en los sujetos controles se encontraron en equilibrio de Hardy-Weinberg (p>0,05). El desequilibrio observado para el polimorfismo L55M (p=0,005) en el grupo de pacientes no se consideró relevante, porque este sesgo pudiera ser indicativo de una relación causal con la enfermedad.
Frecuencias genotípicas y alélicas de los polimorfismos estudiados, equilibrio de Hardy-Weinberg y estimación de riesgo (OR) en casos y controles
| Gen | SNP | Genotipo Alelo | Casos n= 79 (%) | Controles n= 101 (%) | OR (95% CI) p |
|---|---|---|---|---|---|
| PON1 | -108CT | CC CT TT Alelo C Alelo T *HWE | 26 (33,0) 40 (51,0) 13 (16,0) 92 (58,0) 66 (42,0) 0,72** | 27 (26,7) 49 (48,5) 25 (24,8) 103 (51,0) 99 (49,0) 0,77** | Referencia 0,85 (0,43-1,68) 0,73 0,54 (0,23-1,28) 0,20 Referencia 0,75 (0,49-1,14) 0,20 |
| Q192R | QQ QR RR Alelo Q Alelo R *EHW | 23 (28,6) 41 (52,0) 15 (19,0) 87 (55,0) 71 (45,0) 0,66** | 20 (19,8) 56 (55,4) 25 (24,8) 96 (48,0) 106 (52,0) 0,26** | Referencia 0,82 (0,38-1,75) 0,70 0,52 (0,22-1,25) 0,19 Referencia 0,74 (0,49-1,12) 0,17 | |
| L55M | LL LM MM Alelo L Alelo M EHW | 55 (70,0) 17 (22,0) 7 (9,0) 127 (81,0) 31 (19,0) 0,005** | 67(66,3) 31 (30,7) 3 (3,0) 165 (82,0) 37 (18,0) 0,80** | Referencia 4,25 (0,97-18,6) 0,08 2,84 (0,70-11,5) 0,19 Referencia 1,09 (0,64-1,85) 0,79 |
| GSTT1 | 1/1 1/0 0/0 Presencia Nulo EHW | 31 (39,0) 33 (42,0) 15 (19,0) 95 (60,0) 63 (40,0) 0,25a | 56 (55,4) 37 (36,6) 8 (7,9) 149 (74,0) 53 (26,0) 0,59a | Referencia 2,10 (0,79-5,59) 0,15 3,39 (1,29-8,87) 0,017 Referencia 1,86 (1,19-2,91) 0,007 | |
| MTFFR | C677T | C/C C/T T/T Alelo C Alelo T EHW | 18 (23,0) 42 (53,0) 19 (24,0) 78 (49,0) 80 (51,0) 0,57a | 25 (25,0) 41 (41,0) 35 (35,0) 92 (46,0) 110 (54,0) 0,07a | Referencia 0,53 (0,26-1,07) 0,08 0,75 (0,33-1,72) 0,53 Referencia 0,86 (0,57-1,30) 0,52 |
| A1298C | A/A A/C C/C Alelo A Alelo C EHW | 56 (71,0) 22 (28,0) 1 (10,0) 134 (85,0) 24 (15,0) 0,47a | 77 (55,4) 21 (36,6) 3 (7,9) 175 (87,0) 27 (13,0) 0,30a | Referencia 0,32 (0,31-3,31) 0,60 0,46 (0,05-4,52) 0,64 Referencia 1,16 (0,64-2,10) 0,65 |
EHW: equilibrio de Hardy-Weinberg.
El análisis de asociación para cada polimorfismo independiente detectó que tanto el genotipo como el alelo nulo del gen GSTT1 confieren a sus portadores 3,39 y 1,86 veces, respectivamente, mayor susceptibilidad a CI que los sujetos portadores del genotipo y el alelo silvestre. El resto de los polimorfismos no mostraron asociación de riesgo.
Se detectó un alto desequilibrio de ligamiento entre los nucleótidos 677 y 1298 del gen MTHFR (LD¿ = 0,858; r2 = 0,369; p ≤ 0,0001) y en menor medida entre Q192R y L55M (LD¿ = 0,394; r2= 0,207; p ≤ 0,0001), entre -108CT y Q192R (LD¿ = 0,312; r2=0,282; p≤0,0001) y entre -108CT y L55M (LD¿ = 0,394; r2= 0,207; p ≤ 0,0001) del gen PON1. El gen GSTT1 y la variante C677T mostraron un moderado desequilibrio de ligamiento (LD¿ = 0,133; r2= 0,087). Sin embargo, con base en los valores de los coeficientes de correlación y para los efectos de asociación, ninguno de los polimorfismos puede sustituirse entre sí. No se encontró asociación de riesgo con la CI con base en la estimación de haplotipos (datos no mostrados).
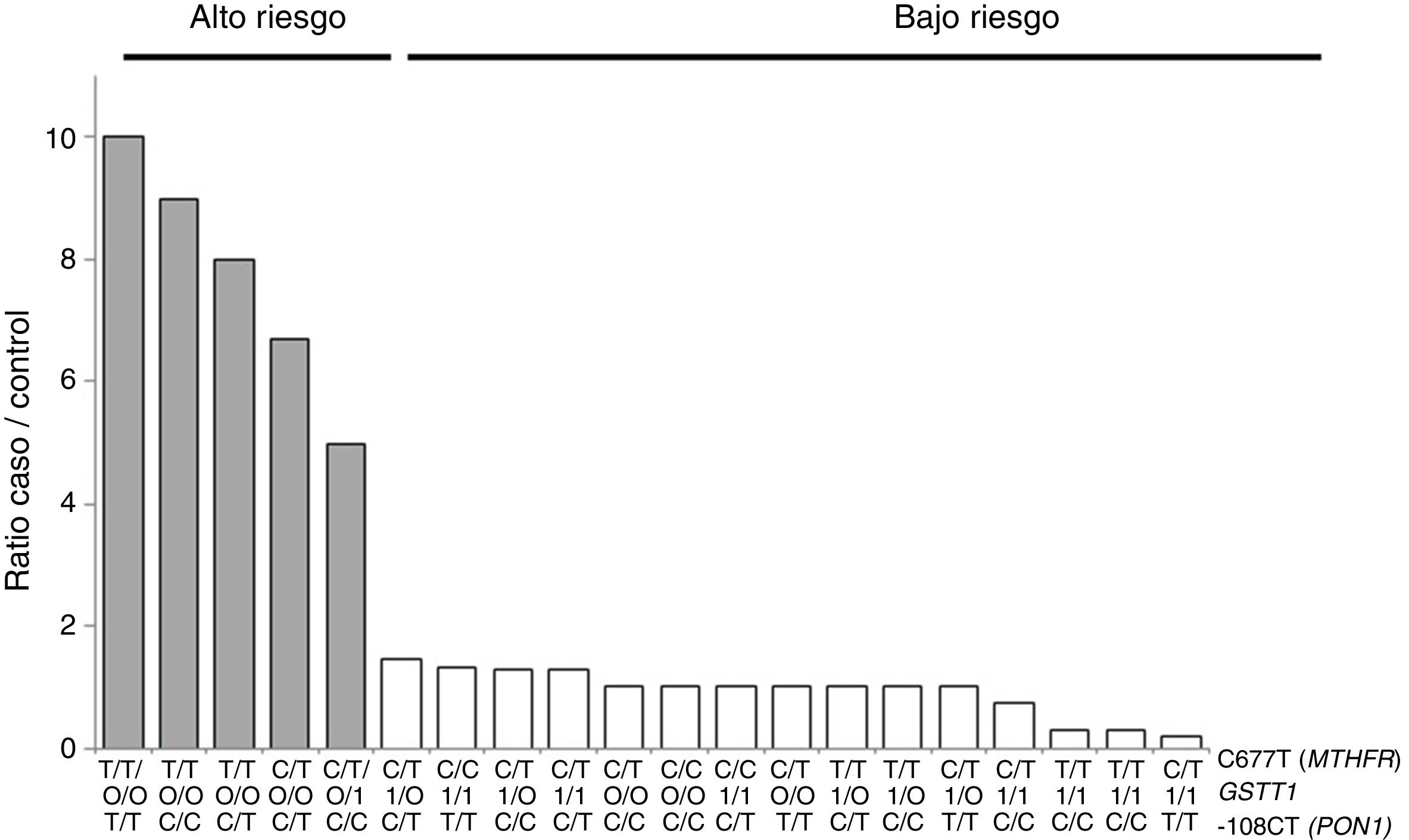
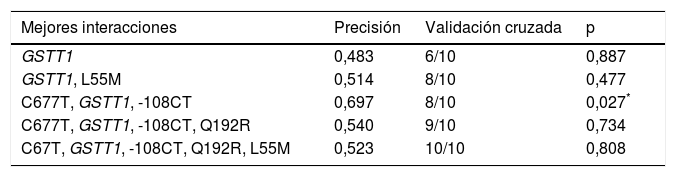
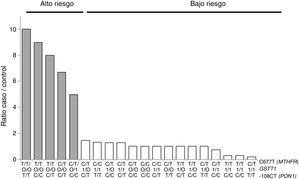
Para el análisis multilocus (MDR) se evaluaron los 3genotipos por separado para cada polimorfismo (modelo de herencia codominante). El MDR identificó como mejor modelo de predicción la interacción entre el gen GSTT1 y los polimorfismos C677T del gen MTHFR, y -108CT de PON1 con una precisión del 69,7%, una significación de p = 0,027 y una validación cruzada de 8/10. Los modelos con 2, 4y 5interacciones mostraron una disminución en la precisión, sin significación estadística (tabla 3). De las 24 combinaciones genotípicas estimadas, los individuos con deleción del gen GSTT1 (genotipo nulo) y los homocigotos para el alelo T (C677T), con independencia del genotipo -108CT, fueron identificados en el grupo de alto riesgo cardiovascular. El modelo consideró alto riesgo cuando el cociente del porcentaje de casos vs. controles fue superior a 1,25 (fig. 1).
Resumen de las mejores combinaciones de interacción gen-gen obtenidas con el análisis MDR
| Mejores interacciones | Precisión | Validación cruzada | p |
|---|---|---|---|
| GSTT1 | 0,483 | 6/10 | 0,887 |
| GSTT1, L55M | 0,514 | 8/10 | 0,477 |
| C677T, GSTT1, -108CT | 0,697 | 8/10 | 0,027* |
| C677T, GSTT1, -108CT, Q192R | 0,540 | 9/10 | 0,734 |
| C67T, GSTT1, -108CT, Q192R, L55M | 0,523 | 10/10 | 0,808 |
Distribución de combinaciones genotípicas de alto (barras grises) y bajo (barras blancas) riesgo estadísticamente significativas (p < 0,005), correspondiente a los 3polimorfismos identificados en el análisis MDR como el mejor modelo de interacción (GSTT1/C677T/-108CT). Las barras grises representan los casos y las blancas los controles.
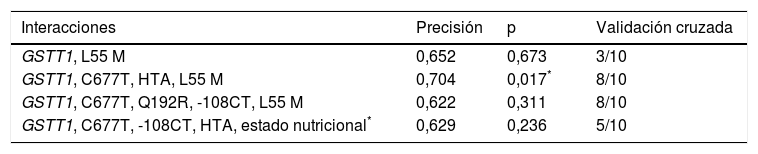
Al incluir en el análisis el MDR (interacción gen-ambiente) de los factores de riesgo obesidad, HTA, dislipidemia mixta, colesterol HDL, colesterol LDL, DM, arco corneal y xantelasmas, el mejor modelo de predicción (p = 0,017) mantuvo la interacción entre el gen GSTT1 y el polimorfismo C677T (MTHFR), e identificó a la hipertensión arterial como el factor de riesgo que más contribuye al riesgo cardiovascular en esta población (tabla 4).
Mejores modelos de interacción gen-ambiente estimados con el análisis MDR
| Interacciones | Precisión | p | Validación cruzada |
|---|---|---|---|
| GSTT1, L55 M | 0,652 | 0,673 | 3/10 |
| GSTT1, C677T, HTA, L55 M | 0,704 | 0,017* | 8/10 |
| GSTT1, C677T, Q192R, -108CT, L55 M | 0,622 | 0,311 | 8/10 |
| GSTT1, C677T, -108CT, HTA, estado nutricional* | 0,629 | 0,236 | 5/10 |
El IMC se consideró variable categórica del estado nutricional.
Para establecer modelos de predicción de riesgo para enfermedades complejas se requieren instrumentos estadísticos avanzados que consideren tanto el efecto de las múltiples interacciones genéticas como del ambiente. El análisis MDR ya ha sido utilizado en estudios de asociación de enfermedades complejas como cáncer27, diabetes de tipo 228, hipertensión esencial29, enfermedad coronaria30 y polineuropatía amiloide31, entre otras.
En este estudio, la asociación independiente entre el genotipo nulo GSTT1 y la CI (tabla 2) se confirmó en el análisis de epistasia multilocus, lo que puede indicar que, al menos en esta población, la ausencia del gen GSTT1 pudiera constituir un marcador de riesgo genético para el desarrollo temprano de CI. Estudios previos han evaluado la asociación entre el genotipo nulo GSTT1*0 y la susceptibilidad a la enfermedad coronaria, pero los resultados no son concluyentes: algunos trabajos han encontrado asociación significativa y otros no32-36. Estas inconsistencias pueden atribuirse a las diferentes magnitudes de riesgo obtenidas en los diferentes estudios, al pequeño efecto del polimorfismo en la enfermedad, a reducidos tamaños de muestras y a las metodologías utilizadas. Desde el punto de vista fisiopatológico, la relación entre GSTT1 y la aterosclerosis se establece por vía enzimática, a través de la cual GSTT1 elimina metabolitos tóxicos y productos del estrés oxidativo37,38. En los sujetos carentes de la enzima, los compuestos generados por el metabolismo celular que son eliminados por la vía GSTT1 se acumulan en el endotelio, propiciando la disfunción endotelial39-41. La segunda vía, definida recientemente, se refiere al papel de GSTT1 como modulador y regulador de proteínas que intervienen en los mecanismos de señalización celular42,43. Se ha propuesto que GSTT1 envía señales inhibitorias a proteínas cinasas responsables de regular la proliferación de las células musculares lisas en la íntima arterial43. En los individuos que carecen de la enzima, la proliferación de las células musculares pudiera estar exacerbada, lo que contribuiría a un mayor crecimiento de las placas de ateroma en comparación con los sujetos portadores de la enzima funcional.
Con respecto al gen MTHFR, también existen discrepancias sobre su asociación con el riesgo cardiovascular. La mayoría de los estudios proceden de grupos caucásicos y asiáticos, con escasos reportes en poblaciones latinas. Un metaanálisis que incluyó 22 estudios de casos y controles pareados por edad, encontró una diferencia en el valor promedio de Hcy entre el genotipo silvestre CC y el mutado TT (C677T) de 2,7 mmol/L44. El polimorfismo C677T y la alteración en los niveles de folato se ha relacionado también con la hipometilación del ADN y, en consecuencia, con un mayor riesgo de aterosclerosis45,46. Existen pruebas de que los portadores del genotipo TT poseen valores de metilación de ADN genómico más bajos que los sujetos con genotipo silvestre CC47. Sin embargo, también se ha reportado que no todos los individuos portadores de la variante termolábil (677TT) poseen niveles aumentados de Hcy, y que, entre aquellos que lo tienen, sus valores se han normalizado después de la suplementación con folato48,49, por lo que podría tratarse de una mutación neutral para los niveles de Hcy cuando el estatus de folato es adecuado50. Por otra parte, existen pocos datos sobre el papel de la Hcy en pacientes con CI prematura. Se ha reportado que la hiperhomocisteinemia es un factor de riesgo independiente para trombosis coronaria en sujetos menores de 50 años, más que para el desarrollo de enfermedad arterial coronaria51,52. En México, poco se ha explorado sobre la relación del gen MTHFR con la enfermedad isquémica de causa aterosclerótica. Isordia et al., al evaluar a 167 pacientes de la Ciudad de México, no encontraron asociación independiente entre los portadores del genotipo TT (C677T) y el riesgo de infarto de miocardio prematuro (≤45 años)53. En nuestro estudio, ninguno de los polimorfismos MTHFR mostraron asociación de riesgo independiente con la CI temprana (tabla 2). Sin embargo, con base en los resultados del análisis multilocus, pudiéramos considerar que el gen MTHFR no es suficiente pero sí necesario para el desarrollo de enfermedad isquémica, al menos en esta población. En este sentido, el análisis MDR puede ser útil como estrategia analítica para indagar el efecto simultáneo de diferentes loci y detectar así relaciones de riesgo con enfermedades complejas.
Con respecto al análisis de epistasia, el MDR identificó como mejor modelo la interacción entre el gen GSTT1 y el polimorfismo C677T (MTHFR) con independencia de la variante -108CT (PON1), que pudiera actuar como un modificador de efecto en la interacción (fig. 1). Con base en los genotipos de alto y bajo riesgo obtenidos, podemos señalar que GSTT1 y C677T pueden actuar sinérgicamente: los sujetos portadores del genotipo 677TT (MTHFR) con ausencia del gen GSTT1 tendrán mayor susceptibilidad a desarrollar eventos isquémicos, mientras que aquellos con el gen GSTT1 funcional y la variante CC677 estarán más protegidos. Varios estudios han reportado interacción de genes GST con MTHFR54-56, pero solo unos pocos han realizado análisis de epistasia57,58. Además de los mecanismos epistáticos en los que un gen puede modificar su expresión por acción de otro u otros genes, el efecto de interacción GSTT1-MTHFR también podría darse a través de mecanismos epigenéticos implicados en la regulación de la expresión génica, específicamente la metilación, cuyas alteraciones se producen en diversas enfermedades. En la aterosclerosis, modelos in vitro han evidenciado que la metilación del ADN es un proceso de inicio temprano, en el que existe tanto metilación excesiva como deficiente en distintos genes, mientras que, en las etapas avanzadas de la enfermedad, la hiperproliferación de las células del músculo liso vascular induce la hipometilación del ADN45,47,59,60.
Otra posible explicación del efecto combinado GSTT1-MTHFR podría estar en la relación que las enzimas codificadas por estos genes tienen en las vías metabólicas involucradas en la protección contra el estrés oxidativo. La Hcy sirve como precursor de las enzimas S-adenosilmetionina (SAM)/S-adenosilmetionina (SAH), vinculadas con la metilación y desmetilación de ADN, ARN y proteínas; y también como precursor del glutatión (GSH), necesario en los procesos de desintoxicación mediados por GST61,62. Por tanto, se podría decir que los cambios en los patrones de metilación y la alteración en los niveles de ciertas enzimas del metabolismo de oxidación-reducción podrían ser parte de los mecanismos involucrados en el desarrollo de la aterosclerosis.
Finalmente, el análisis de interacción gen-ambiente identificó a los genes GSTT1 y MTHFR conjuntamente con la HTA como los factores que mejor pronostican la CI en la población estudiada. Respecto al polimorfismo L55M, su presencia en el modelo gen-ambiente pudiera deberse al desequilibrio de ligamiento con la variante -108CT (LD¿ = 0,394; r2=0,207; p ≤ 0,0001) (tabla 4). Estudios previos han mostrado que la patogénesis de la HTA se asocia con alteraciones en el metabolismo del glutatión63,64. Hay pruebas de que las células mononucleares de sujetos hipertensos tienen niveles significativamente más bajos de GST que en los sujetos sanos, y que la actividad de las enzimas en esta vía metabólica también disminuye, incluyendo las GST65,66. Estos bajos niveles de enzimas antioxidantes en la hipertensión se deben a las condiciones de estrés oxidativo imperantes en el entorno vascular, las cuales se revierten con el tratamiento antihipertensivo67. También se ha reportado a los genotipos nulos GSTM1 y GSTT1 como potenciales factores de riesgo para la predicción de hipertensión esencial67,68.
ConclusionesEn este estudio, el análisis de epistasia señala que la combinación de diferentes variantes alélicas de genes antioxidantes como GSTT1 y MTHFR conjuntamente con la HTA puede influir en la variabilidad genética para la predisposición al desarrollo de eventos isquémicos tempranos en la población de Yucatán. El análisis MDR puede ser útil para evidenciar el papel de las interacciones epistáticas en la etiopatogenia de enfermedades complejas como la cardiopatía isquémica.
FinanciamientoEste trabajo fue financiado por el Laboratorio Biomédicos de Mérida (Yucatán, México).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.