La osteoporosis es una enfermedad esquelética sistémica, caracterizada por baja masa ósea y deterioro en la microarquitectura del tejido óseo, que origina un aumento de la fragilidad ósea y, en consecuencia, mayor susceptibilidad a fracturas. Es la enfermedad metabólica ósea más frecuente en nuestra población, y las fracturas resultantes de la osteoporosis son cada vez más comunes. Por otro lado, la calcificación vascular es un factor de riesgo reconocido de morbimortalidad cardiovascular, que históricamente era considerada como un proceso pasivo y degenerativo. Sin embargo, en la actualidad se reconoce como un proceso activo que tiene características histopatológicas, de composición mineral y de mecanismos de iniciación y desarrollo propias de la formación del hueso. Paradójicamente, los pacientes con osteoporosis muestran con frecuencia calcificaciones vasculares. Tradicionalmente se han considerado como procesos independientes relacionados con la edad, aunque estudios epidemiológicos recientes han evidenciado que existe una estrecha relación entre la pérdida de masa ósea y la calcificación vascular, independiente de la edad. De hecho, ambas entidades comparten factores de riesgo y mecanismos fisiopatológicos. Entre ellos destacan la relación entre proteínas de origen óseo, como la osteopontina y la osteoprotegerina, con la patología vascular, y el sistema intercelular proteico RANK/RANKL/OPG y la vía de señalización Wnt. Los mecanismos vinculados en ambas patologías deben considerarse en las decisiones clínicas, dado que los tratamientos para la osteoporosis podrían tener efectos imprevistos en la calcificación vascular, y a la inversa. En definitiva, una mejor comprensión de la relación entre ambas entidades puede contribuir a plantear estrategias para disminuir la prevalencia creciente de calcificación vascular y osteoporosis en la población que envejece.
Osteoporosis is a systemic skeletal disease, characterised by low bone mass and deterioration in the micro-architecture of bone tissue, which causes increased bone fragility and consequently greater susceptibility to fractures. It is the most frequent metabolic bone disease in our population, and fractures resulting from osteoporosis are becoming more common. Furthermore, vascular calcification is a recognised risk factor of cardiovascular morbidity and mortality that historically has been considered a passive and degenerative process. However, it is currently recognised as an active process, which has histopathological characteristics, mineral composition and initiation and development mechanisms characteristic of bone formation. Paradoxically, patients with osteoporosis frequently show vascular calcifications. Traditionally, they have been considered as independent processes related to age, although more recent epidemiological studies have shown that there is a close relationship between the loss of bone mass and vascular calcification, regardless of age. In fact, both conditions share risk factors and pathophysiological mechanisms. These include the relationship between proteins of bone origin, such as osteopontin and osteoprotegerin (OPG), with vascular pathology, and the intercellular protein system RANK/RANKL/OPG and the Wnt signalling pathway. The mechanisms linked in both pathologies should be considered in clinical decisions, given that treatments for osteoporosis could have unforeseen effects on vascular calcification, and vice versa. In short, a better understanding of the relationship between both entities can help in proposing strategies to reduce the increasing prevalence of vascular calcification and osteoporosis in the aging population.
La osteoporosis es una enfermedad esquelética sistémica, caracterizada por baja masa ósea y deterioro en la microarquitectura del tejido óseo, que origina fragilidad ósea aumentada, con el consecuente aumento en el riesgo de fractura1. Supone un grave problema de salud pública, ya que afecta a más de 200 millones de personas. La incidencia anual de fractura de cadera es de 1,7 millones en todo el mundo. Esta patología comporta a su vez un incremento de la morbimortalidad en estos pacientes, de tal forma que las mujeres con fractura de cadera tienen una mortalidad de un 10 a un 20% superior a lo esperado para su edad. Para el año 2050 se estima que la incidencia anual de fractura de cadera aumentará, con un total de 6,3 millones de afectados, debido principalmente al envejecimiento de la población mundial y al aumento en la incidencia de caídas en estos individuos2. El hueso es un tejido conectivo con alta actividad metabólica que se encuentra bajo un proceso constante de renovación. La osteoporosis se produce por un desequilibrio entre la formación y la reabsorción del hueso, responsabilidad de los osteoblastos y osteoclastos, respectivamente3. Paradójicamente, los pacientes con osteoporosis muestran con frecuencia calcificaciones vasculares4.
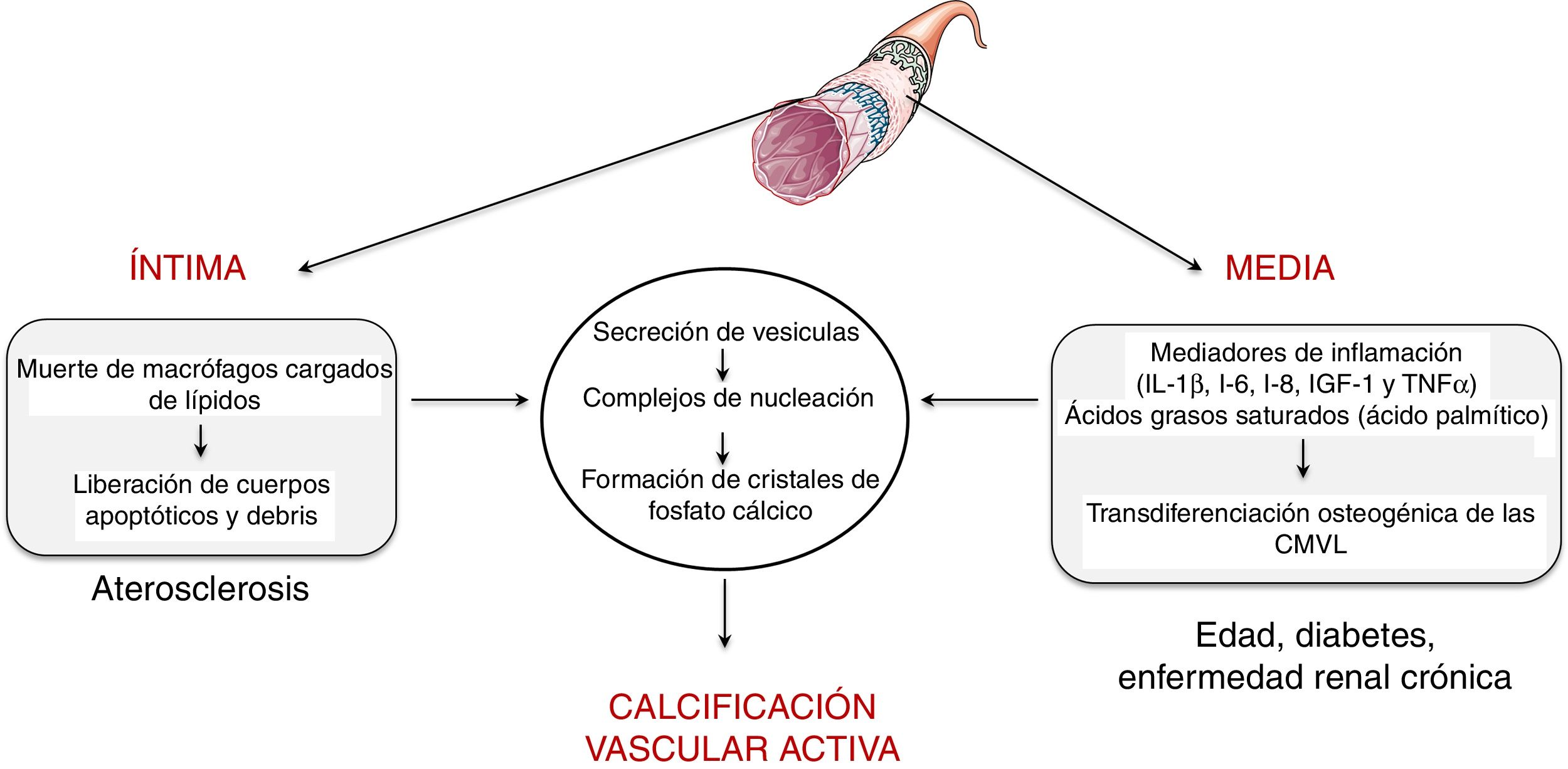
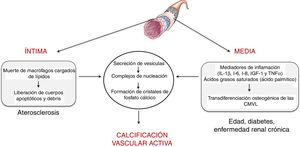
Calcificación vascularTipos y mecanismosLa calcificación vascular fue descrita por primera vez por el patólogo Rudolph Virchow en 1863, el cual la describió como un proceso parecido al de osificación5. De hecho, la calcificación vascular comparte una serie de características histopatológicas, composición mineral y de mecanismos de iniciación y desarrollo que caracterizan la formación del hueso. Se han descrito dos procesos capaces de inducir calcificación vascular, uno pasivo y otro activo. La calcificación pasiva es un proceso independiente de la actividad celular y resulta de la deposición de iones de calcio y fosfato sobre la elastina y las fibrillas de colágeno que componen el vaso debido a la afinidad de carga6. Concretamente, los iones de calcio tienen afinidad espontánea por los sitios de unión a la elastina y el colágeno. Estas estructuras, que inicialmente tienen una carga neutra, se cargan positivamente y atraen iones de fosfato y carbonato con carga negativa, lo que inicia el proceso de mineralización. Este fenómeno conduce a la formación de cristales de hidroxiapatita y la consiguiente calcificación de la matriz extracelular de manera amorfa. Por el contrario, la calcificación activa depende de la actividad celular, en donde la inflamación crónica juega un papel primordial7. De hecho, la relación causal entre inflamación vascular y calcificación se ha demostrado clínicamente8. Concretamente, se ha observado mediante tomografía por emisión de positrones, que la inflamación vascular precede a la calcificación vascular8. La calcificación activa puede desencadenarse tanto en la capa íntima como en la media de la pared vascular (fig. 1). Mientras que la calcificación intimal está asociada al desarrollo de la aterosclerosis, la calcificación de la media está asociada a la edad, a la diabetes y a la enfermedad renal crónica6.
La calcificación intimal viene determinada en gran medida por la respuesta inflamatoria que gobierna el desarrollo de la enfermedad aterosclerótica. Brevemente, el desarrollo del proceso aterogénico se inicia por la retención de las lipoproteínas de baja densidad (low density lipoproteins [LDL]) en la matriz extracelular subendotelial9. Estas lipoproteínas retenidas experimentan modificaciones (mayoritariamente asociadas a la oxidación) y son capaces de activar al endotelio vascular induciendo la expresión de moléculas de adhesión, citoquinas y factores de crecimiento que inician el reclutamiento de células proinflamatorias. Los monocitos atraídos se internalizan en la íntima vascular, donde se diferencian en macrófagos y son capaces de fagocitar y acumular el colesterol de las lipoproteínas oxidadas convirtiéndose en células espumosas10. Cuando la capacidad fagocítica de las células espumosas se ve superada por la cantidad de colesterol se desencadena su muerte celular, con la consiguiente liberación de cuerpos apoptóticos y restos necróticos, que sirven como centros de nucleación para la formación de cristales de fosfato de calcio.
En cuanto a la calcificación en la capa media, se cree que viene determinada en gran medida por la presencia y la actividad de mediadores inflamatorios. Diversos estudios han establecido que las citoquinas inflamatorias —interleuquina (IL)-1β, IL-6, IL-8—, el factor de crecimiento insulínico tipo-1 y el factor de necrosis tumoral (TNF)-α son capaces de inducir in vitro la diferenciación osteogénica de células musculares lisas vasculares (vascular smooth muscle cells [VSMC]). De este modo, la presencia de un ambiente inflamatorio puede desencadenar una transformación osteogénica de las VSMC. De la misma manera, también se ha descrito que los ácidos grasos saturados proinflamatorios, como el ácido palmítico, son capaces de inducir directamente la transdiferenciación de las VSMC hacia un fenotipo osteoblástico. Al igual que sucede en la formación del hueso, tanto los macrófagos/células espumosas en estado apopótico presentes en la placa aterosclerótica como las células vasculares osteogénicas tienen la capacidad de liberar vesículas calcificantes y contribuyen así a las etapas iniciales de la calcificación intimal y medial, respectivamente. Específicamente, se ha sugerido que liberan vesículas que contienen lípidos (fosfocolina y fosfoetanolamina), proteínas (anexinas) y componentes iónicos (Ca2+ y fosfato inorgánico) necesarios para formar estructuras ancladas a la membrana que son el punto de partida para la formación de minerales de fosfato de calcio, un proceso conocido como nucleación (para más detalles, véase Krohn et al.11).
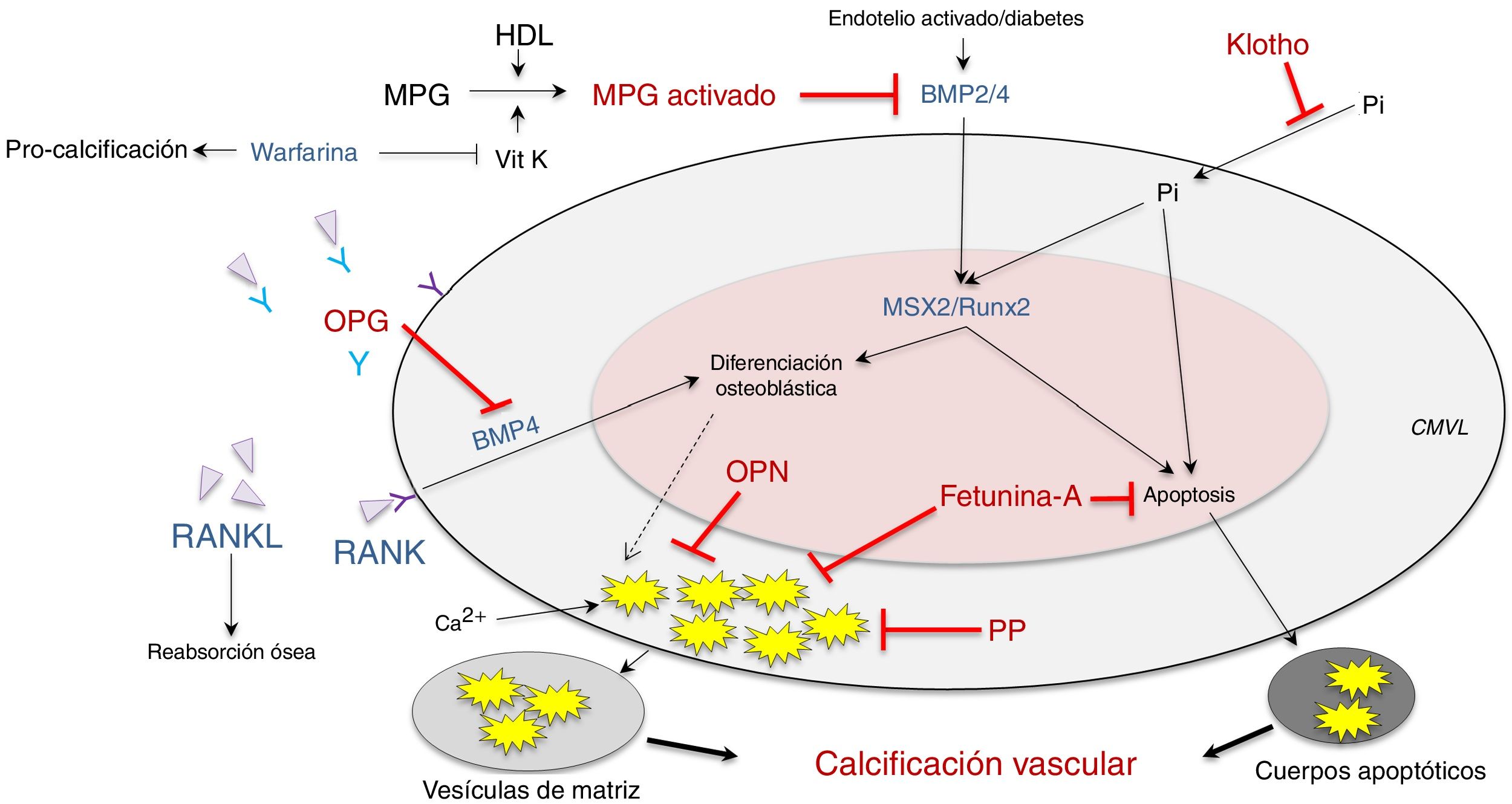
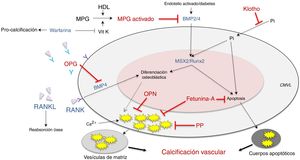
También se ha postulado que la calcificación vascular ocurre cuando existe una mayor actividad en los inductores de la calcificación —receptor activador de factor nuclear κB/ligando del receptor activador del factor nuclear κB/osteoprotegerina (RANK/RANKL/OPG), la proteína morfogenética ósea (BMP)2/4 y los factores de transcripción (factor de transcripción relacionado con runt [RUNX-2] y de la proteína homeobox [MSX2])—, así como alteraciones en sus inhibidores —proteína acida γ-carboxiglutámico (MGP), pirofosfato, fetuina-A, osteopontina (OPN), Klotho y osteoprotegerina—, los cuales se expresan de manera constitutiva tanto en el tejido como a nivel circulante (fig. 2; modificada de Nakahara et al.12).
Inhibidores (rojo) e inductores (azul) de calcificación vascular a nivel de las células musculares vasculares lisas.BMP: proteína morfogenética ósea 2/4; CMVL: células musculares vasculares lisas; HDL: lipoproteínas de alta densidad; MGP: proteína de matriz del ácido g-carboxiglutámico; MPG: activador del receptor para el ligando del factor nuclear κB (RANKL); MSX2: factor de transcripción relacionado con la proteína homeobox; OPG: osteoprotegerina; OPN: osteopontina; PP: pirofosfato; RUNX-2: factor de transcripción relacionado con runt; VitK: vitamina K.
En 1964, un estudio pionero publicado en Lancet13 describió que la calcificación de la arteria coronaria aumenta con el envejecimiento en igual grado en hombres como en mujeres, y que su prevalencia está incrementada en presencia de enfermedad isquémica coronaria. Concretamente, el estudio evidenció que en personas mayores de 65años la presencia de calcificación en la arteria coronaria (coronary artery calcium [CAC]) se detectaba en el 60% de sujetos sanos y alrededor del 95% en pacientes con cardiopatía isquémica. Este estudio también destacó que la incidencia de calcificación por debajo de los 65años era menor en las mujeres que en los hombres13.
Hasta la fecha, muchos estudios han examinado la relación entre el CAC y los factores de riesgo cardiovasculares convencionales. Prácticamente todos los estudios coinciden con las observaciones publicadas en Lancet en 1964, donde la edad y el género masculino son factores predictivos clave. Así, las mujeres retrasan el desarrollo y la extensión del CAC en 10años. Sin embargo, los estudios no muestran un acuerdo consistente del impacto de los demás factores de riesgo cardiovascular sobre el desarrollo de calcificación coronaria. En este aspecto, Oei et al.14 reportaron que el 30% de los hombres y el 15% de las mujeres sin factores de riesgo cardiovascular presentaban una extensa calcificación coronaria, y por el contrario Silverman et al.15 observaron que alrededor del 35% de los sujetos con ≥3factores de riesgo tienen cero CAC. En conjunto, estas observaciones sugieren que la presencia de factores de riesgo cardiovascular en sí misma no es un indicador fiable de CAC, y viceversa. Sin embargo, los estudios sí han validado que la presencia de una alta carga de CAC, incluso entre individuos sin factores de riesgo cardiovascular, se asocia con una tasa de eventos clínicos elevada, mientras que la ausencia de CAC, incluso entre aquellos con muchos factores de riesgo cardiovascular, se asocia con una tasa de eventos baja14.
Características del calcio (volumen y densidad) sobre el riesgo de eventos cardiovascularesEn 2008, el estudio Multi-Ethnic Study of Atherosclerosis (MESA) analizó de manera prospectiva, en 6.722 participantes con edades entre 45 y 84años y composición multiétnica (39% blancos no hispanos, 12% chinoamericanos 28% afroamericanos y 22% hispanoamericanos), la influencia del volumen del CAC en el riesgo cardiovascular. Todos los participantes estaban libres de enfermedad cardiovascular basalmente y fueron seguidos durante 10años. Los datos del estudio evidenciaron una relación directa entre el volumen de CAC y el riesgo de sufrir enfermedad coronaria, y consolidó el CAC como un fuerte predictor de futuros eventos cardiovasculares16. En línea con estas observaciones, una metaanálisis de 30 estudios prospectivos de cohorte demostró en 2009 que la presencia de calcificación vascular se asociaba con un mayor riesgo de muerte cardiovascular, eventos coronarios e infarto cerebral, así como de mortalidad por cualquier causa17. Es más, un estudio reciente del MESA acaba de demostrar que el CAC también se asocia fuertemente y de manera gradual con un mayor riesgo de eventos cardiovasculares asociados a enfermedad aterosclerótica, independientemente de los factores de riesgo estándar, y de manera similar por edad y género18. Sin embargo, es importante remarcar que un subestudio del ensayo MESA realizado en 3.398 sujetos detectó que, a diferencia del volumen, la densidad de CAC se asociaba de manera inversa y significativa con un mayor riesgo de enfermedad coronaria y cardiovascular independientemente del volumen del CAC19. Estos hallazgos apoyan el concepto de que las calcificaciones más grandes y densas pueden estabilizar las placas ateroscleróticas20,21, mientras que las calcificaciones más pequeñas y dispersas parecen contribuir a la desestabilización de la placa22,23. De hecho, Krishnamoorthy et al.24 describieron que la calcificación irregular detectada por tomografía computarizada está probablemente asociada con la rotura de la placa. Por todo ello, parece más preciso recalcar que la morfología de la calcificación es la que determina directamente el riesgo cardiovascular asociado.
En cuanto al poder de la cuantificación del CAC en la estratificación del riesgo cardiovascular, las últimas recomendaciones clínicas de la ACC/AHA publicadas en 2013 para el uso de la cuantificación del CAC en pacientes asintomáticos se limita a los que presentan un riesgo estimado intermedio a fin de mejorar la evaluación del riesgo cardiovascular25. Sin embargo, lo califican con un nivel de recomendación relativamente bajo (IIb). Por otro lado, el estudio MESA publicado en 2016 concluyó que si en un paciente detectamos ausencia de calcio coronario (score calcio=0 en una tomografía computarizada coronaria) esto permite descartar la enfermedad coronaria con una probabilidad muy alta y reclasificar su riesgo cardiovascular a niveles más bajos26.
Osteoporosis y calcificación vascularDurante muchos años la coincidencia temporal entre la desmineralización del tejido óseo, característica de la osteoporosis, y la calcificación arterial que acompaña a la aterosclerosis se consideró casual al tratarse de dos enfermedades crónicas que aumentaban notablemente con la edad. Sin embargo, estudios epidemiológicos más recientes han evidenciado que existe una estrecha relación entre la pérdida de masa ósea y la calcificación vascular, que es independiente de la edad27. Diversos estudios en la década de 1990 pusieron de manifiesto una asociación entre la osteoporosis y la calificación vascular, particularmente entre las mujeres4. El estudio de Framingham mostró que las mujeres con mayor magnitud de pérdida ósea presentaban una progresión más grave de calcificación aórtica abdominal tras corregir por edad y otros factores etiopatológicos comunes28. Esta asociación no fue tan manifiesta en hombres, lo que evidenció el papel crucial de los estrógenos en la fisiopatología subyacente. Posteriormente se ha observado que esta asociación entre osteoporosis y calcificación vascular también se detecta a nivel coronario, carotídeo y periférico29,30. De hecho, estas dos condiciones comparten, además del envejecimiento, una multitud de factores de riesgo tales como la dislipidemia, la hipertensión, la diabetes tipo2, el tabaquismo, el consumo de alcohol, la actividad física y la menopausia4. Si bien el sobrepeso es considerado un factor de riesgo cardiovascular, en la osteoporosis los individuos con bajo peso presentan un mayor riesgo de fractura31. Cabe destacar que esta paradoja también se ha atribuido a una respuesta específica del tejido a los procesos de inflamación crónica32. Concretamente, como se ha comentado en las secciones anteriores, mientras que una respuesta inflamatoria permanente promueve la formación de hueso a nivel vascular33, por el contrario induce la descalcificación en los tejidos duros34.
Además de compartir factores de riesgo, más recientemente se han sugerido mecanismos fisiopatológicos en común en ambas entidades, entre los que destacaríamos el sistema intercelular proteico RANK/RANKL/OPG, así como la vía de señalización Wnt.
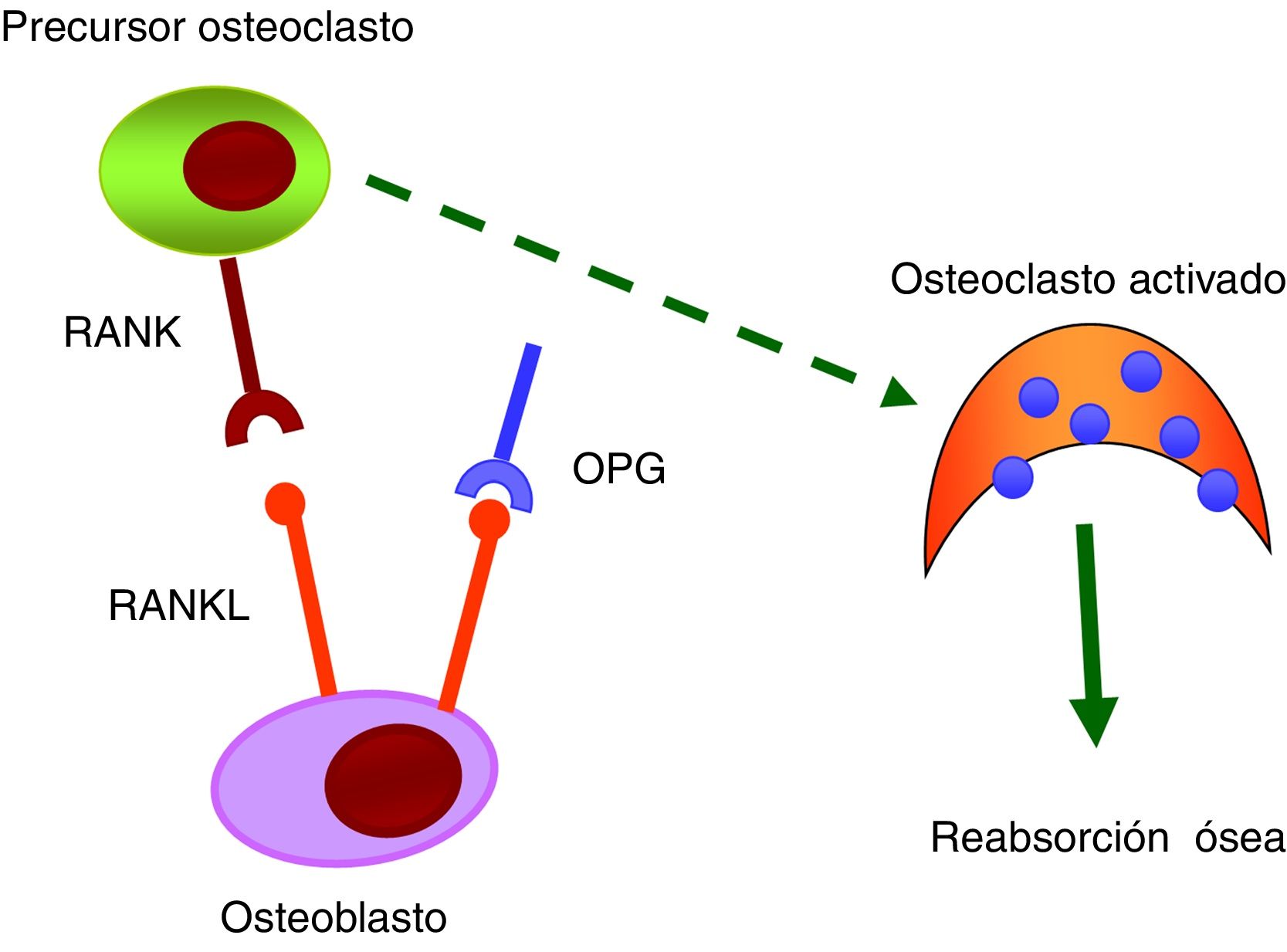
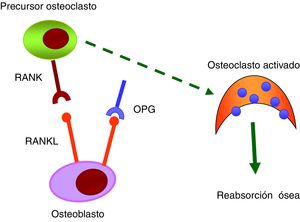
Sistema RANK/RANKL/OPGEl sistema RANK/RANKL/OPG es el encargado de la activación y diferenciación de las células óseas35. Todos sus componentes pertenecen a la familia de los TNF. El RANK es una proteína transmembrana que se expresa en la membrana de los osteoclastos, pero también en la superficie de linfocitosB yT, fibroblastos y células dendríticas. El RANKL es una proteína transmembrana expresada por osteoblastos y células mesenquimales. La unión del RANKL a su receptor natural RANK promueve la activación de la vía de señalización intracelular NF-κB y, como resultado, genera la diferenciación de los preosteoclastos en osteoclastos maduros, facilitando la reabsorción de hueso. La OPG, proteína secretada por los osteoblastos y las células estromales de la médula ósea, se considera con actividad protectora del tejido óseo al impedir la unión RANK/RANKL e inhibir la diferenciación de preosteoclastos a osteoclastos maduros (fig. 3).
Numerosas evidencias científicas relacionan el sistema RANK/RANKL/OPG con las calcificaciones vasculares36. En las primeras etapas del proceso de calcificación vascular las células del músculo liso vascular (CMLV) sufren un cambio de su fenotipo y empiezan a expresar marcadores osteogénicos que permitirían la mineralización de la matriz extracelular. Se ha observado que tanto la OPG como las proteínas RANKL y RANK están presentes en las placas ateroscleróticas y en la enfermedad valvular, y que su nivel de expresión varía en función del estadio de la enfermedad36,37. La OPG parece ser protectora contra la calcificación vascular. Estudios realizados en ratones knockout para osteoprotegerina (OPG−/−) han demostrado que desarrollaban calcificación arterial espontánea38,39. En otros estudios también se ha observado que el RANKL aumenta la calcificación de las CMLV al unirse al RANK. En definitiva, se sugiere que la unión RANK/RANKL puede ser importante para promover la calcificación vascular, mientras que la OPG la inhibe40.
Vía de señalización Wnt-β-cateninaLas vías de señalización Wnt juegan un papel importante en el desarrollo y el mantenimiento de muchos órganos y tejidos41, incluido el hueso. Sin embargo, el rol de las vías de señalización Wnt en la pared del vaso es aún poco conocido42.
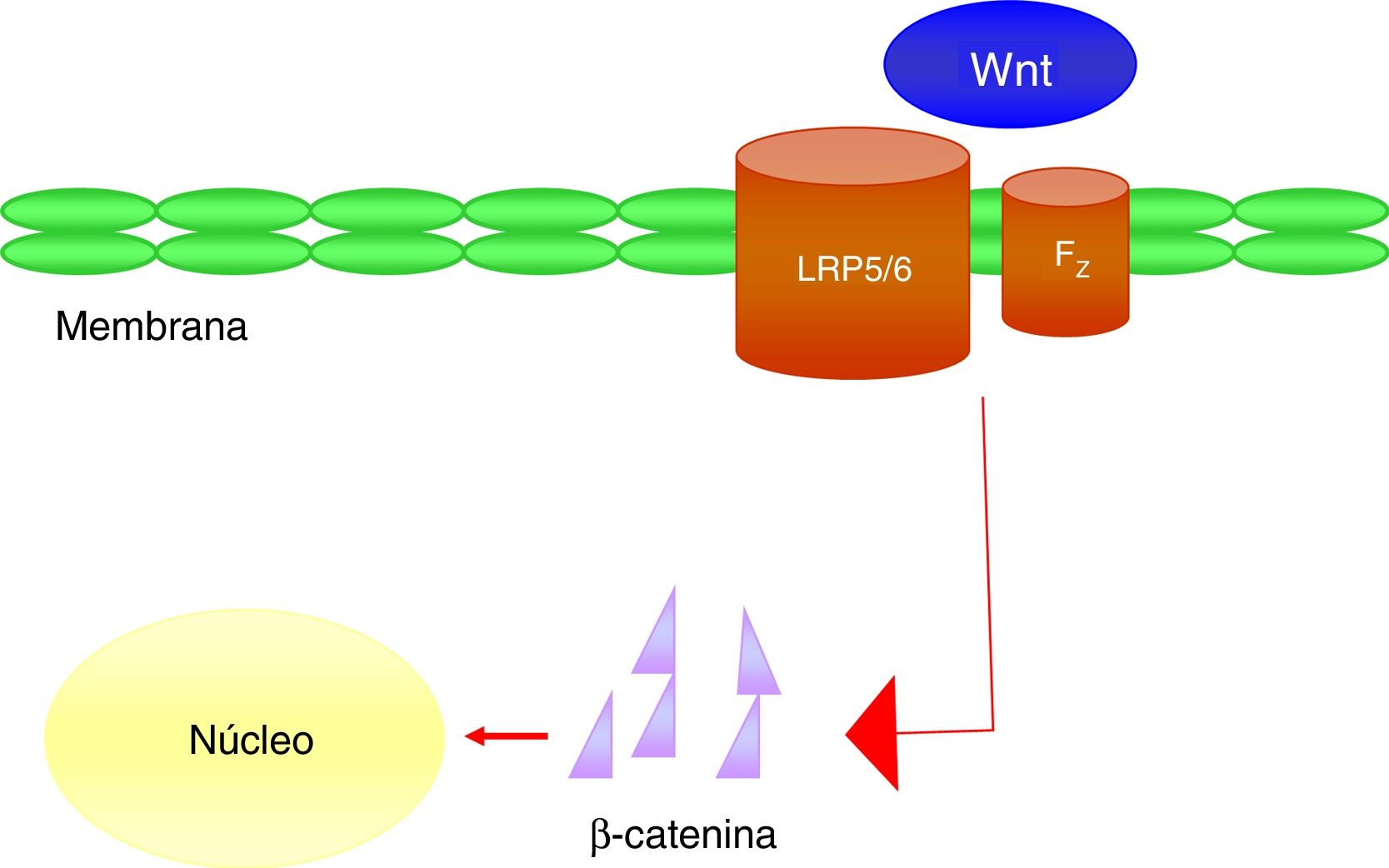
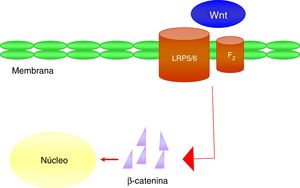
Se trata de un grupo de vías de transducción de señales formadas por proteínas que transfieren las señales del exterior de una célula a través de la superficie receptora de dicha célula hasta su interior. Las proteínas Wnt señalizan mediante varias vías para regular el crecimiento, la diferenciación, la función y la muerte celular. En particular, la ruta Wnt-β-catenina o canónica parece ser importante para la biología ósea, por ser crucial en la diferenciación de osteoblastos y la formación de hueso43. La actividad de la vía de señalización Wnt-β-catenina dependerá de la concentración citoplasmática de β-catenina y del funcionamiento adecuado del complejo co-receptor formado por una proteína relacionada con el receptor de LDL (LRP5/6) y un receptor frizzled (Fz), que implica la activación de mecanismos de transcripción génica en el núcleo mediados por β-catenina, y que a su vez regulará la expresión de genes relacionados con la diferenciación o la función del osteoblasto (fig. 4). La esclerostina y la proteína Dkk1 (Dickkopf-1) son los principales antagonistas de la vía Wnt al unirse a los receptores de membrana (fundamentalmente LRP-5 y -6) e inhibir la activación de dicha vía y, en consecuencia, la actividad osteoblástica.
A nivel vascular se ha observado en mujeres de edad avanzada que los niveles plasmáticos de Dkk1, inhibidor de la vía Wnt, se asocian inversamente con la presencia de calcificaciones arteriales44. Estos datos apoyan el concepto de que la señalización Wnt-β-catenina es un importante regulador del metabolismo mineral vascular. Debido a las similitudes entre la formación ósea y la calcificación, se considera que la inactivación de la vía de Wnt podría atenuar el proceso de la calcificación vascular.
Influencia del tratamiento de los factores de riesgo cardiovascular en el metabolismo óseoHipolipemiantesArtículos publicados recientemente sugieren que el uso de estatinas se asocia con un aumento de la densidad mineral ósea (DMO) y una reducción del riesgo de fractura, incluso tras ajustar por edad, sexo y comorbilidades45. Este efecto protector mejora de forma paralela con las dosis acumuladas de estatinas o con el tiempo de exposición y depende de la potencia de las mismas46. Las estatinas de alta potencia (atorvastatina y rosuvastatina) y de potencia moderada (simvastatina) son más efectivas para disminuir el nuevo desarrollo de osteoporosis; sin embargo, no se ha observado asociación entre la osteoporosis de inicio reciente y las estatinas de baja potencia (lovastatina, pravastatina y fluvastatina). Este efecto positivo de las estatinas sobre el hueso se atribuye en parte a su capacidad de inhibir la osteoclastogénesis, debido a que incrementan la expresión del ARNm de la OPG, que impide la unión RANK/RANKL, y así la diferenciación de preosteoclastos a osteoclastos maduros47. Los datos sobre los efectos óseos de los agonistas del receptor peroxisoma-proliferador-activadoα (peroxisome proliferator-activated receptor [PPARα]), incluido el fenofibrato, son muy limitados y contradictorios. En modelos animales se ha observado que disminuyen la expresión de osteocalcina en los osteoblastos, lo que afecta negativamente a la estructura y a la resistencia ósea48; pero también se ha sugerido que pueden prevenir la pérdida ósea, al disminuir la formación de osteoclastos en cultivos derivados de la médula de ratón49. En la actualidad no hay datos disponibles en la literatura respecto al efecto que ejercen los inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (proprotein convertase subtilisin/kexin type9 [PSCK9]) sobre el hueso.
HipoglucemiantesLos pacientes con diabetes tienen mayor riesgo de fracturas, no solo por disminuir la DMO, sino también por alterar la calidad del hueso, especialmente en diabetes mellitus tipo2 (DM2)50. Tanto la deficiencia de insulina como la hiperglucemia deterioran el hueso. Por tanto, sería de esperar que los fármacos que mejoran el control de la diabetes pudiesen prevenir los cambios en el tejido óseo, aunque esto no parece ser así con todos los fármacos.
Respecto a los antidiabéticos orales, se ha observado en algunos estudios un potencial efecto positivo de la metformina sobre el hueso, mostrando una reducción de hasta un 20% el riesgo de fractura51, a diferencia del estudio A Diabetes Outcome Progresion Trial (ADOPT), en el que no se demostró un efecto beneficioso de la metformina sobre el riesgo de fractura52. Sin embargo, los modelos in vitro sugieren que la metformina puede tener un efecto osteogénico directo al promover la diferenciación del linaje de osteoblastos de las células estromales multipotenciales derivadas de tejido adiposo, lo que favorece la formación de hueso53. El uso de sulfonilureas se considera neutral o mínimo para el hueso humano, al no haberse observado una clara correlación entre el uso de estos agentes y la incidencia de fracturas54. Se debe prestar especial atención al tratamiento de la diabetes con tiazolidinedionas o glitazonas, agonistas del PPARγ, particularmente en mujeres mayores, debido a que se ha demostrado en ensayos clínicos aleatorizados un aumento del riesgo de fractura con esta clase de fármacos55,56. Se considera que es un efecto de clase, y los factores de riesgo relacionados con el aumento de las fracturas en los usuarios de glitazonas son el sexo femenino, el aumento de la edad, las condiciones preexistentes (comorbilidades, el uso de glucocorticoides, el tabaquismo y el historial de fracturas previas) y la duración del tratamiento57. Los agonistas PPARγ favorecen la diferenciación de la célula madre mesenquimal hacia el adipocito en detrimento de la osteoblastogénesis49. Además, se ha descrito que estimulan la producción de RANKL, hecho que favorece la osteoclastogénesis58. En relación con las incretinas y los inhibidores de la dipeptidil peptidasa-4 (dipeptidyl peptidase-4 [DPP-4]), en un metaanálisis sobre ensayos clínicos aleatorizados se observó que las incretinas no modificaban el riesgo de fractura ósea en pacientes con DM259, mientras que los DPP-4 se cree que podrían tener un efecto positivo sobre el metabolismo óseo y podrían reducir el riesgo de fractura60, aunque estos resultados no se han confirmado en otro metaanálisis posterior61. Si bien modelos in vitro y en animales han mostrado que inhiben la reabsorción ósea, a la vez que promueven la formación y la calidad del hueso57, se necesitan ensayos clínicos para aclarar si existen efectos similares y clínicamente relevantes en humanos. Respecto a los inhibidores del co-transportador de sodio-glucosa tipo2 (type 2 sodium-glucose cotransporter [SGTL2]), también conocidos como gliflozinas, los datos disponibles son controvertidos. Según un metaanálisis que incluía 38 ensayos clínicos aleatorizados, no se observaron diferencias en el riesgo de fracturas entre los pacientes tratados con SGTL2 (dapagliflozina, canagliflozina o empagliflozina) y los controles62. Sin embargo, en el estudio CANagliflozin cardioVascular Assessment Study (CANVAS) se observó un aumento del riesgo de fracturas con el tratamiento con canagliflozina63. El uso de insulina se ha asociado a un incremento de fracturas54,64, en parte atribuido a una mayor propensión a presentar episodios de hipoglucemia, y en consecuencia a un incremento en el riesgo de caídas65. También se ha observado en modelos animales que la alteración del flujo sanguíneo óseo estimulado por la insulina se asocia con cambios perjudiciales en la microarquitectura trabecular ósea y propiedades biomecánicas corticales en DM2. Esto sugiere que la disfunción vascular podría jugar un papel causal en la fragilidad ósea diabética66.
AntihipertensivosExisten datos en la literatura que confirman que los diuréticos tiazídicos tienen un efecto positivo en la densidad de la masa ósea y en la reducción del riesgo de fractura67. Tradicionalmente estos efectos se han atribuido al aumento de la reabsorción renal de calcio que se produce como consecuencia de la inhibición del co-transportador de cloruro de sodio sensible a la tiazida en el túbulo distal68. Posteriormente se ha observado en modelos animales que estimulan la producción de los marcadores de diferenciación de osteoblastos relacionados con el Runx2 y la OPN69. Los diuréticos de asa se han asociado con un efecto negativo sobre el tejido óseo70, mientras que la espironolactona parece tener el potencial de preservar la DMO en el contexto de hiperaldosteronismo primario o secundario. Respecto a los fármacos que bloquean el sistema renina-angiotensina, los inhibidores de la enzima convertidora de angiotensina (IECA) y los fármacos bloqueadores de receptores de angiotensinaII (ARA-II), se considera que ejercen un efecto beneficioso sobre el hueso, al observarse una discreta disminución en el riesgo de fractura71, sobre todo con los ARA-II72. Aun así, los estudios realizados hasta el momento son escasos y tienen limitaciones, por lo que no hay un consenso concluyente al respecto. Existen pocos estudios que evalúen el efecto de los betabloqueantes en el hueso. En modelos animales se ha demostrado que inhiben la reabsorción ósea al inhibir la osteoclastogénesis mediada por el RANKL73. Un reciente metaanálisis mostró una reducción del riesgo de fractura del 15% en los pacientes tratados con betabloqueantes, y los agentes cardioselectivos fueron los más efectivos74. Respecto a los bloqueadores de los canales de calcio, los datos disponibles hasta la actualidad no han mostrado ningún efecto considerable de estos fármacos sobre el metabolismo óseo75. No se dispone de datos respecto al efecto de los α-bloqueantes en el hueso, probablemente por ser los antihipertensivos menos utilizados. Sin embargo, se considera que indirectamente pueden aumentar el riesgo de fractura de fémur, debido a su efecto vasodilatador, que induce hipotensión arterial y, en consecuencia, aumenta el riesgo de caídas y fracturas.
Influencia de los tratamientos para la osteoporosis en las calcificaciones vasculares o riesgo cardiovascularSuplementos de calcioExiste controversia sobre el papel de los suplementos de calcio en las calcificaciones vasculares y en los procesos ateroscleróticos. Según datos obtenidos de la cohorte Framingham, la ingesta de calcio basal en la dieta y suplementos no parece aumentar ni disminuir la calcificación vascular después de 4años76. Sin embargo, en un estudio de cohorte longitudinal que incluía 61.433 mujeres con un seguimiento de 19años se observó una relación en forma de U con la ingesta total de calcio, de forma que la ingesta de calcio >1.400mg/día se asoció con una mayor mortalidad en general, incluida la de causa cardiovascular. Cabe subrayar que esta relación era más pronunciada con el uso de suplementos que con el calcio de la dieta77. La relación del consumo de calcio y el riesgo cardiovascular es complejo y parece depender de la dosis y de la fuente de ingesta de calcio. Aun así, por la evidencia disponible se considera que la dosis recomendada de 1.000-1.200mg/día no parece perjudicial a nivel cardiovascular, especialmente si el aporte procede de la dieta78.
Moduladores selectivos de los receptores estrogénicosEl papel de los moduladores selectivos de los receptores estrogénicos (selective estrogen receptor modulator [SERM]) sobre las calcificaciones vasculares es desconocido. En modelos in vitro se ha observado que el estradiol y el raloxifeno afectan la secreción de OPG de las células endoteliales, lo que puede sugerir un papel modificador en la patogénesis de la calcificación vascular en mujeres posmenopáusicas20,21,79.
Fármacos antirresortivosLos bifosfonatos parecen tener el potencial de reducir la progresión de las calcificaciones vasculares, dependiendo del tipo, la potencia, la dosificación y la vía de administración. Este efecto es más modesto con los bifosfonatos nitrogenados o aminados administrados por vía oral80. El denosumab, anticuerpo monoclonal que actúa como un inhibidor del ligando RANK (RANKL), no ha demostrado tener efecto sobre la progresión de la calcificación aórtica ni en la incidencia de eventos cardiovasculares respecto a placebo81.
Fármacos osteoformadoresApenas existen datos en la literatura en relación a la teriparatida (análogo de la hormona paratiroidea humana) y las calcificaciones vasculares. En modelos animales se ha observado que la teriparatida no afectó al contenido de calcio de los depósitos cardiovasculares82.
ConclusionesLas evidencias disponibles señalan la interacción entre la pérdida de masa ósea y las calcificaciones vasculares. La naturaleza de esta relación es muy compleja y su importancia clínica aún no está clara. Ambos procesos comparten muchos de los factores de riesgo conocidos para la enfermedad cardiovascular, y se han sugerido mecanismos fisiopatológicos implicados en ambas entidades, entre los que destacaríamos el sistema RANKL/RANK/OPG y la vía de señalización de Wnt. De acuerdo con esta visión holística, los pacientes con osteoporosis podrían beneficiarse de una evaluación de su riesgo cardiovascular, así como los pacientes con enfermedad cardiovascular de una evaluación de su riesgo de fractura ósea. Los mecanismos vinculados en ambas entidades deben considerarse en las decisiones clínicas, dado que los tratamientos para la osteoporosis pueden tener efectos imprevistos en la calcificación arterial, y a la inversa. En particular se considera que las estatinas y las tiazidas pueden tener un efecto beneficioso sobre el hueso, así como los bifosfonatos sobre las calcificaciones arteriales. Por el contrario, se desaconseja el uso de los agonistas PPARγ (tiazolidinedionas o glitazonas), al demostrar en ensayos clínicos aleatorizados un aumento del riesgo de fractura, especialmente en mujeres de edad avanzada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.