Numerosos estudios han demostrado que las estatinas reducen la mortalidad cardiovascular. Si bien la mayor parte del efecto es probablemente debido a su acción hipolipemiante, se han descrito otras acciones de estos fármacos, independientes de la reducción del colesterol, que podrían contribuir a este efecto beneficioso. El objetivo del presente estudio fue evaluar el efecto del tratamiento con estatinas sobre la expresión de moléculas de adhesión, citocinas y receptores celulares de monocitos de sangre periférica, células estrechamente ligadas al desarrollo de la arteriosclerosis.
Pacientes y métodosSe seleccionó a 22 pacientes con hipercolesterolemia moderada (59% mujeres, edad media 51 años). Tras seguir durante 6 semanas una dieta baja en grasas, se aleatorizaron a recibir 40 mg/día de pravastatina o placebo durante 8 semanas, tras lo cual recibieron durante otras 8 semanas el tratamiento contrario.
ResultadosEl tratamiento con pravastatina redujo de manera significativa, respecto al período placebo, la concentración de colesterol total (22%; p<0,01) y el colesterol unido a lipoproteínas de baja densidad (30%; p<0,01). La expressión intracitoplasmática monocitaria del factor de necrosis tumoral alfa (TNFα) se redujo en un 17,3% (p=0,03). No se observaron modificaciones en la expresión de CD62L, CD162, CD11a, CD11b, CD49d, CD54, MCP-1 y CCR2.
ConclusiónEl tratamiento con pravastatina durante 8 semanas en pacientes con hipercolesterolemia moderada induce un descenso en la intensidad media de fluorescencia con la que los monocitos de sangre periférica expresan TNFα, sin modificar la expresión de otras moléculas de adhesión.
Numerous studies have shown that statins reduce cardiovascular mortality. While most of the effect is probably due to their lipid-lowering action, other actions of these drugs, independent of cholesterol reduction, have been described that could influence these beneficial action. The aim of this study was to evaluate the effect of statins on the expression of adhesion molecules, cytokines and receptors of peripheral blood monocytes, cells closely linked to development of atherosclerosis.
Patients and methodsWe selected 22 patients with moderate hypercholesterolemia (59% female, mean age 51 years). After 6 weeks of a low fat they were randomized to receive 40 mg of pravastatin or placebo for 8 weeks. After that period they received for another 8 weeks the other treatment.
ResultsTreatment with pravastatin significantly reduced the concentration of total cholesterol (22%; p<0.01) and LDL-cholesterol (30%; p<0.01). Monocytic intracytoplasmic expression of TNFα was reduced by 17.3% (p=0,03). Other cellular markers, CD62L, CD162, CD11a, CD11b, CD49d, CD54, MCP-1 and CCR2, did not change their expression.
ConclusionTreatment with pravastatin for 8 weeks in patients with moderate hypercholesterolemia induces a decline in the average intensity of fluorescence with which peripheral blood monocytes express TNFα without changing the expression of other adhesion molecules.
En numerosos ensayos clínicos se ha demostrado que el tratamiento con inhibidores de la hidroximetil glutaril CoA reductasa (estatinas) reduce la morbilidad y la mortalidad cardiovascular1. Si bien la mayoría del efecto es probablemente dependiente de su capacidad para reducir el colesterol, se ha indicado que estos fármacos podrían presentar otras acciones independientes de las hipolipemiantes, denominadas acciones pleiotrópicas2, que parcialmente podrían contribuir a su efecto beneficioso. La mayoría de estas teóricas acciones pleiotrópicas se han centrado en su acción en otras lipoproteínas, su capacidad antioxidante y antiinflamatoria y en su acción en la función endotelial3. Se ha prestado menos atención a su acción en las células mononucleares de sangre periférica (CMSP) las cuales están estrechamente relacionadas con el desarrollo de arteriosclerosis.
Las CMSP, tanto monocitos/macrófagos, como linfocitos, desempeñan un papel fundamental en los primeros estadios del proceso aterogénico, así como en fases más avanzadas de éste4. Su adhesión a la superficie endotelial y posterior internalización al espacio subendotelial constituyen pasos iniciales imprescindibles en la formación de la estría grasa, lesión inicial de la arteriosclerosis, constituida por macrófagos cargados de lípidos (células espumosas). La unión de las CMSP a la superficie endotelial, así como su paso posterior al espacio subendotelial, está condicionada por la interacción entre moléculas de adhesión presentes en la superficie celular y sus receptores específicos.
En una primera fase, los leucocitos se adhieren de forma ligera al endotelio vascular activado, para después iniciar el rolling o rodamiento de estos leucocitos sobre la pared. En esta fase participan los 3 tipos de moléculas de la familia de las selectinas: E-selectina y P-selectina, presentes en la célula endotelial, y L-selectina en el leucocito, que interaccionan con ligandos específicos de la superficie endotelial5. En una segunda etapa, propiciada por la menor velocidad y por la activación leucocitaria derivada de la acción de las citocinas liberadas por el endotelio activado, las uniones pasan a hacerse más fuertes. En estas uniones intervienen moléculas de la superfamilia de las inmunoglobulinas expresadas por las células endoteliales, como CD54, CD102 (ICAM-2) y VCAM-1, que interaccionan con receptores de la membrana leucocitaria pertenecientes a la familia de las β-integrinas, como CD11a, CD49d y CD11b6. Finalmente, en la tercera fase, tiene lugar la diapedesis o internalización del leucocito al espacio subendotelial. Este paso se encuentra propiciado por la unión del CD54 expresado en la superficie leucocitaria7 a sus ligandos de la matriz extracelular, como colágeno y laminina. Todo este proceso está mediado por la producción, tanto en el ámbito endotelial, como en el de células residentes y de leucocitos circulantes, de factores solubles8, como MCP-1, citocina quimiotáctica implicada en la selección de leucocitos al foco inflamatorio, y factor de necrosis tumoral α (TNFα), citocina proinflamatoria que estimula la expresión de moléculas de adhesión y quimiocinas.
El objetivo de este trabajo fue evaluar el efecto del tratamiento hipolipemiante con pravastatina en pacientes con hipercolesterolemia moderada, en la expresión de diversas moléculas de adhesión, receptores y citocinas en monocitos de sangre periférica.
Pacientes y métodosDiseño del estudioSe realizó un estudio de 16 semanas de duración, aleatorizado, controlado con placebo y con un diseño cruzado.
Selección de pacientesSe incluyó a 22 individuos de ambos sexos, con una edad comprendida entre los 18 y los 80 años, y con hipercolesterolemia definida por un colesterol unido a lipoproteínas de baja densidad (cLDL) superior a 190mg/dl tras 6 semanas de dieta hipolipemiante.
Se excluyó a los individuos con una enfermedad infecciosa o inflamatoria que pudiera alterar la actividad monocitaria, con cualquier enfermedad endocrinológica, hepática, digestiva o renal graves, así como los que presentaran cáncer o que tuvieran enfermedad coronaria, cerebrovascular o arterial periférica conocidas. También se excluyó a los individuos en tratamiento con fármacos que pudieran alterar el metabolismo lipídico o modificar la oxidación lipoproteica, incluidos suplementos vitamínicos, y aquéllos con un consumo de alcohol superior a 30g/día.
El Comité de ensayos clínicos del Hospital Carlos III ha aprobado el estudio, el cual ha cumplido las normas éticas de la Declaración de Helsinki de 1975, con la revisión de octubre de 2000. Todos los participantes firmaron un consentimiento informado.
Desarrollo del estudioAntes de empezar el estudio, se indicó a los participantes que durante las 6 semanas previas a su comienzo debían seguir una dieta baja en grasas saturadas y pobre en colesterol, de acuerdo con las recomendaciones dietéticas españolas9. Los pacientes que presentaron cifras de cLDL > 190mg/dl tras el período de dieta fueron aleatorizados a recibir durante 8 semanas 40mg de pravastatina en una única dosis nocturna o placebo. Una vez concluidas las primeras 8 semanas de tratamiento, se administró a los pacientes la medicación contraria durante otro período de igual duración, sin lavado entre ambos períodos.
Se obtuvieron muestras de sangre en ayunas de 12h al término de cada uno de los 2 períodos de tratamiento.
MétodosTodas las muestras se procesaron de forma ciega para el período de tratamiento.
La concentración de colesterol total, colesterol unido a lipoproteínas de alta densidad (cHDL) y triglicéridos se determinaron a partir del plasma mediante métodos enzimáticos colorimétricos en un autoanalizador CX4 Delta (Beckman, Fullerton, CA, Estados Unidos). La concentración de cLDL se calculó mediante la fórmula de Friedewald10.
La expresión monocitaria de CD62L, CD162, CD11a, CD11b, CD49d, CD54, MCP-1, CCR2 y TNFα se valoró mediante citometría de flujo. Se utilizó sangre entera en heparina de litio para evitar cambios fenotípicos inducidos por los procedimientos de aislamiento.
Para los marcajes de superficie e intracelular, se utilizaron anticuerpos monoclonales (AcMos) conjugados con fluorocromos. Para conocer la IMF con la que los monocitos expresaban los diferentes marcadores celulares, se utilizó un citómetro FACScan previamente calibrado con bolas estándares (Cali-BRITE) y equipado con un láser de argón que emite luz a una longitud de onda de 488nm y con 3 detectores de fluorescencia (FL1 para isotiocianato de fluoresceina [FITC], FL2 para ficoeritrina [PE] y FL3 para PerCP); todo ello fue suministrado por BD Biosciences (Erembodegen, Bélgica).
Se estudiaron 5 combinaciones de AcMos siguiendo el protocolo oficial del fabricante (BD Biosciences): CD11a conjugado con FITC, CD49d conjugado con PE y CD14 conjugado con PerCP; CD62L (FITC), CD54 (PE) y CD14 (PerCP); CD11b (FITC), CD162 (PE) y CD14 (PerCP); MCP-1 (FITC), TNF-α (PE) y CD14 (PerCP); CCR2 (PE) y CD14 (PerCP). Además se realizó un marcaje con los controles isotópicos siguientes: IgG1, IgG2a e IgG2b. Posteriormente, se adquirió la suspensión de células y se analizaron con el programa CellQuest. La citometría de flujo nos permitió llevar a cabo una selección específica y diferencial de la población monocitaria frente al resto de CMSP. Esta selección de monocitos se realizó de acuerdo a sus características de tamaño (FSC), granularidad (SSC) y alta expresión de CD14, marcador característico de esta población celular. Al menos se adquirieron 1.000 episodios. Tras la adquisición, se analizaron los datos representados en gráficos de puntos de 2 colores (FL1/FL2) para determinar la IMF de los diferentes marcadores y el porcentaje de células positivas para cada uno de ellos con el programa Cell-Quest.
El coeficiente de variabilidad interanálisis fue menor del 15% y el intraanálisis menor del 3% para todas los marcadores celulares en estudio.
La baja intensidad de fluorescencia de MCP-1, CCR2 y TNFα dificultó establecer el límite entre el marcaje positivo y el correspondiente control negativo. Para evitar la variabilidad en el análisis de las muestras al fijar manualmente el límite de positividad, se analizaron los datos de dichas moléculas con la corrección de Overton mediante el programa FCS Express V3 para Windows.
Estudio estadísticoEl tamaño muestral se calculó para un error alfa de 0,05 bilateral y un error beta de 0,02 (potencia de 0,8), con objeto de detectar un tamaño del efecto estandarizado de 0,1. El número de pacientes necesarios a incluir resultó ser igual a 20.
Las variables cuantitativas se expresan como media y desviación estándar y las cualitativas, como porcentaje.
Los cambios en los valores de las distintas variables cuantitativas contempladas en el estudio (lípidos y lipoproteínas, marcadores celulares), con y sin tratamiento hipolipemiante, se evaluaron mediante ANOVA para muestras repetidas, teniendo en consideración los factores período y tratamiento.
Se realizaron correlaciones entre los valores obtenidos, con y sin tratamiento para la concentración de colesterol total en plasma y la expresión monocitaria de las diferentes moléculas de adhesión, citocinas y receptores celulares evaluados, mediante el coeficiente de Pearson.
En todos los casos, se consideró que había diferencias estadísticamente significativas si la p resultante del análisis era menor de 0,05.
El análisis estadístico se llevó acabo usando el paquete estadístico SPSS versión 13.0 para Windows.
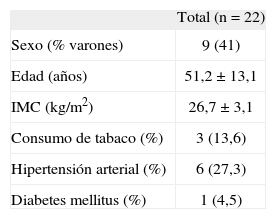
ResultadosEn la tabla 1 se presentan las características de la población incluida en el estudio, compuesta por 22 individuos. Todos los participantes finalizaron el estudio y no hubo efectos adversos con ningún tratamiento. No hubo modificaciones en el peso durante el período de estudio.
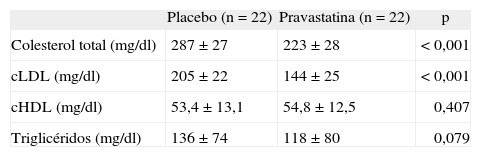
En la tabla 2 puede observarse la concentración de lípidos y lipoproteínas en cada período de tratamiento.
Resultados lipídicos al final del período con placebo y con pravastatina
| Placebo (n = 22) | Pravastatina (n = 22) | p | |
| Colesterol total (mg/dl) | 287 ± 27 | 223 ± 28 | < 0,001 |
| cLDL (mg/dl) | 205 ± 22 | 144 ± 25 | < 0,001 |
| cHDL (mg/dl) | 53,4 ± 13,1 | 54,8 ± 12,5 | 0,407 |
| Triglicéridos (mg/dl) | 136 ± 74 | 118 ± 80 | 0,079 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad.
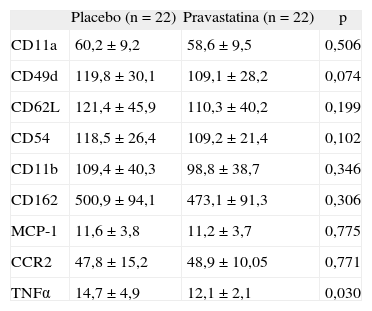
En la tabla 3 se indica la expresión de moléculas de adhesión, citocinas y receptores celulares al final de cada período de tratamiento. Hubo una expresión menor de TNFα y CD49d, esta última no significativa, al final del período de tratamiento con pravastatina.
Intensidad media de fluorescencia (IMF) de moléculas de adhesión, citocinas y receptores monocitarios al final del período con placebo y con pravastatina
| Placebo (n = 22) | Pravastatina (n = 22) | p | |
| CD11a | 60,2 ± 9,2 | 58,6 ± 9,5 | 0,506 |
| CD49d | 119,8 ± 30,1 | 109,1 ± 28,2 | 0,074 |
| CD62L | 121,4 ± 45,9 | 110,3 ± 40,2 | 0,199 |
| CD54 | 118,5 ± 26,4 | 109,2 ± 21,4 | 0,102 |
| CD11b | 109,4 ± 40,3 | 98,8 ± 38,7 | 0,346 |
| CD162 | 500,9 ± 94,1 | 473,1 ± 91,3 | 0,306 |
| MCP-1 | 11,6 ± 3,8 | 11,2 ± 3,7 | 0,775 |
| CCR2 | 47,8 ± 15,2 | 48,9 ± 10,05 | 0,771 |
| TNFα | 14,7 ± 4,9 | 12,1 ± 2,1 | 0,030 |
La IMF se expresa en unidades arbitrarias.
TNFα: factor de necrosis tumoral alfa.
No se observó ninguna correlación entre la concentración del colesterol, total o en fracciones, y la IMF con la que los monocitos expresaron los distintos marcadores celulares evaluados, ni de forma basal, ni al comparar el porcentaje de cambio con el tratamiento respecto al período con placebo (datos no mostrados). Tampoco se observó ninguna relación entre las modificaciones de las moléculas de adhesión con el tratamiento y el sexo, el tabaquismo o el IMC (resultados no mostrados).
DiscusiónNuestros datos demuestran que el tratamiento durante 8 semanas con pravastatina reduce la expresión de TNFα en monocitos procedentes de pacientes con hipercolesterolemia moderada, pero no modifica significativamente otras moléculas de adhesión, receptores celulares, ni citocinas implicados en el proceso aterogénico.
Las CMSP desempeñan un papel importante en la aterogenia4. La importancia de las moléculas de adhesión en el proceso aterogénico se ha demostrado en diferentes estudios en los que se ha observado que la utilización de anticuerpos frente a una o varias de ellas11, así como la creación de animales defectivos para uno o varios de los genes que expresan estas moléculas12, genera una reducción de la adhesión leucocitaria en modelos de inflamación y reduce la progresión de la arteriosclerosis. Se ha demostrado que la presencia de diversos factores de riesgo13–15, entre ellos la hipercolesterolemia16,17, se asocia con la activación de CMSP. En este mismo sentido, los pacientes con arteriosclerosis tienen una activación mayor de estas células, indicado por una mayor expresión de CD11a y CD5418 y unos valores solubles incrementados de MCP-119.
En diversos estudios se ha evaluado el efecto del tratamiento hipolipemiante en la expresión de diversas moléculas de adhesión con resultados contradictorios. La mayoría de los estudios han demostrado que las estatinas reducen la activación celular, con descenso en la expresión de CD54, CD11a20 y CD11b21, tanto in vitro, como ex vivo, lo cual se acompaña de una adhesión celular menor al endotelio20. También se ha observado un descenso en los valores solubles de CD54 y E-selectina con este tratamiento22. Por el contrario, otros autores no han observado cambios ni en la expresión23, ni en los valores solubles24 de las moléculas de adhesión estudiadas, o han observado un aumento en la actividad celular con incremento en la expresión de CD11a y CD11b25.
Nuestro estudio ha demostrado que el tratamiento con pravastatina reduce la expresión intracitoplásmica de TNFα. En estudios previos se ha demostrado que las estatinas reducen su expresión linfocitaria26, en monocitos activados ex vivo con lipopolisacárido27 y en plasma24. El TNFα desempeña un papel importante en el proceso aterogénico al regular el tráfico leucocitario hacia el foco inflamatorio28 y estimular la activación de las CMSP, lo que favorece su adhesión firme al endotelio y su posterior paso al espacio subendotelial. Una vez en el interior de la pared arterial, los monocitos diferenciados a macrófagos secretan TNFα29, el cual favorece la expresión endotelial de distintas moléculas de adhesión y quimiocinas que aumentan la selección de nuevas CMSP hacia el foco inflamatorio28. Los linfocitos del espacio subendotelial también secretan TNFα, lo cual amplifica la respuesta inflamatoria al promover la activación del macrófago. En diversas enfermedades inflamatorias agudas y crónicas30 se han observado unos valores incrementados de TNFα que se acompañan de una activación mayor de las CMSP. Algunas enfermedades inflamatorias, como es el caso de la artritis reumatoide, se asocian a un riesgo mayor de morbilidad y mortalidad cardiovascular, que se reduce con la utilización de fármacos modificadores biológicos de la enfermedad, en particular el agente anti-TNFα31. Además, se han observado valores elevados de TNFα en pacientes con dislipemia32 y otros factores de riesgo cardiovascular14,33,34, así como en pacientes con enfermedad coronaria35.
Aunque no hemos encontrado una correlación entre el descenso de TNFα y la reducción de la concentración de colesterol, nuestros datos no permiten descartar esta posibilidad, si bien numerosos estudios han demostrado que las estatinas presentan acciones pleiotrópicas, independientes del descenso del colesterol2.
Nuestro estudio tiene algunas limitaciones. El número de pacientes incluido se calculó teniendo en cuenta una desviación estándar menor en las muestras evaluadas, lo que, dada la gran variabilidad en la expresión de estas moléculas en los diferentes individuos del estudio, podría hacer que el descenso obtenido en todas las moléculas no fuera significativo.
En conclusión, los pacientes hipercolesterolémicos tratados con pravastatina durante 8 semanas presentan un descenso significativo en la expresión de la citocina proinflamatoria TNFα, cuando se compara con placebo. La reducción de TNFα podría ser un mecanismo más a través del cual esta estatina reduce el riesgo de complicaciones vasculares.
Nuestro más profundo agradecimiento a todas las personas que de manera voluntaria participaron en el estudio, así como a Luisa Elez y Paloma Gordo por su asistencia técnica.
Este estudio ha sido parcialmente financiado por una beca FIS n.° PI031211 y por una beca de la Sociedad Española de Arteriosclerosis.