Fatty acid-binding protein 4 (FABP4) es una adipocina secretada por el tejido adiposo implicada en la regulación del metabolismo energético y la inflamación. FABP4 circulante se asocia con obesidad, dislipidemia aterogénica y síndrome metabólico. Estudios recientes muestran una asociación entre FABP4 circulante y disfunción endotelial, aunque se desconoce cómo se produce esta. El objetivo de este trabajo es estudiar la interacción entre FABP4 con las proteínas de la membrana citoplasmática en células endoteliales.
MetodologíaSe incubaron células HUVEC con y sin FABP4 (100ng/ml) durante 5min. La inmunolocalización de FABP4 se estudió mediante microscopia confocal. Para estudiar las interacciones de FABP4 con las proteínas de membrana de las células HUVEC se diseñó una estrategia que combina incubaciones con o sin 6XHistidine-tag FABP4 (FABP4-His) (100ng/ml), cross-linking con formaldehído, extracción de proteínas de membrana y western blot.
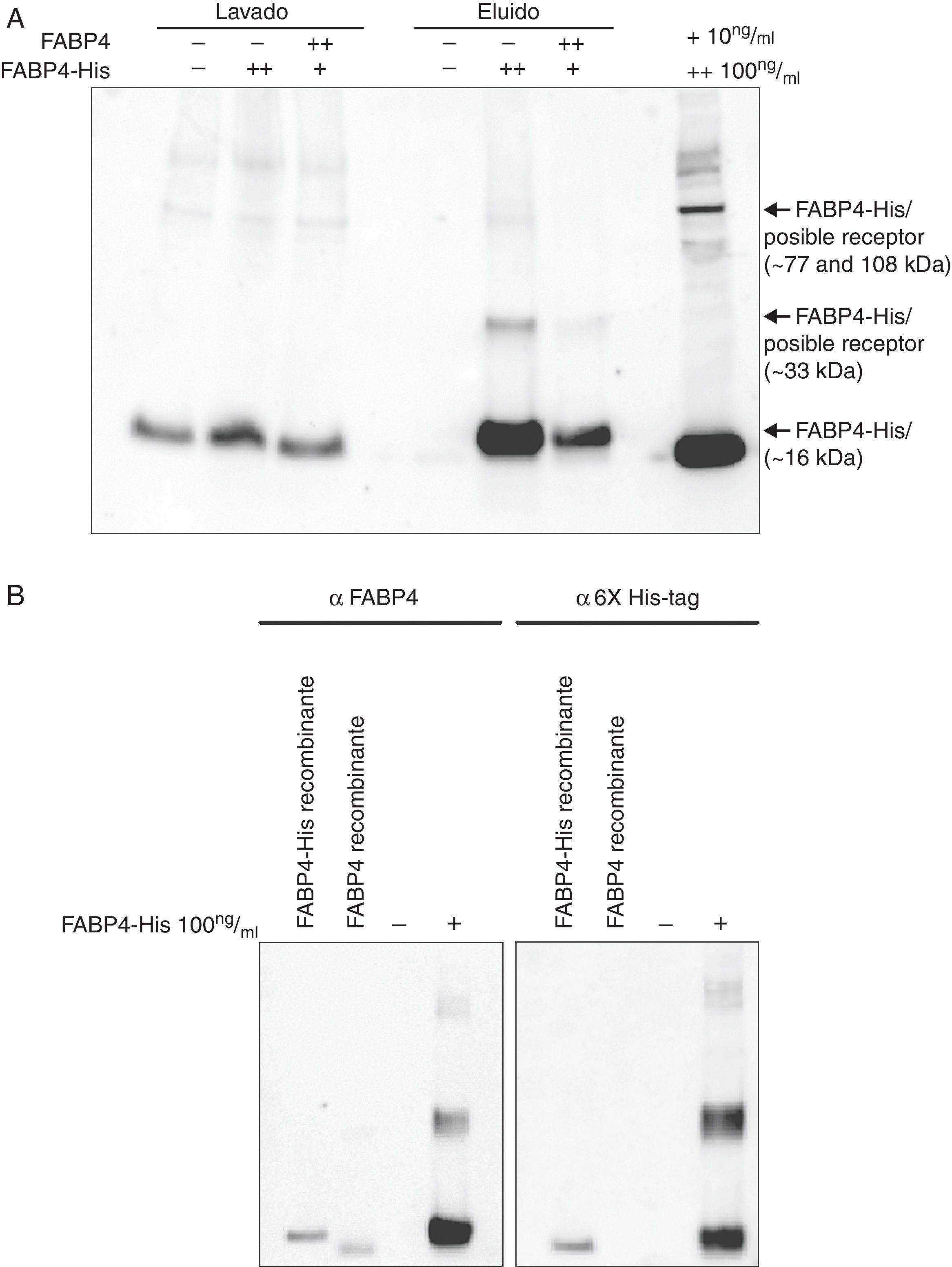
ResultadosLos resultados muestran que FABP4 colocaliza con CD31, una proteína utilizada como marcador de membrana citoplasmática. Además se observan diferentes patrones de western blot en función de la incubación con o sin FABP4-His. El inmunoblot revela la existencia de 3 complejos proteicos de aproximadamente 108, 77 y 33kDa formados por FABP4 exógena y su posible receptor/es.
DiscusiónLos resultados obtenidos apoyan la existencia de un complejo proteico capaz de unir FABP4 a las células endoteliales mediante una unión específica. Además, nos permiten avanzar en el conocimiento de los efectos moleculares de FABP4 y, en caso de confirmarse, podrían utilizarse como diana terapéutica para prevenir enfermedades cardiovasculares.
Fatty acid binding protein (FABP4) is an adipose tissue-secreted adipokine implicated in the regulation of the energetic metabolism and inflammation. High levels of circulating FABP4 have been described in people with obesity, atherogenic dyslipidemia, diabetes and metabolic syndrome. Recent studies have demonstrated that FABP4 could have a direct effect on peripheral tissues and, specifically, on vascular function. It is still unknown how the interaction between FABP4 and the endothelial cells is produced to prompt these effects on vascular function. The objective of this work is studying the interaction between FABP4 and the plasma membrane proteins of endothelial cells.
MethodologyHUVEC cells were incubated with and without FABP4 (100ng/ml) for 5minutes. Immunolocalization of FABP4 was studied by confocal microscopy. The results showed that FABP4 colocalizates with CD31, a membrane protein marker.
A strategy which combines 6XHistidine-tag FABP4 (FABP4-His), incubations with or without FABP4-His (100ng/ml), formaldehyde cross-linking, cellular membrane protein extraction and western blot, was designed to study the FABP4 interactions with membrane proteins of HUVECs.
ResultsThe results showed different western blot profiles depending of the incubation with or without FABP4-His. The immunoblot revelead three covalent protein complexes of about 108, 77 and 33kDa containing FAPB4 and its putative receptor.
DiscussionThe existence of a specific binding protein complex able to bind FABP4 to endothelial cells is supported by these results. The obtained results will permit us advance in the molecular knowledge of FABP4 effects as well as use this protein and its receptor as therapeutic target to prevent cardiovascular.
La fatty acid-binding protein 4 (FABP4; adipocyte-FABP; aP2) es un miembro de la familia de proteínas intracelulares que se unen a ácidos grasos (FABP)1. Las FABP pertenecen a una familia multigénica con al menos 9 tipos distintos de proteínas que codifican para proteínas de ∼15kDa formadas por 126-134 aminoácidos, y que tienen una expresión específica de tejido1,2.
La estructura génica de la familia de las FABP está altamente conservada entre los miembros estudiados. Además, esta conservación también se mantiene con otros miembros de la familia multigénica de proteínas que se unen a lípidos. Las FABP se expresan abundantemente (1-5% proteínas citosólicas) en células involucradas activamente en el metabolismo lipídico. Los miembros de esta familia presentan un patrón de expresión tejido-específica y se nombran según el tejido en el que fueron identificados por primera vez3.
Las FABP son capaces de unir una gran variedad de ligandos hidrofóbicos, como por ejemplo ácidos grasos de cadena larga, eicosanoides, leucotrienos y prostaglandinas4-6. Sin embargo, la secuencia divergente entre los miembros de esta familia confiere a las proteínas pequeñas diferencias en cuanto a las propiedades de unión a ligandos y también define diferentes patrones de interacción proteína-proteína dependiendo del contexto celular. Se ha visto que las FABP adipocitaria, epitelial y cardiaca interaccionan con la lipasa sensible a hormonas, mientras que la intestinal y la hepática no interaccionan con ella3,7. Se sabe también que la FABP4 interacciona con JAK2 de una manera ácido graso-dependiente, estableciendo un nuevo rol para FABP4 como sensor de ácidos grasos y afectando al metabolismo celular mediante interacciones proteína-proteína8.
La FABP4 se expresa predominantemente en el tejido adiposo y en macrófagos, y juega un papel importante en el metabolismo lipídico e inflamación de ambos tipos celulares8. En adipocitos, la FABP4 interacciona con PTEN, lo que sugiere un nuevo papel para esta fosfatasa en la regulación del metabolismo lipídico y en la diferenciación adipocitaria9. En macrófagos, participa en la regulación de la actividad inflamatoria y del tráfico de colesterol vía NF-κB y peroxisome proliferator-activated receptor (PPAR)-γ, interacción que podría ser responsable de efectos opuestos en la supervivencia y la proliferación en células endoteliales10.
Los niveles de FABP4 circulantes están aumentados en la obesidad, el síndrome metabólico (SM)11, la diabetes mellitus tipo2 (DM2) y la hiperlipidemia familiar combinada o síndromes lipodistróficos, y se correlacionan con lípidos y resistencia a la insulina12-18. Los niveles de FABP4 en suero predicen el riesgo de desarrollar SM, DM2 y enfermedad aterosclerótica17,19-21. La FABP4 también tiene un efecto directo en la disminución de la contractilidad de las células musculares de miocardio, lo cual sugiere que la liberación de FABP4 al torrente circulatorio podría tener un efecto directo sobre algunas células y tejidos periféricos22. Las FABP4 en lesiones ateroscleróticas están asociadas con un fenotipo de placas inestables23,24.
Un estudio reciente de nuestro grupo ha demostrado que los niveles de FABP4 circulante están inversamente asociados con la hiperemia reactiva periférica, un marcador de disfunción endotelial25. En este sentido, resultados de nuestro grupo muestran que la FABP4 exógena disminuye la expresión y la activación de eNOS26. La FABP4 tiene un efecto directo sobre la migración y la proliferación de células humanas musculares de arteria coronaria lisa a través de la activación de MAPK y los factores de transcripción c-jun y c-myc27.
Por todo ello, el objetivo de este trabajo es estudiar la interacción de FABP4 exógena con proteínas de membrana de células endoteliales.
Material y métodosReactivosLas células utilizadas en este estudio fueron Human umbilical vein endothelial cells (HUVEC) (GIBCO, Oregon, OR, EE.UU.) en pase 3 (C-015-5C). Las células se sembraron en medio M-200 (Cascade Biologics, New York, NY, EE.UU.) suplementado con 2% Low Serum Growth Supplement (LSGS) (Cascade Biologics) y con 1% Gentamicin/Amphotericin solution (Cascade Biologics) en placas de cultivo y/o portas con cámaras individuales (Nunc, Roskilde, Dinamarca). La FABP4 recombinante humana era de BioVendor (Heidelberg, Alemania) y 6XHistidine-tag FABP4 recombinante humana era de Enzo Life Sciences (San Diego, CA, EE.UU.). El anticuerpo anti-FABP4 era de R&D System (Minneapolis, MN, EE.UU.), el anticuerpo anti-6X His-tag era de Abcam (Cambridge, MA, EE.UU.), y los anticuerpos anti- CD31, anti-mouse, anti-rabbit y anti-goat eran de DAKO (Glostrup, Dinamarca). Los anticuerpos marcados con fluorescencia, Alexa Fluor*488 anti-goat y Alexa Fluor*532 anti-mouse, eran de Invitrogen (Carlsbad, CA, EE.UU.). Dulbecco's phosphate-buffered saline (DPBS) era de GIBCO® (14190-169). Paraformadehído era de Sigma (St. Louis, MO, EE.UU.) (P6148-500G) y Mowiol era de Calbiochem (San Diego, CA, EE.UU.) (475904). Las pastillas anti-proteasas sin EDTA (Complete ULTRA Tablets, Mini EDTA-Free EASYpac) eran de Roche (Indianapolis, IN, EE.UU.). El kit FABP4 Inhibitor/Ligand Screening Assay Kit era de Cayman Chemical Company (Ann Harbor, MI, EE.UU.), y el kit HisPurTM Cobalt Purification Kit era de Pierce (Rockford, IL, EE.UU.).
Cultivos celulares y reactivosLas células HUVEC crecieron con medio 2% LSGS durante 15min y se incubaron con y sin FABP4 (100ng/ml) a diferentes tiempos. Tras la incubación en placas de Petri de 10cm se procedió a la extracción de proteínas de membrana. Se eliminó el medio de cultivo y las células se lavaron con DPBS, seguidamente se añadió el tampón de extracción (50mM Tris-HCl pH=7,4, 150mM NaCl, 2mM Ca2+, 1% TX100, 1% NP40, antiproteasas)28. Se recogieron las células en un tubo, se rompieron pasándolas a través de una aguja (5/8in) y se incubaron 10min en hielo. Finalmente se centrifugan a 14.000xg durante 10min y se recupera el sobrenadante.
InmunoblotLa concentración total de proteína se cuantificó con el método Bradford (Bio-Rad). La electroforesis y el inmunoblot se realizaron utilizando el sistema de análisis NuPAGE (Invitrogen Life Technologies, Reino Unido). Las membranas fueron bloqueadas con reactivo ECL Advance Blocking Reagent al 2% (Amersham Biosciences, EE.UU.) e incubadas con anticuerpos anti-FABP4, anti-6X His-tag y anti-CD31. Los complejos antígeno-anticuerpo fueron detectados incubando la membrana con anticuerpos anti-IgG conjugados con HRP. Las bandas se visualizaron con los reactivos ECL (Amersham Pharmacia, EE.UU.) en el sistema de imagen ChemiDoc y se cuantificaron con el programa de análisis Image Lab (Bio Rad, EE.UU.). Los niveles relativos de FABP4 se cuantificaron y se normalizaron con los niveles de CD31; todos los valores se expresaron en unidades arbitrarias.
InmunofluorescenciaDespués de la incubación con y sin FABP4, las células fueron lavadas una vez con solución de lavado (PBS+2% FBS+0,1% BSA) durante 5min, fijadas con paraformaldehído 4% durante 20min a 4°C y lavadas con solución de lavado 3 veces, 5min. La incubación con los anticuerpos primarios anti-FABP4 y anti-CD31 (proteína utilizada como marcador de membrana citoplasmática) se llevó a cabo durante toda la noche a 4°C. Tras los lavados, las células fueron incubadas con los anticuerpos secundarios Alexa Fluor*488 anti-goat y Alexa Fluor*532 anti-mouse y lavadas 3 veces con la solución de lavado. Los portas se montaron con mowiol con antifading y las imágenes de microscopia confocal de inmunofluorescencia fueron tomadas con Nikon Eclipse TE2000-E y procesadas con el programa EZ-C1 3.40.
Las imágenes de inmunofluorescencia también fueron captadas con un microscopio invertido Olympus IX71, procesadas con el programa Cell^F y cuantificadas con el programa ImageJ.
Cross-linking en HUVECTras la incubación con y sin FABP4 exógena se realizó el cross-linking en las células HUVEC con formaldehído al 2% en DPBS a temperatura ambiente durante 30min. La reacción se paró con 5ml de glicina 0,125M29,30. Tras esto, las células se lavaron con DPBS y se extrajeron las proteínas de membrana citoplasmática.
Purificación proteica a partir de cola de histidinaLa FABP4-His-tag del extracto de las proteínas de membranas de las células HUVEC fue purificada del resto de proteínas a partir de la cola de histidina. La purificación se hizo siguiendo las instrucciones de HisPurTM Cobalt Purification Kit (Pierce).
Ensayos de unión a ligandoConcentraciones crecientes de proteína (de 0 a 60.000pg/ml) de membrana de células HUVEC incubadas 5min con y sin FABP4 exógena fueron analizadas con el kit FABP4 Inhibitor/Ligand Screening Assay Kit (Cayman) siguiendo las instrucciones del mismo. Brevemente, este kit detecta ligandos de FABP4. Los extractos de proteínas de membrana se incubaron con una sonda que muestra fluorescencia creciente cuando se une a FABP4. La presencia en la muestra de proteínas que se unen a FABP4 desplaza la sonda fluorescente y la fluorescencia emitida decae. Se utiliza ácido araquidónico como control positivo y FABP4 recombinante a una concentración de 10mM. La pérdida de fluorescencia se monitoriza excitando a 475nm y leyendo la emisión a 370nm en un fluorímetro Synergy HT (BioTek, Winooski, VT, EE.UU.). Los resultados obtenidos se presentan como porcentaje de fluorescencia de cada muestra respecto al máximo de fluorescencia (FABP4+sonda fluorescente).
Análisis estadísticoLos resultados se presentan como media±error estándar. Los resultados representan la media de 3 experimentos independientes cada uno realizado por duplicado. Los análisis estadísticos se realizaron utilizando el programa Graphpad Prism (versión 5, San Diego, CA, EE.UU.). Se utilizó el test t-Student para comparar medias. Las diferencias entre medias se consideraron estadísticamente significativas con un valor de p<0,05.
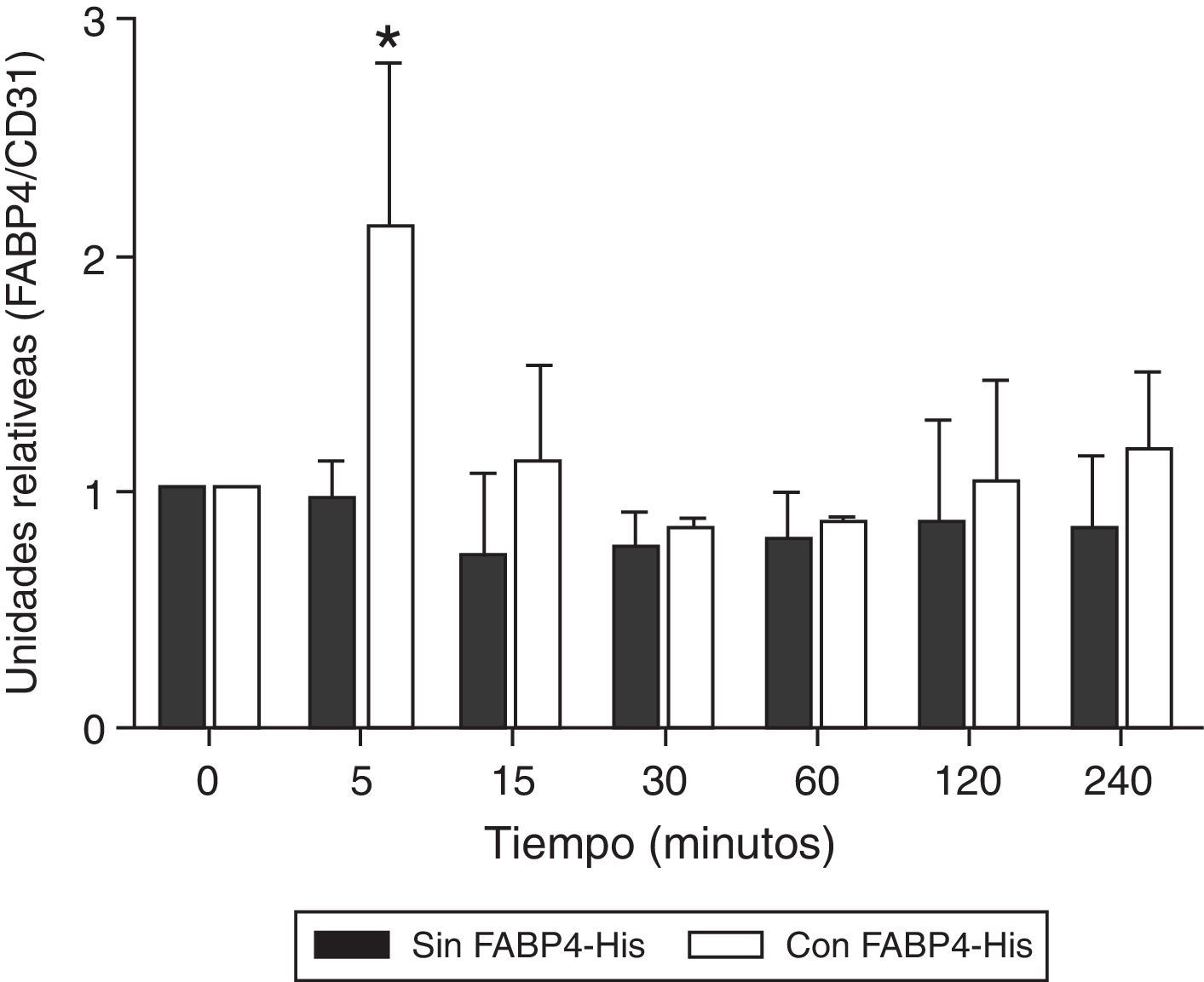
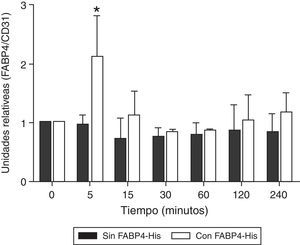
ResultadosFABP4 colocaliza con CD31 en membrana de células HUVECTras la incubación de las células HUVEC con FABP4-His a diferentes tiempos (5min, 15min, 30min, 1h, 2h y 4h) se observó un aumento significativo (p<0,05) en los niveles de FABP4 en los extractos de proteínas de membrana a los 5min (2,22; p<0,05), volviendo a los niveles basales tras ese tiempo. Cuando las células no estaban incubadas con FABP4 exógena, los niveles de FABP4 permanecían constantes durante las 4h (fig. 1).
Variación de la cantidad de FABP4 en la membrana citoplasmática de HUVEC en función de la incubación con y sin FABP4 y del tiempo. A)Western blots de lisados de proteínas de membrana de células HUVEC después de la incubación con y sin FABP4 exógena a diferentes tiempos, usando anticuerpos anti-FABP4 y anti-CD31. CD31 se utiliza para corregir el error de carga. B)Gráfico de barras de la comparación cuantitativa entre los niveles de FABP4 en membrana citoplasmática. La intensidad de la señal de las bandas fue analizada por el programa ImageLab a partir de imágenes de 3 experimentos independientes. Los valores de FABP4 fueron normalizados utilizando los valores de CD31 y se expresan como niveles de proteína relativos en cada tiempo. Estos resultados son expresados como media±error estándar.*p<0,05 cantidad de FABP4 en la membrana de las células incubadas con FABP4 exógena durante 5min versus cantidad de FABP4 en la membrana de las células incubadas sin FABP4 exógena durante 5min y versus cantidad de FABP4 en la membrana de las células incubadas con FABP4 exógena a 30min, 1 y 2h.
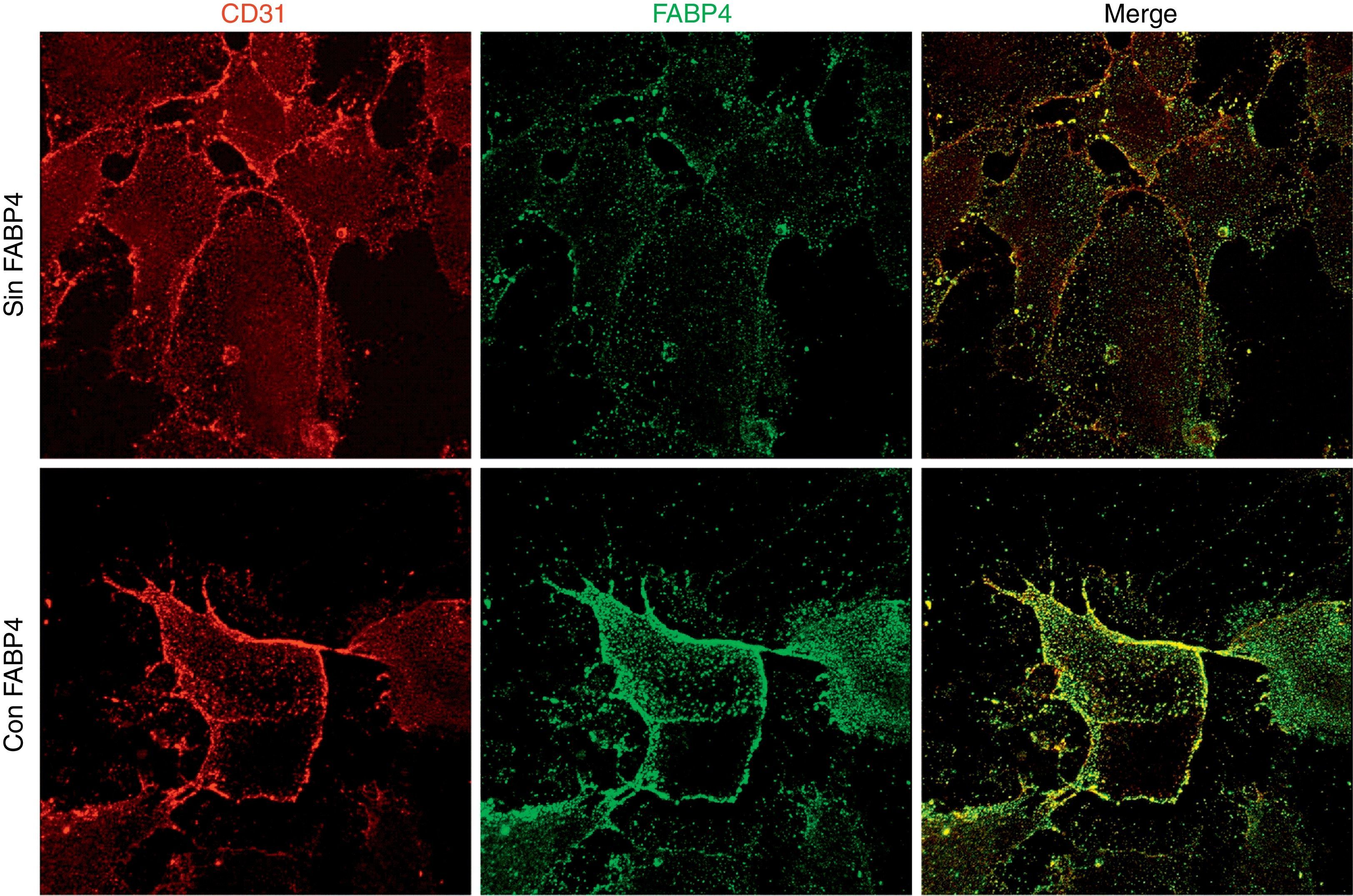
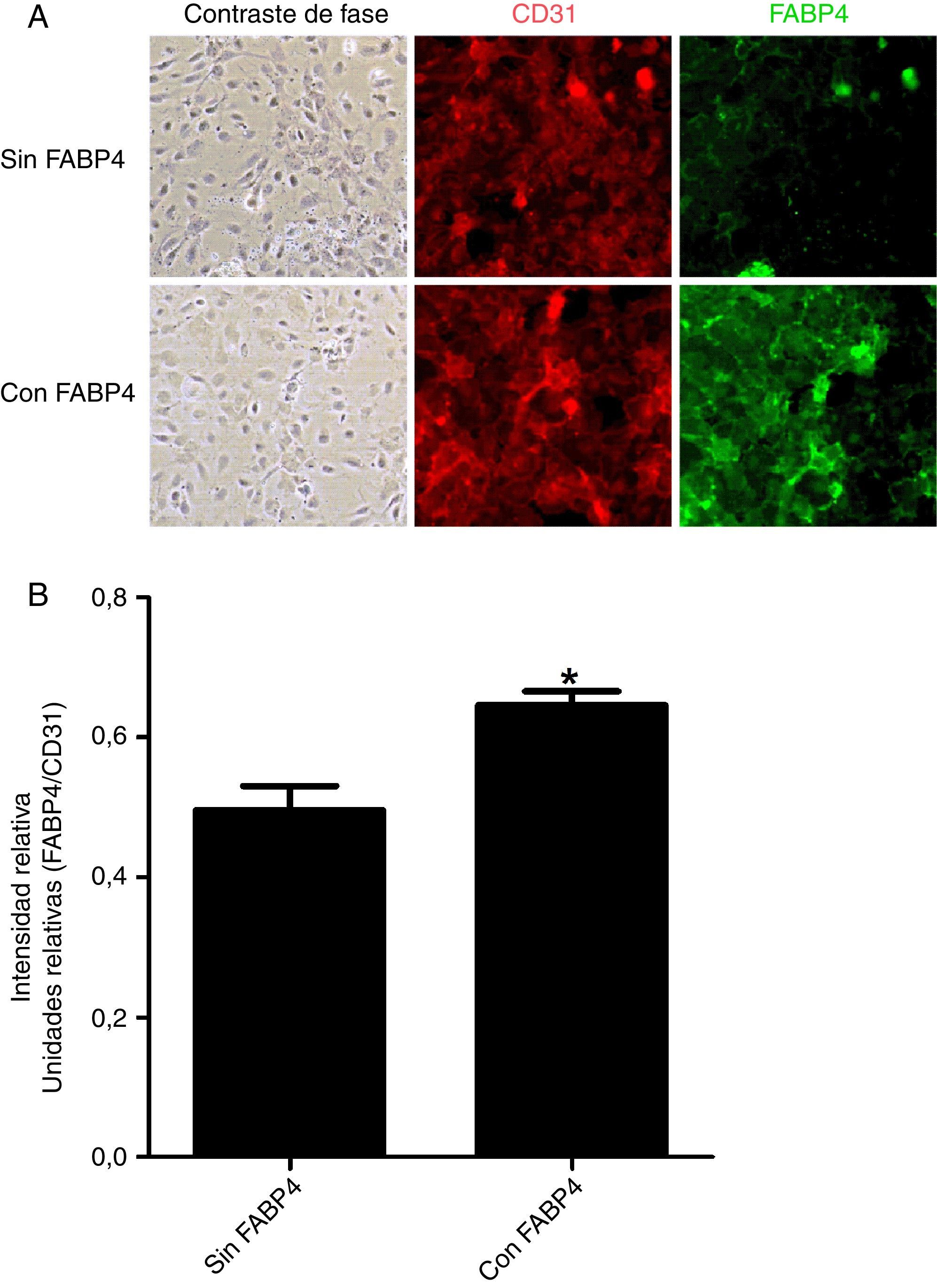
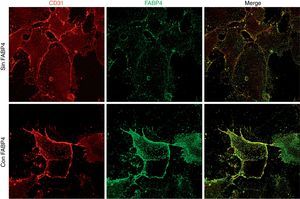
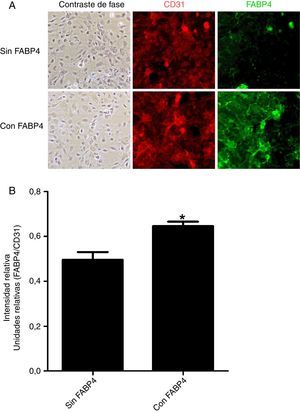
Los experimentos de inmunofluorescencia mostraron colocalización de FABP4 con CD31 (proteína utilizada como marcador de membrana citoplasmática) en la membrana de las células endoteliales (fig. 2) tras 5min de incubación con FABP4 exógena. En la figura 3 observamos que la inmunocolocalización de FABP4 con CD31 se acompaña de un aumento significativo en los niveles de fluorescencia de FABP4 (p<0,05).
Imágenes y cuantificación de fluorescencia en HUVEC en función de la incubación con y sin FABP4. A)Doble inmunofluorescencia para CD31 (rojo) y FABP4 (verde) realizada en 2 condiciones: incubación con FABP4 exógena e incubación sin FABP4 exógena. Imágenes de fluorescencia obtenidas mediante un microscopio invertido. B)Gráfico de barras que muestra la cuantificación de la inmunofluorescencia de FABP4 tras la normalización con los valores de CD31.*p<0,05 cantidad de FABP4 en la membrana de las células incubadas con FABP4 exógena versus cantidad de FABP4 en la membrana de las células incubadas sin FABP4 exógena.
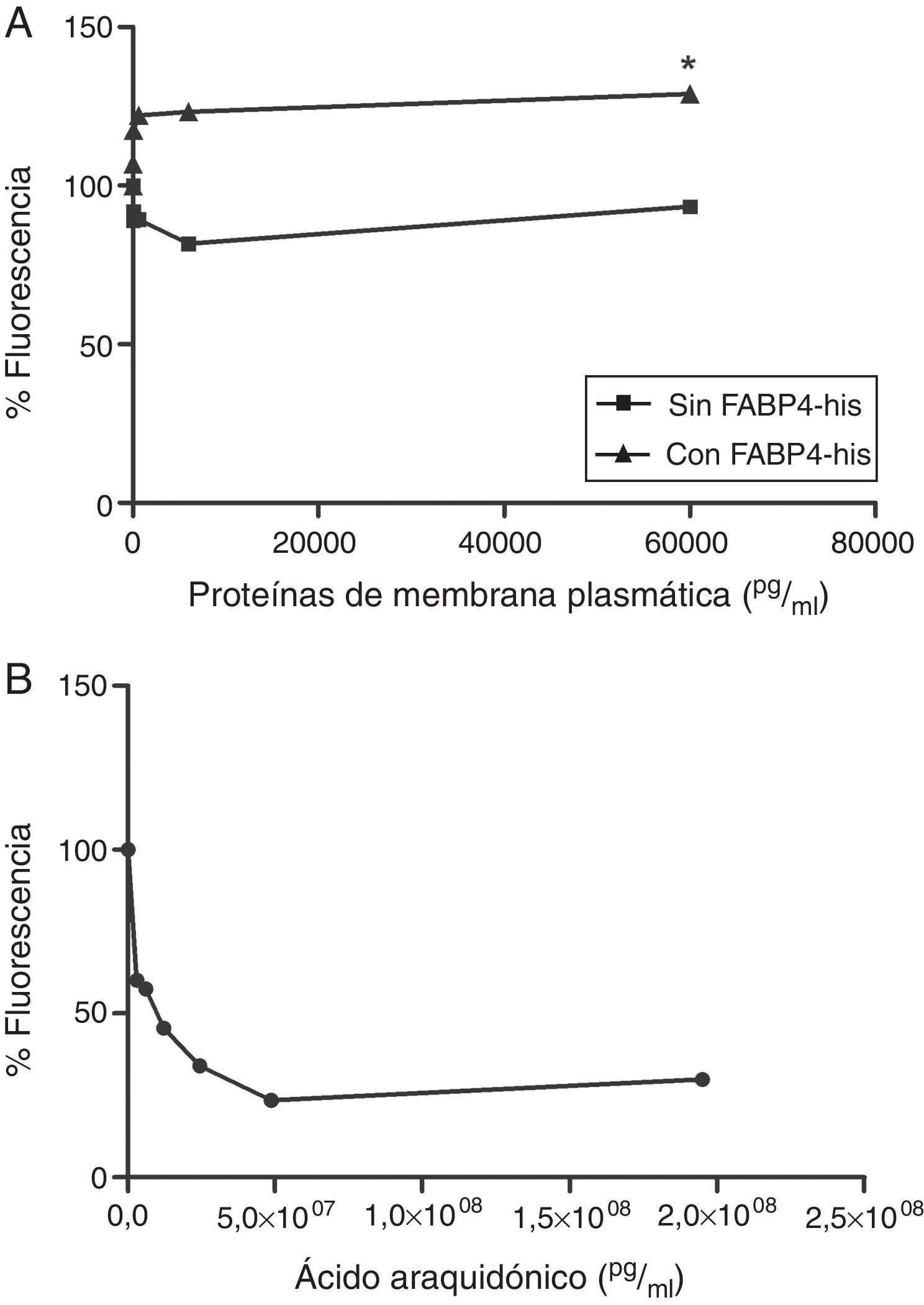
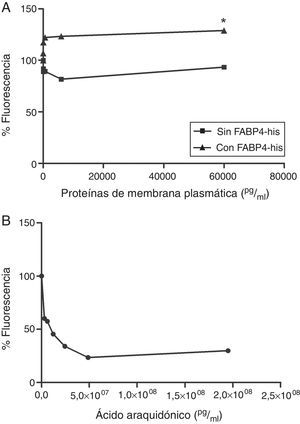
Realizamos un ensayo de unión a ligando (FABP4 Inhibitor/Ligand Screening Assay Kit) utilizando proteínas de membrana de HUVEC incubadas con y sin FABP4 exógena durante 5min. Observamos un aumento en la fluorescencia cuando las células eran incubadas con FABP4 exógena (fig. 4A), sugiriendo la presencia de FABP4 exógena en la membrana. También observamos que cuando usábamos las proteínas de membrana de las células que habían sido incubadas sin FABP4 exógena, la señal de fluorescencia disminuía sugiriendo la presencia de proteínas de membrana capaces de unirse a FABP4 (fig. 4A). A partir de la concentración proteica de 60pg/ml, las diferencias entre la fluorescencia de las proteínas de membrana de las células incubadas con y sin FABP4 exógena son significativas (p<0,05). El ácido araquidónico fue utilizado como control positivo (fig. 4B).
Curvas de desplazamiento del ensayo de unión a ligando. A)Comparación de las curvas de desplazamiento de las proteínas de membrana citoplasmática de células HUVEC incubadas con y sin FABP4 exógena. B)Curva de desplazamiento del ácido araquidónico, control positivo del kit.*p<0,05 diferencia en el porcentaje de fluorescencia entre las proteínas de las células incubadas con FABP4 y las incubadas sin FABP4 exógena a partir de una concentración de 60 pg/ml.
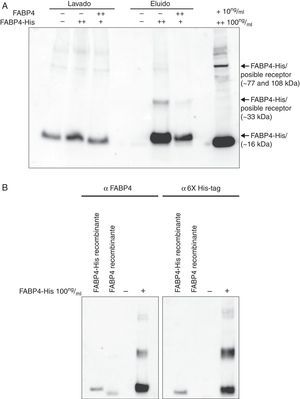
La figura 5A muestra diferentes patrones de bandas de inmunoblot en función de la incubación con o sin FABP4-His. En el control negativo no se detectó ninguna banda, mientras que en las células incubadas con FABP4-His se detectaron 4 bandas diferentes: 15, 33, 77 y 108kDa aproximadamente. En el control de especificidad (células HUVEC incubadas con FABP4 a 100ng/ml y con FABP4-His a 10ng/ml) se detectaban únicamente las bandas de 15 y 33kDa indicando que los complejos de 77 y 108kDa eran complejos específicos formados por FABP4 exógena y otras proteínas. Cuando revelamos estas muestras con anticuerpo anti-6X His-tag (fig. 5B), encontramos el mismo patrón de bandas que observábamos con anti-FABP4.
Formación de complejos en la membrana citoplasmástica de HUVEC con FABP4-His. A)Western blot de extractos de proteínas de membrana citoplasmática de células HUVEC después de la incubación con y sin FABP4-His y después de la purificación a partir de la cola de histidina, utilizando anticuerpos anti-FABP4. B)Western blot de extractos de proteínas de membrana citoplasmática de células HUVEC después de la incubación con y sin FABP4-His y después de la purificación a partir de la cola de histidina, utilizando anticuerpos anti-FABP4 y anti-6X His-tag.
El principal resultado de nuestro trabajo es la existencia de proteínas de membrana de células endoteliales capaces de formar complejos proteicos específicos con FABP4 exógena.
En estudios previos se ha postulado FABP4 como biomarcador plasmático del SM, DM2 y enfermedad aterosclerótica17,19-21. Además, el aumento de las concentraciones de FABP4 plasmática se considera un riesgo para los tejidos periféricos, ya que modula la vía de la insulina en células vasculares y, consecuentemente, disminuye la activación de eNOS y la producción de NO, afectando a la vasodilatación arterial. Estos resultados apoyan el papel directo que juega FABP4 en la disfunción endotelial26. Resultados previos de nuestro grupo muestran que FABP4 circulante también tiene un efecto directo en las complicaciones observadas en la lesión vascular en DT225.
En este trabajo se demuestra la interacción entre FABP4 circulante y la membrana citoplasmática de las células HUVEC (figs. 2 y 3), lo cual apoya la hipótesis de que la FABP4 circulante no es solamente un biomarcador sino que puede que tenga un efecto causal directo al interaccionar con células periféricas. Además, observamos que esta interacción se produce a través de la formación complejos proteicos específicos (fig. 4). A partir de estos resultados, nuestro grupo está trabajando en la identificación de las proteínas que se unen a FABP4 para formar estos complejos, lo que sería necesario para conocer el papel de la FABP4 plasmática en estas enfermedades y entender mejor la función biológica de esta proteína. Se sabe que la FABP cardiaca (62% de homología con FABP4) tiene la capacidad de unirse a un receptor de membrana descrito en células cardiacas, observación que no ha sido confirmada ni demostrada en otras FABP31.
La FABP4 intracelular interacciona con el receptor de insulina, y los ácidos grasos modifican la estructura de la FABP4 activándola como sustrato del receptor de insulina32. No se sabe si esta interacción se produce forma directa o si es a través de otros componentes de la membrana plasmática. Además, la FABP4 endógena es una diana de la ruta VEGF/VEGFR2 y un regulador positivo de la proliferación de células endoteliales in vitro10.
No se sabe todavía si la FABP4 circulante puede internalizarse y activar mecanismos intracelulares. Se ha visto que la cantidad de FABP4 intracelular en células endoteliales aumenta cuándo las células se incuban con FABP4 exógena en comparación con células no tratadas, lo que puede ser un indicio de la internalización de FABP4 circulante. Además, este aumento en la concentración intracelular de FABP4 va acompañado de una inhibición en la producción de eNOS y NO, debido a una alteración en la ruta de eNOS mediado por insulina a causa de la inhibición de la activación de IRS1 y Akt26. Se sabe también que la FABP4 exógena regula la proliferación en células musculares a través de la activación de MAPK y los factores de transcripción c-jun y c-myc27.
Todos estos datos sobre la interacción y la activación de rutas de la FABP4 exógena apoyan la hipótesis de su internalización. Además es probable que, una vez internalizada, la FABP4 pueda llegar hasta el núcleo, en donde active factores de transcripción o incluso actúe como factor de transcripción.
En conclusión, estos resultados muestran por primera vez la existencia de un complejo proteico específico que se forma a partir de la unión de FABP4 exógena con las células HUVEC. Los resultados obtenidos nos permiten avanzar en el conocimiento de los efectos moleculares de la FABP4, pudiéndose utilizar como diana terapéutica para prevenir enfermedades cardiovasculares asociadas con la obesidad y la diabetes.
Responsabilidades éticas:Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo ha sido subvencionado por las becas de ISCIII, Madrid, España (PI11/02216) y CIBER de Diabetes y Enfermedades Metabólicas Asociadas (ISCIII, Ministerio de Ciencia e Innovación).
AutoríaTodos los autores han contribuido en el diseño y análisis de los datos, así como en la redacción del artículo. La versión final de este manuscrito está aprobada por todos los autores.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Una comunicación referente a esta línea de trabajo, titulada «Interacción de FABP4 con proteínas de membrana en células endoteliales», fue presentada en el XXV Congreso Nacional de la SEA-Reus 2012 y galardonada con una mención especial.