El metabolismo del colesterol está alterado en células leucémicas, existiendo controversia acerca del uso combinado de estatinas y agentes quimioterapéuticos en el tratamiento contra el cáncer. En nuestro laboratorio habíamos demostrado con anterioridad cómo la deficiencia de colesterol mediante el uso de inhibidores distales de su biosíntesis inducía la diferenciación de las células humanas HL-60 hacia granulocitos. Se desconoce hasta la fecha si la extracción del colesterol de la membrana de estas células es capaz de producir un proceso de diferenciación similar, lo que podría abrir una vía más hacia nuevas líneas terapéuticas.
Material y métodosLas células HL-60 se mantuvieron en un medio libre de colesterol y se extrajo el colesterol de membrana mediante el uso de metil-β-ciclodextrina. Tras los distintos tratamientos, se analizó la disminución del contenido total de colesterol mediante HPLC, la proliferación celular por contaje de células vivas y el ciclo celular por citometría de flujo. A continuación se evaluó la diferenciación celular por la expresión del marcador temprano de diferenciación CD11c por citometría de flujo y expresión de componentes de la NADPH oxidasa mediante Western blot.
ResultadosEl tratamiento con metil-β-ciclodextrina redujo el contenido celular de colesterol, detuvo la proliferación celular e indujo la expresión de CD11c, al tiempo que se incrementó la expresión de los componentes p47phox y p67phox de la enzima NADPH oxidasa. Con dosis altas de metil-β-ciclodextrina, también se observó la formación de células poliploides y muerte celular, más notables cuanto más se prolongó la incubación.
ConclusionesLa extracción del colesterol de membrana en las células de la línea HL-60 desencadena la parada del ciclo celular y, seguidamente, las células que escapan a la muerte se diferencian, como lo avalan la expresión de CD11c y de los componentes de la NADPH oxidasa p47phox y p67phox.
Cholesterol metabolism is increased in leukaemia cells and, accordingly, the use of chemotherapeutic agents in combination with statins for cancer treatment is being evaluated. In our laboratory, we demonstrated that cholesterol deficiency, as produced by distal inhibitors of the cholesterol biosynthesis pathway, induces the differentiation of HL-60 human leukaemia cells through the granulocytic pathway. The aim of the present work was to determine whether the selective extraction of cholesterol from the cell membrane induces cell differentiation, which may open new possibilities in cancer therapy and other proliferative processes.
Material and methodsPromyelocytic HL-60 cells were maintained in a cholesterol-free medium. Cholesterol was extracted by incubating the cells in the presence of methyl-β-cyclodextrin. Cholesterol cell content was measured by HPLC; cell proliferation was assessed by cell counting; cell cycle distribution was analysed by flow cytometry. Cell differentiation was assessed by measuring CD11c expression by flow cytometry and NADPH oxidase components by Western blot.
ResultsTreatment with methyl-β-cyclodextrin reduced the cholesterol content in cells, and resulted in cell proliferation inhibition, the induction of CD11c expression and the synthesis of p47phox and p67phox.
ConclusionsSelective extraction of membrane cholesterol in HL-60 cells triggers cell differentiation, as indicated by the expression of both CD11c and NADPH oxidase components.
ResultsTreatment with methyl-β-cyclodextrin reduced the cell cholesterol content and inhibited cell proliferation in a dose-dependent manner. As this treatment is prolonged, part of the cells die but a substantial proportion of cells survives and acquire differentiation markers, such as CD11c, p47phox and p67phox.
ConclusionsSelective extraction of membrane cholesterol in HL-60 cells induces cell cycle arrest, which is followed by cell death and, alternatively, cell differentiation, as indicated by the expression of both CD11c and NADPH oxidase components.
La homeostasis del colesterol está alterada en células tumorales. Las células leucémicas presentan una mayor demanda de colesterol, con aumentada expresión del receptor de LDL actividad de HMG-CoA reductasa respecto a las células normales, lo que puede ser reflejo de la alta tasa proliferativa que presentan estas células cancerosas1–3. Dado el aumento de actividad de la HMG-CoA reductasa, se han utilizado estatinas a fin de reducir la capacidad proliferativa de estas células tumorales4,5, aunque con resultados contradictorios. En roedores se ha podido observar que el tratamiento con altas dosis de estatinas inhibe el crecimiento de algunos tipos de tumores6,7. En humanos, algunos resultados muestran que pacientes tratados con agentes hipocolesterolemiantes presentan una menor incidencia de cáncer de mama y colorectal8,9. Sin embargo, otros estudios clínicos no han sido capaces de establecer una relación clara entre el uso de estatinas y el riesgo de cáncer10–14.
A nivel celular se conoce que el tratamiento con estatinas sensibiliza las células mieloides a la radioquimioterapia15. La lovastatina es capaz de inducir la diferenciación en células de meduloblastoma y células mieloides16,17, pero en otros tipos celulares solo induce apoptosis18. Un inhibidor de la mevalonato (5) pirofosfatodescarboxilasa, el fenilacetato, se ha demostrado que es eficaz frenando la proliferación en diversas líneas celulares, pero sus efectos en diferenciación celular no son concluyentes18,19.
La aparente controversia entre los resultados de estos estudios puede deberse a la distinta sensibilidad de las células a los distintos inhibidores y a la mayor o menor demanda de los derivados isoprenoides de los distintos tipos celulares. A este respecto, en nuestro laboratorio hemos observado que los distintos inhibidores de la síntesis de colesterol afectan de manera diversa a la progresión del ciclo celular20–23. Además, hemos demostrado que la deficiencia experimental de colesterol en las células HL-60 producida por el uso de inhibidores distales de la biosíntesis de colesterol, inducía su diferenciación24. Con estos antecedentes, en el presente trabajo nos planteamos estudiar si el colesterol presente en la membrana plasmática es capaz de intervenir en procesos de diferenciación en estas células tumorales.
MetodologíaMaterialesEl forbol 12-miristato 13-acetato (PMA), la metil-β-ciclodextrina (MCD) y el yoduro de propidio se adquirieron a Sigma-Aldrich Chemicals Co. la CM-H2DCFDA a Molecular Probes. El Ac anti-CD11c (555392) marcado con ficoeritrina y los Ac monoclonales de ratón p47phox (610354) y p67phox (610912) se obtuvieron de BD Pharmingen, El Ac de conejo policlonal anti-GAPDH (sc-25778) se adquirió a Santa Cruz Biothecnology. Los Ac secundarios conjugados con peroxidada correspondientes se obtuvieron de Jackson InmunoResearch Laboratories, Inc.
La MCD se preparó en recipiente de vidrio disolviéndola por sonicación en el medio de cultivo ITS+. El PMA se disolvió en dimetisulfóxido (DMSO, concentración máxima en los cultivos 0,044%). Las soluciones madre se almacenaron a −20°C.
El resto de productos químicos utilizados fueron de calidad analítica.
Cultivos celularesLas células de la línea HL-60 (ECACC 98070106) se compraron a la Colección Europea de Cultivos Celulares (Salisbury, Reino Unido) y mantuvieron en medio ITS+ libre de colesterol, como se ha descrito anteriormente24. El número de células y la viabilidad para el estudio de proliferación se determinaron por exclusión del azul de tripano en un hemocitómetro.
Para la extracción del colesterol de membrana, las células se trataron con distintas concentraciones de MCD disuelta en medio de cultivo.
Análisis del ciclo celularLas células se cultivaron en frascos a una densidad de 2×105células/ml. Tras los tratamientos correspondientes, fueron recolectadas por centrifugación y procesadas para medir el contenido en DNA por citometría de flujo, tras tinción con yoduro de propidio25. Los datos se analizaron con los programas WinMDI 2.8 (Build #13 01-19-2000, Copyright Joseph Trotter) y ModFit LT version 2.0 (Verity Software House, Inc.).
Análisis del contenido total de colesterol mediante HPLCSe tomaron 10×106 de células HL-60 por cada condición y se incubaron en 10ml de medio de cultivo correspondiente, en presencia o no de MCD. Después de 24h se sedimentaron las células mediante centrifugación, se lavaron 2 veces con PBS y se resuspendieron finalmente en 500μl de KOH (10%) para su lisado. Los lípidos se extrajeron con cloroformo/metanol (2:1) y, a partir de este extracto, se separaron los lípidos no saponificables mediante saponificación con potasa etanólica y extracción en hexano26. Esta última fracción se inyectó en el equipo de HPLC (Beckman). La separación cromatográfica se realizó con una columna de fase reversa Luna 5μm C18 (250×4,60mm, Phenomenex, Torrance, CA). Los lípidos se eluyeron con acetonitrilo agua (95:5, v/v) durante los primeros 37min y a continuación se prosiguió la elución con metanol absoluto, a un flujo de 1,2ml/min. El efluente fue monitorizado por UV (Beckman 168 detector de onda variable; Beckman Instruments) analizándose la absorbancia a 206nm correspondiente al colesterol. El porcentaje de recuperación total del proceso se determinó con un estándar interno (3H-colesterol) (Amersham).
Actividad NADPH oxidasaEl estallido respiratorio se analizó cuantificando la oxidación de la molécula CM-H2DCFDA, mediante citometría de flujo. Se recogieron las células por centrifugación y se incubaron con CM-H2DCFDA 10μM en presencia de PMA 100ng/ml (estado activado) o PBS (estado de reposo), tal como se ha descrito anteriormente24.
Expresión del marcador de superficie CD11cPara la detección del marcador de superficie CD11c, se recogieron 5×105 células por centrifugación y se procesaron como ha sido descrito previamente24. Inmediatamente después se analizaron en el citómetro de flujo. Por cada condición, se tomó una alícuota adicional que se trató con PBS en lugar de los Ac correspondientes para determinar la fluorescencia inespecífica de los controles no marcados.
Electroforesis e inmunodetecciónFinalizados los diferentes tratamientos, se recogieron 4–8×106 células, se lisaron tras lavado y se sometieron a electroforesis en geles al 12% de poliacrilamida como se ha descrito anteriormente24.
Análisis estadísticoEn las gráficas de barras los resultados se muestran como medias±error estándar. En el caso de los datos normalizados, las comparaciones se realizaron mediante el test de t de Student pareada. En el resto de casos, los resultados se analizaron mediante ANOVA de una vía y, en el caso de resultar significativo, las diferencias entre las distintas condiciones se evaluaron mediante el test de Tukey. El nivel mínimo de significatividad se fijó en p<0,05. Los cálculos se realizaron utilizando el programa estadístico Statgraphics Plus v5.0 (Statistical Graphics).
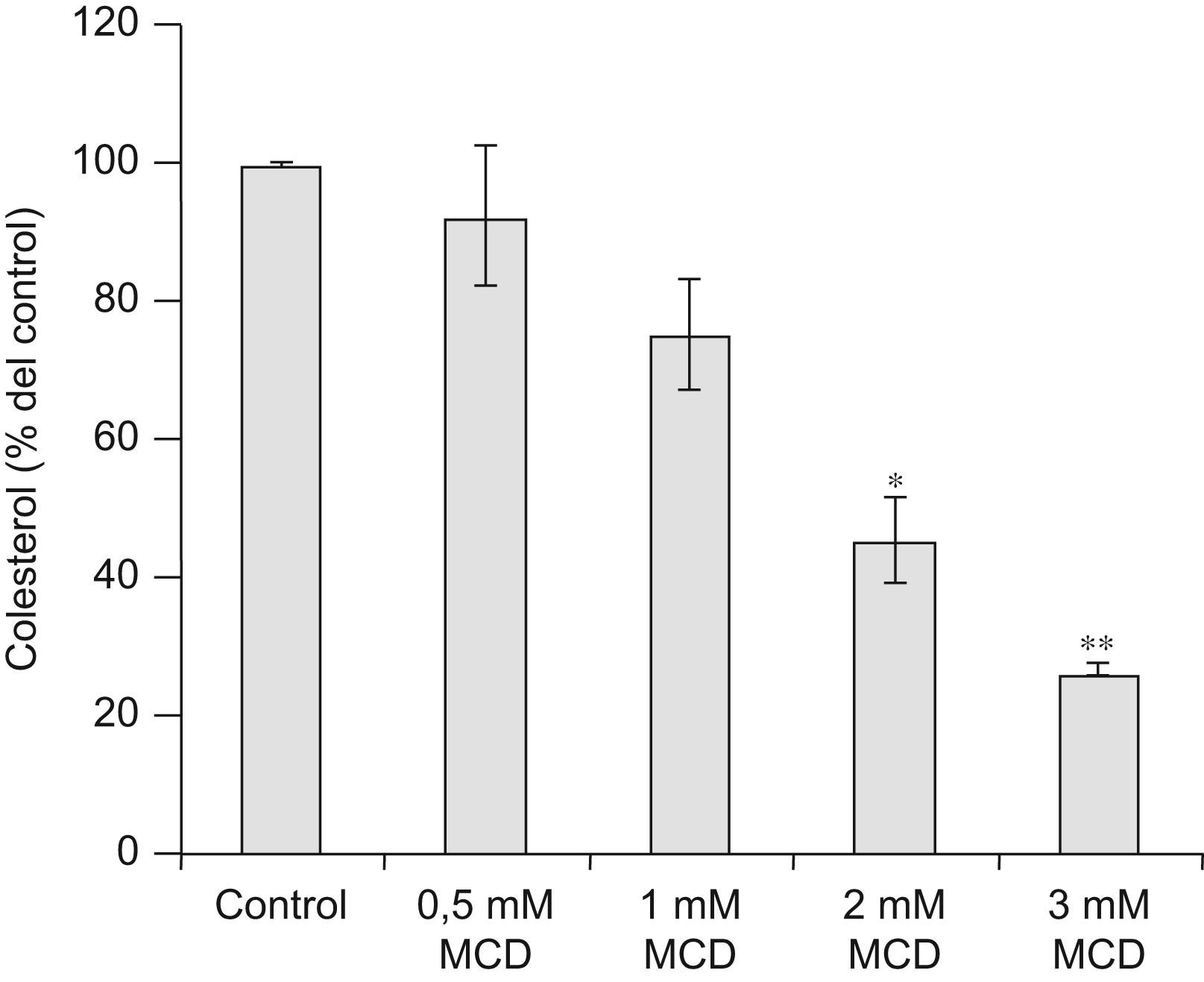
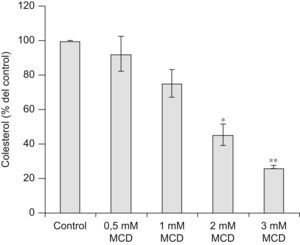
ResultadosReducción del contenido celular de colesterol mediante el tratamiento con MCDPara comprobar el efecto de la MCD, el contenido celular de colesterol se midió mediante HPLC. Como se muestra en la figura 1, el tratamiento de las células durante 24h con dosis de MCD de 0,5mM no afectó significativamente el contenido de colesterol; sin embargo, con dosis superiores se redujo sustancialmente, más de un 20% respecto al control con la dosis de 1mM y más de un 70% con la dosis de 3mM.
Efectos de la MCD sobre el contenido celular de colesterol. Las células se incubaron en ausencia (control) o presencia de dosis crecientes de MCD durante 24h. Al final de la incubación se lisaron las células con KOH al 10% y se extrajeron los lípidos con cloroformo: metanol (2:1). La fracción no saponificable se analizó mediante HPLC, midiéndose la absorbancia a 206nm, correspondiente a colesterol. El contenido de colesterol se corrigió por la cantidad de proteína y los resultados se normalizaron respecto al control (100%). Los datos corresponden a la media±E.E de 3 experimentos. Comparación estadística frente a Control (t pareada): *p<0,05; **p<0,01.
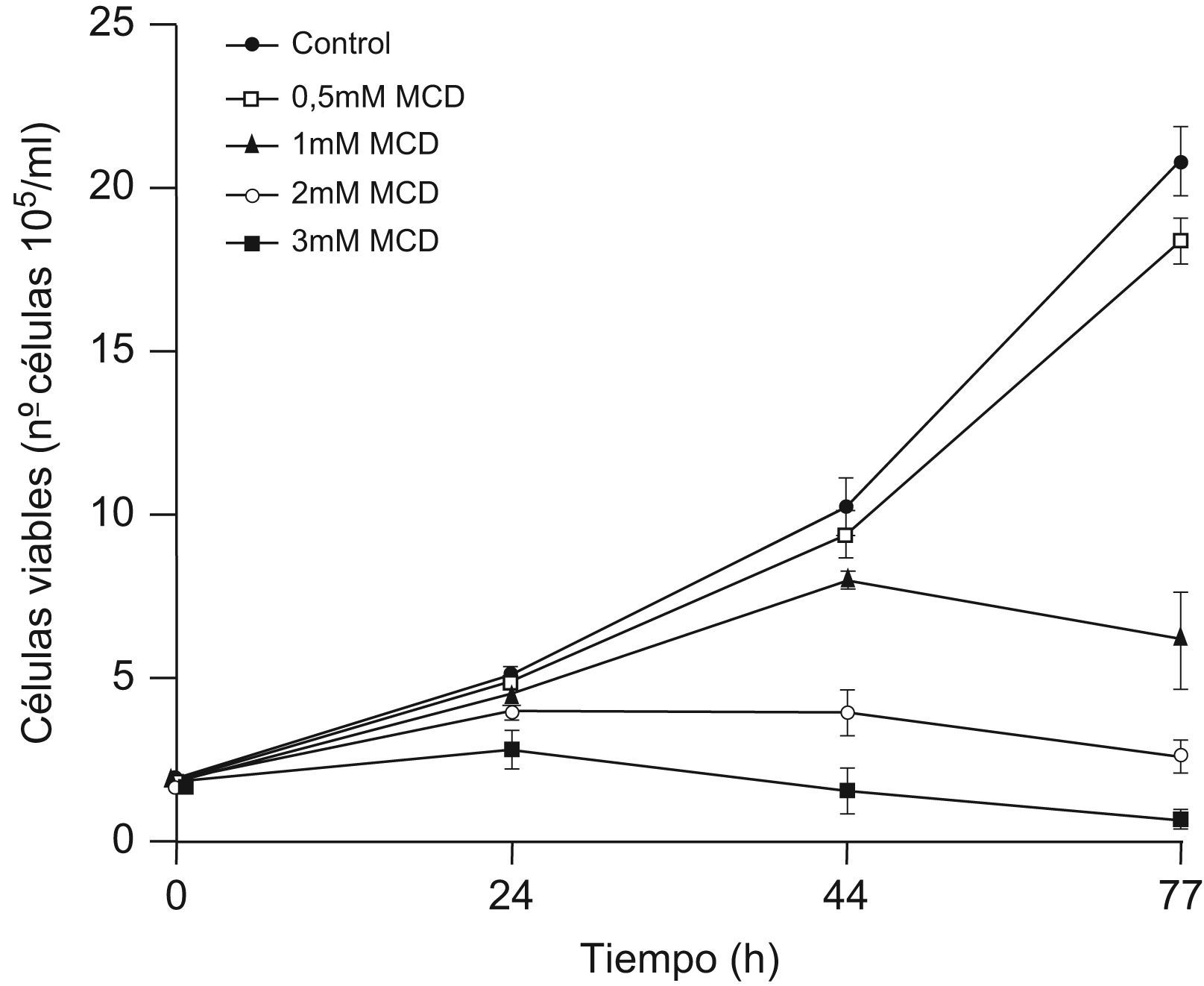
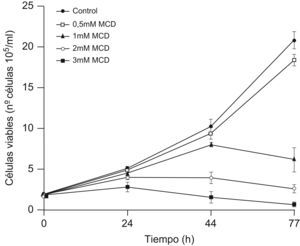
Para analizar los efectos de la extracción del colesterol celular sobre la proliferación, las células se incubaron en medio ITS+ conteniendo diferentes concentraciones de MCD, y se contaron las células viables a distintos tiempos. Como se muestra en la figura 2, a la dosis de 0,5mM la MCD no tuvo efectos apreciables sobre la proliferación a ninguno de los tiempos analizados. Con dosis de 1mM o superiores se observó una parada de la proliferación, más temprana cuanto mayor fuera la dosis. Con la dosis más alta (3mM), a partir de las 24h ya se observó un descenso del número de células vivas, indicando que se había inducido muerte celular.
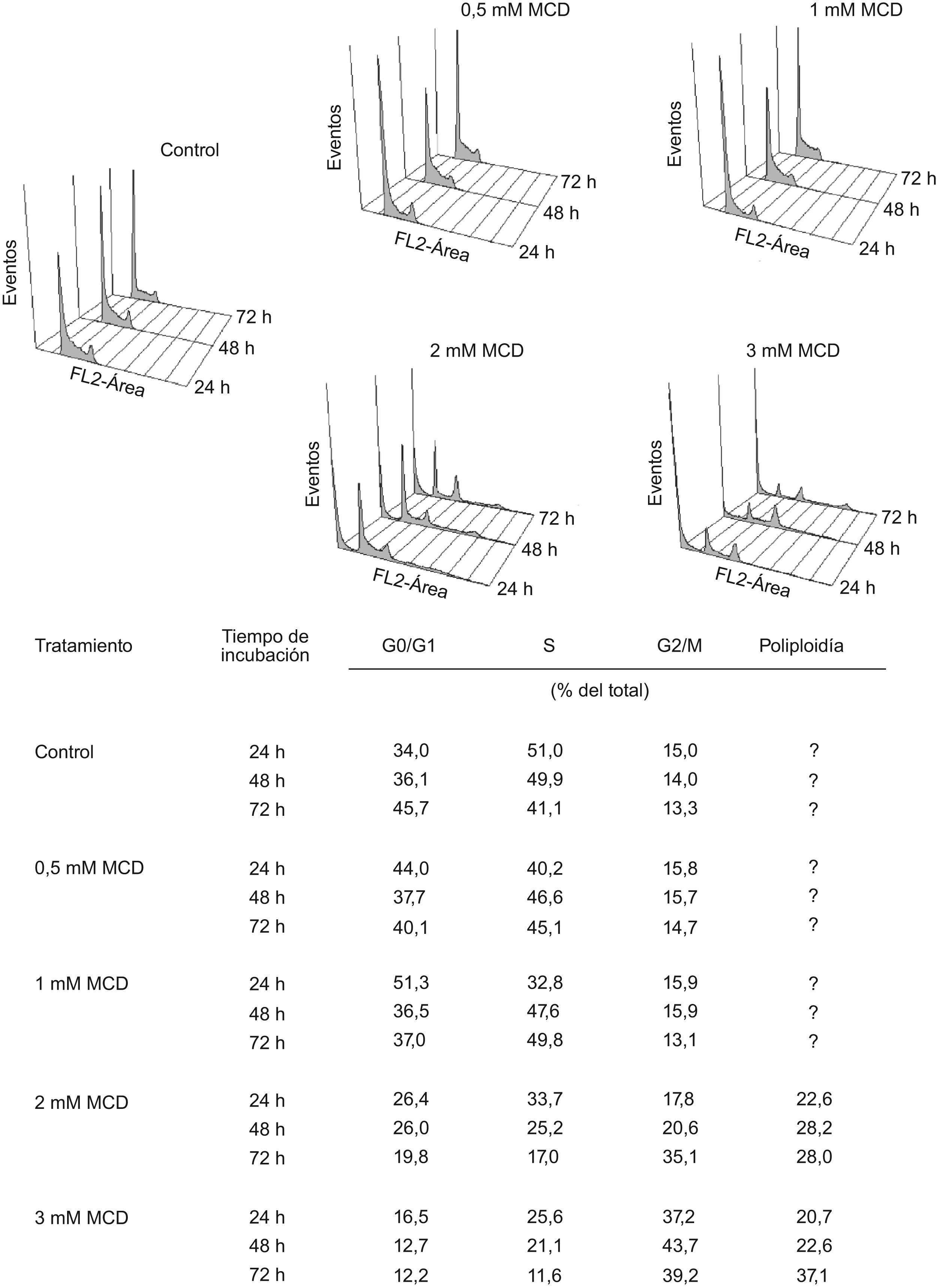
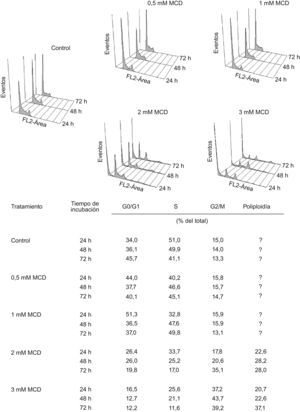
La extracción del colesterol celular con MCD produce una parada del ciclo celular en G2/M y la aparición de poliploidíaEn paralelo a los experimentos de proliferación analizada mediante contaje celular, se examinó el ciclo celular mediante citometría de flujo, tras tinción del DNA con yoduro de propidio. Como se muestra en la figura 3. No se observaron cambios reseñables en la distribución del número de células en las distintas fases del ciclo celular tras el tratamiento con dosis de 0,5mM de MCD en ninguno de los tiempos analizados (24, 48 y 72h); dosis mayores produjeron, además de la muerte de un número sustancial de células (subG1), una acumulación de las células en G2/M de una manera dependiente de la dosis. Al prolongar el tiempo de incubación, parte de estas células entraron en una nueva fase de síntesis de DNA (S2), convirtiéndose en células poliploides multinucleadas.
Efectos de la MCD sobre el ciclo celular. Las células se incubaron en ausencia (control) o presencia de dosis crecientes de MCD. A los tiempos indicados se analizó el ciclo celular mediante citometría de flujo tras tinción del DNA teñido con yoduro de propidio. Se muestran los histogramas de un experimento representativo y, en la tabla, las medias de dos experimentos independientes.
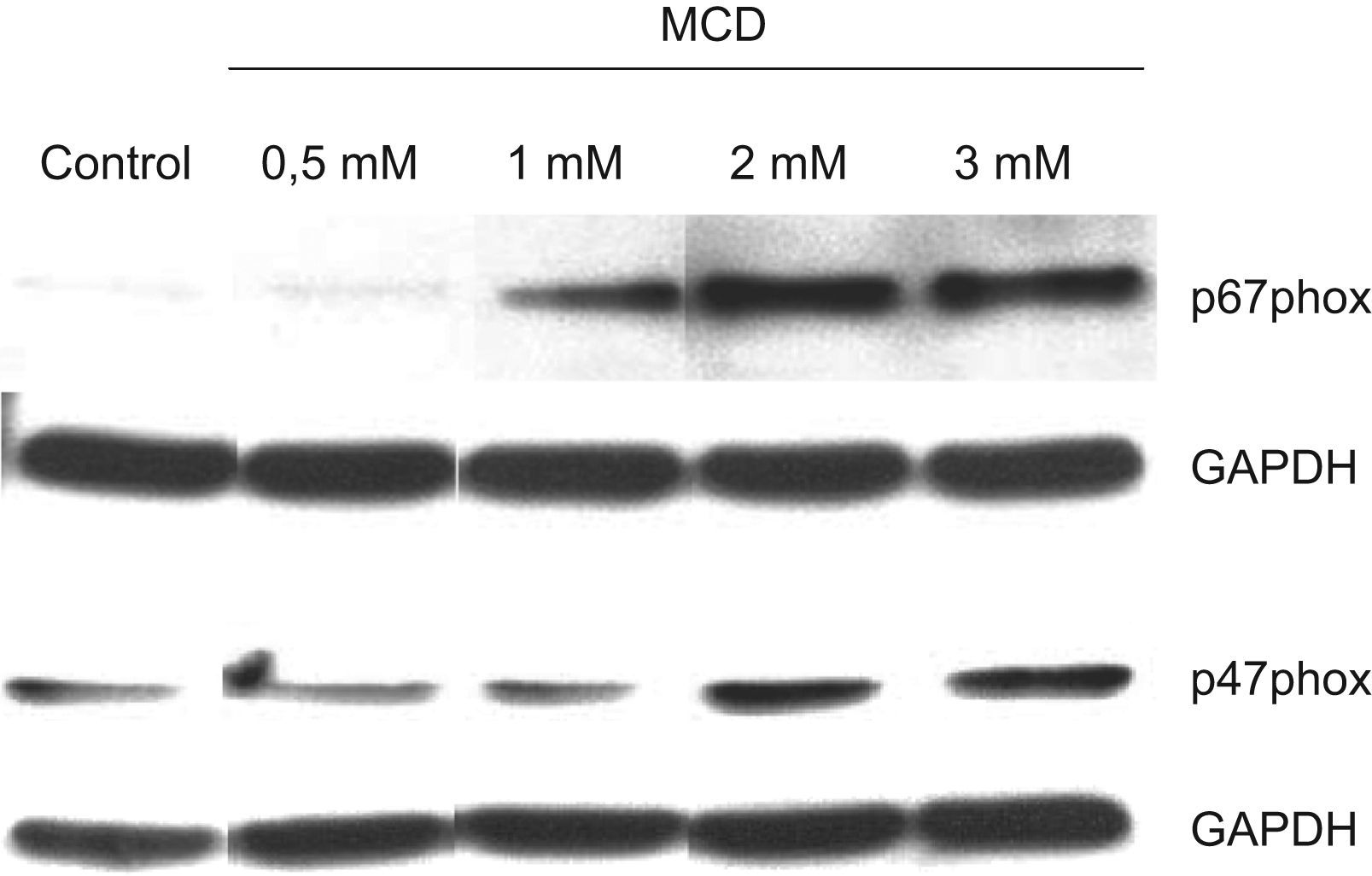
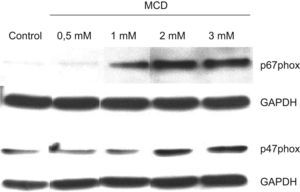
Una vez analizados los efectos sobre la proliferación y ciclo celulares, nos planteamos estudiar si la disminución del contenido celular de colesterol mediante el uso de MCD inducía también un proceso de diferenciación en las células HL-60. Para ello, en primer lugar se analizó la expresión de las subunidades reguladoras de la nicotinamin adenin dinucleótido fosfato (NADPH) oxidasa, p47phox y p67phox, actividad que es responsable del estallido respiratorio que desarrollan las células fagocíticas, especialmente los neutrófilos. Como se muestra en la figura 4, que corresponde al análisis mediante Western blot de lisados de células totales, dichos componentes, que apenas se expresaban en las células HL-60 no tratadas, indujeron intensamente su expresión por efecto del tratamiento con MCD, de forma dependiente de la dosis.
Efectos de la MCD sobre la expresión de los componentes de la NADPH oxidasa por Western blot. Las células se incubaron en ausencia (control) o presencia de dosis crecientes de MCD. A las 48h de tratamiento las células se recogieron y se lisaron para Western blot. Se analizó la expresión de los componentes p47phox y p67phox. La GAPDH se utilizó como control de carga.
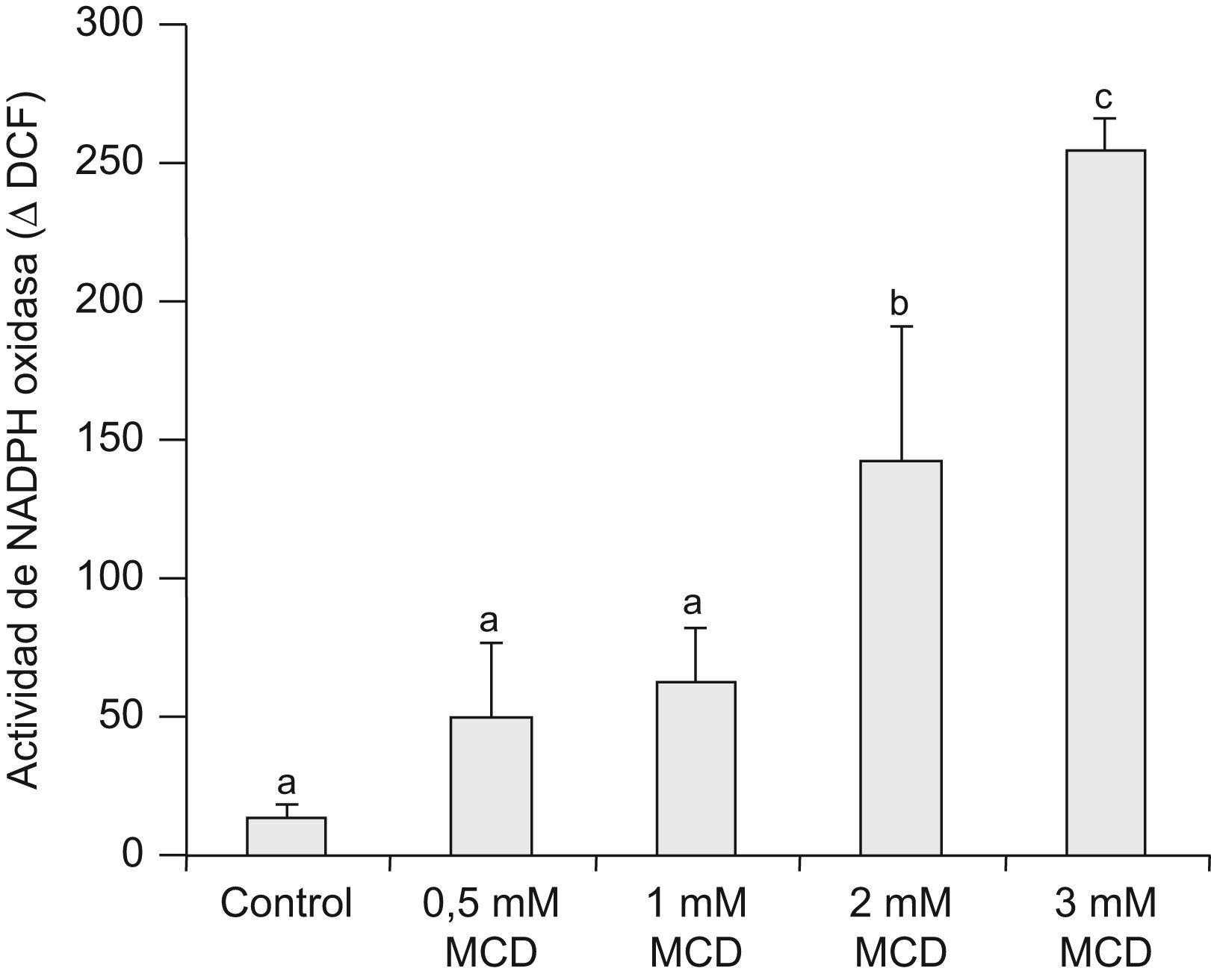
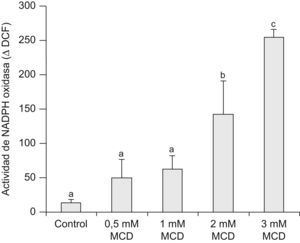
La actividad de la NADPH oxidasa se analizó mediante citometría de flujo, determinando la capacidad de oxidación de la molécula CM-H2DCFDA (DCF) tras la estimulación con PMA. El tratamiento durante 72h con MCD produjo un incremento significativo de dicha actividad, claramente perceptible en las células tratadas con la dosis más alta de MCD (fig. 5).
Efectos de la MCD sobre la actividad de la NADPH oxidasa medida por citometría de flujo. Las células se incubaron en ausencia (control) o presencia de dosis crecientes de MCD durante 72h. Para medir la actividad NADPH oxidasa, se recogieron las células y se incubaron con DCFH2-DA, en ausencia (reposo) o en presencia de PMA (activado) y se determinó la fluorescencia del DCF producido. Se hallaron las medianas de la fluorescencia de cada condición y la actividad de la NADPH oxidasa se calculó como el incremento de la fluorescencia por efecto del PMA, expresándose como % con respecto al estado de reposo. Los datos corresponden a la media±E.E de 3 experimentos. La comparación estadística se realizó mediante ANOVA de una vía (p<0,001) y posterior test de Tukey: los grupos con letra diferente presentan diferencias estadísticamente significativas (p<0,05).
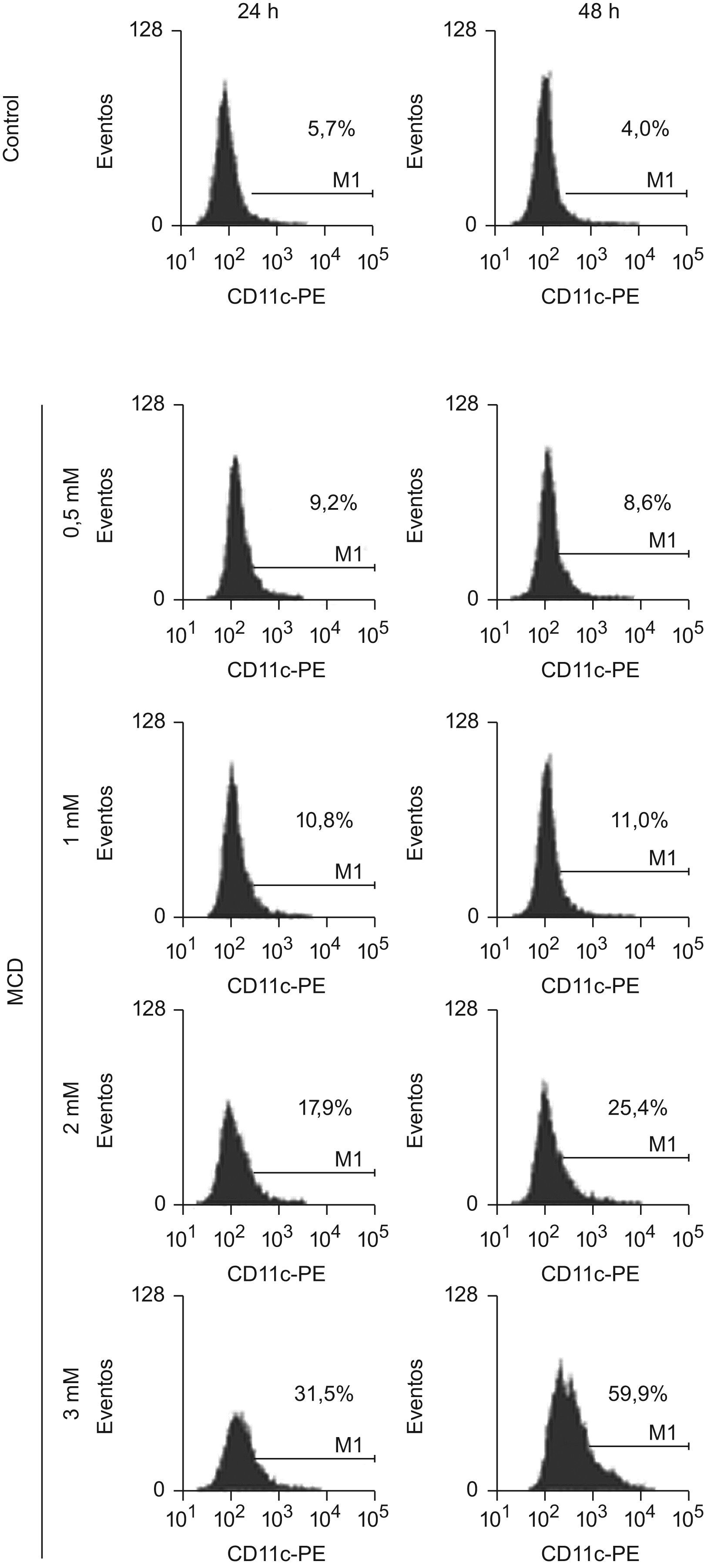
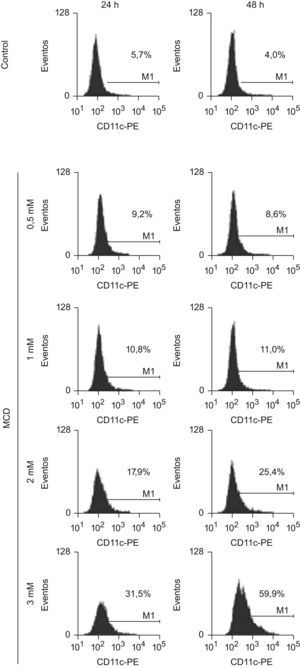
Finalmente, se analizó la expresión de la proteína CD11c en la superficie celular, un marcador de diferenciación. Podemos observar en la figura 6 que las células tratadas con MCD aumentaron gradualmente la expresión de esta integrina en función de la dosis de MCD y de la duración del tratamiento, llegando a ser el número de las células que lo expresan el 60% de las células vivas, a los 2 días de tratamiento con la dosis de 3mM de MCD.
Efectos de la MCD sobre la expresión del marcador de superficie CD11c. Las células HL-60 se incubaron en ausencia (control) o presencia de dosis crecientes de MCD. A los tiempos indicados se recogieron las células y se procesaron para citometría de flujo. Se muestran los histogramas de fluorescencia de la expresión de CD11c-PE donde los números indican el porcentaje de células positivas para dicho marcador. Los resultados corresponden un experimento representativo de 3 experimentos independientes.
Numerosos estudios han tratado de establecer el papel que el colesterol y sus intermediarios juegan en el desarrollo del cáncer y la resistencia de las células cancerosas a la quimioterapia. En general, en las células cancerosas la homeostasis del colesterol está alterada, presentando mayor tasa de internalización de colesterol exógeno vía LDL y mayor actividad de la HMG-CoA reductasa1,3,27. Como la mayoría de estos estudios han sido realizados con inhibidores tanto de la formación de esteroles como de derivados no esteroídicos, y estos últimos tienen una mucha importancia en diversos procesos celulares, la divergencia de efectos observados puede explicarse en función de la distinta afectación de la síntesis de unos, otros o de ambos. Previamente, en nuestro laboratorio habíamos demostrado cómo la inhibición distal de la biosíntesis de colesterol inducía una diferenciación celular en la línea promielocítica humana HL-6024. La inhibición sostenida de la biosíntesis, particularmente cuando las células se incuban en un medio sin colesterol, produce un descenso en la disponibilidad intracelular de colesterol que, posteriormente, repercute en la cantidad de colesterol presente en la membrana. Así pues, lo siguiente que nos planteamos fue averiguar si la retirada de colesterol de la membrana plasmática, sin afectación de la síntesis endógena, producía también un proceso de diferenciación celular.
Para extraer el colesterol de la membrana de las células HL-60 utilizamos MCD, un oligosacárido cíclico con alta capacidad para solubilizar colesterol y demostrada actividad antitumoral y antiproliferativa28–30. En consonancia con estos antecedentes, en el presente trabajo hemos comprobado que el tratamiento de las células HL-60 con MCD produce un descenso del contenido intracelular de colesterol, ya detectable con dosis de 1mM, y que llega a ser de más del 70% con la dosis de 3mM. En estrecha correspondencia con la disminución del contenido celular de colesterol, se observa una parada del ciclo celular y, si se prolonga la incubación, se produce muerte celular, lo cual está en concordancia con el requerimiento de colesterol para la proliferación celular20,31. Esta es la causa de la citotoxicidad de la MCD a dosis altas.
Al igual que las células tratadas con ácido zaragózico A o con SKF 10497622,24,31, una cierta proporción de las células HL-60 tratadas con MCD acaban convirtiéndose en células poliploides (fig. 3). Esta observación está de acuerdo con lo descrito por Feng y cols, quienes demostraron en embriones de pez cebra que el tratamiento con MCD 5mM inhibía la citocinesis32, hecho que atribuyeron a la afectación de la endocitosis33.
Una de las peculiaridades de las células HL-60 es que son promielocitos inmaduros que tras el tratamiento con distintas sustancias son capaces de diferenciarse hacia diversas tipos celulares34–36. La aparición de poliploidía en las células tratadas con MCD, ácido zaragózico A y SKF 10497624 dificulta la evaluación de la diferenciación por simple observación morfológica, a diferencia de lo que ocurre con otros inductores de diferenciación conocidos (ácido todo trans retinoico y vitamina D3)34–36. Así pues, la diferenciación la basamos principalmente en el estudio de marcadores de diferenciación característicos por citometría de flujo (CD11c) y Western blot y en medida de la capacidad oxidativa.
Tanto la actividad de la NADPH como la expresión de los componentes que la integran se han considerado como marcadores de la diferenciación celular en la línea HL-6037. Nosotros observamos que las células tratadas con MCD aumentaban la expresión de los componentes de la NADPH oxidasa p47phox y p67phox. Sorprende, no obstante, que este notable incremento de la expresión de las proteínas de la NADPH oxidasa se acompañara solo de un pequeño aumento en la capacidad de oxidar la DCFH2-DA (fig. 5). De hecho, el tratamiento con ATRA, vitamina D3, ácido zaragózico o SKF 104976 produce un intenso incremento en la actividad de la NADPH oxidasa con cambios en la expresión de las subunidades reguladoras comparables a los de la MCD24. Esta relativa incapacidad de activar la NADPH oxidasa puede ser debida a la desestabilización de los «lipid rafts» por acción de la MCD, que afectaría al correcto ensamblaje de la NADPH oxidasa, como han propuesto otros autores38. Finalmente, pudimos comprobar que las células tratadas con MCD expresaban el marcador de superficie CD11c, de una manera dependiente del tiempo y la dosis utilizada (fig. 6), al igual que lo hacen las células tratadas con los inhibidores distales de la biosíntesis de colesterol24. CD11c es una de las cadenas α que pueden interactuar con CD18 (cadena β), para formar el heterodímero CD11c/CD18 y tiene funciones similares al complejo CD11b/CD1839, expresándose tanto en monocitos como en neutrófilos.
Por lo tanto, las células tratadas con MCD experimentan un proceso de diferenciación, como lo avalan la adquisición de los componentes de la NADPH oxidasa (p47phox y p67phox) y la expresión del marcador de diferenciación CD11c. A diferencia de las células tratadas con inhibidores distales de la biosíntesis de colesterol24 y otros inductores conocidos34–36, las diferenciadas con MCD solo activan ligeramente la NADPH oxidasa, lo que puede determinar una menor capacidad lítica. Queda por determinar si la diferenciación inducida por la MCD es hacia la línea granulocítica, como ocurre con los inhibidores distales de la biosíntesis de colesterol. El esclarecimiento del papel que juega el colesterol celular en los procesos de diferenciación puede contribuir a diseñar nuevos tratamientos quimioterapeúticos para combatir la leucemia mieloide aguda y para comprender otros fenómenos de diferenciación celular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
CIBERobn es una iniciativa del Instituto de Salud Carlos III (ISCIII). Este trabajo se ha realizado con sendas ayudas para personal de la Fundación para la Investigación Biomédica del Hospital Universitario Ramón y Cajal (FIBio-HRC) y de la Fundación Carolina, Ministerio de Asuntos Exteriores. El trabajo ha sido financiado en parte por los proyectos SAF2005-07308 y SAF2008-01104 del Ministerio de Ciencia e Innovación. Una comunicación referente a esta línea de trabajo, titulada «Implicación del colesterol de membrana en la diferenciación de las células promielocíticas humanas HL-60» fue presentada en el XXII Congreso Nacional de la SEA- Madrid 2008 y galardonada con una mención especial.