Gran Canaria es una región de aislamiento genético para hipercolesterolemia familiar, debido a una mutación fundadora, p.[Tyr400_Phe402del], en el gen del receptor de LDL (LDLR). Datos iniciales indican que sus portadores podrían tener una alta prevalencia de diabetes.
Material y métodosSe reclutó a los pacientes mayores de 30 años con hipercolesterolemia familiar y mutación confirmada en LDLR en un hospital de tercer nivel de Gran Canaria y se comparó la prevalencia de diabetes y otros datos clínicos entre los portadores de p.[Tyr400_Phe402del] y los de otras mutaciones en LDLR.
ResultadosEl 76,4% de los 89 participantes era portador de p.[Tyr400_Phe402del]. En ese grupo la prevalencia de diabetes fue significativamente más alta (25 vs. 4%, p=0,045). Dichos casos también tenían mayor prevalencia de enfermedad cardiovascular y niveles más altos de colesterol LDL y triglicéridos. No hubo diferencias en edad, peso, índice de masa corporal, cintura, edad de inicio y tiempo de tratamiento con estatinas. Sin embargo, sí precisaban más a menudo inhibidores de PCSK9 (51,5 vs. 24%, p=0,027).
ConclusionesLa mutación p.[Tyr400_Phe402del] se asocia a una elevada prevalencia de diabetes, no explicada por factores de riesgo clásicos, como la edad, la obesidad o el uso prolongado de estatinas.
Gran Canaria is a region of genetic isolation of familial hypercholesterolemia due to a founder mutation, p. [Tyr400_Phe402del], in the LDL receptor (LDLR) gene. Initial data suggest that its carriers could have a high prevalence of diabetes.
Material and methodsPatients over 30 years of age with familial hypercholesterolemia and a confirmed mutation in LDLR were recruited from a tertiary hospital in Gran Canaria. The prevalence of diabetes and other clinical data were compared among carriers of p. [Tyr400_Phe402del] and those with other LDLR mutations.
Results76.4% of the 89 participants were carriers of p.[Tyr400_Phe402del]. The prevalence of diabetes in this group was significantly higher (25 vs. 4%, P=.045). These cases also had a higher prevalence of cardiovascular disease and higher levels of LDL cholesterol and triglycerides. There were no differences in age, weight, body mass index, waist, age of onset, and time of statin treatment. However, they required PCSK9 inhibitors more often (51.5 vs 24%, P=.027).
ConclusionsThe mutation p.[Tyr400_Phe402del] is associated with a high prevalence of diabetes, not explained by classic risk factors, such as age, obesity, or long-term use of statins.
La hipercolesterolemia familiar (HF) se caracteriza por concentraciones muy elevadas de colesterol LDL (C-LDL) y riesgo elevado de enfermedad cardiovascular (ECV) prematura1. Tiene una herencia autosómica codominante y está causada por mutaciones en distintos genes implicados en el metabolismo del C-LDL: receptor de LDL (LDLR), apolipoproteína B (APOB), apolipoproteína E (APOE), proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) y proteína adaptadora tipo 1 del receptor de LDL (LDLRAP1), esta última responsable de una forma recesiva de la enfermedad2.
En España se han identificado más de 400 mutaciones en LDLR, ninguna de las cuales explica más de un 7% de los casos3. Sin embargo, un estudio realizado recientemente en la isla de Gran Canaria ha puesto de manifiesto la existencia de una mutación con efecto fundador, la p.[Tyr400_Phe402del] en el gen LDLR, que representa casi el 70% de los pacientes con diagnóstico genético positivo en esta región, por lo que se considera una población de aislamiento genético para la HF4.
Una característica peculiar, inicialmente observada en los portadores de p.[Tyr400_Phe402del] fue la alta prevalencia de diabetes (DM) tipo 2, presente en el 17,8% de los sujetos estudiados4. Esta es una cifra mayor de la esperada en la población general y mucho más alta que la descrita en pacientes con HF portadores de mutaciones en LDLR en otras poblaciones5. Los pacientes con HF generalmente reciben tratamiento prolongado con estatinas y esto se ha asociado a un aumento del riesgo de DM de entre un 9 y un 25%6. Sin embargo, estudios publicados hasta ahora indican que, a diferencia de lo observado en la población general, los pacientes con HF parecen estar protegidos frente a este efecto diabetogénico de las estatinas7. De hecho, algunos estudios han mostrado que la prevalencia de DM es menor entre pacientes con HF que entre sus familiares no afectos por la enfermedad5. Este hallazgo se corroboró también en España, en pacientes con HF heterocigota del Registro Nacional de Dislipemias de la Sociedad Española de Arterioesclerosis (SEA), en el que la prevalencia de DM fue bastante inferior a la observada en población general española (5,94 vs. 9,44%)8, lo cual podría estar relacionado, al menos en parte, a un estilo de vida más saludable entre las personas con HF9.
La elevada prevalencia de DM en los sujetos que presentan la mutación fundadora en Gran Canaria no tiene una clara explicación. El objetivo de este estudio es comparar la frecuencia y las características de la diabetes en los portadores de la p.[Tyr400_Phe402del] frente a los portadores de otras mutaciones de LDLR en la isla.
Material y métodosSe reclutó a todos los pacientes mayores de 30 años atendidos en la Unidad de Lípidos del Complejo Hospitalario Universitario Insular Materno-Infantil con HF heterocigota y mutaciones confirmadas en el gen LDLR, y se comparó a los portadores de p.[Tyr400_Phe402del] con el resto, ampliando la muestra del estudio previo4, de la que, además, se excluyeron los sujetos menores de 30 años para poder estimar mejor la prevalencia de DM en población adulta.
Se excluyeron los pacientes en tratamiento con glucocorticoides, con antecedente de pancreatectomía, DM tipo 1 u otras causas conocidas de DM secundaria.
Protocolo de estudioDe cada participante se recogió su edad, sexo y antecedentes conocidos de diabetes, así como la edad al diagnóstico de la enfermedad, cuando esta estaba presente, el tiempo de evolución, tipo de tratamiento hipoglucemiante, complicaciones crónicas y antecedentes de diabetes en familiares de primer grado. También se analizaron otros datos, incluyendo los resultados del estudio genético de LDLR, antecedentes personales de ECV, tipo y edad de instauración, antecedentes de tabaquismo e hipertensión arterial y tipo de tratamiento hipolipidemiante (edad de inicio y tiempo de tratamiento). Se registraron los niveles séricos basales y los más recientes disponibles con tratamiento hipolipidemiante de colesterol total, colesterol HDL (C-HDL), C-LDL, triglicéridos, lipoproteína (a) [lp(a)], además de la glucemia basal y la hemoglobina glucada (HbA1c). El examen físico incluyó peso, talla, perímetro de cintura, presión arterial, existencia de arco corneal y xantomas tendinosos. Se calculó el índice de masa corporal (IMC).
El diagnóstico de DM se estableció en aquellos individuos que tenían un diagnóstico previo documentado en la historia clínica, o cuando la glucemia basal era>125mg/dl y/o la HbA1c era≥6,5%.
Todos los pacientes fueron informados del procedimiento del estudio y firmaron un consentimiento informado siguiendo las normas éticas de la Declaración de Helsinki de 1975. El estudio fue aprobado por el Comité Ético del Centro.
Análisis genéticoLa variante p.[Tyr400_Phe402del] en LDLR fue genotipada en todos los sujetos por un procedimiento previamente descrito4. En aquellos probandos en los que el análisis de esta variante resultó negativo, se procedió a la secuenciación de los genes LDLR, APOB, PCSK9, APOE, LDLRAP1 y STAP1 (Progénika Biopharma, Gendiag Laboratorios). Las mutaciones se clasificaron como no patogénicas o benignas, posiblemente no patogénicas, de significado clínico incierto, posiblemente patogénicas o patogénicas según la Asociación Científica de Genética Clínica10. Para el presente análisis se incluyeron únicamente los portadores de mutaciones en LDLR y se compararon los portadores de la mutación prevalente p.[Tyr400_Phe402del] con el resto.
Análisis estadísticoLos datos se resumen como medias±DE o medianas (rango intercuartílico) para las variables continuas y frecuencias (%) para las variables categóricas. Para las diferentes comparaciones entre grupos, los porcentajes se compararon mediante la prueba de Chi cuadrado (χ2), las medias por la prueba-T, y las medianas por la prueba de Wilcoxon para datos independientes. La significación estadística se estableció en una p<0,05. Los datos se analizaron utilizando el paquete estadístico SPSS, versión 20.0 (IBM Corporation, Armonk, NY).
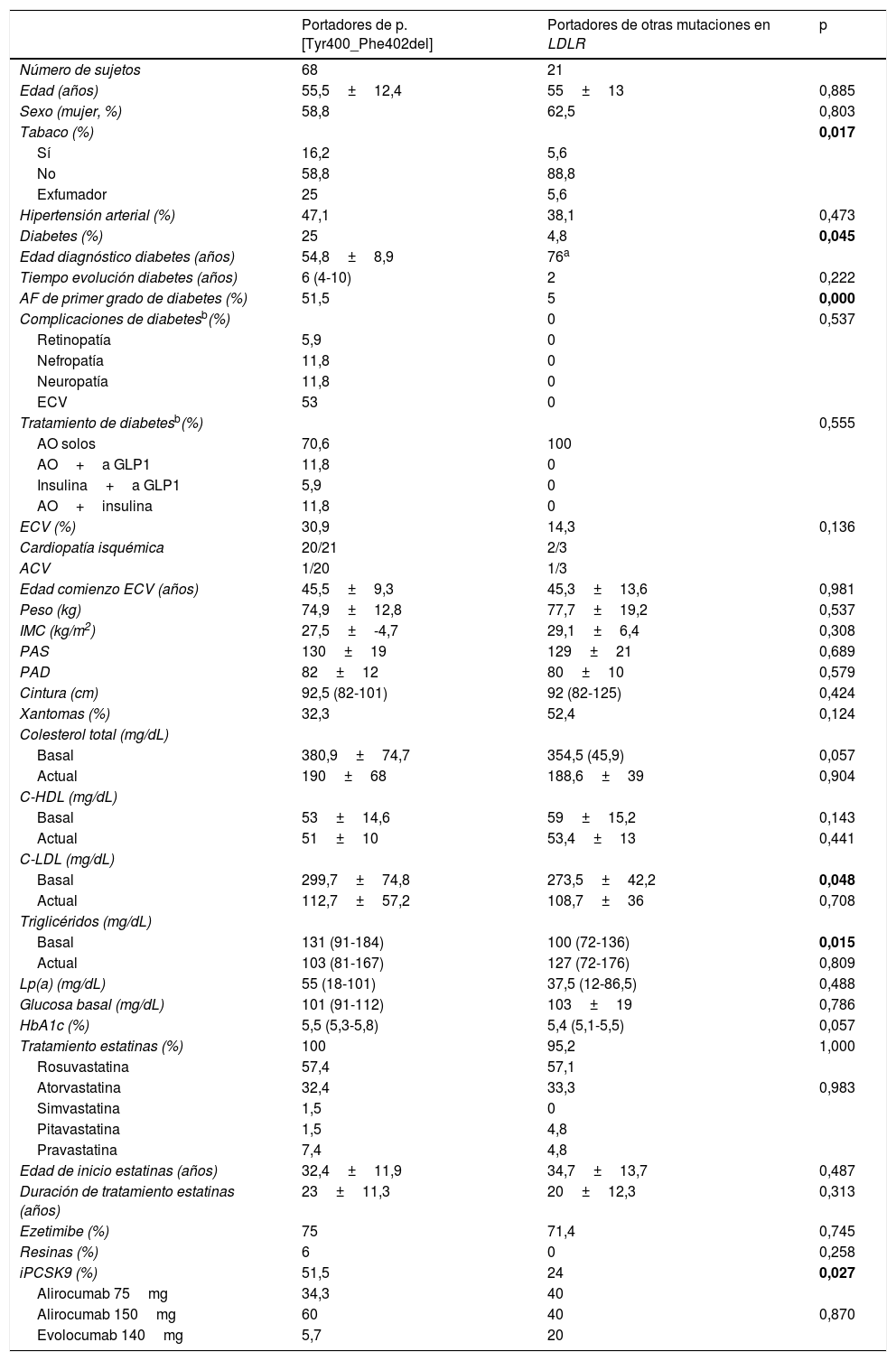
ResultadosSe incluyeron 89 pacientes pertenecientes a 46 familias con HF con diagnóstico genético positivo, de los que 68 (76,4%) eran portadores de la mutación p.[Tyr400_Phe402del]. Las características clínicas de los participantes se recogen en la tabla 1, de acuerdo con la presencia o ausencia de la mutación fundadora. La prevalencia de diabetes fue superior entre aquellos con la variante p.[Tyr400_Phe402del] (25 vs. 4,8%; p=0,045). La edad media de presentación de la diabetes fue de 55 años. El 51,5% de los pacientes con la mutación fundadora tenían antecedentes de diabetes entre familiares de primer grado, frente a solo el 5% de los portadores de otras mutaciones (p<0,0001) y el porcentaje de fumadores y exfumadores era mayor (16,5 y 25 vs. 5,6 y 5,6%; p=0,017). Entre los pacientes con diabetes, el 12% de los portadores de la variante p.[Tyr400_Phe402del] habían desarrollado nefropatía y otros tantos polineuropatía diabética. No hubo diferencias entre grupos entre variables característicamente asociadas a la diabetes, como la edad, el IMC, el perímetro de la cintura o las cifras de presión arterial. La prevalencia de ECV establecida fue casi el doble entre los portadores de la mutación que entre el resto (31 vs. 14%), aunque estas diferencias no alcanzaron significación estadística. Los niveles basales de C-LDL y triglicéridos eran mayores en los portadores de p.[Tyr400_Phe402del], sin embargo, no había diferencias en los lípidos postratamiento entre grupos. En cuanto al tratamiento, un porcentaje elevado de participantes estaba en tratamiento con estatinas de alta intensidad y ezetimiba, sin diferencias entre grupos, pero el uso de iPCSK9 fue mayor entre los portadores de la mutación fundadora (51,5 vs. 24%, p=0,027). No hubo diferencias ni en la edad de inicio de las estatinas ni en el tiempo total de tratamiento.
Comparación de las características clínicas y bioquímicas de los portadores de la mutación p.[Tyr400_Phe402del] con los portadores de otras mutaciones en LDLR
| Portadores de p.[Tyr400_Phe402del] | Portadores de otras mutaciones en LDLR | p | |
|---|---|---|---|
| Número de sujetos | 68 | 21 | |
| Edad (años) | 55,5±12,4 | 55±13 | 0,885 |
| Sexo (mujer, %) | 58,8 | 62,5 | 0,803 |
| Tabaco (%) | 0,017 | ||
| Sí | 16,2 | 5,6 | |
| No | 58,8 | 88,8 | |
| Exfumador | 25 | 5,6 | |
| Hipertensión arterial (%) | 47,1 | 38,1 | 0,473 |
| Diabetes (%) | 25 | 4,8 | 0,045 |
| Edad diagnóstico diabetes (años) | 54,8±8,9 | 76a | |
| Tiempo evolución diabetes (años) | 6 (4-10) | 2 | 0,222 |
| AF de primer grado de diabetes (%) | 51,5 | 5 | 0,000 |
| Complicaciones de diabetesb(%) | 0 | 0,537 | |
| Retinopatía | 5,9 | 0 | |
| Nefropatía | 11,8 | 0 | |
| Neuropatía | 11,8 | 0 | |
| ECV | 53 | 0 | |
| Tratamiento de diabetesb(%) | 0,555 | ||
| AO solos | 70,6 | 100 | |
| AO+a GLP1 | 11,8 | 0 | |
| Insulina+a GLP1 | 5,9 | 0 | |
| AO+insulina | 11,8 | 0 | |
| ECV (%) | 30,9 | 14,3 | 0,136 |
| Cardiopatía isquémica | 20/21 | 2/3 | |
| ACV | 1/20 | 1/3 | |
| Edad comienzo ECV (años) | 45,5±9,3 | 45,3±13,6 | 0,981 |
| Peso (kg) | 74,9±12,8 | 77,7±19,2 | 0,537 |
| IMC (kg/m2) | 27,5±-4,7 | 29,1±6,4 | 0,308 |
| PAS | 130±19 | 129±21 | 0,689 |
| PAD | 82±12 | 80±10 | 0,579 |
| Cintura (cm) | 92,5 (82-101) | 92 (82-125) | 0,424 |
| Xantomas (%) | 32,3 | 52,4 | 0,124 |
| Colesterol total (mg/dL) | |||
| Basal | 380,9±74,7 | 354,5 (45,9) | 0,057 |
| Actual | 190±68 | 188,6±39 | 0,904 |
| C-HDL (mg/dL) | |||
| Basal | 53±14,6 | 59±15,2 | 0,143 |
| Actual | 51±10 | 53,4±13 | 0,441 |
| C-LDL (mg/dL) | |||
| Basal | 299,7±74,8 | 273,5±42,2 | 0,048 |
| Actual | 112,7±57,2 | 108,7±36 | 0,708 |
| Triglicéridos (mg/dL) | |||
| Basal | 131 (91-184) | 100 (72-136) | 0,015 |
| Actual | 103 (81-167) | 127 (72-176) | 0,809 |
| Lp(a) (mg/dL) | 55 (18-101) | 37,5 (12-86,5) | 0,488 |
| Glucosa basal (mg/dL) | 101 (91-112) | 103±19 | 0,786 |
| HbA1c (%) | 5,5 (5,3-5,8) | 5,4 (5,1-5,5) | 0,057 |
| Tratamiento estatinas (%) | 100 | 95,2 | 1,000 |
| Rosuvastatina | 57,4 | 57,1 | |
| Atorvastatina | 32,4 | 33,3 | 0,983 |
| Simvastatina | 1,5 | 0 | |
| Pitavastatina | 1,5 | 4,8 | |
| Pravastatina | 7,4 | 4,8 | |
| Edad de inicio estatinas (años) | 32,4±11,9 | 34,7±13,7 | 0,487 |
| Duración de tratamiento estatinas (años) | 23±11,3 | 20±12,3 | 0,313 |
| Ezetimibe (%) | 75 | 71,4 | 0,745 |
| Resinas (%) | 6 | 0 | 0,258 |
| iPCSK9 (%) | 51,5 | 24 | 0,027 |
| Alirocumab 75mg | 34,3 | 40 | |
| Alirocumab 150mg | 60 | 40 | 0,870 |
| Evolocumab 140mg | 5,7 | 20 |
ACV: accidente cerebrovascular; AF: antecedentes familiares; AO: agentes orales; ECV: enfermedad cardiovascular; HbA1c: hemoglobina glucada; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; iPCSK9: inhibidores de PCSK9; LDL: lipoproteínas de baja densidad; Lp(a): lipoproteína (a); PAD: presión arterial diastólica; PAS: presión arterial sistólica.
El valor p < 0,05 queda señalado en negrita, en cada caso.
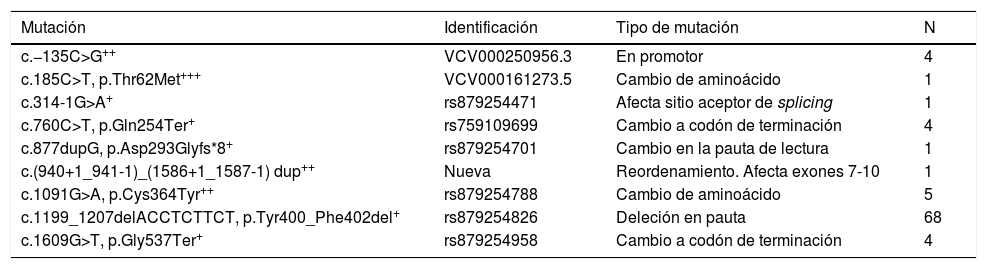
Además de p.[Tyr400_Phe402del], se encontraron otras 8 mutaciones patogénicas o posiblemente patogénicas en el gen LDLR (tabla 2). La mutación fundadora es una deleción de 3 aminoácidos en el dominio YWTD de la proteína, que podría afectar la interacción con PCSK9 y/o su procesamiento4. La [c.877dupG, p.Asp293Glyfs*8] se describió por primera vez en esta población4, es una duplicación que rompe el marco de lectura generando una proteína truncada, identificada en un varón de 45 años con cardiopatía isquémica a los 33 años y unos niveles sin tratamiento de colesterol total de 346mg/dl y C-LDL de 258mg/dl. La variante c.(940+1_941-1)_(1586+1_1587-1) dup, no estaba descrita previamente y es un reordenamiento con alteración del empalme que afecta a los exones 7-10, generando un alelo nulo, y se identificó en un paciente varón de 42 años con niveles de colesterol total y C-LDL de 340mg/dl y 274mg/dl respectivamente, con 2 hermanos con hipercolesterolemia y cardiopatía isquémica a los 40 años.
Mutaciones encontradas en la población
| Mutación | Identificación | Tipo de mutación | N |
|---|---|---|---|
| c.−135C>G++ | VCV000250956.3 | En promotor | 4 |
| c.185C>T, p.Thr62Met+++ | VCV000161273.5 | Cambio de aminoácido | 1 |
| c.314-1G>A+ | rs879254471 | Afecta sitio aceptor de splicing | 1 |
| c.760C>T, p.Gln254Ter+ | rs759109699 | Cambio a codón de terminación | 4 |
| c.877dupG, p.Asp293Glyfs*8+ | rs879254701 | Cambio en la pauta de lectura | 1 |
| c.(940+1_941-1)_(1586+1_1587-1) dup++ | Nueva | Reordenamiento. Afecta exones 7-10 | 1 |
| c.1091G>A, p.Cys364Tyr++ | rs879254788 | Cambio de aminoácido | 5 |
| c.1199_1207delACCTCTTCT, p.Tyr400_Phe402del+ | rs879254826 | Deleción en pauta | 68 |
| c.1609G>T, p.Gly537Ter+ | rs879254958 | Cambio a codón de terminación | 4 |
Las numeraciones indicadas en la tabla se refieren al transcrito de referencia NM_000527.5, que origina el péptido de referencia NP_000518.1.
La identificación de las variantes se refiere a ClinVar (VCV; https://www.ncbi.nlm.nih.gov/clinvar) o a dbSNP (rs; https://www.ncbi.nlm.nih.gov/snp)
Este estudio confirma la observación inicial4 de que la población con la variante p.[Tyr400_Phe402del] en LDLR, una mutación fundadora de HF propia de Gran Canaria, tiene una alta prevalencia de DM (25%), mucho mayor que la existente entre los portadores de otras mutaciones en este gen procedentes de la isla (4%). Varios trabajos han estudiado la relación entre la HF y la DM y hasta ahora se ha observado que el porcentaje de pacientes con DM en la población con HF es inferior al de la población general, siendo menor en aquellos con mutaciones más agresivas en LDLR5,11. Los datos encontrados en el grupo de HF con otras mutaciones en LDLR en nuestra población confirman esta baja prevalencia, a pesar de estar en tratamiento prolongado con estatinas de alta intensidad (20±12 años) y tener un IMC medio en rango de sobrepeso, que se asocia a un mayor riesgo de diabetes6. En el Registro Español de Dislipemias de la SEA se obtuvo una prevalencia de diabetes del 5,94% entre población con HF heterocigota, un 40% menor que la de la población general española. Los factores de riesgo para diabetes en dicho estudio fueron la edad, el sexo masculino, mayor IMC, presencia de hipertensión arterial, niveles elevados de triglicéridos y duración de tratamiento con estatinas. Sin embargo, la diabetes no se relacionó con las concentraciones basales de C-LDL ni con la presencia de ninguna mutación específica8.
La frecuencia de DM en los portadores de la mutación p.[Tyr400_Phe402del] se sitúa en niveles superiores a los de la población general española12 y a los observados anteriormente en la misma zona geográfica de Gran Canaria13. En la franja de edad de los pacientes del presente estudio, cuya edad media fue de 55,5±12 años, la prevalencia de diabetes en población general es del 10-15% en España12 y del 16,5% en Gran Canaria13. No se encontraron diferencias en la edad, IMC, perímetro de cintura, tiempo de tratamiento y edad de inicio con estatinas entre los 2 grupos analizados, factores que podrían explicar una mayor prevalencia de DM. Los portadores de p.[Tyr400_Phe402del] también exhibieron un perfil lipídico más adverso, con niveles más altos de C-LDL y triglicéridos, hallazgo que precisamente podría explicarse por la mayor frecuencia de DM. Este hallazgo coincide con un estudio reciente de pacientes con DM tipo 2 y HF del Registro nacional de la SEA14. Además, el aclaramiento de partículas ricas en triglicéridos también se realiza en parte a través del receptor de LDL. La mayor concentración de triglicéridos en este grupo de pacientes podría estar alternativamente asociada a efectos singulares de la propia mutación. Esta hipertrigliceridemia podría contribuir al desarrollo de resistencia a la insulina y disfunción de las células beta, aumentando la susceptibilidad a la diabetes15.
En cuanto a las complicaciones, los pacientes con DM no presentaban muchas complicaciones microvasculares, pero sí un alto porcentaje de ECV establecida (53%). La DM constituye un factor de riesgo independiente para el desarrollo de ECV en pacientes con HF14 y esto podría explicar la mayor frecuencia de ECV en los portadores de la p.[Tyr400_Phe402del] (31 vs. 14%).
Por último, el grupo de sujetos con la mutación fundadora requería con más frecuencia de tratamiento con iPCSK9 (51,5 vs. 24%, p=0,027). En los últimos años han aparecido estudios que relacionan el uso de iPCSK9 con aumentos significativos de los niveles de glucosa y HbA1c16, por lo que se ha planteado una posible relación entre la actividad de PCSK9 con el metabolismo hidrocarbonado17. La mutación p.[Tyr400_Phe402del] afecta al dominio YWTD, altamente conservado, lo que podría suponer una mayor afinidad por PCSK94. Esto último podría indicar que determinadas vías metabólicas, tal vez afectando directa o indirectamente la actividad de PCSK9, podrían inducir simultáneamente hipercolesterolemia, resistencia a la insulina y alteración del metabolismo de la glucosa. Asimismo, no es descartable que en esta población de aislamiento genético puedan existir anomalías genéticas, aún no conocidas, que pudieran segregar conjuntamente con la mutación p.[Tyr400_Phe402del], ya sea porque se encuentran en ligamiento o porque se hallan con mayor frecuencia en este grupo, al poseer todos sus miembros un antepasado común. Estas nuevas variantes genéticas, aún desconocidas, serían entonces las que pudieran modificar la homeostasis de la glucosa en los portadores de esta mutación en LDLR, con efectos contradictorios a los que parecen provocar otras mutaciones patogénicas ya conocidas.
ConclusionesLa isla de Gran Canaria es una región de aislamiento genético para la mutación p.[Tyr400_Phe402del] de LDLR. Esta mutación se asocia con una prevalencia muy elevada de diabetes, que podría explicar el fenotipo más adverso de estos pacientes. Esta alta prevalencia no se explica por factores de riesgo para diabetes, como la edad, el sobrepeso, la obesidad o el tratamiento prolongado con estatinas. Son necesarios estudios familiares más amplios para valorar la agregación entre esta mutación y la diabetes, con el fin de explicar mejor este hallazgo.
LimitacionesLa principal limitación de este trabajo es el tamaño muestral, particularmente por lo que respecta a los sujetos con HF portadores de mutaciones no prevalentes. Esto dificulta la estimación de la prevalencia de diabetes dentro de ese grupo. Sin embargo, la prevalencia en el grupo de portadores de la p.(Tyr400_Phe402del), que es un grupo mayor, es superior a la población española y canaria y esto da robustez a la observación.
Otra limitación es que no se midieron los niveles de insulina plasmática y no es posible comprobar si existen diferencias entre grupos en cuanto a la insulin-resistencia (HOMA-IR) o a parámetros de disfunción de la célula beta (HOMA-beta).
FinanciaciónEste trabajo ha recibido financiación de la Sociedad Española de Arterioesclerosis, España (Beca Clínico-Epidemiológica 2015) y del Colegio Oficial de Médicos de Las Palmas, España (Beca González Jaraba 2015).
Conflicto de interesesLos autores declaran no tener conflictos de interés relacionados con este trabajo.