Las concentraciones elevadas de fitoesteroles plasmáticos, que reflejan una mayor absorción intestinal de colesterol se han relacionado con un aumento del riesgo cardiovascular. Sin embargo, una situación de riesgo alto, el síndrome metabólico (SM), se asocia a un aumento de la síntesis y una disminución de la absorción de colesterol y, por tanto, a una menor fitoesterolemia. En este estudio hemos investigado la relación entre los fitoesteroles del plasma y la dieta y la presencia de factores de riesgo cardiovascular, incluidos los componentes del SM.
Métodos y resultadosEn un estudio transversal, se evaluaron la ingesta de fitoesteroles y concentraciones plasmáticas de esteroles nocolesterol ajustadas por colesterol en 592 individuos sanos de la cohorte española del estudio EPIC (European Prospective Investigation into Cancer and Nutrition) fenotipados para factores de riesgo cardiovascular, incluidas las variables del SM. La ingesta de fitoesteroles, que se asoció a alimentos saludables, y el colesterol unido a lipoproteínas de alta densidad (HDL) aumentaron, y las medidas de adiposidad, cociente colesterol/ HDL y concentraciones de glucosa, triglicéridos y latosterol, un precursor del colesterol, disminuyeron con los terciles de sitosterol plasmático ajustado por colesterol (p<0,05; todos). Los resultados para latosterol fueron opuestos a los de sitosterol. El genotipo de la apolipoproteína E no se relacionó con los terciles de esteroles no-colesterol del plasma. Las odds ratio (OR) ajustadas de ser portador de un SM o sus componentes para el tercil superior de sitosterol plasmático comparado con el inferior oscilaron entre 0,23 y 0,42 (p<0,05; todas). Las OR de las mismas variables para los terciles respectivos de latosterol variaron entre 1,99 y 3,00 (p<0,05; todas)
ConclusionesEl SM se asocia a un aumento de latosterol, marcador de la síntesis de colesterol, y una disminución de sitosterol, marcador a la vez de absorción de colesterol y de una dieta saludable. Por tanto, las concentraciones elevadas de fitoesteroles se relacionan con un riesgo cardiometabólico menor.
Increased plasma phytosterols, which reflect increased cholesterol absorption, have been related to an increased cardiovascular risk. However, the metabolic syndrome (MetS), a cluster of risk factors that carries a high risk for cardiovascular diseases, has been associated with increased cholesterol synthesis and reduced cholesterol absorption, which translate into lower plasma phytosterol levels. In this study we investigated the relationships between plasma and dietary phytosterols and cardiovascular risk factors, including the components of MetS.
Methods and resultsIn a cross-sectional study, we measured phytosterol intake and cholesteroladjusted plasma non-cholesterol sterol levels in 592 healthy subjects of the Spanish EPIC (European Prospective Investigation into Cancer and Nutrition) cohort who were phenotyped for cardiovascular risk factors, including MetS constituents. Phytosterol intake, which reflects healthy food choices, and the HDL-cholesterol level increased and adiposity measures, cholesterol/HDL ratios, and glucose levels, triglycerides and lathosterol, a cholesterol synthesis marker, decreased across tertiles of plasma sitosterol-to-cholesterol ratios (P<0.05; all). Results were inverse for plasma lathosterol. The ApoE genotype was unrelated to plasma non-cholesterol sterol tertiles. The multivariable-adjusted odds ratios (OR) for the MetS and its components across the lowest to the highest plasma sitosterol tertile ranged between 0.23 and 0.42 (P<0.05; all). The OR for the same variables across respective lathosterol tertiles ranged between 1.99 and 3.00 (P<0.05; all).
ConclusionsThe MetS is associated with increased plasma lathosterol, a cholesterol synthesis marker, and decreased plasma sitosterol, a joint marker of cholesterol absorption and a healthy diet. Thus, elevated plasma phytosterol concentrations are related to a lower cardiometabolic risk.
Los esteroles que ingerimos con los alimentos se componen de colesterol de origen animal y esteroles vegetales o fitoesteroles. Los fitoesteroles son componentes importantes de los cereales integrales, frutos secos, semillas y aceites derivados, y, por tanto, de una dieta rica en vegetales. El sitosterol y el campesterol son las principales formas moleculares1. Estos compuestos se relacionan estructuralmente con el colesterol, pero su molécula tiene un peso molecular mayor y es más hidrofóbica, lo cual les confiere una afinidad mayor por las micelas intestinales. De este modo, el colesterol sería desplazado de las micelas y se limitaría la cantidad disponible para absorberlo2. Aunque es indiscutible que los fitoesteroles reducen la absorción intestinal del colesterol, y por esto se utilizan en dosis farmacológicas (1,5-2g) como agentes hipocolesteromiantes3, el mecanismo de este efecto no está aún completamente aclarado4. El contenido de fitoesteroles en la dieta habitual es similar al del colesterol (150-450mg/día)5, pero su absorción intestinal es menos eficiente. Debido a su baja absorción y rápida eliminación biliar, las concentraciones fisiológicas de fitoesteroles en plasma son del orden de 10-3 las de colesterol6.
La absorción baja de fitoesteroles, comparada con la de colesterol, se atribuye a una resecreción activa al lumen intestinal, un proceso que está mediado por los transportadores ABCG5 y ABCG8. Los defectos genéticos en estos transportadores7 causan sitosterolemia, una rara enfermedad autosómica recesiva que se caracteriza por hiperabsorción intestinal de esteroles, aumento de las concentraciones de fitoesteroles plasmáticos, xantomas y aterosclerosis acelerada. Debido al supuesto papel patogénico de la concentración elevada de fitoesteroles en la sitosterolemia, se ha propuesto que ésta podría ser también aterogénica en individuos no sitosterolémicos3,8,9.
Las concentraciones plasmáticas de campesterol o sitosterol y sus cocientes con el colesterol reflejan la eficiencia de la absorción intestinal de colesterol10, mientras que las de latosterol, un precursor del colesterol, son un buen índice de la síntesis endógena del esteroide11. Hay una relación recíproca entre síntesis y absorción de colesterol, de modo que las personas que sintetizan poco tienden a absorber mucho, y viceversa12, lo cual es coherente con el preciso control homeostático del metabolismo del colesterol. Desde hace tiempo se sabe que la obesidad se asocia con un aumento de la síntesis de colesterol13, y esto se ha confirmado en estudios recientes de Miettinen y Gylling14. Estos autores también han mostrado que el síndrome metabólico (SM) se caracteriza por una síntesis aumentada de colesterol (determinada por el incremento de las cifras plasmáticas de latosterol) junto con una absorción menor del esteroide (determinada por unas concentraciones plasmáticas disminuidas de fitoesteroles)15–17. Por tanto, hay una contradicción entre el presunto riesgo cardiovascular de las concentraciones moderadamente elevadas de fitoesteroles y el que la situación opuesta (concentraciones bajas de fitoesteroles) ocurra en el SM, una entidad de riesgo cardiovascular alto. Por otro lado, el consumo de una dieta naturalmente rica en fitoesteroles, y por tanto saludable, se asocia a incrementos modestos de las concentraciones plasmáticas de fitoesteroles11,18. Además, en 2 grandes estudios transversales recientes se ha mostrado una asociación inversa entre la ingesta de fitoesteroles con la dieta habitual y las concentraciones plasmáticas de colesterol total y de lipoproteínas de baja densidad (LDL)19,20, lo cual indica de nuevo que las concentraciones moderadamente elevadas de fitoesteroles se asocian a un riesgo cardiovascular menor y no a uno mayor. Para intentar resolver estas contradicciones, en la cohorte de población española del estudio European Prospective Investigation into Cancer and Nutrition (EPIC)21, hemos investigado los fitoesteroles de la dieta y del plasma en relación con la presencia de factores de riesgo cardiovascular, incluido el SM.
Pacientes y métodosDiseño del estudio y participantesEl EPIC es un estudio prospectivo y de colaboración entre 10 países europeos diseñado para investigar los determinantes dietéticos del cáncer22. La población española del estudio EPIC incluye a 41.440 individuos21. Los participantes eran voluntarios sanos, principalmente donantes de sangre, con una edad de 30–69 años en el momento de la selección. Entre octubre de 1992 y julio de 1996 se realizó la selección en 5 regiones, 3 en el norte (Asturias, Navarra y Guipúzcoa) y 2 en el sur (Murcia y Granada). Mediante entrevistas personales, cada participante proporcionó cuestionarios con información sobre características sociodemográficas; componentes del estilo de vida, incluido el consumo de alimentos y el hábito de fumar; e historia clínica, que comprendía el diagnóstico previo de hipertensión, hiperlipemia, diabetes mellitus o enfermedad cardiovascular y uso de medicamentos. De todos los participantes se obtuvieron medidas antropométricas (altura y peso, con el cálculo del índice de masa corporal [IMC] en kg/m2, y la circunferencia de la cintura) mediante procedimientos estándar y una muestra de sangre en tubos con citrato. La muestra de sangre se obtuvo tras ayuno nocturno en cerca de un 60% de los individuos del estudio. Todos los participantes firmaron el consentimiento informado al protocolo, que aprobaron los comités éticos y de investigación clínica correspondientes.
Los participantes en el presente estudio fueron 630 individuos, que se escogieron como controles sanos apareados por sexo, edad y tiempo de selección con casos de infarto de miocardio detectados durante un seguimiento medio de 10 años, cuyos datos constituyen la base de un estudio de casos y controles anidado dentro de la cohorte EPIC de España.
Definición del síndrome metabólicoDado que en la cohorte EPIC no se determinó la presión arterial en el momento de la selección, para este estudio se consideró una definición conservadora del SM por la presencia de 3 o más de los 4 criterios siguientes: obesidad visceral (circunferencia de cintura ≥ 88 para mujeres y ≥ 102 para varones); triglicéridos en ayunas (concentración ≥ 150mg/dl); glucosa en ayunas (concentración ≥ 110mg/dl y/o presencia de diabetes mellitus tipo 2); colesterol unido a lipoproteínas de alta densidad (cHDL) (concentración < 50mg/dl en mujeres y < 40mg/dl en varones)23.
Evaluación dietéticaLa información sobre la ingesta de comida durante el año previo a la selección se recogió mediante un cuestionario validado de historia dietética computarizado24,25. Se estructuró por comidas y se registró la frecuencia de consumo de alimentos, teniendo en cuenta la variación estacional. Aunque el cuestionario era abierto, contenía una lista de los alimentos y recetas más comunes. Aparte de la frecuencia, se registró el método de preparación y la cantidad de cada alimento consumido; el tamaño de la porción consumida se calculó a partir de medidas de fotografías, unidades naturales y medidas familiares. La cantidad final de cada alimento consumido se presenta como ingesta diaria en gramos. La ingesta de energía y nutrientes se estimó utilizando una tabla de conversión en una base de datos computarizada recopilada especialmente para el estudio EPIC de España26. La ingesta de fitoesteroles totales y sus componentes principales se estimó a partir de la base de datos de alimentos españoles desarrollada por Jiménez-Escrig et al27.
Análisis de laboratorioLas muestras de plasma y células sanguíneas (buffy coat) se codificaron y se remitieron a un laboratorio central para su conservación a −80 °C hasta el momento del análisis. La glucosa se midió por el método de glucosa-oxidasa en las muestras en ayunas. El colesterol y los triglicéridos se determinaron por procedimientos enzimáticos; los triglicéridos solo se midieron en las muestras en ayunas. El cHDL se cuantificó tras precipitación con ácido fofotúngstico y cloruro magnésico. La concentración de colesterol unido a LDL (cLDL) se calculó como colesterol total menos cHDL menos triglicéridos/5 cuando la concentración de triglicéridos era ≤ 300mg/dl en las muestras en ayunas, y por el método homogéneo de Daiichi Pure Chemicals Company (N-geneous® LDL, Genzyme Diagnostics, Cambridge, MA [Estados Unidos]) cuando los triglicéridos eran > 300mg/dl y en las muestras que no se recogieron en ayunas. Las determinaciones se hicieron en un autoanalizador ADVIA 1800 (Siemens Healthcare Diagnostics, Madrid [España]). Se obtuvo ácido desoxirribonucleico (ADN) genómico para determinar el genotipo de la apolipoproteína E (Apo E) mediante el método de Hixson y Vernier28.
Las concentraciones de los esteroles no-colesterol se determinaron por cromatografía de gases utilizando una modificación del método de Heinemann et al29. Como estándar interno se añadió al plasma 0,1ml de epicoprostanol (2μg). Tras hidrólisis alcalina, extracción y derivación a trimetilsilil ésteres, los esteroles se cuantificaron en una columna capilar no polar de 30-m (TRB-Esterol, Teknokroma, Barcelona [España]) equipada con detector de ionización de llama en un aparato de cromatografía de gases (AutosystemTM, Perkin Elmer, Norwalk, CT [Estados Unidos]). En cada serie se cuantificaron el latosterol, el campesterol y el sitosterol. Los esteroles se expresan como cocientes de colesterol (μg/mg colesterol). Los coeficientes de variación interanálisis e intraanálisis fueron de 5,0 y 3,2% para el latosterol, 1,9 y 1,6% para el campesterol y 2,0 y 1,8% para el sitosterol, respectivamente.
Análisis estadísticosLas variables se expresan como número (porcentaje). Los datos para las variables continuas se expresan como media ± desviación estándar (DE). La ingesta de fitoesteroles y las concentraciones plasmáticas de triglicéridos y esteroles no-colesterol tenían una distribución sesgada y sus valores se presentan como medianas y rangos intercuartílicos. Los participantes con más de 3 DE de la media de la ingesta de energía total diaria se excluyeron del análisis por datos dietéticos inverosímiles. La cohorte total se distribuyó en terciles de los cocientes esteroles no-colesterol/colesterol y las diferencias entre ellos se evaluaron mediante pruebas estadísticas ANOVA, χ2 o Kruskall-Wallis según fuera apropiado. La relación entre la ingesta de fitoesteroles y componentes de la dieta se analizó mediante regresión lineal. Para estimar las odds ratio (OR) ajustadas del SM y sus componentes y los correspondientes intervalos de confianza del 95% se utilizó un análisis de regresión logística. El riesgo se estimó como bruto (sin ajustar), ajustado por factores de riesgo cardiovascular no incluidos en la definición de SM (sexo, edad, tabaquismo y colesterol total) y con un ajuste adicional por ingesta de energía y nutrientes (proteínas, fibra, ácidos grasos saturados, monoinsaturados y poliinsaturados, alcohol y colesterol), incluidos los fitoesteroles de la dieta. Las pruebas estadísticas se realizaron con SPSS, versión 15.0 (SPSS Inc., Chicago, IL [Estados Unidos]) y la significación se estableció como p < 0,05.
ResultadosSe excluyó a 38 de los 630 participantes: 3 debido a una ingesta de energía fuera de rango y 35 porque falló la determinación de esteroles plasmáticos debido a una muestra insuficiente o en mal estado. La muestra final fue de 592 participantes (460 varones y 132 mujeres, con una edad media de 60,4 años).
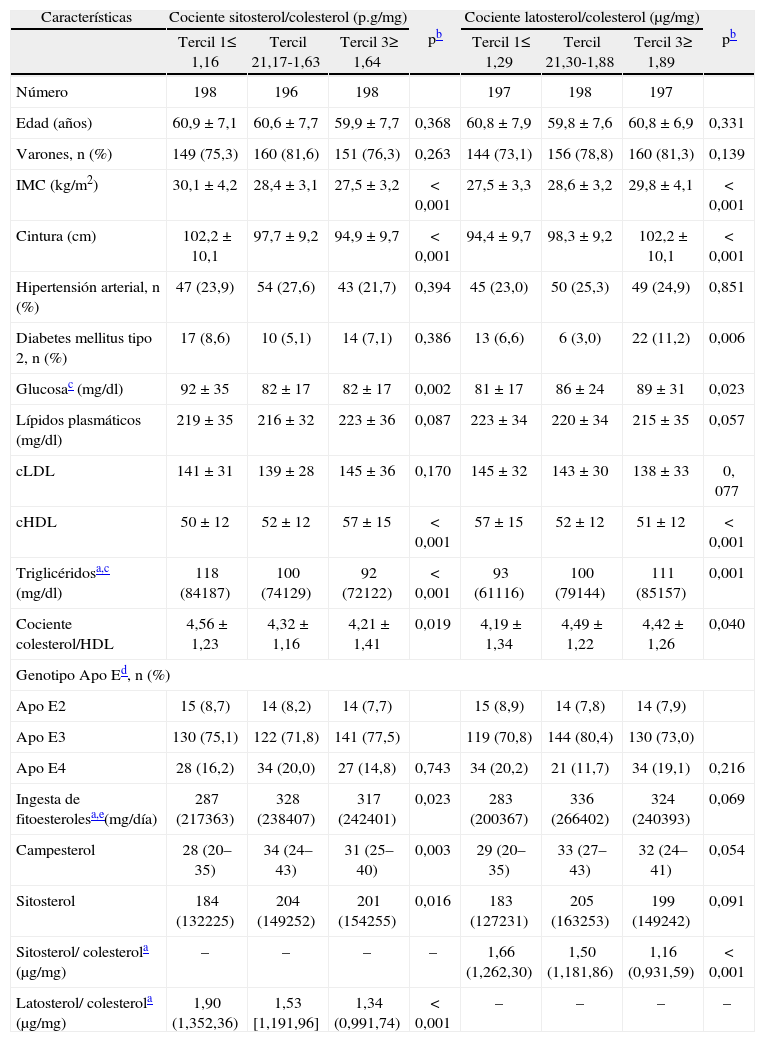
En la tabla 1 se muestra la distribución de los factores de riesgo cardiovascular, cocientes de esteroles no-colesterol plasmáticos e ingesta de fitoesteroles de la dieta en los diferentes terciles de los cocientes sitosterol/colesterol y latosterol/colesterol. Los terciles de sitosterol ajustado por colesterol se asociaron directamente con la concentración de cHDL y la ingesta de fitoesteroles e inversamente con el IMC, circunferencia de cintura, glucemia, trigliceridemia y cociente colesterol/HDL. Los terciles latosterol/colesterol se asociaron de forma recíproca que los de sitosterol/colesterol a estas mismas variables, con excepción de la ingesta de fitoesteroles, que siguió el mismo patrón. Las variantes del genotipo de la Apo E no se relacionaron con las cifras plasmáticas de esteroles no-colesterol. Los cocientes de latosterol y sitosterol con colesterol se asociaban inversamente entre ellos. Los cocientes campesterol/colesterol mostraron un comportamiento similar al del sitosterol (datos no mostrados).
Distribución de factores de riesgo cardiovascular e ingesta de fitoesteroles en función de los terciles de sitosterol y latosterol ajustados por colesterol en la población de estudio
| Características | Cociente sitosterol/colesterol (p.g/mg) | pb | Cociente latosterol/colesterol (μg/mg) | pb | ||||
| Tercil 1≤ 1,16 | Tercil 21,17-1,63 | Tercil 3≥ 1,64 | Tercil 1≤ 1,29 | Tercil 21,30-1,88 | Tercil 3≥ 1,89 | |||
| Número | 198 | 196 | 198 | 197 | 198 | 197 | ||
| Edad (años) | 60,9 ± 7,1 | 60,6 ± 7,7 | 59,9 ± 7,7 | 0,368 | 60,8 ± 7,9 | 59,8 ± 7,6 | 60,8 ± 6,9 | 0,331 |
| Varones, n (%) | 149 (75,3) | 160 (81,6) | 151 (76,3) | 0,263 | 144 (73,1) | 156 (78,8) | 160 (81,3) | 0,139 |
| IMC (kg/m2) | 30,1 ± 4,2 | 28,4 ± 3,1 | 27,5 ± 3,2 | < 0,001 | 27,5 ± 3,3 | 28,6 ± 3,2 | 29,8 ± 4,1 | < 0,001 |
| Cintura (cm) | 102,2 ± 10,1 | 97,7 ± 9,2 | 94,9 ± 9,7 | < 0,001 | 94,4 ± 9,7 | 98,3 ± 9,2 | 102,2 ± 10,1 | < 0,001 |
| Hipertensión arterial, n (%) | 47 (23,9) | 54 (27,6) | 43 (21,7) | 0,394 | 45 (23,0) | 50 (25,3) | 49 (24,9) | 0,851 |
| Diabetes mellitus tipo 2, n (%) | 17 (8,6) | 10 (5,1) | 14 (7,1) | 0,386 | 13 (6,6) | 6 (3,0) | 22 (11,2) | 0,006 |
| Glucosac (mg/dl) | 92 ± 35 | 82 ± 17 | 82 ± 17 | 0,002 | 81 ± 17 | 86 ± 24 | 89 ± 31 | 0,023 |
| Lípidos plasmáticos (mg/dl) | 219 ± 35 | 216 ± 32 | 223 ± 36 | 0,087 | 223 ± 34 | 220 ± 34 | 215 ± 35 | 0,057 |
| cLDL | 141 ± 31 | 139 ± 28 | 145 ± 36 | 0,170 | 145 ± 32 | 143 ± 30 | 138 ± 33 | 0, 077 |
| cHDL | 50 ± 12 | 52 ± 12 | 57 ± 15 | < 0,001 | 57 ± 15 | 52 ± 12 | 51 ± 12 | < 0,001 |
| Triglicéridosa,c (mg/dl) | 118 (84187) | 100 (74129) | 92 (72122) | < 0,001 | 93 (61116) | 100 (79144) | 111 (85157) | 0,001 |
| Cociente colesterol/HDL | 4,56 ± 1,23 | 4,32 ± 1,16 | 4,21 ± 1,41 | 0,019 | 4,19 ± 1,34 | 4,49 ± 1,22 | 4,42 ± 1,26 | 0,040 |
| Genotipo Apo Ed, n (%) | ||||||||
| Apo E2 | 15 (8,7) | 14 (8,2) | 14 (7,7) | 15 (8,9) | 14 (7,8) | 14 (7,9) | ||
| Apo E3 | 130 (75,1) | 122 (71,8) | 141 (77,5) | 119 (70,8) | 144 (80,4) | 130 (73,0) | ||
| Apo E4 | 28 (16,2) | 34 (20,0) | 27 (14,8) | 0,743 | 34 (20,2) | 21 (11,7) | 34 (19,1) | 0,216 |
| Ingesta de fitoesterolesa,e(mg/día) | 287 (217363) | 328 (238407) | 317 (242401) | 0,023 | 283 (200367) | 336 (266402) | 324 (240393) | 0,069 |
| Campesterol | 28 (20–35) | 34 (24–43) | 31 (25–40) | 0,003 | 29 (20–35) | 33 (27–43) | 32 (24–41) | 0,054 |
| Sitosterol | 184 (132225) | 204 (149252) | 201 (154255) | 0,016 | 183 (127231) | 205 (163253) | 199 (149242) | 0,091 |
| Sitosterol/ colesterola (μg/mg) | – | – | – | – | 1,66 (1,262,30) | 1,50 (1,181,86) | 1,16 (0,931,59) | < 0,001 |
| Latosterol/ colesterola (μg/mg) | 1,90 (1,352,36) | 1,53 [1,191,96] | 1,34 (0,991,74) | < 0,001 | – | – | – | – |
Apo: apolipoproteína; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal.
Los valores se expresan como media ± desviación estándar o cifras (porcentaje).
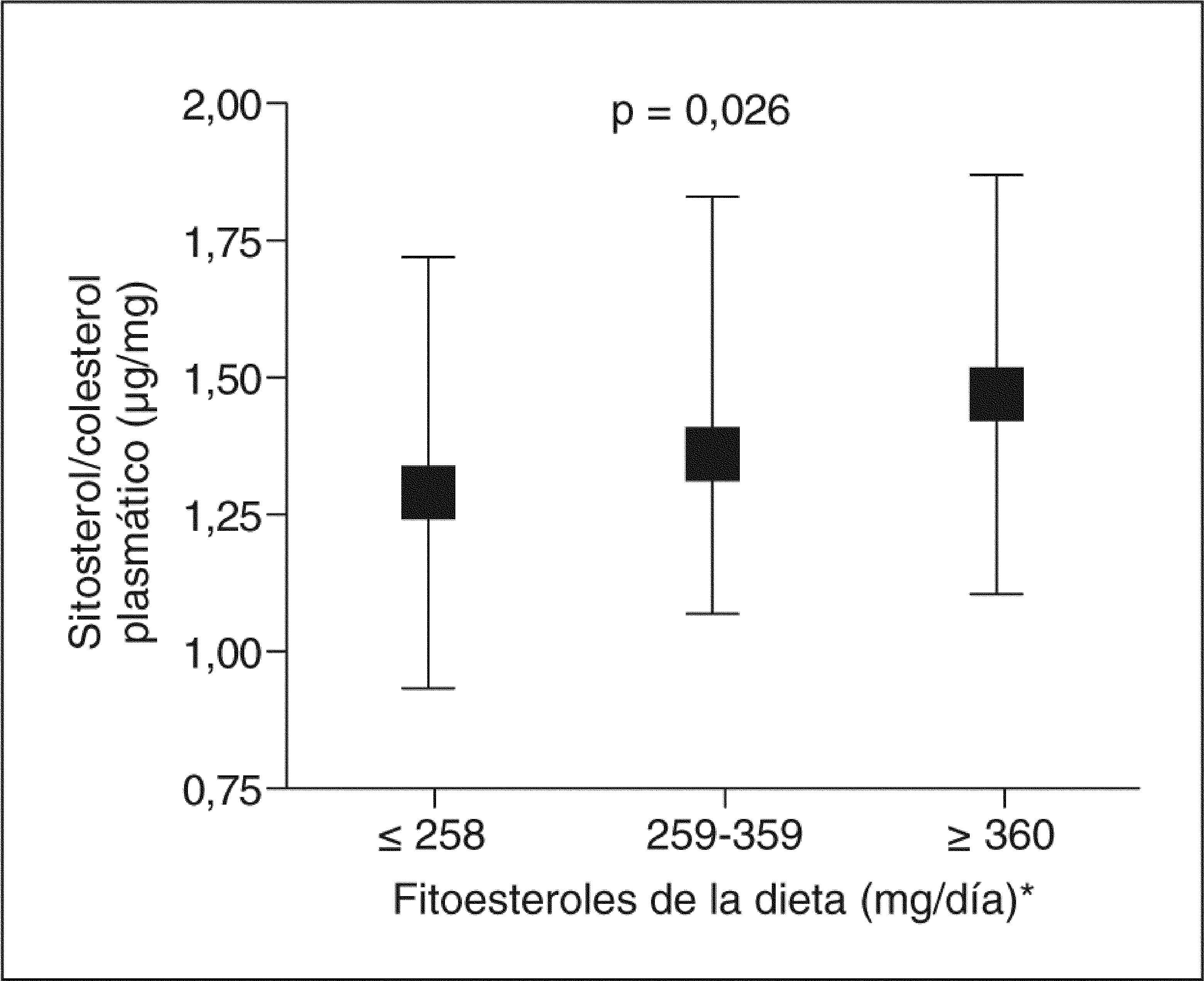
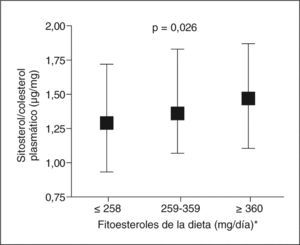
En la figura 1 se observa que el sitosterol plasmático ajustado por colesterol aumenta con la ingesta de fitoesteroles de la dieta. La ingesta media de fitoesteroles en toda la cohorte (n = 592) fue de 318mg/día, más elevada en varones (334mg/día, rango 82–851) que en mujeres (224mg/día, rango 84–501) (p < 0,001). Los valores de fitoesteroles dietéticos ajustados por sexo, edad y energía se correlacionaron directamente (p < 0,001) con la ingesta de verduras (r = 0,298), frutas (r = 0,446), legumbres (r = 0,277), cereales (r = 0,260), fibra (r = 0,598) y ácidos grasos poliinsaturados (r = 0,250) e inversamente (p < 0,001) con la ingesta de ácidos grasos saturados (r = −0,299) y colesterol (r = − 0,229). Se observaron asociaciones similares de la ingesta de los subtipos de fitoesteroles estimados (datos no mostrados).
Concentración de sitosterol plasmático ajustada por colesterol (mediana y rango intercuartil) según los terciles de ingesta de fitoesteroles. *El consumo de fitoesteroles totales comprende la suma de los principales fitoesteroles (campesterol, estigmasterol, sitosterol y esteroles no especificados).
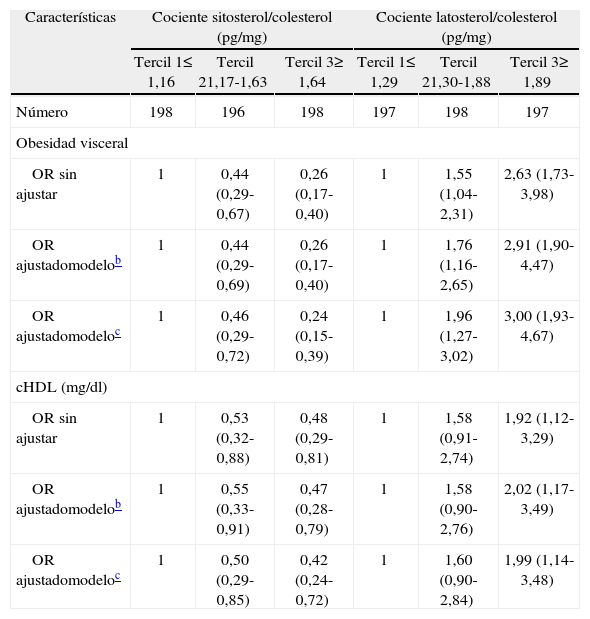
Se disponía de las variables circunferencia de cintura y cHDL en la cohorte total (n = 592), mientras que la glucemia y trigliceridemia sólo estaban disponibles en las muestras de plasma obtenidas en ayunas (n = 361). La prevalencia de estas variables (N y porcentaje) fue: obesidad visceral (349/592 = 59%), cHDL bajo (105/592 = 18%), glucosa alterada en ayunas o diabetes (36/361 = 10%) y aumento de triglicéridos (83/361 = 23%). Usando la definición conservadora del SM (sin el componente presión arterial elevada), su prevalencia fue de 38/361 = 11%. En la tabla 2 se muestran las OR brutas y ajustadas por diversos factores de confusión para los componentes evaluados del SM y el propio síndrome sin la presión arterial en los terciles de sitosterol y latosterol plasmático. En el modelo con ajuste multivariado completo, el tercil superior de sitosterol plasmático comparado con el tercil inferior se asociaba a una prevalencia menor de todos los componentes del SM y del propio síndrome (p < 0,05; todas). El latosterol siguió un patrón inverso, y se asoció a una prevalencia mayor de todos los componentes y del síndrome per se (p < 0,05; todas).
Odds ratio (intervalo de confianza del 95%) de los componentes del síndrome metabólico y del propio síndrome en función de los terciles de sitosterol y latosterol plasmáticos ajustados por colesterol en la cohorte EPIC de Españaa
| Características | Cociente sitosterol/colesterol (pg/mg) | Cociente latosterol/colesterol (pg/mg) | ||||
| Tercil 1≤ 1,16 | Tercil 21,17-1,63 | Tercil 3≥ 1,64 | Tercil 1≤ 1,29 | Tercil 21,30-1,88 | Tercil 3≥ 1,89 | |
| Número | 198 | 196 | 198 | 197 | 198 | 197 |
| Obesidad visceral | ||||||
| OR sin ajustar | 1 | 0,44 (0,29-0,67) | 0,26 (0,17-0,40) | 1 | 1,55 (1,04-2,31) | 2,63 (1,73-3,98) |
| OR ajustadomodelob | 1 | 0,44 (0,29-0,69) | 0,26 (0,17-0,40) | 1 | 1,76 (1,16-2,65) | 2,91 (1,90-4,47) |
| OR ajustadomodeloc | 1 | 0,46 (0,29-0,72) | 0,24 (0,15-0,39) | 1 | 1,96 (1,27-3,02) | 3,00 (1,93-4,67) |
| cHDL (mg/dl) | ||||||
| OR sin ajustar | 1 | 0,53 (0,32-0,88) | 0,48 (0,29-0,81) | 1 | 1,58 (0,91-2,74) | 1,92 (1,12-3,29) |
| OR ajustadomodelob | 1 | 0,55 (0,33-0,91) | 0,47 (0,28-0,79) | 1 | 1,58 (0,90-2,76) | 2,02 (1,17-3,49) |
| OR ajustadomodeloc | 1 | 0,50 (0,29-0,85) | 0,42 (0,24-0,72) | 1 | 1,60 (0,90-2,84) | 1,99 (1,14-3,48) |
| Tercil 1≤ 1,19 | Tercil 21,20-1,68 | Tercil 3≥ 1,69 | Tercil 1≤ 1,37 | Tercil 21,38-1,96 | Tercil 3≥ 1,97 | |
| Número | 120 | 121 | 120 | 121 | 120 | 120 |
| Glucosa (mg/dl) | ||||||
| OR sin ajustar | 1 | 0,46 (0,20-1,06) | 0,46 (0,20-1,07) | 1 | 1,98 (0,76-5,15) | 2,51 (0,99-6,33) |
| OR ajustadomodelob | 1 | 0,45 (0,19-1,07) | 0,41 (0,17-0,99) | 1 | 2,14 (0,80-5,72) | 2,77 (1,06-7,24) |
| OR ajustadomodeloc | 1 | 0,41 (0,16-1,06) | 0,35 (0,14-0,91) | 1 | 2,04 (0,73-5,69) | 2,84 (1,04-7,80) |
| Triglicéridos (mg/dl) | ||||||
| OR sin ajustar | 1 | 0,43 (0,24-0,76) | 0,25 (0,13-0,48) | 1 | 1,99 (1,04-3,80) | 2,26 (1,19-4,29) |
| OR ajustadomodelob | 1 | 0,40 (0,21-0,74) | 0,17 (0,08-0,34) | 1 | 2,03 (1,03-3,99) | 2,75 (1,40-5,38) |
| OR ajustadomodeloc | 1 | 0,38 (0,20-0,73) | 0,15 (0,07-0,33) | 1 | 1,99 (0,99-3,98) | 2,62 (1,31-5,24) |
| Síndrome metabólico | ||||||
| OR sin ajustar | 1 | 0,26 (0,11-0,63) | 0,30 (0,13-0,70) | 1 | 2,15 (0,84-5,53) | 2,69 (1,07-6,74) |
| OR ajustadomodelob | 1 | 0,26 (0,11-0,64) | 0,27 (0,11-0,64) | 1 | 2,26 (0,87-5,89) | 3,00 (1,17-7,66) |
| OR ajustadomodeloc | 1 | 0,25 (0,10-0,65) | 0,23 (0,09-0,60) | 1 | 2,29 (0,86-6,10) | 2,87 (1,09-7,60) |
cHDL: colesterol unido a lipoproteínas de alta densidad.
Los resultados de este estudio transversal en 592 participantes del estudio prospectivo EPIC de España indican que los componentes del SM, como la obesidad visceral, las concentraciones altas de glucosa y triglicéridos o bajas de cHDL, o la presencia del propio síndrome se asocian a un aumento de las concentraciones plasmáticas de latosterol (marcador de la síntesis de colesterol) y a una disminución de las de sitosterol (marcador de su absorción). El grupo de Miettinen10,14,30 ha descrito anteriormente la influencia de la obesidad, la diabetes mellitus y el SM en la homeostasis del colesterol. En nuestro estudio, la ingesta de fitoesteroles con la dieta habitual se relacionó con un aumento de sus concentraciones plasmáticas, lo cual confirma y extiende los resultados de estudios previos11,18. La relación recíproca entre la síntesis de colesterol, determinada por el cociente latosterol/colesterol, y su absorción, medida por el cociente sitosterol/colesterol (tabla 1), concuerda con la regulación precisa de la homeostasis del esteroide12. La novedad de nuestro trabajo ha sido unir en una sola investigación el estudio de los fitoesteroles del plasma con los datos de consumo de fitoesteroles con la dieta habitual, adiposidad, glucemia y perfil lipídico en una cohorte poblacional relativamente grande y no contaminada por la ingesta de alimentos funcionales enriquecidos en fitoesteroles. Los resultados indican que los fitoesteroles plasmáticos son a la vez marcadores de una dieta saludable y de un riesgo cardiometabólico menor.
La media de la ingesta de fitoesteroles (301mg/ día) en la cohorte EPIC-España fue similar a las descritas en otra población española27 y en el estudio EPIC-Norfolk19, pero mayor que la observada recientemente en población de Suecia19. Confirmando estudios previos19,20, el contenido dietético de fitoesteroles en nuestro estudio se correlacionó de forma positiva con el consumo de alimentos y nutrientes saludables, como frutas y semillas, proteína vegetal, fibra y ácidos grasos poliinsaturados, e inversamente con el de componentes poco saludables de la dieta, como proteína animal, ácidos grasos saturados y colesterol. Es importante resaltar que el sitosterol plasmático aumentó con el incremento de la ingesta de fitoesteroles de la dieta. En ausencia de suplementación con productos enriquecidos con fitoesteroles, que no estaban comercializados en España en el momento de la selección del estudio EPIC en 1992–1996, este hecho confirma que las concentraciones de fitoesteroles plasmáticos son un marcador de la ingesta de fitoesteroles de la dieta11,18, que a su vez refleja una alimentación saludable.
Además de la dieta, hay otros factores que pueden influir las concentraciones plasmáticas de fitoesteroles9. Se determinó el genotipo de la apoE porque los fitoesteroles circulantes son marcadores de la absorción de colesterol y esta proteína representa un papel importante en el transporte lipídico, si bien los resultados de estudios previos han sido inconsistentes9. En todo caso, las variantes de la Apo E no se relacionaron con los fitoesteroles circulantes en nuestro estudio. No estudiamos la variabilidad de los genes ABCG5/8, un factor hereditario que influye las concentraciones de fitoesteroles31. Un factor adicional que determina las cifras de esteroles circulantes es la adiposidad excesiva y resistencia a la insulina asociada, que se acompañan de un aumento de la síntesis de colesterol (incremento del latosterol plasmático) y una reducción de su absorción intestinal (disminución de la sitosterolemia)14–17. En personas con obesidad y diabetes mellitus, estas alteraciones revierten con la pérdida de peso30. Además, hay evidencias de que en la regulación de la homeostasis del colesterol hay una sinergia por la cual los cambios en la síntesis resultan en una respuesta opuesta de la absorción12. En concordancia con estos conceptos y de acuerdo con estudios previos32, nuestros resultados muestran que el marcador plasmático de absorción de sitosterol se asocia directamente con el cHDL e inversamente con la adiposidad, glucosa, triglicéridos y el marcador de síntesis de latosterol, mientras que el latosterol plasmático muestra unas asociaciones opuestas. Estos resultados se confirman en el análisis de regresión logística, en el que se muestran unas OR ajustadas de menor prevalencia del SM y sus componentes para las concentraciones más altas de sitosterol plasmático, así como el efecto contrario del aumento del latosterol. El hecho de tener una concentración elevada de sitosterol, que refleja a la vez un consumo alto de fitoesteroles con la dieta y una tasa absortiva elevada, disminuye entre un 58 y un 78% la probabilidad de ser portador de los componentes del SM o del propio síndrome, tal como se define en este estudio. En cambio, tener una síntesis elevada de colesterol, que se relaciona con una hipoabsorción intestinal de colesterol, obesidad visceral y resistencia a la insulina, la aumenta entre 2 y 3 veces.
Un factor adicional que influye la fitoesterolemia es el tratamiento con estatinas, debido a la disminución del colesterol circulante (el denominador del cociente) y al aumento compensatorio de la absorción intestinal de colesterol y sus marcadores (el numerador)9,30. Esto no incide en los resultados del presente estudio, dado que el uso de estatinas era infrecuente en el momento de la selección de la cohorte (1992–1996).
Nuestro estudio tiene limitaciones. La población estudiada fueron los controles apareados de casos infarto de miocardio de un estudio de casos y controles anidado dentro de la cohorte EPIC. Por esta razón, la proporción de varones es superior a la de mujeres y los resultados deben interpretarse en este contexto, si bien todas las OR se ajustaron por sexo. La presión arterial, uno de los factores del SM, no era una de las variables recogidas en el estudio EPIC. Por esto, nuestra definición de SM es parcial. Otra limitación del estudio es que una parte de las muestras de plasma se habían obtenido de sangre no recogida en ayunas, lo cual podría asociarse a pequeñas variaciones en las concentraciones de esteroles en comparación con las determinaciones en muestras obtenidas después de ayuno nocturno. Por este mismo motivo, la población en la que se pudieron evaluar los componentes del SM glucemia y trigliceridemia (en ayunas) era sólo una parte de la cohorte total. A pesar de esto, las asociaciones entre esteroles no-colesterol del plasma y todos los componentes del síndrome fueron significativas, apuntando a su potencia como marcadores de riesgo cardiometabólico.
En conclusión, nuestros resultados indican que las concentraciones moderadamente elevadas de fitoesteroles son marcadores de una dieta saludable, a la vez que reflejan una absorción intestinal elevada y una síntesis baja de colesterol, que se relacionan inversamente con la obesidad y el SM.