La preeclampsia es una afección caracterizada por daño vascular sistémico producido por factores liberados desde la placenta. Entre esos factores hay radicales libres de oxígeno, factores de crecimiento y citocinas inflamatorias producto de ciclos de hipoxia placentaria. Aunque hay evidencia de disfunción endotelial durante la preeclampsia, no la hay de cambios estructurales en la vasculatura periférica materna ni de la expresión de factores patológicos que se podría considerar de riesgo arteriosclerótico.
MétodosComparamos las concentraciones plasmáticas del factor de crecimiento de endotelio vascular y de su receptor soluble sFlt-1 entre 16 gestantes sanas y 24 con preeclampsia a término mediante pruebas de ELISA, relacionamos la expresión de los factores inducibles por hipoxia y CD40L mediante RT-PCR y Western blot de células endoteliales de la arteria humeral materna, y medimos el grosor mediointimal (GMI) y la vasodilatación mediada por flujo (DMF) mediante ultrasonografía vascular periférica. Se consideró un valor de p < 0,05 como estadísticamente significativo.
ResultadosLas pacientes preeclámpsicas presentaron elevadas concentraciones plasmáticas de sVEGFR-1/sFlt-1, lo que correlaciona directamente con la expresión de HIF-2α y CD40L en células endoteliales, mientras que HIF-1α se encontró disminuido significativamente. Curiosamente, el GMI se encontró incrementado en las gestantes preeclámpsicas, hecho que coincide con una disminución marcada en la DMF.
ConclusionesNuestros resultados demuestran que moléculas involucradas en la fisiopatología de la arteriosclerosis se encuentran incrementadas en la vasculatura periférica con un significativo engrosamiento de la íntima arterial de pacientes con preeclampsia, lo que predispone a una enfermedad arteriosclerótica materna tras el parto que puede ser extrapolada a un futuro riesgo neonatal.
Pre-eclampsia is a pathological condition characterized by vascular damage produced by systemic factors released from the placenta. These factors include oxygen free radicals, growth factors and inflammatory cytokines that are products released by the placenta during hypoxia cycles. Although, there is evidence of endothelial dysfunction during preeclampsia, there is no evidence of structural changes in the maternal peripheral vasculature or expression of pathological factors which could be considered as arteriosclerotic risk.
MethodsWe compared the plasma levels of vascular endothelial growth factor and its soluble receptor sVEGFR-1/sFlt-1 between 16 healthy pregnant women and 24 with pre-eclampsia at term, using the ELISA test. We correlated the expression of hypoxia-inducible factors and the CD40L by RT -PCR and Western blot of endothelial cells of the maternal brachial artery, and measured the Intima-Media- Thickness (IMT) and Flow- Mediated Vasodilation (FMD) by peripheral vascular ultrasound. A P value < 0.05 was considered as statistically significant.
ResultsThe pre-eclamptic women had high levels of plasma sVEGFR-1/sFlt-1, which directly correlated with the expression of HIF-2α and CD40L in endothelial cells, whereas HIF-1α was significantly diminished. Curiously, the IMT was increased in pregnant women with pre-eclampsia, coinciding with a marked decrease in the FMD.
ConclusionsOur results demonstrate that molecules involved in the pathophysiology of atherosclerosis are increased in the peripheral vasculature, with a significant thickening of the arterial intima of patients with pre-eclampsia, a condition that predisposes to maternal arteriosclerosis and could be extrapolated to a future neonatal risk.
La preeclampsia es una enfermedad que aparece con síntomas y signos vasculares tardíos de diferentes grados de severidad que ocasionan un grave riesgo maternofetal1,2. Pese a las diferentes hipótesis de su fisiopatología, todas concuerdan en que el proceso se debe a un fallo en la implantación y la deficiente remodelación de las arterias espirales uterinas que llevan a una mala perfusión sanguínea con zonas de isquemia placentaria3,4. Diversos factores inflamatorios son liberados de estas áreas poco perfundidas a la circulación maternofetal y ocasionan daño vascular, evidenciado por la disfunción endotelial característica en esta enfermedad5,6. Recientemente se ha demostrado que los ciclos de hipoxia placentaria incrementan la expresión de novo de moléculas antiangiogénicas como el receptor soluble 1 del factor de crecimiento de endotelio vascular (sVEGF-R1 o sFlt-1), el cual se une al factor de crecimiento de endotelio vascular (VEGF) y produce alteraciones en la remodelación vascular placentaria7-10. Es interesante que dicho receptor soluble sea regulado por el factor inducible por hipoxia 2α (HIF-2α) y no por HIF-1α, que modula la forma membranosa del receptor11. Curiosamente, parece que HIF-2α se acumula en las células trofoblásticas y mantiene una expresión constitutiva de sVEGF-R1/sFlt-1, con un mayor incremento durante los ciclos de hipoxia, con lo que se forma un ciclo de retroalimentación positiva que inhibe la remodelación arterial y empeora la isquemia en el curso de la gestación12. Así, la evidencia de la producción de moléculas estimuladas por hipoxia constituye un importante factor en la patogenia de la enfermedad, aunque su importancia como factor de riesgo sistémico de otras enfermedades cardiovasculares maternas o neonatales futuras, como la arteriosclerosis, no ha sido evaluada adecuadamente.
La arteriosclerosis es una afección progresiva que se inicia en etapas de la vida tempranas13, dado que la estría grasa y el engrosamiento de la íntima, que son lesiones iniciales de la aterogénesis, se han encontrado en las arterias coronarias de infantes y niños14,15. Lesiones con similar distribución a las de lesiones presentes en adultos se han detectado en coronarias de muchos recién nacidos y fetos13,16. En este contexto, un estudio reciente observó una susceptibilidad incrementada a la formación de alteraciones arterioscleróticas en arterias de adultos que habían sido expuestas a riesgos maternos arterioscleróticos durante la etapa intrauterina17. Sin embargo, en ese estudio, como en otro que evaluó aspectos de la dieta materna como riesgo en la arteriosclerosis temprana en el neonato18, no evaluaron a gestantes con preeclampsia, que son las que más suelen presentar daño vascular sistémico. Por otro lado, diferentes factores inflamatorios y procesos hipóxicos también han sido relacionados con la progresión de la inflamación crónica en arteriosclerosis19,20, lo que hace lógico pensar en un efecto importante de la disfunción endotelial durante la preeclampsia en la promoción de daños estructurales de la íntima arterial y la formación de placas arterioscleróticas por mecanismos inflamatorios crónicos al menos desde la segunda mitad del embarazo.
Dado que hay trabajos que encontraron el receptor soluble sVEGFR-1/sFlt-1 en plasma de gestantes con preeclampsia8,21, en el presente estudio se pretende evaluar la expresión de esta molécula y su regulador, HIF-2α, directamente en las células endoteliales de la arteria humeral materna, así como la expresión del ligando de CD40 (CD40L) una molécula inflamatoria que también se expresa en hipoxia y está involucrada en la afección arteriosclerótica20,22, con el objetivo de demostrar la expresión de dichos factores inflamatorios considerados marcadores de la enfermedad arteriosclerótica por parte de vasos arteriales maternos durante la preeclampsia. Además, medimos el grosor mediointimal (GMI), un fuerte predictor de eventos vasculares, en la arteria humeral, a la que se considera representativa de la funcionalidad arterial periférica23 para demostrar que existe daño estructural. Finalmente, la evaluación de la respuesta vasodilatadora pretende ratificar el estado de disfunción endotelial que se da en este tipo de pacientes5. En conjunto, estos datos permitirán entender de manera más integral el papel de la hipoxia y la inflamación vascular periférica en la preeclampsia iniciada por factores inflamatorios liberados a la circulación desde la placenta, lo que predispone a la formación futura de placas arterioscleróticas tanto en la madre como en el neonato.
Pacientes y métodoÉticaTodos los procedimientos y permisos para el uso de tejidos vaculares y análisis fueron aprobados por el Comité de Ética e Investigación del Hospital Nacional del Sur CASE EsSalud y por cada paciente mediante consentimiento informado.
PacientesSe examinó a 16 gestantes sanas (GS) (edad, 33 ± 3,3 años; gestación media, 34,2 ± 1,2 semanas) y 24 gestantes con preeclampsia (GP) (edad, 33,2 ± 4 años; gestación media, 34,4 ± 2,3 semanas). Ninguna de las gestantes tenía hábitos nocivos como tabaquismo o consumo de alcohol. Las gestantes fueron reclutadas durante 7 meses del Departamento de Obstetricia y Ginecología del Hospital Yanahuara y del Hospital Nacional CASE EsSalud. El diagnóstico de preeclampsia fue hecho según los criterios del Comité en Terminología del Colegio Americano de Obstetricia y Ginecología24. De manera resumida, estos criterios se basan en la aparición de dos de los tres signos alterados de la tríada presión arterial, proteinuria y edema. La presión arterial es considerada patológica cuando aparece una elevación sostenida de la presión sistólica ≥ 140mmHg y de la presión diastólica ≥ 90mmHg, en ausencia de hipertensión crónica, después de las 20 semanas de gestación. Todo valor debe ser confirmado con dos lecturas separadas 6h. La proteinuria, si aparece un valor ≥ 0,3g de proteína determinada en orina de 24h. Se considera edema cuando la retención de fluidos se evidencia en la cara y/o las extremidades superiores y/o inferiores por encima de las rodillas, o el incremento de peso es ≥ 500g en 1 semana. Se excluyó del estudio a las pacientes con enfermedad cardiovascular concomitante o con alguna enfermedad aguda o crónica, como infecciones, diabetes mellitus o cáncer, entre otras.
Dado que numerosos factores afectan a la reactividad vascular mediada por flujo (FMD), como la temperatura, los alimentos, las drogas y los estímulos simpáticos, las pacientes fueron evaluadas en habitaciones con temperatura controlada y espacios confortables, su medicación vasoactiva fue suspendida por al menos 4 veces el tiempo de vida media y se las instruyó sobre no ingerir sustancias como cafeína, comidas ricas en grasa y vitamina C al menos 4-6h antes del estudio.
Obtención de biopsias arterialesLos tejidos frescos de arteria humeral fueron obtenidos de las gestantes sanas y con preeclampsia incluidas en el estudio mediante cirugía según protocolos del Servicio de Cirugía Cardiovascular del hospital y publicaciones previas19. Las muestras arteriales se lavaron con suero salino y se congelaron en nitrógeno líquido hasta su análisis en el laboratorio. El procedimiento fue realizado durante la cesárea programada en todas las pacientes.
EnzimoinmunoanálisisEl plasma de las pacientes se recogió en tubos estériles con anticoagulante entre las 32 y las 36 semanas de gestación y 2 días después del parto y se almacenó a −20°C hasta el momento del análisis. Las concentraciones de VEGF libre y sVEGFR-1/sFlt-1 se determinaron utilizando ELISA tipo sandwich (R&D Systems). Las concentraciones de VEGF total (libre y unida) se evaluaron con enzimoinmunoanálisis competitivo (Chemikine EIA, Chemicon Internacional). Las dosis mínimas detectables de los análisis fueron 7,5pg/ml para VEGF libre, 10pg/ml para sVEGFR-1 y 150pg/ml para VEGF total. Cuando las concentraciones fueron menores que los límites detectables se registraron como cero.
RT-PCR en tiempo realPreviamente a la extracción del ARN total, el tejido fue homogeneizado con un Tekmar Tissuemizer durante 1min como ya se publicó12. El ARN total fue aislado de los tejidos arteriales utilizando un kit comercial de Trizol (Invitrogen Corp.). El ARN fue cuantificado por espectrofotometría, se trató con ADNasa libre de ARNasa y se pasó a cADN (Invitrogen Corp.). El cADN purificado se llevó a reacción de PCR en tiempo real. Las secuencias de los primers y las temperaturas de alineamiento para VEGF, sFlt-1, HIF-1α y HIF-2α ya se publicaron en otro trabajo12. Las secuencias flanqueadas para VEGF toman regiones compartidas de las moléculas variantes de VEGF. La secuencia del ligando de CD40 (CD40-L) fue la siguiente: sentido 5'-CACTGGGGAGAGCATTCAGG-3' y antisentido 5'-CAGAGAT GGTATGGGCAGAG-3'. Los transcriptos fueron cuantificados usando SYBR Green en un ABI Prism 7000 (Applied Biosystems) durante 40 ciclos y se analizaron con su propio software. Los datos del RT-PCR en tiempo real se presentan como expresión relativa luego de normalizar el valor del ciclo límite (CT) del gen de interés dividido entre el valor del CT del gen de betactina utilizado como control de carga. Cada muestra se analizó por triplicado y el valor del ciclo límite (CT) se evaluó en cada reacción.
Western blotLas proteínas totales de los tejidos arteriales fueron extraídas utilizando un tampón Laemmli 1X (50mmol de Tris-HCl [pH 6,8]; 2% de SDS y 10% de glicerol) que contenía 7mol de urea, 5mmol de ditiotreitol, 0,5mmol de fenilmetilsulfonilfluoruro y 1μg/ml de los inhibidores de proteasas leupeptina, aprotinina y pepstatina. Los tejidos fueron homogeneizados con un Tekmar Tissuemizer durante 1min. El crudo fue centrifugado a 6.000rpm a 4°C durante 5min y el sobrenadante fue sonicado moderadamente unos 10s. El sobrenadante luego se guardó a −70°C hasta su determinación.
Se cargó 30-50μg de proteína en geles de poliacrilamida al 12% que se sometieron a 100V durante 2,5h. Luego las proteínas fueron transferidas a membranas de nitrocelulosa con alta afinidad de unión a proteínas (90V por 2h a 4°C). La cantidad de carga y transferencia de proteínas se evaluó inicialmente por tinción con Ponceau-S (Sigma Diagnostics). Después de bloquear la unión inespecífica con el 5% de leche sin grasa en neutralizante Tris salino con el 0,1% de Tween 20 por 3h a temperatura ambiente, las membranas fueron incubadas con un anticuerpo monoclonal anti-HIF-1α (dilución 1:200, BD Biosciences), un anticuerpo policlonal contra HIF-2α (dilución 1:500, Novus Biologicals) o un anticuerpo anti-CD40L (2μl/ml, R&D systems). Se utilizó como control de carga un anticuerpo monoclonal antibetactínico (dilución 1:2000, Sigma Diagnostics). Las membranas fueron lavadas en el tampón TBS-T tres veces por 10min cada uno y fueron incubadas con un anticuerpo secundario conjugado a peroxidasa (dilución 1:5.000, Sigma Diagnostics) por 1h a temperatura ambiente. Las membranas fueron lavadas nuevamente en PBS con y sin Tween-20 tres veces por 10min. Para la quimioluminiscencia se usó un escáner con el programa NIH Image 1.63. La concentración de la proteína se determinó usando el kit Micro Bicinchoninic Acid Protein Assay (Pierce).
Medición del grosor mediointimal y la vasodilatación mediada por flujoLa función vasodilatadora se evaluó según protocolos ya publicados23,25. Las imágenes de la arteria humeral se obtuvieron longitudinalmente en el área superior del antebrazo con un traductor lineal de 12,5MHz (modelo ALOKA 5500, Tokio, Japón). La reactividad arterial se evaluó por las mañanas. Para crear el estímulo de flujo en la arteria humeral, se colocó un mango de esfigmomanómetro en la parte media del brazo y se insufló a 50mmHg por encima de la presión sistólica durante 5min para ocasionar isquemia. Las mediciones del diámetro arterial fueron tomadas antes de insuflar el mango (basal) y 0, 15, 30, 60 y 90s después de soltar el aire del mando (hiperemia reactiva). Se eligió este intervalo debido al hallazgo previo23 de que el máximo estímulo de dilatación es a los 60s. La vasodilatación mediada por flujo se determinó al calcular el cambio porcentual en el diámetro arterial con respecto al basal.
Las imágenes del GMI se tomaron antes del estímulo de flujo en la arteria humeral. Las mediciones ultrasonográficas fueron realizadas por un solo operador que no conocía el diagnóstico de la paciente evaluada.
Análisis estadísticoPrimeramente, los datos fueron analizados con la prueba de Kolmogorov-Smirnov para determinar su distribución. Las medias fueron comparadas usando la prueba de la t de Student y/o la de la U de Mann-Whitney según el tipo de distribución. El análisis de las diferencias entre medias de las mediciones repetidas de la vasodilatación mediada por flujo se obtuvo con prueba de ANOVA para mediciones repetidas, seguida de la prueba post-hoc de Newman-Keuls. En los análisis de resultados de RT-PCR en tiempo real, la cantidad de ARNm se expresa como el número de transcriptos de interés normalizados con betactina. Todos los valores se presentan en media ± desviación estándar y se consideró significativo p < 0,05.
ResultadosDe manera preliminar, los grupos de pacientes sanas (n = 16) y con preeclampsia (n = 24) incluidas en el estudio no presentaron diferencia estadísticamente significativa cuando se comparó la edad materna y la edad gestacional (p > 0,05 en ambas comparaciones). Ninguna de las pacientes tuvo complicaciones como eclampsia, síndrome HELLP u otro que haya requerido terminar el embarazo antes de las 38 semanas.
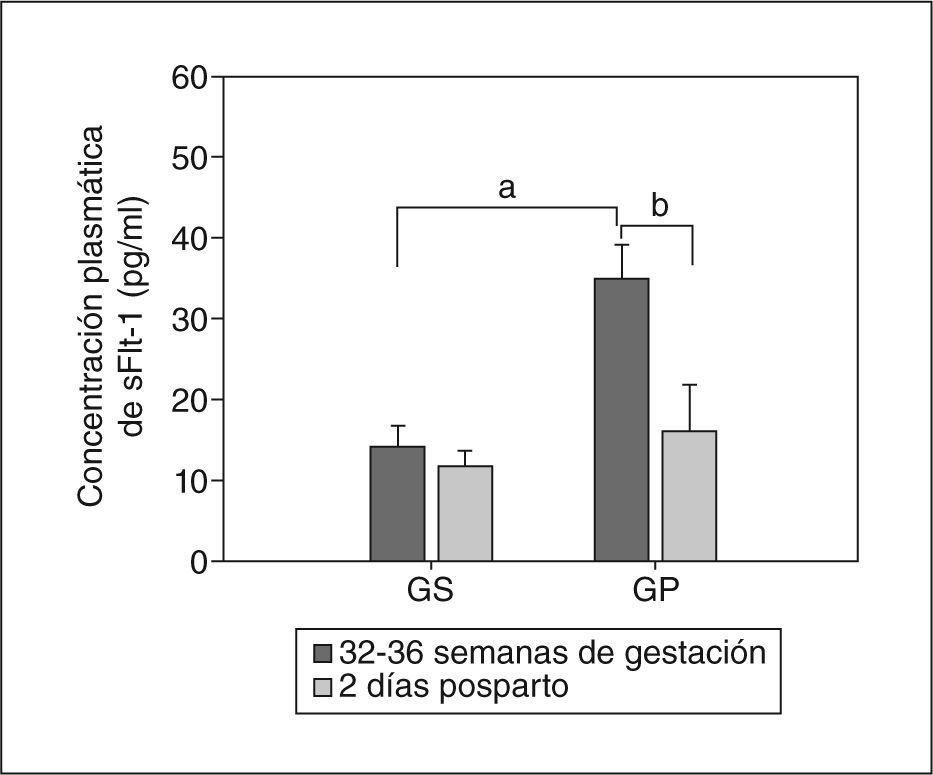
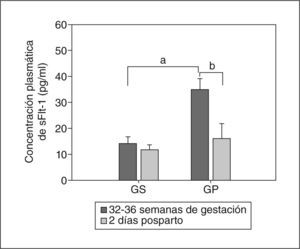
Valores de sVEGR-1/sFlt-1, VEGF total y VEGF libre en plasmaAnteriormente, nuestro grupo demostró12 la expresión y la secreción del receptor 1 soluble de VEGF (sVEGFR-1/sFlt-1) selectivamente por células trofoblásticas; sin embargo, no se evaluó su importancia a nivel circulatorio. Dado que es un factor altamente antiangiogénico, decidimos analizarlo conjuntamente con las concentraciones de VEGF. Los resultados fueron interesantes debido a que encontramos en mujeres preeclámpsicas valores plasmáticos de sVEGFR-1/sFlt-1 muy elevados respecto a las gestantes sanas (GP,35 ± 4,2 frente a GS, 14,3 ± 2,5pg/ml; p < 0,001) (fig. 1). Estos valores tomados en las semanas 32 a 36 de gestación disminuyeron abruptamente el segundo día tras el parto, retornando a valores similares y sin significación estadística (11,8 ± 1,9 frente a 16,2 ± 5,7pg/ml) (fig. 1).
Concentración plasmática del receptor 1 soluble de VEGF (sVEGFR-1/sFlt-1). La concentración se evaluó mediante ELISA entre las semanas 32 y 36 de gestación y 2 días después del parto. Los valores representan media ± desviación estándar. GP: gestantes con preeclampsia; GS: gestantes sanas..
ap < 0,01.
bp < 0,05.
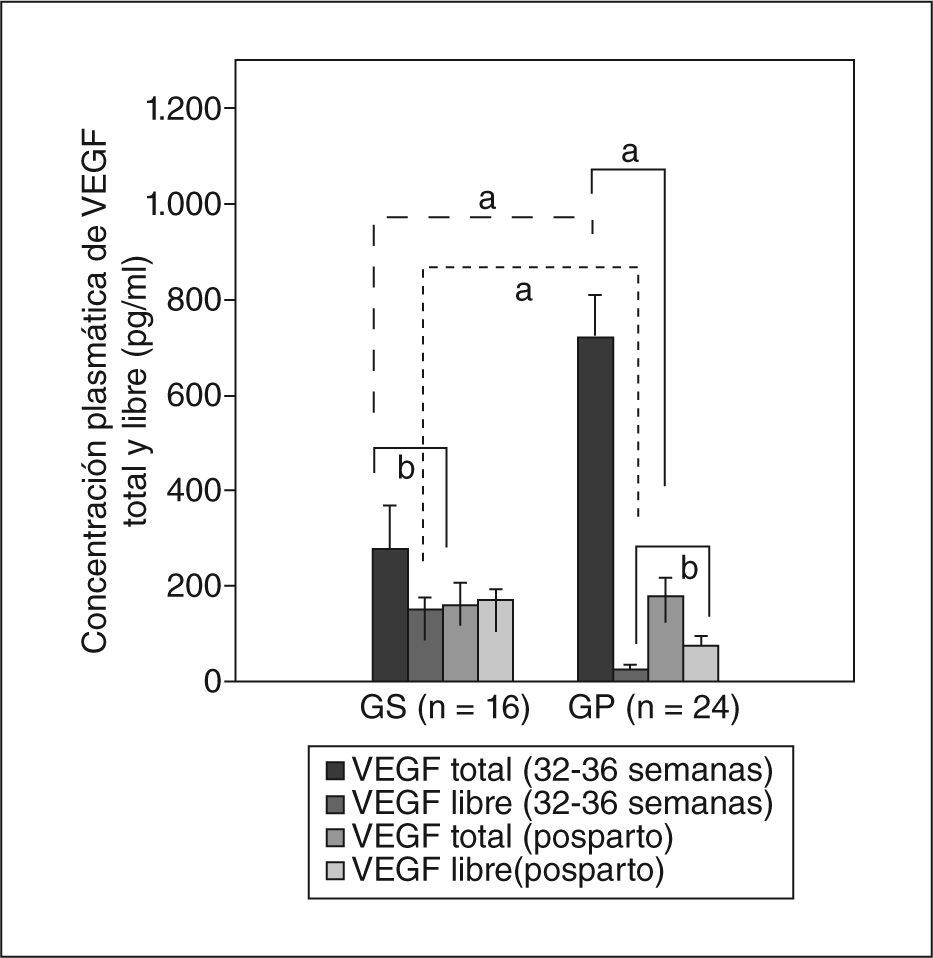
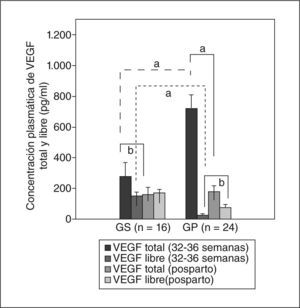
De manera coincidente con lo encontrado en el microambiente placentario, donde el VEGF total se encuentra mayormente unido a su receptor soluble, la concentración plasmática en las preeclámpsicas mostró un comportamiento similar. Los valores de VEGF total, evaluados entre las semanas 32 a 36 de gestación, fueron mucho mayores en las gestantes con preeclampsia que en las sanas de manera estadísticamente significativa (GP frente a GS, 720,3 ± 87,5 frente a 275,8 ± 91,4pg/ml; p < 0,001) (fig. 2). Contradictoriamente, los valores de VEGF libre se encontraron muy disminuidos en las gestantes con preeclampsia (21,8 ± 10,3 frente a 150,1 ± 23,7pg/ml; p < 0,001) (fig. 2). Dos días después del parto, los valores de VEGF total disminuyeron rápidamente a valores sin diferencia estadísticamente significativa entre ambos grupos (175,2 ± 39,9 frente a 160,4 ± 45,3pg/ml), mientras que los de VEGF libre se incrementaron significativamente en el grupo de gestantes preeclámpsicas respecto a los valores previos (72,7 ± 21pg/ml; p < 0,05). Los valores de VEGF libre en gestantes sanas se incrementaron sin diferencia estadísticamente significativa (170,2 ± 21,4pg/ml). Entre ambos grupos la diferencia continuó siendo estadísticamente significativa (p < 0,01) (fig. 2).
Concentraciones plasmáticas de VEGF total y VEGF libre en gestantes. La concentración se evaluó mediante ELISA entre las semanas 32 y 36 de gestación y 2 días después del parto. Los valores representan media ± desviación estándar GP: gestantes con preeclampsia; GS: gestantes sanas.
ap < 0,01.
bp < 0,05.
Para demostrar que el estado antiangiogénico originado en la placenta podía llevar a una retroalimentación positiva en la vasculatura periférica de manera similar a las células trofoblásticas, decidimos evaluar la expresión del sVEGR-1/sFlt-1 en células de la arteria humeral. Aunque este receptor se expresa selectivamente en células trofoblásticas y alternativamente en células endoteliales placentarias12, su expresión en endotelio periférico podría explicar mejor la disfunción endotelial sistémica en la preeclampsia.
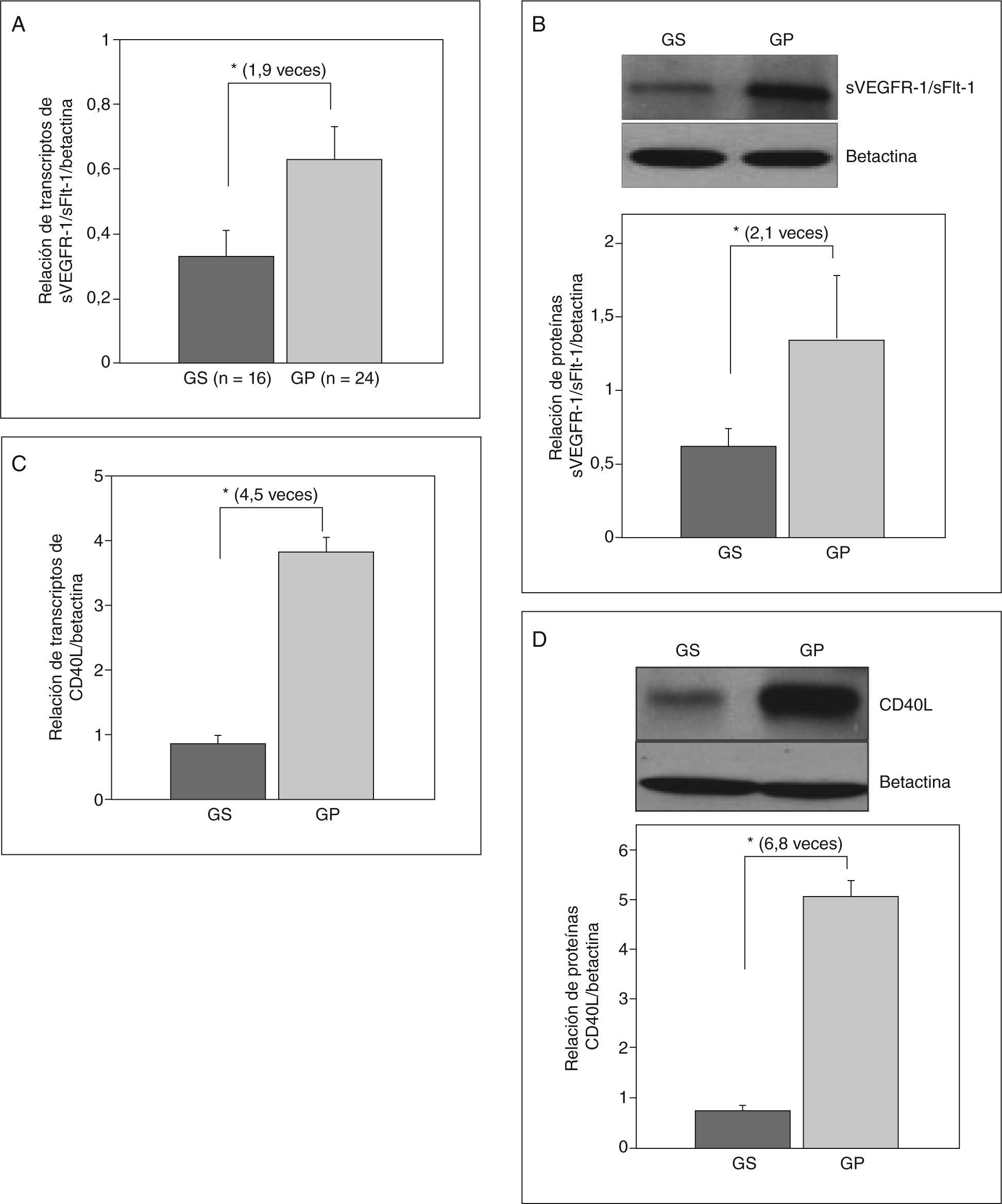
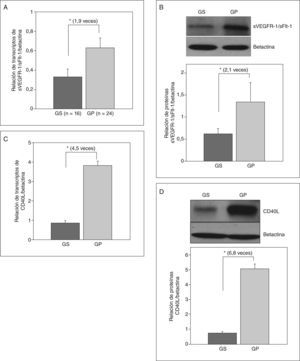
La expresión de ARNm de sVEGFR-1/sFlt-1 fue 1,9 veces mayor en gestantes con preeclampsia que en las gestantes sanas (expresión relativa, 0,63 ± 0,1 frente a 0,33 ± 0,08; p < 0,01) (fig. 3A). Asimismo, las concentraciones de la proteína fueron 2,1 veces más en las preeclámpsicas (relación proteína sFlt-1/betactina: 1,34 ± 0,44 frente a 0,62 ± 0,12; p < 0,01) (fig. 3B).
Expresión de ARN y proteína de sVEGFR-1/sFlt-1 y CD40L en la arteria humeral. A: relación de transcriptos de ARN del receptor soluble de VEGF/los transcriptos control (betactina) mediante RT-PCR en tiempo real. B: secreción de la proteína del receptor 1 soluble de VEGF expresada como una relación de la proteína obtenida/la proteína control (betactina) mediante Western blot. C: relación de transcriptos de ARN de CD40L/betactina. D: relación de la proteína de CD40L/betactina. Los valores representan media ± desviación estándar. GP: gestantes con preeclampsia; GS: gestantes sanas; VEGF: factor de crecimiento del endotelio vascular.
*p < 0,01.
Por otro lado, decidimos evaluar la expresión de la molécula CD40L, debido a que es el nexo perfecto entre factores hipóxicos placentarios con la expresión de factores angiogénicos e inflamatorios in situ como VEGF o su receptor21,26, además de que la alta concentración plasmática de CD40L ha sido considerada recientemente como un factor de riesgo arteriosclerótico27. Nuestros resultados mostraron que CD40L se expresa mucho en la vasculatura periférica de pacientes con preeclampsia, con cifras de ARN mensajero hasta 4,5 veces mayores que en las gestantes sanas (expresión relativa, 3,81 ± 0,22 frente a 0,852 ± 0,13; p < 0,001) (fig. 3C). La proteína de CD40L también fue 6,8 veces más en las preeclámpsicas que en las sanas (relación proteína CD40L/betactina, 5,06 ± 0,32 frente a 0,74 ± 0,1; p < 0,001) (fig. 3D).
Expresión de los factores inducidos por hipoxia (HIF-1α y 2α) en la arteria humeral maternaDebido a que el sVEGR-1/sFlt-1 se regula de manera selectiva a través del HIF-2α en las células trofoblásticas12, decidimos evaluar si dicha regulación también podría darse en la periferia por las células endoteliales. Además evaluamos si el factor HIF-1α involucrado en la regulación de diversos factores inflamatorios durante la hipoxia podría ser una alternativa paralela.
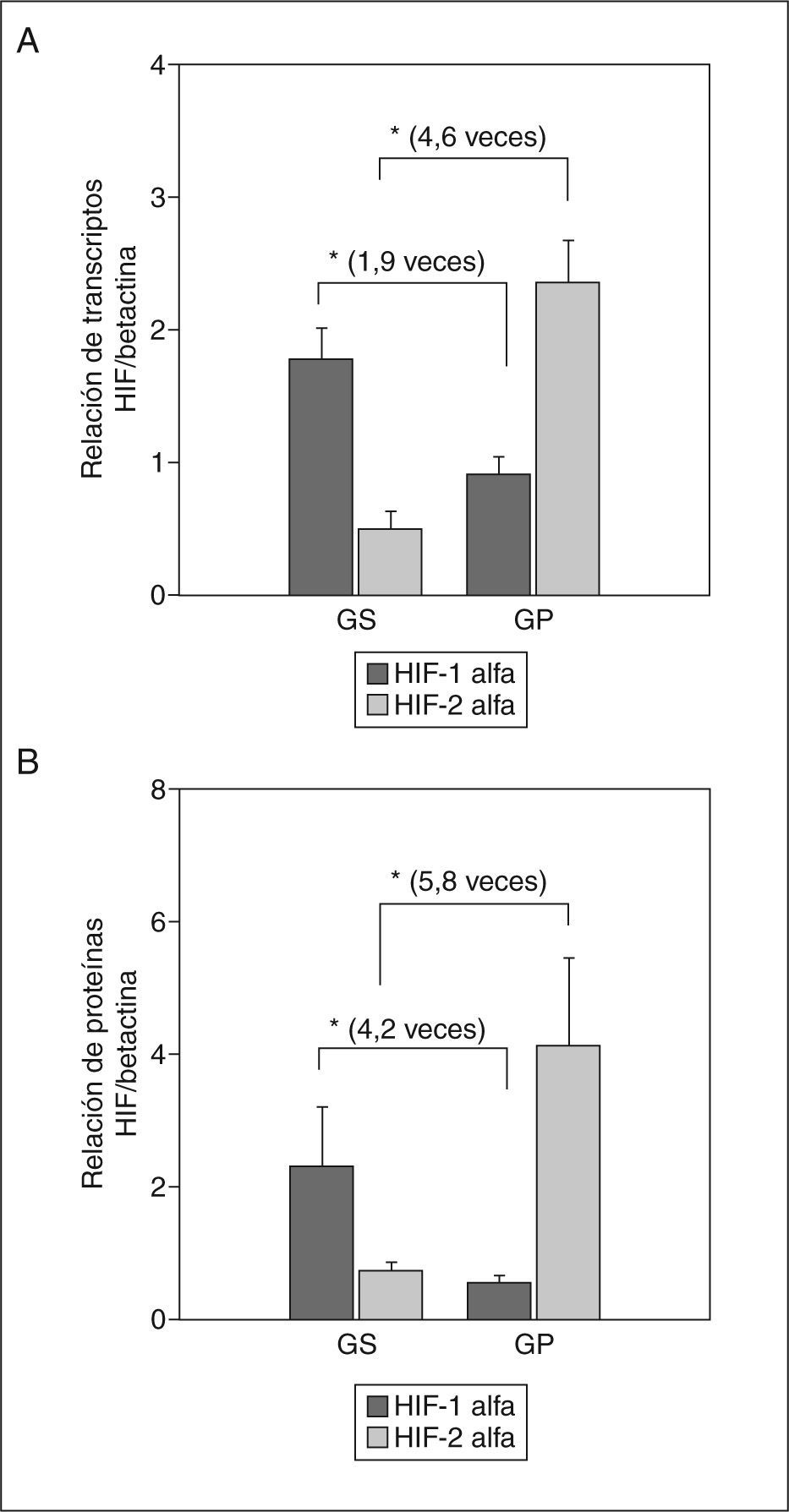
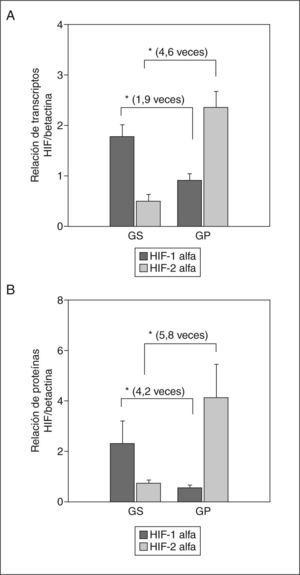
Los resultados fueron interesantes, debido a que la expresión tanto del ARNm como de la proteína de ambos HIF mostraron un comportamiento in verso al comparar ambos grupos de gestantes. La expresión de ARNm de HIF-1α mostró una expresión mayor estadísticamente significativa de 1,9 veces más en las gestantes sanas que en las preeclámpsicas (GS frente a GP; expresión relativa, 1,78 ± 0,24 frente a 0,92 ± 0,13; p < 0,01) (fig. 4A) y la proteína mostró una expresión 4,2 veces mayor (relación proteína HIF-1α/betactina, 2,31 ± 0,9 frente a 0,54 ± 0,11; p < 0,001) (fig. 4B). Contradictoriamente, la expresión de ARNm de HIF-2α fue 4,6 veces mayor en las preeclámpsicas (expresión relativa, 0,51 ± 0,13 frente a 2,36 ± 0,32; p < 0,001) (fig. 4A) y la proteína fue 5,8 veces mayor (relación proteína HIF-2α/betactina, 0,71 ± 0,15 frente a 4,12 ± 1,33; p < 0,001) (fig. 4B). Dado que el HIF-2α regula la expresión de este receptor selectivamente en células trofoblásticas12, al parecer también las células endoteliales podrían presentar esta regulación. Curiosamente, el HIF-1α aparece marcadamente disminuido en la enfermedad, lo que confirmaría el efecto protector propuesto recientemente por Ben-Shoshan et al28.
Expresión de ARN y proteína de HIF-1α y HIF-2α en la arteria humeral. A: relación de transcriptos de ARN de los HIF/los transcriptos control (betactina) mediante RT-PCR en tiempo real. B: secreción de la proteína de los HIF/la proteína control (betactina) mediante Western blot. Los valores representan media ± desviación estándar. GP: gestantes con preeclampsia; GS: gestantes sanas.
*p < 0,01.
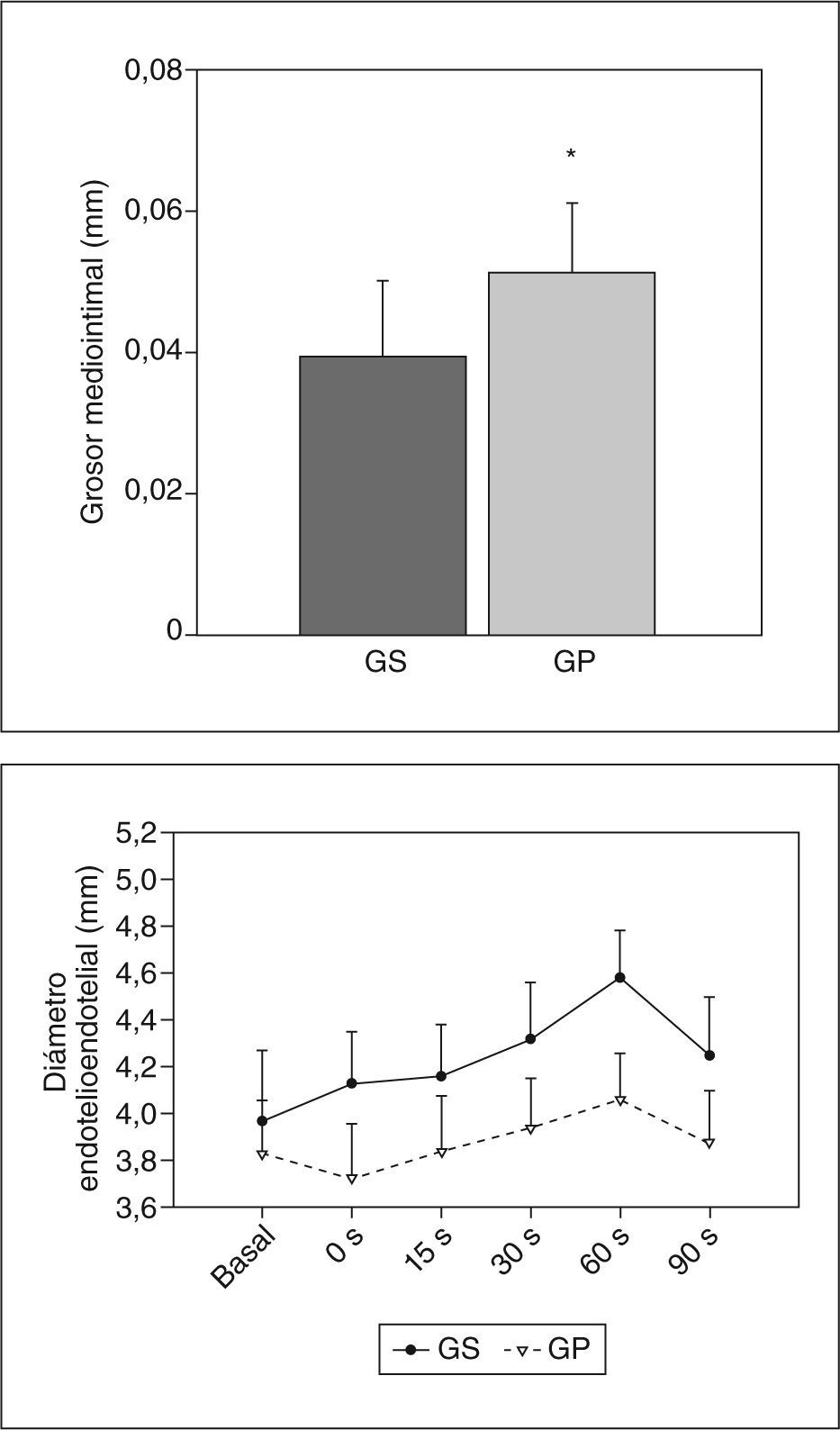
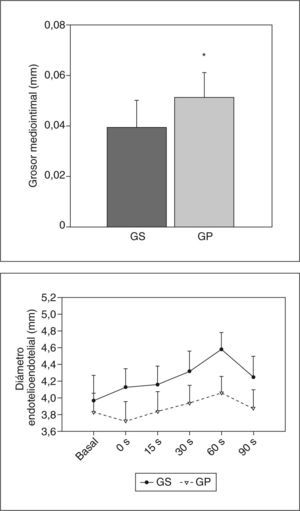
Para demostrar que el efecto inflamatorio en las arterias periféricas se traduce en daño estructural y funcional, decidimos evaluar el GMI de la arteria humeral y su respuesta fisiológica a cambios de flujo. El GMI de la arteria humeral evaluado por ultrasonografía demostró que las mujeres con preeclampsia presentaban valores significativamente mayores que los observados en mujeres sanas (0,051 ± 0,01 frente a 0,039 ± 0,01mm; p = 0,006) (fig. 5A).
Evaluación ultrasonográfica del grosor mediointimal (GMI) y la vasodilatación mediada por flujo en la arteria humeral. A: medida del GMI en la arteria humeral comparando gestantes sanas y preeclámpsicas. B: medida del FMD basal y tras estímulo (0, 15, 30, 60 y 90s). La comparación entre gestantes sanas y gestantes con preeclampsia dio valores estadísticamente significativos en cada uno de los tiempos. Los valores representan media ± desviación estándar. GP: gestantes con preeclampsia; GS: gestantes sanas.
*p < 0,01.
Además, los diámetros basales de la arteria humeral en mujeres gestantes sanas y preeclámpsicas también mostraron diferencias incluso en ausencia de estímulo (3,97 ± 0,31 frente a 3,83 ± 0,27mm; p < 0,05). Estas diferencias se incrementaron notablemente después de aplicar el estímulo de flujo tras isquemia. Durante la hiperemia reactiva, el ingreso de flujo en la arteria ocasionó un incremento significativo en los diámetros arteriales de ambos grupos; sin embargo, las gestantes sanas tuvieron valores de vasodilatación mucho mayores que las gestantes preeclámpsicas los segundos 0, 15, 30, 60 y 90 (p < 0,001). La máxima dilatación se obtuvo 1min tras el estímulo (después de soltar el mango) (fig. 5B). En ambos grupos, los diámetros vasculares mostraron diferencias estadísticamente significativas entre todos los tiempos evaluados tras el estímulo (ANOVA-MR: GS, F = 137,72; GP, F = 49,15; p < 0,001). Los análisis posteriores con la prueba de Newman-Keuls mostraron las mayores diferencias estadísticamente significativas cuando se comparó todos los momentos frente a 60s tras el estímulo (p < 0,001).
Los incrementos del diámetro arterial durante la hiperemia reactiva en gestantes sanas y con preeclampsia fueron del 17,03% ± 3,14% y del 6,58% ± 2,42%, respectivamente. Así, la vasodilatación mediada por flujo en la preeclampsia fue significativamente menor que en las gestantes sanas (p < 0,001) (fig. 5B).
Además, al utilizar el coeficiente de correlación r de Pearson entre los datos de vasodilatación y el GMI, los resultados mostraron una pequeña relación negativa pero estadísticamente significativa a los 15 y 60s de dilatación tras el estímulo en las gestantes preeclámpsicas (GS, r = −0,39, p = 0,013; GP, r = −0,557, p = 0,044). Esto significa que el incremento del GMI es un factor que tener en cuenta en la disminución de la vasodilatación observada en la preeclampsia.
DiscusiónEl presente trabajo relaciona de manera interesante los fenómenos antiangiogénicos e hipóxicos que ocurren en la placenta durante la preeclampsia y procesos patológicos considerados de riesgo arteriosclerótico en la vasculatura arterial periférica materna.
Nuestros datos corroboran los hallazgos previos, en los que se encuentra aumentado el receptor soluble sVEGFR-1/sFlt-1 en el plasma de gestantes preeclámpsicas8,21; sin embargo, este incremento se ha estudiado principalmente como un marcador de la enfermedad, y se ha estudiado poco su efecto biológico en la vasculatura periférica.
En primer lugar, nuestros resultados corroboran el efecto antiangiogénico en la preeclampsia ya señalado anteriormente por otros estudios6,7, dado que se muestra una disminución importante de las concentraciones de VEGF libre en plasma, que es la forma funcional de la molécula y tiene efectos proangiogénicos. Pese a que la respuesta fisiológica a la hipoxia es el incremento en la expresión del VEGF, la molécula es atrapada por el receptor soluble, lo que impide que ejerza su acción. Así, ante la falta del efecto de retroalimentación negativa de VEGF en su expresión, las células placentarias continúan produciéndolo y aumentando sus valores plasmáticos, como se observa en nuestras figuras. Es contradictorio e interesante que también esté incrementada la liberación de su receptor 1 soluble (sVEGFR-1/sFlt-1). Sin embargo, tras el parto los valores de sVEGFR-1/sFlt-1 plasmáticos disminuyeron drásticamente, aunque siguieron elevados respecto a las gestantes sanas, lo que indicaría una expresión no sólo placentaria, sino también periférica. Corroborando este hecho, los valores de VEGF libre posteriores al parto continuaron bajos y no recuperaron los valores alcanzados por las gestantes sanas. Así, los valores altos del receptor soluble expresado por la vasculatura periférica continuarían uniéndose al VEGF en plasma. Tras el parto, el VEGF total en plasma disminuyó a valores semejantes a los de las gestantes sanas, lo que corrobora que principalmente se expresó en la placenta. Aunque el papel del VEGF y su receptor 1 soluble en la arteriosclerosis no es claro, recientemente Sandhofer et al29 evaluaron en 909 pacientes europeos adultos y sanos, seleccionados del estudio SAPHIR30, para analizar la correlación de los valores plasmáticos de VEGF y sVEGFR-1/sFlt-1 como factores de riesgo. Sus resultados mostraron correlaciones débiles de la presencia de VEGF y su receptor 1 soluble con factores de riesgo cardiovascular, aunque éstos diferían significativamente entre varones y mujeres. Nuestros datos no son comparables a los de ese estudio, dado que los sujetos evaluados estaban sanos y en nuestro trabajo las pacientes son preeclámpsicas, una enfermedad que se caracteriza por daño endotelial sistémico. Sin embargo, en ese estudio sí encuentran una relación positiva entre concentraciones de VEGF y sVEGFR-1/sFlt-1 y el GMI de la carótida que concuerda con nuestros resultados, aunque en nuestro caso la relación del receptor 1 soluble mostró significación mucho mayor (r = 0,1; p = 0,004 —tabla 2 de Sandhofer et al30— frente a r = 0,41; p < 0,001).
Diversos trabajos han demostrado la liberación de factores inflamatorios a la circulación producto de la hipoxia placentaria en la preeclampsia6,7,9, además de relaciones lógicas de su acción patológica sobre el endotelio evidenciada principalmente por una menor respuesta o una menor producción de óxido nítrico por diversas vías31,32; sin embargo, muy poco se ha relacionado la respuesta periférica con el comportamiento de la células placentarias. En este trabajo proponemos un mecanismo de daño vascular iniciado o potenciado por el incremento de la molécula sVEGFR-1/sFlt-1 plasmática, liberada por las células trofoblásticas placentarias12 e inducida a mayor producción de novo en células endoteliales periféricas, conjuntamente con varios factores inflamatorios, entre los que destacamos CD40L.
La molécula ligando de CD40 (CD40L) es una proteína transmembrana de la familia del factor de necrosis tumoral (TNF), que ha sido implicada en la patogenia de la arteriosclerosis debido a sus propiedades inflamatorias, angiogénicas y protrombóticas21,33. Esta molécula se expresa en diferentes tipos de células hematopoyéticas, como linfocitos, monocitos o plaquetas, y en no hematopoyéticas, como células endoteliales y del músculo liso33,34. Puesto que se expresa durante la activación plaquetaria, clínicamente ha adquirido gran papel como marcador y predictor de eventos cardiovasculares como inestabilidad de placa35, infarto de miocardio y accidente cerebrovascular en pacientes con fibrilación auricular27,36. Asimismo, estudios previos han mostrado que el CD40L soluble derivado de linfocitos y plaquetas puede estimular en células endoteliales la generación de más CD40L33,37, que a su vez induce la expresión de las proteínas ICAM-1 y HSP27, las cuales no sólo se vinculan con el desarrollo de arteriosclerosis20,35, sino con eventos de adhesión celular y proliferación de actina, encargada de migración celular, infiltrados celulares y remodelación de músculo liso, característica de la aterogénesis20,36. Nuestro trabajo es el primero en demostrar la expresión de CD40L por el endotelio periférico en la preeclampsia, lo que indicaría la presencia de un microambiente muy susceptible a la aterogénesis y al daño vascular, que también se demuestra en este estudio. Así, la producción del sVEGFR-1/ sFlt-1 y la desregulación del VEGF estimularían —junto con otras moléculas, como radicales de oxígeno y citocinas inflamatorias— la expresión de CD40L. No negamos la posibilidad de que CD40L a su vez pueda estimular la expresión de sVEGFR-1/sFlt-1, pero nuestros datos no respaldan esa hipótesis porque el regulador de dicho receptor soluble es inducido principalmente por hipoxia, como se ha demostrado con análisis de ARN de interferencia12 o por procesos de retroalimentación positiva por el mismo receptor, como se muestra en este trabajo. Aunque no se conoce la relación de los factores involucrados entre hipoxia y CD40L20, es muy conocida la relación para VEGF y su receptor 1 soluble con HIF-1α11 y HIF-2α12 respectivamente. Curiosamente, un posible nexo que no descartamos pero deberá ser evaluado para CD40L es el factor HIF-2α, debido a que su expresión presentó un comportamiento similar a sVEGFR-1/sFlt-1, que sí se regula por ese factor. Ciertamente, la expresión de HIF-2α parece ser un nexo importante entre estos cuadros, no así HIF-1α como algunos estudios indican38; además, en nuestro trabajo no encontramos una sobreexpresión del factor de transcripción HIF-1α en vasculatura de pacientes con preeclampsia.
Estos datos podrían parecer contradictorios con estudios que muestran HIF-1α asociado a enfermedades cardiovasculares38-40, pero están de acuerdo con uno recientemente publicado, donde se le asocia un efecto antiaterogénico y reductor de placa arteriosclerótica en ratones ApoE−/−28. Es interesante en nuestros hallazgos que muestran una disminución de HIF-1α en la preeclampsia altamente significativa frente a las gestantes sanas, lo que respalda la idea de un factor protector que deberá ser evaluado en estudios posteriores. Por su parte, HIF-2α parece regular también en la periferia la expresión de sVEGFR-1/sFlt-1 y quizá de CD40L, pero nuestros datos no son concluyentes al respecto. Otros datos interesantes pero que deben ser confirmados son los valores plasmáticos de sCD40L en gestantes preeclámpsicas. En 3 de 5 pacientes las concentraciones estuvieron incrementadas con respecto a los valores de 3 gestantes sanas. De comprobarse estos hallazgos en una mayor población, indicarían procesos de retroalimentación positiva y mayor riesgo arteriosclerótico, como se ha demostrado20,33,35-37.
Finalmente, nuestro estudio demostró de manera significativa un incremento del GMI de la arteria humeral, que evidencia el daño estructural en la vasculatura arterial periférica. Es conocido que el incremento del GMI, principalmente carotídeo, es un fuerte predictor de eventos vasculares en adultos mayores como accidente cerebrovascular e infarto de miocardio en valores cercanos al 47 y el 43% respectivamente41, además de que se considera en riesgo arterosclerótico a las poblaciones de adolescentes y niños que presentan un incremento significativo del GMI41,42. Aunque el valor predictivo del GMI todavía es desconocido en poblaciones jovenes, diversos estudios indican mayor susceptibilidad para la formación de lesiones arterioscleróticas tempranas en estos grupos cuando hay factores intrauterinos y de dieta materna durante el embarazo que incrementan el riesgo arteriosclerótico del neonato17,18. Nuestros resultados de gestantes con preeclampsia muestran un incremento significativo del GMI que se podría considerar de riesgo de enfermedad arteriosclerótica materna y del neonato, o de susceptibilidad futura durante su vida adulta17. Si bien nuestra evaluación fue hecha en la arteria humeral (y no en la arteria carotídea como normalmente se realiza la evaluación de este parámetro), los datos obtenidos son válidos, reproducibles y representativos de cualquier arteria periférica sistémica (ventajas evaluadas previamente23,32). En este contexto, la funcionalidad de la arteria humeral utilizando la técnica de hiperemia reactiva o la vasodilatación mediada por flujo —descrita por Celermajer et al25 y protocolizada por Correti et al23— sirvieron para evaluar la grave disminución de la respuesta dilatadora en preeclámpsicas. Este proceso, que depende de la integridad endotelial, confirmó la disfunción endotelial presente en la preeclampsia y el riesgo de aterogénesis.
En resumen, el presente trabajo demuestra primero la expresión de factores antiangiogénicos e inflamatorios de novo considerados de riesgo arteriosclerótico en la vasculatura arterial periférica, de manera similar a lo que ocurre en células placentarias, y segundo, el daño estructural y funcional del endotelio periférico, que se puede extrapolar como un factor de riesgo vascular temprano o tardío en el neonato.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a todo el equipo de Gineco-Obstetras del Hospital CASE y Yanahuara EsSAlud, Arequipa (Perú) su colaboración en la realización de este trabajo. Un reconocimiento especial a las Srtas. Claudia y Fernanda Torres y al Sr. Miguel Contreras por su apoyo incondicional durante la realización de este trabajo.
El presente trabajo fue subvencionado económicamente por el Grupo de Investigación en Inmunología, Facultad de Medicina, partida IRG2007-BV001A y por la Academia Peruana de Medicina Molecular APMM2008-JVS001.