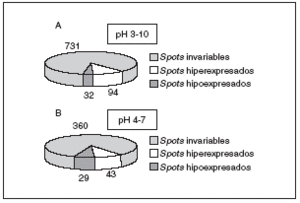
well-defined spots. In comparison with those obtained in normotensive rat hearts, 360 spots remained invariable, 43 increased and 29 decreased or were absent. The identification by mass spectrometry (MALDI-TOF) of altered spots is under study. To date, few spots such as alpha-tropomyosin and the Va polypeptide of cytochrome c-oxidase have been identified. Conclusions. Via a proteomic approach, we analyzed the difference between proteomes of hypertrophic hearts of hypertensive and normotensive rats and observed a number of
over or under expressed proteins in damaged hearts. These data illustrate a hitherto unexplored use of proteomics to discover new therapeutic targets for antihypertensive drugs.
Introducción
La hipertensión arterial (HTA) es uno de los principales factores de riesgo cardiovascular y afecta a alrededor del 20% de la población del mundo occidental. Las complicaciones asociadas a esta enfermedad son la insuficiencia cardíaca, el accidente vascular cerebral, la insuficiencia renal y la aterosclerosis (aunque en esta última hay otros factores que desempeñan un papel clave)1.
Diversos estudios epidemiológicos y clínicos realizados en los últimos 30 años han mostrado que la hipertrofia ventricular izquierda (HVI) es un hallazgo común en la HTA2-4, de modo que la presentan entre el 20 y el 90% de los pacientes hipertensos, dependiendo de la intensidad y duración de la presión arterial elevada. También está bien demostrado que la HVI es un factor de riesgo mayor e independiente de la mortalidad y morbilidad car-
diovasculares, ya que la incidencia de infarto de miocardio, insuficiencia cardíaca congestiva y muerte súbita es aproximadamente 3 veces más elevada en estos sujetos que en pacientes hipertensos con cifras similares, pero sin HVI. Morfológicamente existe hipertrofia de los miocitos cardíacos y aumento de la matriz extracelular, sobre todo colágenos, reflejo de la extensa reorganización del tejido cardíaco5.
Mecanismos moleculares de la hipertrofia cardíaca
El proceso hipertrófico se caracteriza por la inducción de genes de respuesta temprana como c-fos, c-jun y erg-1, la reexpresión de genes embriónicos como el factor natriurétrico atrial, la miosina beta de cadena pesada y la actina alfa esquelética, así como la síntesis aumentada de miosina de cadena ligera 2 y la actina alfa cardíaca6-9. La sobrecarga de presión se consideraba hace unos años el estímulo exclusivo de la hipertrofia. Sin embargo, una amplia variedad de factores, además de la elevación de la presión arterial, puede contribuir significativamente al desarrollo de las alteraciones estructurales del corazón que caracterizan el estado hipertensivo. Entre los factores humorales conviene destacar la angiotensina II, la endotelina y las catecolaminas, entre otras. Estudios in vivo han demostrado que esos agentes pueden inducir efectos tróficos cardíacos y periféricos que favorecerían la síntesis de proteínas miocárdicas (crecimiento del miocito) y de matriz extracelular, y el aumento de apoptosis, componentes importantes de la hipertrofia cardíaca10-14.
En los últimos años, se ha señalado que la apoptosis de los cardiomiocitos podría ser clave en la reducción de esas células que acompañan la transición de la hipertrofia compensada a la insuficiencia cardíaca. Muy recientemente, se ha demostrado la existencia de apoptosis aumentada en cardiomiocitos y no cardiomiocitos en pacientes hipertensos con enfermedad cardíaca15,16.
A pesar de la normalización de la presión arterial sistémica obtenida por los antihipertensivos actuales, la hipertrofia cardíaca frecuentemente evoluciona a insuficiencia cardíaca congestiva. Por tanto, la regresión de la HVI y la prevención de sus repercusiones funcionales y electrofisiológicas son del mayor interés terapéutico. De hecho, el tratamiento antihipertensivo ha mostrado la regresión de la hipertrofia del miocito y la fibrosis, así como la normalización de la expresión de algunos marcadores moleculares en modelos experimentales17-19. Sin embargo, los fármacos difieren sustancialmente con respecto a sus efectos sobre la regresión de la HVI, lo que indicaría que, además de reducir la HTA (sobrecarga), los mecanismos neurohormonales deben tenerse en cuenta en el tratamiento adecuado de la HVI.
Nuestro objetivo principal es el estudio del proteoma del corazón (ventrículo izquierdo) de ratas normotensas y ratas espontáneamente hipertensas para identificar el perfil de cambio de las proteínas cardíacas generado por la hipertrofia cardíaca asociada a HTA. El conocimiento de estas proteínas ofrecería una nueva visión de los mecanismos moleculares (la mayoría de los cuales siguen siendo desconocidos, aunque se han asociado a diversos patrones moleculares y génicos) que llevan a la evolución de la hipertrofia cardíaca, y permitiría la posibilidad de descubrir nuevas dianas terapéuticas para la generación de nuevos tratamientos antihipertensivos.
El análisis proteómico implica la separación, identificación y caracterización de las proteínas presentes en una muestra biológica20. Aunque existen diversos métodos de separación de mezclas complejas de proteínas21, uno de los más utilizados es la electroforesis bidimensional, desarrollada por O'Farrel y Klose en los años 1975-197722,23, debido a su gran resolución (permite separar hasta 10.000 proteínas en un gel) y buena reproducibilidad24. Por ello se está utilizando actualmente para el estudio de las enfermedades cardiovasculares25,26 y, más concretamente, en el estudio del corazón27,28.
Materiales y métodos
Modelo experimental
Los estudios se realizaron con ratas macho espontáneamente hipertensas (SHR; Criffa, Barcelona, España) y con ratas normotensas Wistar-Kyoto (WKY). A las 48 semanas de edad se sacrificó a las ratas por decapitación. Se extrajeron los corazones y se midieron las dimensiones cardíacas. Para cada animal, el índice cardíaco se calculó por división del peso del corazón por el peso corporal. A continuación se diseccionaron los ventrículos izquierdos y se congelaron en nitrógeno líquido para su posterior análisis.
Estudio del control de la presión arterial
La presión arterial se determinó semanalmente en los
animales conscientes por medio de un esfigmomanómetro (NARCO Biosystems, Austin, TX, Estados Unidos). Para cada animal, el valor de la presión arterial se calculó con la media de 3 determinaciones independientes realizadas en la misma sesión.
Estudios histopatológicos
Para microscopia óptica se extrajeron secciones de masa cardíaca que se fijaron con paraformaldehído al 4%; se deshidrataron con alcohol y se incluyeron en parafina. Se tiñeron con tricrómico de Masson secciones de 4 µm de grosor. La lesión cardíaca (pérdida de células miocárdicas y presencia de fibrosis e infiltrado celular) se determinó usando la siguiente puntuación semicuantitativa: 0 cuando no se observan cambios; 1 para cambios que envuelven el 25% de la muestra;
2 para cambios que afectan del 25 al 50%; 3 para cambios que afectan del 50 al 75%, y 4 para lesiones que afectan a más del 75% de la muestra.
Electroforesis bidimensional
Las muestras de ventrículo izquierdo se pulverizaron usando un mortero con N2. Los pulverizados se solubilizaron en tampón de lisis (7 M urea, 2 M tiourea, 2% biolite, 2 mM TCEP y 4% CHAPS), donde se homogeneizaron. La concentración proteica de los sobrenadantes se determinó por el método Bradford29. Para la realización de los geles bidimensionales, se aplicaron 200 µg de proteína a la primera dimensión de acuerdo con el protocolo proporcionado por el fabricante. El isoelectroenfoque (IEF) se llevó a cabo utilizando la cubeta Protean IEF Cell (Bio-Rad, Hercules, CA, Estados Unidos). Para esta primera dimensión se utilizaron tiras de pH en gradiente inmovilizado (170 mm, pH de 3-10 o de 4-7; Bio-Rad). La focalización de las proteínas se efectuó rehidratando activamente a 50 V durante 12 h para facilitar su absorción. Cada lisado se aplicó a la tira de pH en gradiente inmovilizado junto con el buffer de rehidratación (8 M de urea, un 2% de CHAPS, un 2% de biolite y trazas de azul de bromofenol) hasta un volumen final de 300 µl. Las condiciones de focalización tras la rehidratación fueron: 1 h a 500 V, 1 h a 1.000 V, y 8.000 V hasta 50.000 V/h. A lo largo de todo el proceso de IEF los geles se mantuvieron a una temperatura constante de 20 °C.
Una vez finalizado el IEF, las tiras se equilibraron en tampón Tris de pH 8,8, 1,5 M con urea 6 M, un 30% de glicerol, dodecilsulfato de sodio (SDS) al 2% y azul de bromofenol (trazas), a lo que se añadió dititreitol al 1%, seguido del mismo tampón con yodoacetamida al 2,5% durante 20 min en cada caso.
La separación de las proteínas en función de su masa molecular (segunda dimensión) se realizó aplicando las tiras equilibradas del IEF sobre geles de acrilamida (20 * 20 cm) al 12,5% en presencia de SDS (PAGE-SDS) en la cubeta Protean II XL system (Bio-Rad). Esta segunda electroforesis se llevó a cabo a un voltaje de 15 mA/gel durante 30 min, seguido de 30 mA/gel durante 5 h y a una temperatura constante de 4 °C.
Una vez que se hubieron obtenido los geles bidimensionales, se procedió a su tinción con plata para la detección de los spots proteicos de acuerdo con el protocolo de Blum et al modificado por Rabilloud et al30. Este tipo de tinción presenta la ventaja de ser compatible con la posterior identificación mediante espectrometría de masas.
Análisis bioinformático
Para el análisis comparativo de los geles, éstos se digitalizaron en el escáner DUOSCAN-HDI (AGFA) a una resolución de 150 dpi (píxeles por pulgada). Posteriormente, los spots proteicos se analizaron cuantitativamente con el programa PDQuest 2-D software V 6.2.1 (Bio-Rad, Hercules, CA, Estados Unidos). Las imágenes consenso de los geles se prepararon macheando los spots de 4 geles distintos por cada uno de los grupos analizados. Para compensar los posibles errores introducidos durante la carga proteica y en el desarrollo de la tinción de plata entre los geles, las intensidades de los spots se normalizaron expresando la intensidad de cada mancha respecto a la intensidad total de todas las manchas presentes en el gel. Los valores medios y los coeficientes de variación de los puntos diferenciados (en expresión o presencia/ausencia) se calcularon con el mismo programa.
Huella peptídica
Los spots de interés se escindieron de los geles y se les aplicó un protocolo estándar de digestión tríptica. La enzima utilizada fue tripsina porcina modificada (Promega, Southampton, Reino Unido; 20 µl a 12 ng/µl-1 en hidrógeno carbonato amónico 25 nM). Terminada la digestión, los péptidos resultantes se recuperaron y liofilizaron para después reconstituirlos en 10 µl compuestos por ácido trifluoracético al 0,1% acetonitrilo al 33%. El extracto reconstituido (0,5 µl) se mezcló con 0,5 µl de matriz (10 mg/ml de ácido hidroxicinámico-4-alfaciano en ácido trifluoracétuo al 0,1% acetimotrilo al 50%), se colocó en la placa del espectrómetro y se secó a temperatura ambiente. La espectrometría de masas de cada una de las muestras se llevó a cabo utilizando el Voyager DE-STR Mass Spectrometer (MALDI-TOF; PerSeptive Biosystems)31,32.
Una vez procesados los espectros (la huella peptídica), se extrajo la lista de péptidos propios de cada spot para posteriormente obtener las identificaciones en las bases de datos Mascot y Profound, ambas disponibles en internet33.
Resultados
Evolución de la presión arterial
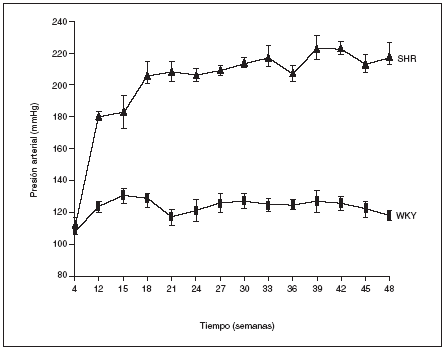
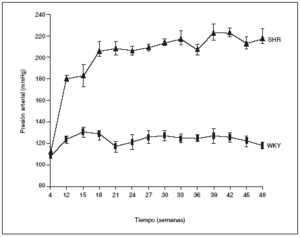
Como puede observarse en la figura 1, a las 4 semanas de vida los animales WKY y los SHR presentaban los mismos valores de presión arterial. La HTA empezó a hacerse patente a partir de la duodécima semana de vida en los animales SHR y las cifras se incrementraron con la edad hasta alcanzar al final del estudio (48 semanas de vida) un valor de 219 ± 7 mmHg. Por el contrario, los animales normotensos WKY mantuvieron constante la presión arterial a lo largo de todo el estudio, con valores que oscilaron entre los 120 y 130 mmHg (fig. 1).
Figura 1. Evolución de la presión arterial en las ratas macho espontáneamente hipertensas (SHR) y Wistar Kyoto (WKY).
Los resultados se expresan como media ± error estándar (n = 7-8 animales por grupo). *p < 0,01 frente a WKY en el mismo período (excepto para 4 semanas).
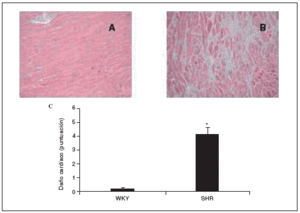
Morfología cardíaca
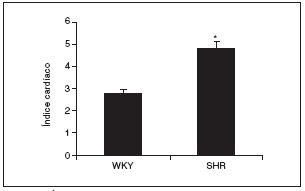
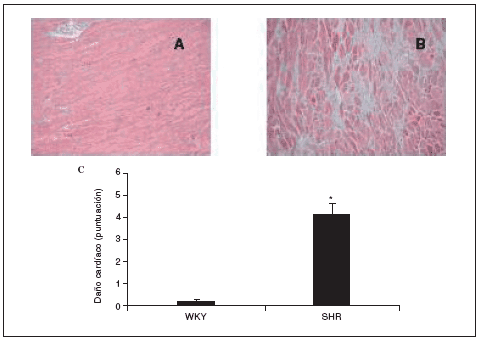
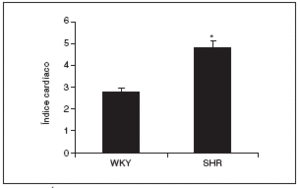
Al final del estudio el índice cardíaco fue mucho mayor en los animales hipertensos que en los normotensos (fig. 2). El índice cardíaco está calculado como el peso del corazón/peso corporal * 103, por lo que puede observarse el crecimiento, es decir, la hipertrofia generada en las ratas SHR mediada por la HTA. Este resultado indica que para que esto ocurra debe de haber tenido lugar una serie de cambios en el corazón de estos animales, lo que puede observarse en la figura 3. El examen histológico de los corazones procedentes de animales hipertensos (fig. 3B) reveló un importante daño en el miocardio, caracterizado por la pérdida de cardiomiocitos y numerosas áreas de fibrosis e inflamación. Los animales normotensos apenas tuvieron daño en el tejido, como puede observarse en la figura 3A. La semicuantificación de las lesiones cardíacas puede verse en la figura 3C.
Figura 2. Índice cardíaco en las ratas Wistar Kyoto (WKY) y espontáneamente hipertensas (SHR).
Los resultados se expresan como media ± error estándar (n = 7-8 animales por grupo). *p < 0,001 frente a WKY.
Análisis por electroforesis bidimensional del proteoma de los corazones
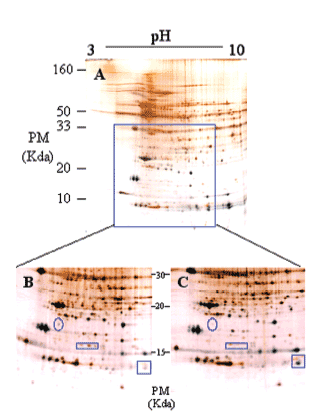
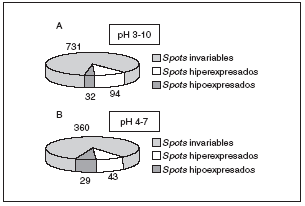
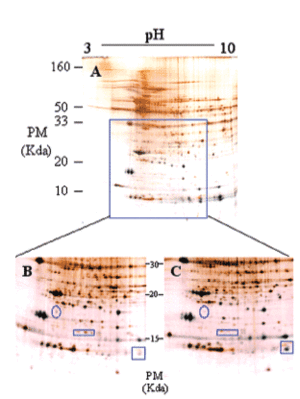
Los mecanismos moleculares por los que progresa la hipertrofia cardíaca se desconocen en su mayor parte, pero los cambios en la estructura del co razón son claramente diferenciables (fig. 3), por lo que la expresión del perfil proteico (el proteoma) ha tenido que variar en los corazones hipertróficos. Para detectar globalmente los cambios ocurridos en las proteínas utilizamos el análisis proteómico mediante electroforesis bidimensional en geles de poliacrilamida. Como puede observarse en la figura 4, realizamos geles bidimensionales en un rango ampliado de pH de 3 a 10. A simple vista, y sin ningún tipo de análisis bioinformático, ya se aprecian diferencias en la expresión de las proteínas en los geles WKY y en los SHR, como puede observarse en las figuras 4B y 4C (círculo y cuadrados). De los más de 2.000 spots detectados, el análisis comparativo de los geles se realizó en 857. En comparación con los corazones de ratas normotensas, se vieron 126 spots proteicos alterados (incrementados o disminuidos) en las ratas hipertensas (fig. 5A).
Figura 3. Histología de los corazones de ratas Wistar Kyoto (WKY; A) y espontáneamente hipertensas (SHR; B) (magnificación *10). Semicuantificación de la puntuación del daño cardíaco (C).
Los datos se expresan como media ± error estándar (n = 7-8 animales por grupo). *p < 0,001 frente a WKY.
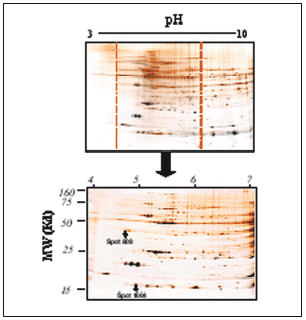
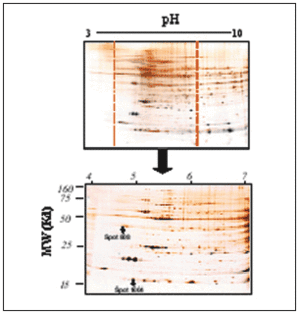
Figura 4. Ejemplo representativo de electroforesis bidimensional de proteínas cardíacas de ventrículo izquierdo de rata (A): primera dimensión, pH 3-10; segunda dimensión, SDS-PAGE al 12,5%. Se cargaron 200 µg de proteína y se utilizó la tinción de plata.
Ampliación de una zona del gel (B y C). El gel de la izquierda (B) corresponde a ratas Wistar Kyoto, y el de la derecha (C) a ratas espontáneamente hipertensas. Los círculos y cuadrados muestran zonas de diferencia a simple vista en los valores de expresión de las proteínas.
Figura 5. Resultados obtenidos del análisis de PDQuest en el pH 3-10 (A), y en el pH 4-7 (B). Para el pH 3-10 se analizaron un total de 857 spots proteicos, mientras que para el pH 4-7 se analizaron 432.
El análisis comparativo de estos geles es bastante complicado debido a la gran cantidad de spots resueltos, a que hay zonas que no se resuelven totalmente por la agregación de proteínas de parecidos puntos isoeléctricos o pesos moleculares en determinadas zonas del gel y a la presencia en la parte de alto peso molecular de rayado o streaking que impide la correcta resolución de las proteínas, tanto cualitativa como cuantitativamente. Para solventar estos problemas se realizaron geles acotados de pH 4 a 734. Al expandir una región del gradiente de pH a la longitud total de la tira de IEF (17 cm), se produce un incremento notable en la resolución de los geles bidimensionales, como puede observarse en la figura 6. Con esto se consiguió centrar el estudio en la zona donde más spots proteicos aparecen en los geles (pH 4-7), además de una mayor resolución de éstos y la pérdida del streaking.
Figura 6. Ejemplo representativo de gel acotado de pH 4-7, de proteínas cardíacas del ventrículo izquierdo de rata. La segunda dimensión se realizó en geles PAGE-SDS al 12,5% cargando 200 µg de proteína total en cada gel. Puede observarse cómo resuelve la zona de pH 4 a 7 respecto a la misma zona dentro del gel del pH 3-10; con esto se consiguen una claridad y una resolución mayores de los spots para el análisis y la identificación. Puede observarse en el gel la posición de los spots proteicos 808 y 1004.
Análisis acotado del proteoma y espectrometría de masas
Una vez obtenidos los geles de pH acotado 4-7 (fig. 6), se procedió a su análisis informático y se detectó un total de 432 spots. En este caso se observó alteración en 72 de ellos, en comparación con los animales normotensos (fig. 5B). Estos 72 spots deben de tener una importancia notable en el desarrollo de la hipertrofia cardíaca por hipertensión, ya que son los que aparecen variados, y sería muy importante su conocimiento.
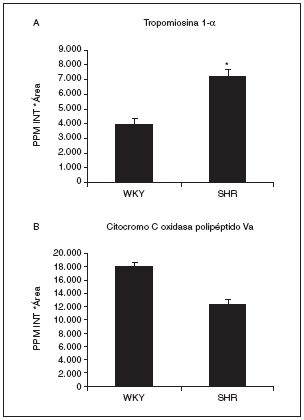
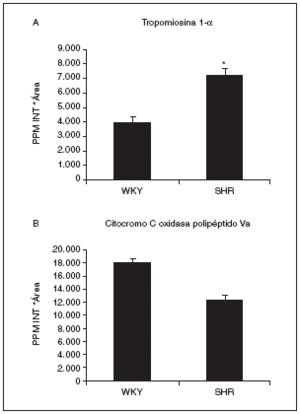
Actualmente estamos analizando por espectrometría de masas estos spots para su identificación por huella peptídica. Dos de los identificados por el momento son el spot 808, que se identificó como tropomiosina 1 de cadena alfa (con 18 péptidos macheados y un 42% de cobertura de la secuencia) y que aumentaba su expresión más de 1,8 veces en las ratas hipertensas respecto a las normotensas (fig. 7A), y el spot proteico 1004, que corresponde al precursor mitocondrial de la citocromo C oxidasa Va (con 7 péptidos macheados y un mínimo del 53% de cobertura de la secuencia). Este spot disminuye en las ratas hipertensas con respecto a las normotensas (fig. 7B).
Figura 7. Valores de expresión cardíaca de la tropomiosina 1-* (A) y el precursor mitocondrial de la citocromo C oxidasa polipéptido Va (B). La tropomiosina 1-* corresponde al spot 808, cuya localización en los geles puede observarse en la figura 6, y la citocromo C oxidasa al spot 1004. p < 0,05 frente a WKY.
Discusión
La HTA es el principal factor de riesgo para el desarrollo de daño ventricular (hipertrofia) y de insuficiencia cardíaca. Esta última es el resultado final de cualquier enfermedad que afecte de forma global o extensa al funcionamiento miocárdico (como las enfermedades valvulares, la destrucción miocárdica extensa o la hipertrofia ventricular generada por hipertensión). El estudio Framinghan demuestra que la HTA es la responsable del 39% de los casos de insuficiencia cardíaca en el varón y del 59% en las mujeres35.
El conocimiento de los mecanismos por los cuales se genera y progresa la hipertrofia cardíaca, que desemboca finalmente en insuficiencia cardíaca, sería de gran utilidad para obtener marcadores o dianas terapéuticas que nos ayudarían a frenar su desarrollo. Por ello hemos aplicado en este estudio una nueva tecnología, la proteómica, la cual permite el estudio de las proteínas, probablemente el sistema experimental más adecuado para conocer el funcionamiento y los mecanismos celulares, ya que se analiza directamente el producto final del genoma de manera global, lo que nos proporciona una visión integrada.
Tanto histológicamente como por el tamaño del corazón hemos podido observar cómo la hipertrofia se genera y avanza hasta producir un daño cardíaco importante (fig. 3), que tiene que traducirse en una serie de cambios proteicos. Así pues, analizando 857 spots hemos observado que 126 estaban alterados, de forma que algunos aumentaban en la hipertensión, otros disminuían y otros desaparecían. Dada la dificultad del análisis en geles de pH expandido 3-10 por su mala resolución debido a la gran cantidad de spots que aparecen, centramos el estudio en el pH acotado 4-7, donde nos fijamos en 72 spots variados. La base del conocimiento de los mecanismos por los cuales progresa la hipertrofia cardíaca pasa por la identificación de estos spots mediante espectrometría de masas, ya que, una vez que conozcamos sus nombres y apellidos, será más fácil el conocimiento de la enfermedad y más sencilla la creación de nuevos tratamientos contra rutas o dianas determinadas. Dos de los spots detectados hasta el momento han sido la cadena alfa de la tropomiosina 1 (aumentada en ratas hipertensas) y el precursor mitocondrial de la citocromo C oxidasa Va (disminuido en ratas hipertensas). De acuerdo con nuestros resultados, se ha observado que las concentraciones de las isoformas de la tropomiosina se encuentran elevadas en las placas de pacientes sin tratamiento con hipertensión esencial y con hipertrofia ventricular cuando se comparaban con pacientes con hipertensión esencial pero sin hipertrofia cardíaca36.
La citocromo C oxidasa es el componente final de la cadena respiratoria mitocondrial que cataliza la conversión de energía redox a adenosintrifosfato. Algunas de sus subunidades están presentes de manera específica según el tejido y el momento del desarrollo; sin embargo, existen unidades ubicuas (incluida la Va) que se expresan en todos los tejidos37. En diversos procesos patológicos cardíacos tanto en humanos38,39 como en modelos experimentales40,41 se ha visto que la actividad de la citocromo C oxidasa disminuye. Dado que la mayoría de la energía necesaria para el funcionamiento cardíaco se deriva de la fosforilación oxidativa producida en la mitocondria, la disminución de las concentraciones de la citocromo C oxidasa en los pacientes con enfermedades cardíacas parece estar relacionada con una reducida capacidad para la producción de energía celular, de forma que deteriora la función ventricular en el fallo cardíaco.
La proteómica no sólo nos va a informar, como hemos visto hasta ahora, de qué proteínas se encuentran variadas, sino que además puede darnos una información mucho más útil. Se trata de una herramienta muy importante para identificar modificaciones postrasduccionales, ya que las proteínas se modifican mediante fosforilación, acetilación, sulfatación, etc. Estas modificaciones afectan a su estructura, localización y función, de manera que la propia enfermedad podría producir el cambio, inhibición o activación de ciertas rutas por medio de las modificaciones, por lo que es algo que hay que tener muy en cuenta y no descartar como posible vía en los mecanismos de la hipertrofia.
Hemos visto cómo expandiendo una región de pH la resolución de los geles mejora considerablemente. En este enfoque proteómico sólo hemos analizado una parte del proteoma total de los corazones, y ya aparece una variación en 72 spots con el análisis de sólo 3 puntos de pH. Así pues, a partir del pH 7 y hasta el 11 quedan muchos spots que también pueden variar y tener importancia, mayor o menor, en los mecanismos de generación o desarrollo de la hipertrofia cardíaca, por lo que es algo a tener en cuenta para el futuro.
En conclusión, a través de un enfoque proteómico hemos sido capaces de detectar cambios en el patrón de expresión de las proteínas cardíacas entre ratas hipertensas y normotensas. Hemos encontrado variación en 72 spots con un análisis acotado de pH 4-7 y hemos identificado algunas proteínas que cambian con la enfermedad. El desafío principal en estos momentos es el conocimiento de todas las proteínas variadas, lo que ofrecería una nueva visión de los mecanismos moleculares (la mayoría de los cuales, aunque se han asociado a diversos patrones moleculares y génicos, siguen siendo desconocidos) por los que evoluciona la hipertrofia cardíaca, y permitiría la posibilidad de descubrir nuevas dianas terapéuticas para la generación de nuevos tratamientos antihipertensivos. Asimismo, estamos estudiando si alguna de las proteínas modificadas en el corazón hipertrófico asociado a la hipertensión podría servir como marcador sérico de ese daño orgánico.