La arteriosclerosis es la enfermedad con mayor mortalidad y morbilidad en el mundo occidental y puede llegar a serlo, en muy poco tiempo, en todo el mundo. A pesar de ello, no parece que se vislumbre una solución razonablemente cercana y los esfuerzos para conocer su patogenia no han sido tan intensos como los empleados en el esclarecimiento de otras enfermedades menos comunes. De hecho, la arteriosclerosis es una enfermedad que no despierta en la población la inquietud y la participación que merece, no al menos en el grado que sí parece preocupar el cáncer. Parece como si ya estuviera resuelta, cuando la probabilidad de enfrentarse a una enfermedad cardiovascular grave es de más del 50% cuando se supera los 40 años (algo menor en las mujeres). Para apoyar lo dicho, baste citar que las enfermedades cardiovasculares han desaparecido del listado de prioritarias en la última convocatoria del Fondo de Investigaciones Sanitarias (FIS 2005) y que tal decisión no haya despertado unánime repugna.
Entre las causas puramente técnicas, debe destacarse la ausencia de un modelo experimental adecuado que permita explorar convenientemente las diferentes hipótesis bioquímicas y celulares que se manejan para explicarla. El único modelo indiscutible sería el humano, pero la arteriosclerosis es una enfermedad progresiva, que empieza en la infancia y, en la mayor parte de los individuos, tarda muchas décadas en manifestarse. También es una enfermedad en la que los factores genéticos y ambientales presentan una continua interacción muy difícil de medir, evaluar y contrarrestar. Cualquier manipulación o experimento requeriría la exploración temporal y repetida del tamaño y la composición de las lesiones. En la actualidad, la exploración cuantitativa y cualitativa de éstas sólo es posible mediante estudios en autopsias1 o a propósito de intervenciones quirúrgicas agresivas2, estudios que, a pesar de sus limitaciones, han conducido a conclusiones determinantes. A pesar de ello, pocos han sido los esfuerzos organizativos para reunir esa información. No deja de ser paradójico que en España, que ocupa el primer lugar en el mundo en mortalidad en las carreteras, y por ello, entre otras razones, en trasplantes de órganos, no hayamos sido capaces de poner en marcha un estudio multicéntrico que unificara y conservara muestras, datos y técnicas e investigara, con un coste relativamente bajo, los factores que llevan a padecer y morir por arteriosclerosis.
Probablemente el avance clínico más esperado y necesitado consista en explorar las lesiones arterioscleróticas in vivo y de forma no agresiva con técnicas de imagen3,4; no sólo los aspectos relacionados con la limitación del flujo sanguíneo, sino sobre todo la composición de las lesiones y, por ende, la posibilidad de evaluar situaciones clínicas potencialmente mortales. Mientras tales avances no llegan, históricamente se han utilizado diversos modelos animales, de los que destacan, fundamentalmente, otros primates, cerdos y conejos, todos ellos con sus limitaciones, ventajas e inconvenientes5-7. De entre los modelos con conejos, cabe destacar el descubrimiento, a finales de la década de los años setenta, de una cepa con hiperlipemia hereditaria8, que más tarde contribuyó al esclarecimiento de los mecanismos proaterogénicos de la deficiencia del receptor de lipoproteínas de baja densidad (LDL)9. En la actualidad, salvo notables excepciones, la investigación en arteriosclerosis con modelos animales se centra en los ratones desde que se descubrió que algunas cepas eran susceptibles, especialmente en respuesta a ciertas dietas10. Más determinante fue la disponibilidad de ratones genéticamente manipulados que presentan lesiones extensas con cierta rapidez11,12.
Diseño experimental: consideraciones prácticas y científicas
Consideraciones éticas
La ciencia no ayuda a tomar decisiones éticas, sino que proporciona hechos sobre los que basar nuestras decisiones, y por tanto un científico no debería confundir la ética con la moral ni con los sentimientos. Pero, al menos nosotros, no nos vemos libres de un cierto desasosiego cuando experimentamos con animales. Particularmente, consideraríamos superior cualquier otro modelo que pudiera darnos las mismas respuestas que las obtenidas con experimentación animal. No sólo eso, aplaudimos que parte de la investigación se dirija a hacer obsoletos los estudios con animales. Los conocedores de Darwin que tenemos acceso al genoma de Mus musculus y Homo sapiens sapiens no olvidamos que hace unos 75 millones de años compartíamos un único ancestro común, posiblemente un pequeño insectívoro. Consideramos que es nuestro deber proceder de forma similar a la que ponemos en práctica en ensayos clínicos con humanos. Es decir que, como mínimo, debemos asegurarnos que nuestra hipótesis sea relevante. Esto se consigue en parte mediante la creación de comités integrados por diferentes estamentos sociales que valoren las explicaciones de los investigadores. También debemos asegurarnos de que la experimentación llegue a buen término contando con un presupuesto, la preparación precisa, un proyecto de investigación escrito y sancionado por la comunidad científica y procedimientos normalizados de trabajo de probada utilidad que tengan en cuenta el ahorro de sufrimientos inútiles. Finalmente, debemos asegurarnos que las condiciones de vida de los animales sean las más adecuadas, las instalaciones lo más tecnificadas posibles y el personal cualificado por las instituciones competentes. Uno de nosotros tiene edad suficiente para haber trabajado en jaulas instaladas en la terraza de los laboratorios o en habitaciones sin ventilación arrancadas a actividades que se iban quedando obsoletas. Ahora es fácil decir que no deberíamos haberlo hecho, pero se abriría un debate estéril y poco práctico. No podemos volver a hacerlo. También somos conscientes del debate sobre que un estabulario científico moderno está mejor dotado que otros dedicados a la obtención de carne para el consumo humano, y que éstos últimos son bien tolerados por la sociedad, pero las comparaciones no sirven, a nuestro juicio, para autorizar a trabajar en condiciones inferiores a las óptimas.
¿Qué modelo o cepa de ratón elegir?
La cepa de ratón C57BL/6 es la preferida por razones históricas10, pero para que este animal desarrolle un cierto grado de arteriosclerosis se debe llevar a cabo importantes manipulaciones dietéticas, lo que ha hecho que este modelo pierda interés. En especial, se necesita añadir colato al colesterol y dietas ricas en grasas saturadas para obtener lesiones relativamente pequeñas. La acción tóxica de ese compuesto hace difícil la interpretación y muchos investigadores tienden a rechazarlo. Los ratones manipulados genéticamente usados con mayor frecuencia también tienden a ser de esa cepa tras varias manipulaciones reproductoras. Tanto es así que son todos extraordinariamente parecidos, lo que obliga, cuando se trabaja con varios modelos, a medidas importantes de identificación y caracterización genética (fig. 1). Nos referimos a los deficientes en la apolipoproteína E (apo-E /)11, que desarrollan lesiones con la dieta normal de un ratón, y los deficientes en receptor de las lipoproteínas de baja densidad (LDLR /)12 que, por el contrario, no desarrollan lesiones grandes si la dieta no se suplementa con colesterol13. Tienen la ventaja añadida de que su disponibilidad es inmediata y a un precio muy asequible (600 euros por pareja) en caso de que se disponga de medios para su reproducción (los precios están disponibles en: http://jaxmice.jax.org/jaxmice-cgi/jaxmicedb.cgi; un catálogo, en: http://www.criver.com/general/2005_ Research_Model_Services_Catalog.pdf). Para mayor comodidad, en España, los distribuidores proveen de todo tipo de servicios y atienden prontamente las consultas. La mayor parte de las veces la elección se circunscribe a uno de estos 2 tipos de ratones y sólo ha de tenerse en cuenta que la tendencia a la obesidad, la respuesta a la glucosa y a diferentes grasas y diversos aspectos de la función inmunitaria pueden diferir. Una posible limitación de estos ratones es que predomina la acción de las lipoproteínas como agente inductor de arteriosclerosis, pero la experiencia de estos últimos años confirma que se puede ensayar numerosas otras posibilidades, incluyendo las genéticas y las farmacológicas, con cierta confianza14. Aun así, las manipulaciones que alteran aún más la hiperlipemia de estos animales, que acostumbra ser cuantitativamente desmesurada en comparación con la habitual en humanos, puede dificultar la interpretación de los resultados. Sin embargo, la elección no está limitada. La generación de animales transgénicos, con sobrexpresión de la molécula de interés o con un doble e incluso triple defecto genético, permite estudiar diferentes mecanismos de forma sencilla y los resultados son fácilmente interpretables15. Generalmente, se ha de obtener esos ratones de los propios creadores, pero en nuestra experiencia, limitada a la deficiencia de paraoxonasa, CX3CR1 o de MCP-1, los trámites son sencillos y los mecanismos de envío, aunque caros (unos 1.600 euros) son muy eficientes. Otro aspecto que tener en cuenta es el tipo de células en el que pensamos influir con nuestros experimentos. En ambos apo-E / y LDLR /, predominan los macrófagos en la lesión, en LDLR / no hay tanta respuesta de células musculares lisas como en apo-E /, y en ninguna de las 2 hay una infiltración considerable por linfocitos T, al menos en comparación con las lesiones humanas. Esto último puede tener importancia si lo que se está ensayando es manipulaciones funcionales inmunitarias. Finalmente, es importante considerar la cepa de origen, especialmente cuando la manipulación es tan extensa, la más frecuente de las cuales es C57BL/6, como ya hemos mencionado, pero también pueden preferirse otras, por diversas razones. Los distribuidores suministran los animales en aquella que solicitamos, pero los investigadores han de tener en cuenta que, según la cepa, las características de la lesión van a ser diferentes, como así va a ser el efecto de las manipulaciones que pretendamos investigar16. En todo caso, es obligatorio conocerla si se va a requerir en el curso de los experimentos un grupo control no modificado genéticamente. Recomendamos fervientemente que los aspectos técnicos los solvente la industria; no sólo lo hacen mejor, sino, paradójicamente, más barato en último término.
Figura 1. Utilizar ratones de la misma cepa tiene ventajas importantes, pero también inconvenientes. El principal, tener medidas de identificación de los animales y de las manipulaciones genéticas, así como disponer de abundante espacio.
¿Machos, hembras, o los dos?
Para evitar problemas con la mentalidad de corrección política dominante, deberíamos recomendar que se incluya en los experimentos ambos sexos. Sin embargo, ha de considerarse que el coste total del experimento se duplica, ya que no pueden plantearse experimentos mixtos. En general, observaremos efectos que van a depender del sexo y, por tanto, debemos contar con el suficiente número de elementos para practicar el análisis estadístico separado entre machos y hembras17-19. Salvo notables excepciones20, existe unanimidad en considerar que las lesiones son más grandes en las hembras que en los machos, con ambos modelos de animales. Por tanto, en principio, el uso de hembras está más generalizado. Sin embargo, no hay indicios de que la elección de un sexo sobre otro tenga mayor importancia. De hecho, nosotros preferimos el uso de machos porque la variabilidad en la medida de la arteriosclerosis, y en otras muchas variables, es menor y, por tanto, permite reducir el número de animales que hay que incluir en un determinado estudio21-24. A pesar de ello, hemos de reconocer que hay aspectos prácticos que pueden hacer atractivo usar hembras en lugar de machos, en especial por el hecho de que las hembras pueden estar enjauladas juntas, aunque procedan de diversas camadas. Ello es prácticamente imposible con machos debido a la agresividad con la que llevan a cabo sus relaciones sociales, y requieren muchas más jaulas y mayor espacio de estabulario. A pesar de que las diferencias entre sexos eran notables, no se procedió a estudiarlas hasta recientemente, y los resultados han sido de lo más esclarecedores25 y de utilidad práctica en el humano26. Lección que conviene aprender.
Variabilidad y número de animales a incluir
La variabilidad es un problema importante. Los estudios se llevan a cabo en animales de un limitado número de camadas originadas en una sola pareja (o en pocas), siempre en ambientes controlados, con dietas bien establecidas y con personal estable y entrenado para el trabajo. A pesar de ello, hay una considerable variabilidad en la extensión de la arteriosclerosis lograda. Lo que es más sorprendente, incluso en las mismas condiciones y con igual tiempo de estudio, la extensión de las lesiones varía entre los laboratorios. Finalmente, es importante asegurarse de que la distribución de las lesiones sea normal estadísticamente y pase la prueba de igualdad de varianzas, lo cual no siempre se consigue y determina el tipo de prueba estadística a considerar. Respecto a ello, los estadísticos consultados coinciden en que no es tan importante el número de animales, ya que para ello se inventaron las pruebas para muestras pequeñas, sino que las pruebas estadísticas se apliquen de acuerdo con sus limitaciones.
Para determinar el número de animales a incluir en un determinado estudio, el tamaño de los grupos, debemos conocer por adelantado la varianza de las variables en los grupos control y asegurarnos de que las predicciones de los cambios introducidos por las manipulaciones a considerar sean suficientemente grandes. Los datos obtenidos de la literatura médica tienen poco valor y deben obtenerse en el propio laboratorio, ya que la mayor parte de la varianza obtenida es consecuencia directa de nuestras condiciones de cuidado, manipulación y estabulado. Algunos investigadores consideran que si tales cambios no son apreciables con un número de animales pequeño, no lo van a ser con números mayores o, si lo son, van a ser poco relevantes para el estudio de la hipótesis previa. Consecuentemente, plantean con frecuencia estudios piloto que dirigen el ensayo final. Para tales ensayos proponemos n = 8 por cuestiones estadísticas, por muy sorprendente que pueda parecer a los investigadores acostumbrados a manejar bases de datos con cientos de pacientes incluidos. Como quiera que convenga repetir los estudios, principalmente para asegurar las conclusiones finales y asegurar la reproducibilidad, si los resultados son satisfactorios, se puede sumar los números para obtener n >= 20. Ello conlleva, como es obvio, un buen número de problemas prácticos, logísticos, presupuestarios y de espacio. No parece haber indicaciones claras sobre la manera óptima de proceder, por lo que se ha de considerar seriamente cualquier sugerencia.
Manipulaciones para obtener lesiones suficientemente grandes o avanzadas
Los ratones apo-E / son hiperlipémicos de forma "espontánea", y sin necesidad de otras manipulaciones desarrollan arteriosclerosis en un lapso razonable. Sin embargo, muy frecuentemente27,28 hemos usado dietas ricas en grasa y colesterol con el fin de acelerar la formación de la lesión, en un intento de obtener lesiones más parecidas a las observadas en humanos. En efecto, las lesiones son más avanzadas que la clásica placa fibrosa y se observan en más zonas del árbol arterial, pero no se puede descartar que con tal proceder introduzcamos nuevos mecanismos que dificulten la interpretación. En particular, añadimos un mayor componente inflamatorio que puede alterar la histología normal de otros órganos, en especial el hígado22, y por tanto alterar la respuesta bioquímica o metabólica a las variaciones experimentales. También modificamos la capacidad de respuesta a la oxidación o variar la respuesta de determinadas condiciones experimentales, como la inclusión de antioxidantes en la dieta, o reducir la masa sanguínea circulante, lo cual a su vez dificulta enormemente la interpretación de los resultados29-32. Ya hemos comentado que, en ratones C57BL/6, la dieta es fundamental para obtener lesiones arterioscleróticas de cierta magnitud y que incluso se hace necesaria la inclusión de ácido cólico y grandes cantidades de colesterol. El colesterol puede inducir la expresión hepática de genes relacionados con la inflamación y el colato tiene un papel relevante en el depósito de colágeno tanto en las arterias como en el hígado33. Una vez más, en experimentos en los que se intenta manipular la inflamación, no sería conveniente utilizar este tipo de dietas21. Por el contrario, en ratones LDLR / no sólo es conveniente, sino necesario, utilizar dietas proaterogénicas para obtener lesiones similares a las obtenidas en ratones apo-E /. Acostumbran ser dietas ricas en grasas saturadas (20%) y en colesterol en un rango que se mueve entre el 0,15 y el 1,25% del peso del alimento. Sorprendentemente, no hay estudios sistemáticos sobre el papel que tienen estos diferentes tipos de dietas en ambos modelos animales, lo que ha sido el motivo fundamental de algunos trabajos que están cerca de finalizar en nuestro laboratorio.
Más recientemente se ha ensayado un nuevo método favorecedor de arteriosclerosis que puede tener relevancia en la enfermedad humana. En efecto, parece que algunos inhibidores de la enzima de conversión de la angiotensina tienen un cierto papel en el proceso de aterogénesis34,35 y por ello se utilizan en la prevención secundaria36. Coincide con los datos obtenidos en ratones hiperlipémicos mediante la infusión continua de angiotensina II37; en ausencia de factores hemodinámicos relevantes, pero en condiciones de hiperlipemia, se produjeron cambios muy significativos en la enfermedad vascular. Probablemente sea pronto para recomendar tal manipulación, pero parece interesante, ya que combina los 2 factores de riesgo más prevalentes: hipercolesterolemia e hipertensión.
¿Cuánto debe durar el experimento?
Una vez más, no hay respuesta clara y el investigador ha de tomar decisiones sin criterios aceptados de forma generalizada. Por tanto, concluiremos que lo ideal es tomar medidas a intervalos regulares durante largo tiempo. Ello comporta ciertos problemas técnicos y aumenta el esfuerzo organizativo del estabulario y el tiempo total de trabajo, por lo que la mayoría de los estudios se plantean a un tiempo final determinado, que puede ser largo o corto, si en la hipótesis se asume que el efecto en el desarrollo de la arteriosclerosis será poco o muy intenso. En nuestra experiencia, sin embargo, el efecto de una manipulación, en este caso la administración de aspirina, puede ser transitorio o únicamente eficaz en las fases iniciales de la aterogénesis24. Siguiendo con el mismo ejemplo, es posible que con tiempos más prolongados el efecto conseguido deje de apreciarse o sea incluso el contrario23. Se han publicado otros ejemplos de efecto transitorio; por ejemplo, en ratones doblemente knockout deficientes en receptor de LDL y también en linfocitos (RAG1), sólo se observó un efecto antiaterogénico en las primeras semanas, efecto que desapareció posteriormente38. También la expresión de 15-lipooxigenasa en el endotelio vascular sólo tiene efecto perjudicial para la arteriosclerosis en las fases precoces de la enfermedad39. En los 3 casos hubo reducciones o aumentos de lesión que no se mantuvieron y que por tanto necesitaban de una estrategia parecida a la que recomendamos, es decir, medidas a intervalos regulares y prolongación del estudio. Por último, y aunque no conocemos ningún caso en la literatura médica, teóricamente es posible que una determinada manipulación sólo tuviera efectos visibles en fases tardías y en consecuencia no detectáramos tales cambios con estrategias más sencillas.
Cuantificación de la arteriosclerosis. ¿Dónde y cómo?
En modelos animales relativamente grandes, como los conejos, el método habitual era aislar la aorta, cortarla longitudinalmente, extenderla con alfileres en un lecho de cera, fotografiarla y evaluar las zonas de la íntima con lesiones evidentes a simple vista40, manipulación más conocida como método en face. Sin embargo, cuando se empezó a utilizar ratones en estos estudios, se observó que el único sitio donde aparentemente se reproducían las lesiones era la raíz aórtica y que esto era constante en los diversos modelos10. Ello no parece ser así precisamente en los modelos de ratones genéticamente manipulados, por lo que el estudio puede hacerse en cualquier otra zona.
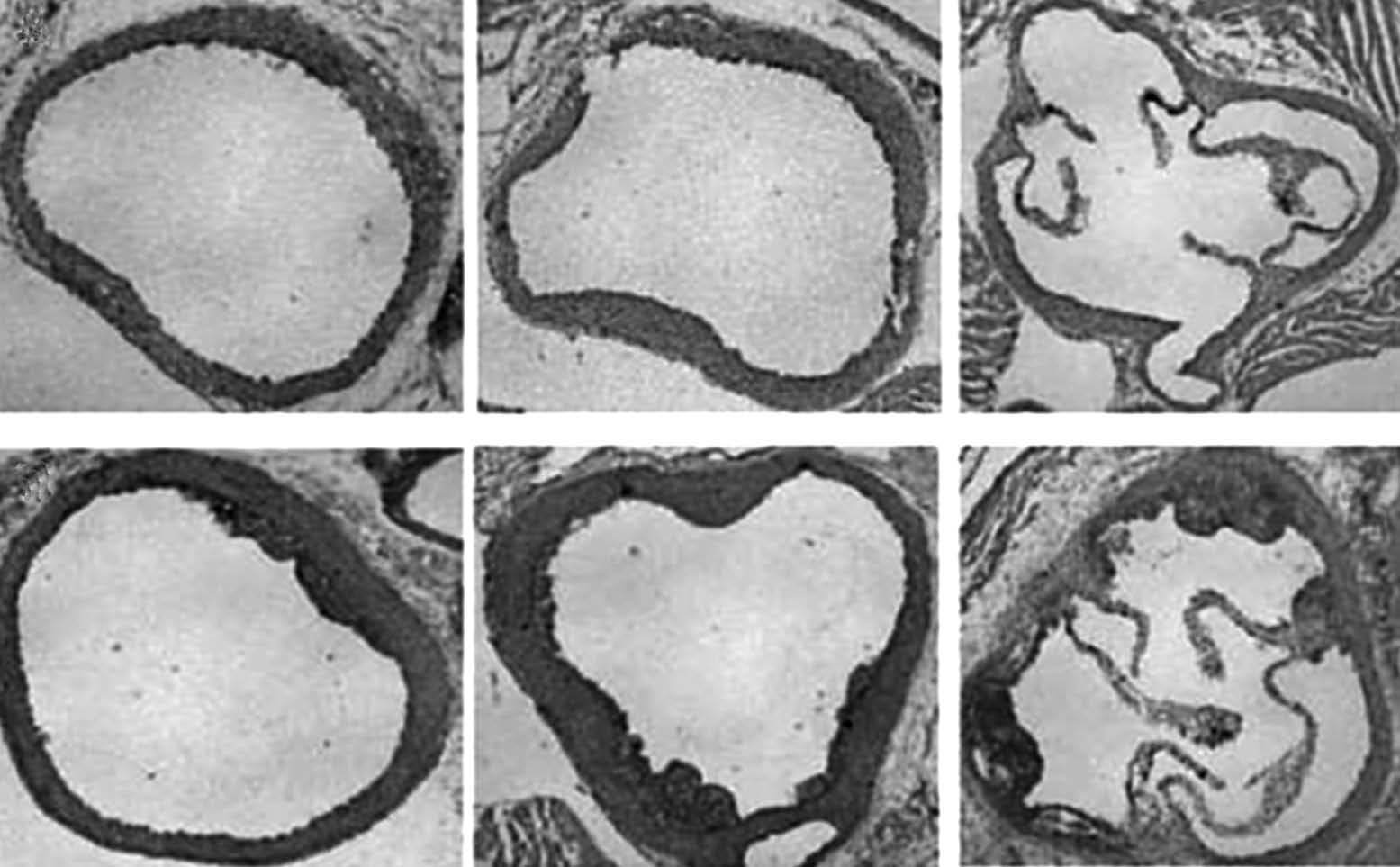
Por lo que respecta a la raíz aórtica, el método está perfectamente descrito desde hace casi 20 años41 y poco nuevo puede añadirse. Básicamente consiste en la exploración secuencial de cortes que van, en sentido descendente, desde el nacimiento de las válvulas aórticas hasta una zona predeterminada en la que no acostumbra haber lesión (la fig. 2 incluye un ejemplo de tal exploración). Las lesiones se ven con claridad con cualquier tinción de lípidos, e incluso sin ellas, y se cuantifican con cualquier programa de análisis de imágenes manejado por algún operador que desconozca los detalles del diseño. La cuantificación automatizada, aunque técnicamente posible, es claramente inferior a la manual asistida, ya que la afinidad del colorante no es reproducible de un experimento a otro. La lesión varía según el tramo estudiado y por tanto hay que tener bien establecido qué y cuántos cortes analizar. El mayor problema, con todo, estriba en que hay que congelar la muestra rápidamente y cortarla con criótomo, habilidades que hay que adquirir no sin esfuerzo y con una gran inversión en tiempo.
Figura 2. Lesiones representativas en el arco aórtico de ratones LDLR / de la misma edad, alimentados con dieta normal (panel A) o con dieta rica en colesterol (panel B). Nótese que las secciones corresponden a diferentes sitios anatómicos del vaso. Las lesiones más grandes se observan en el nacimiento de las válvulas aórticas.
El método en face es más sencillo, pero no está exento de problemas. Normalmente las lesiones son grandes y no se requiere tinción para observarlas. Puede automatizarse, en cuyo caso sí se requiere una coloración adecuada, pero incluso un buen equipo de captación de imágenes deja sitio a tomar arbitraria y ambiguamente la decisión de dónde terminan las lesiones. El tamaño de las lesiones se expresa en porcentaje de superficie de íntima analizada, por lo que se debe normalizar todo el proceso de preparación. Como muchos otros, dividimos el análisis entre arco aórtico, aorta torácica y aorta abdominal, aunque en estas 2 últimas las lesiones son mucho menores que en la primera. Como es obvio, la comparación entre laboratorios es imposible. Tal vez por ello no haya estudios multicéntricos en este campo. Ambas determinaciones tienen en consideración el área dañada, pero difícilmente el grosor de las lesiones y su volumen. Teóricamente el método adecuado sería medir el contenido en colesterol de los segmentos analizados, lo cual tiene también sus problemas y no puede practicarse con tejido teñido, por lo que se perdería la referencia a los métodos clásicos. También podría parecer exagerado cuando, en la práctica, la distinción con los grupos control suele ser satisfactoria.
El principal inconveniente de ambos métodos es que en estas zonas y en estos modelos no se suele ver lesiones clínicamente significativas. En un estudio que analizó todo el árbol arterial, se describió que en la arteria innominada (braquiocefálica), un vaso que conecta el arco aórtico con la subclavia derecha y la arteria carótida derecha, se observan lesiones que constriñen la luz y presentan una media atrófica con inflamación perivascular42. Con el tiempo (más de 60 semanas), las lesiones son muy parecidas a las obtenidas en humanos en fase muy avanzada, así que podría ser un modelo adecuado para estudiar maniobras de curación, si es que alguna vez se descubren. En algunos modelos, los cambios en la arteriosclerosis se descubren fundamentalmente en esta arteria, en fases precoces, y los cambios acostumbran ser mayores43. Por el momento, nuestros intentos no han sido satisfactorios, ya que la disección de un vaso no más grueso que un cabello fino se enfrenta a problemas técnicos importantes. Lo que es más desalentador, la expresión de algunos genes difiere notablemente según la arteria o la zona estudiada. Por tanto, conviene tener en cuenta estos hechos y asumir las limitaciones de las conclusiones inferidas.
Interpretación de los resultados y evaluación de la composición de la lesión
Por lo visto anteriormente, parece haber cierta selectividad en el sitio donde se presentan los efectos de nuestras manipulaciones o experimentos, por lo que pueden derivarse ciertas ventajas al obtener datos en más de una región. Confirmamos que ése es el caso cuando coinciden los resultados en las diversas zonas del lecho vascular. Sin embargo, si hay divergencias, la interpretación se hace aún más difícil. En esos casos, como normalmente se observan en raíz aórtica antes que en otros territorios, el tiempo de experimentación deviene particularmente importante23,44.
Sin embargo, el verdadero problema en la interpretación de los resultados estriba en que no está clara la correspondencia entre la arteriosclerosis del humano y la de nuestros ratones manipulados. La localización de las lesiones es muy diferente y no puede adscribirse alegremente a diferencias hemodinámicas simples entre humanos y ratones. No debemos olvidar que las arterias coronarias o las carótidas de estos ratones no suelen sufrir alteraciones más que en manipulaciones enérgicas y, por el contrario, en humanos, la afección de estas arterias representa la primera causa de muerte. No tendría mayor importancia si tuviéramos pruebas de que los mecanismos básicos son los mismos. Aunque sean indirectas, las tenemos, pero tampoco hay que olvidar que la concentración de lipoproteínas aterogénicas en estos animales es muy superior a la que puede encontrarse en patología humana. En definitiva, aunque estos modelos han hecho avanzar nuestro conocimiento de forma notable, no podemos culpar a los escépticos.
Una manera de reducir la incertidumbre consiste en el estudio pormenorizado de la coma que ello, a la postre, va a constituirse en determinante del episodio clínico45. Podría ocurrir que en los modelos con ratones estuviésemos explorando precisamente eso, la composición de lesiones arterioscleróticas avanzadas. El paradigma actual que explicaría la lesión coronaria mortal sigue siendo el de Virchow, es decir, el ateroma recubierto de capa fibrosa que se rompe y da lugar a estímulos trombogénicos. Si así fuera, deberíamos concluir que lo que exploramos en ratones es otra cosa. Sin embargo, según otras series, sólo en un tercio de los casos hay una verdadera rotura y en el 35% de las lesiones con trombo no la hay. Lo que es más curioso, en muchas lesiones los macrófagos y linfocitos son una excepción, es decir que no hay inflamación significativa. El tejido erosionado se compone fundamentalmente de células musculares lisas rodeadas por una matriz rica en proteoglucano46-48.
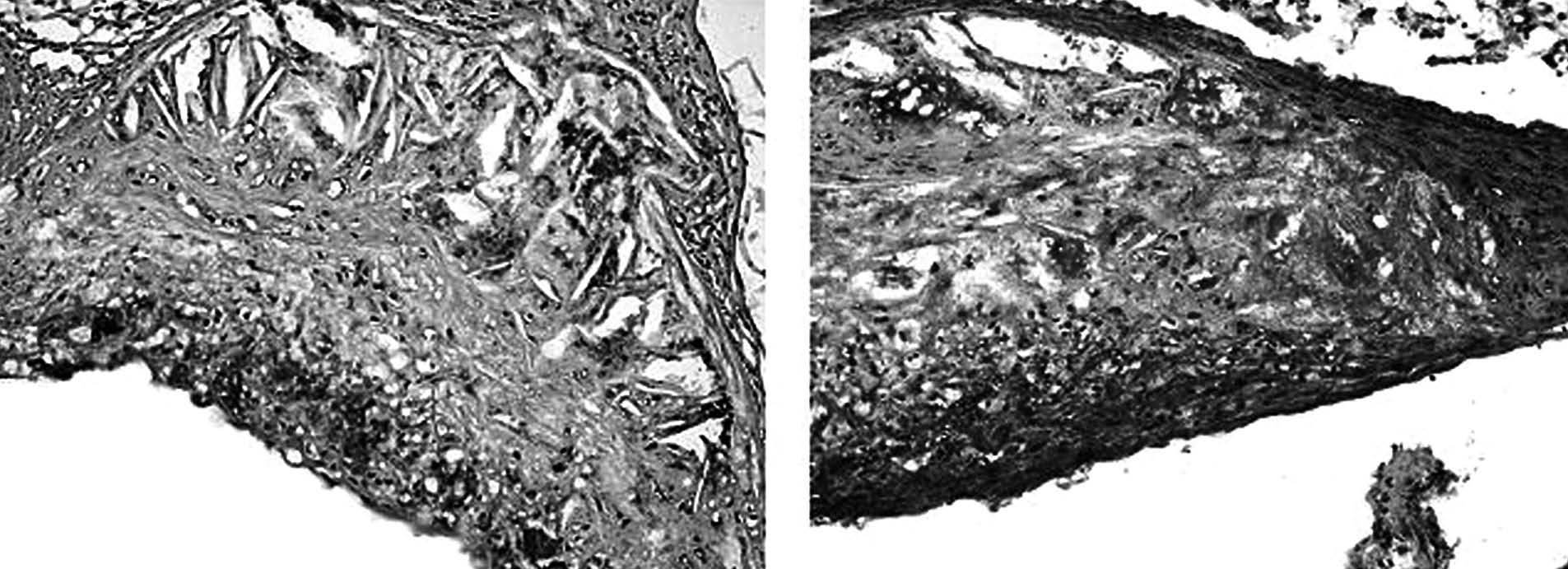
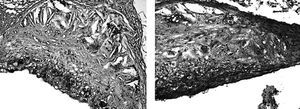
Por ello, entre otras razones, consideramos importante expresar la lesión hallada en los ratones en función de su composición celular, ya que se podría considerarla un marcador de la susceptibilidad de dicha lesión. Por tanto nuestra estrategia consiste en obtener suficientes cortes, que aumentan el tiempo y el presupuesto, para estudiar la composición relativa en macrófagos, células de músculo liso y matriz extracelular mediante técnicas histológicas normales o inmunocitoquímica, todas ellas bien resueltas y aceptadas (fig. 3). Los linfocitos T son demasiado minoritarios para tenerlos en cuenta. Si bien la obtención de las imágenes es buena, la cuantificación es complicada y diferentes laboratorios obtienen diferentes medidas. El problema estriba en que no están estandarizados el número de cortes que hay que analizar, el espectro de las lesiones que tener en cuenta ni el propio método de medida: contar células o contar área de tejido teñido de forma específica. Para terminar de complicarlo, tampoco está reconocido el método para normalizar las medidas: en función de la lesión, del área de la lesión, del porcentaje de células o del área examinada. Por tanto, la interpretación recae especialmente en las medidas obtenidas en el grupo control dentro del mismo estudio e impide la comparación entre diferentes experimentos.
Figura 3. La composición de las lesiones proporciona información valiosa, muy facilitada por las técnicas de inmunohistoquímica habituales. Entre otras, puede evaluarse la presencia de macrófagos (panel A) o la disposición conjunta de macrófagos y células musculares lisas (panel B).
Técnicas de imagen en los animales, ¿por qué no?
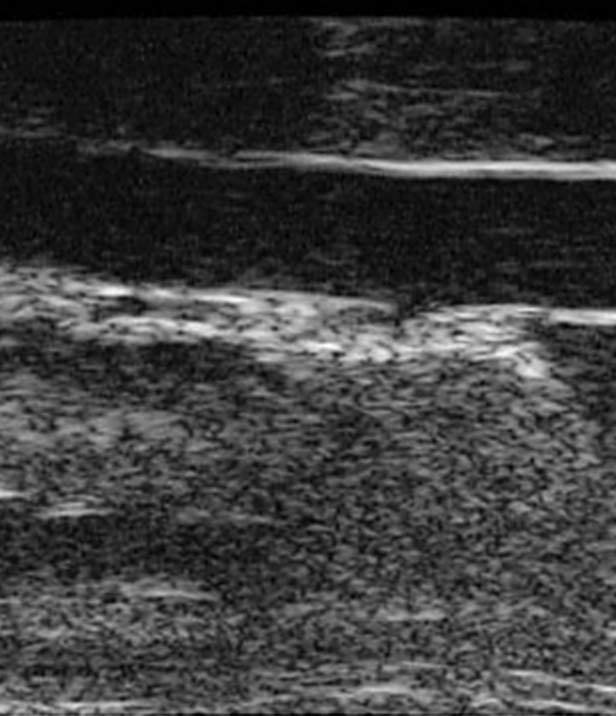
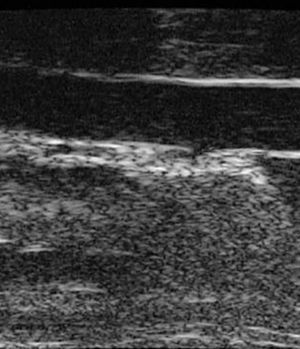
Al principio de este trabajo expresábamos el deseo de disponer para el ser humano de técnicas de imagen que posibilitaran la valoración del tamaño y la composición de las lesiones in vivo, lo que parece estar en vías de solución3,4. No vemos motivos por los que no se pueda aplicarlas a un animal más pequeño. Es más, los estudios de regresión de la placa, que esperamos serán los más numerosos en un futuro, podrían hacerse fácilmente en animales si dispusiéramos de la tecnología adecuada. Por lo que sabemos, sólo un grupo está investigando seriamente esta área con imágenes obtenidas mediante resonancia magnética, con resultados alentadores en cuanto a la posibilidad de explorar continuamente la enfermedad vascular49. Otra estrategia en animales consistiría en medir el grosor de la íntima-media de la aorta de la misma forma en que la medimos en las carótidas en humanos50 para evaluar la progresión de la enfermedad. El instrumento necesario, aunque caro (140.000 euros) y fuera de nuestras posibilidades, ya está diseñado y en funcionamiento. Los datos de los que disponemos son indirectos y fruto de una colaboración internacional pero, como se observa en la figura 4, la exploración in vivo de la aorta de los ratones deficientes en apo-E es perfectamente posible.
Figura 4. Medir el grosor de la íntima-media en la aorta de ratones es fácil y fiable con el instrumento y los programas adecuados. Si se dispone de ellos, pueden plantearse experimentos de regresión o progresión de la placa in vivo. La fotografía fue cedida por Eric de Groot y tomada en un instrumento Visualsonics.
Conclusiones
Los ratones genéticamente manipulados que desarrollan hiperlipemia y, por ende, arteriosclerosis constituyen un modelo experimental válido e interesante para avanzar en el conocimiento tanto de la arteriosclerosis como del metabolismo de las lipoproteínas. La aplicación de técnicas de imagen hará este modelo aún más valioso en el futuro. Sin embargo, el modelo no está libre de limitaciones que se deben conocer y discutir para diseñar eficazmente los experimentos y, por lo tanto, aplicar la máxima atención en el desarrollo, la ejecución, la adquisición de datos y, sobre todo, la interpretación de los resultados.