El sobrepeso y la obesidad han adquirido una dimensión pandémica y se considera que el exceso de peso incluye la asociación de otros factores de riesgo cardiometabólico, como dislipemia aterogénica, hipertensión arterial, resistencia a la insulina y disglucemia, así como un estado proinflamatorio y protrombótico. El objetivo de esta revisión es dar a conocer el descubrimiento reciente de un novedoso sistema endógeno denominado sistema endocannabinoide involucrado en la obesidad y el riesgo cardiometabólico. Recientemente, el tejido adiposo se ha reconocido como un órgano humoral que expresa y segrega varias adipocinas, como leptina, adiponectina, resistina y numerosas citocinas que incluyen el factor de necrosis tumoral alfa y la interleucina 6. Como consecuencia de este agrupamiento de factores de riesgo cardiovascular y metabólico, la expectativa de vida de los pacientes con sobrepeso y obesos se reduce al compararla con individuos de peso normal. Se presentan los resultados de algunos estudios preclínicos y clínicos que han mostrado los efectos dependientes de su bloqueo en el control de la homeostasis de energía y de parámetros metabólicos. Se enfatiza la necesidad de un nuevo enfoque de control del sobrepeso y de los factores de riesgo asociados, basados en su patogenia, que incluya el bloqueo del sistema endocannabinoide, el cual desempeña un papel fundamental en la regulación de la ingestión de alimentos y en la emergencia del conjunto de factores proaterogénicos.
Overweight and obesity have reached pandemic dimensions, and are associated with other cardiometabolic risk factors,such as; atherogenic dyslipemia, high blood pressure, insulin resistance, and dysglycemia, as well as a pro-inflammatory and thrombotic states. The aim of this review is to show the recent discovery of a novel endogenic system, called endocannabinoid system, involved in obesity and cardiometabolic risk. Recently, fat tissue has been recognized as a humoral organ expressing and secreting some adipokines, such as: leptin, adiponectin, resistin, and many cytokines including alfa-tumoral necrosis factor, and interleukin 6. As consequence of this grouping of cardiovascular and metabolic risk factors, the lifeexpectancy of overweight and obese patients is decreased compared to individuals of normal weight. The authors present the findings of some preclinical and clinical studies showing effects dependent of its blockade on control of energyhomeostasis and metabolic parameters. The need of a new approach to controlling overweight and its related risk factors is emphasised, based in its pathogenesis, including blocking of the endocannabinoid system, which plays a critical role in regulation of food ingestion, and in the emergence of pro-atherogenic factors.
El sistema endocannabinoide (SEC) está constituido por derivados lipídicos endógenos que se unen y activan al mismo receptor que media los efectos de los principios activos del cannabis.
Los endocannabinoides (EC) más estudiados son la araquidonil etanolamida- anandamida y el 2-araquidonilglicerol (2-AG). Ambos componentes son psicoactivos y activan los receptores cannabinoides (RCB), al igual que hacen los cannabinoides de plantas de la especie Cannabis sativa y de la marihuana1–3.
A su vez, los RCB se dividen en CB1 y CB2: a) los primeros se distribuyen fundamentalmente en el cerebro y el tejido adiposo, pero también pueden encontrarse en el miocardio, el endotelio vascular, las terminaciones nerviosas simpáticas, el páncreas, los músculos, el aparato gastrointestinal y el hígado4–12, y b) los segundos se localizan en estructuras asociadas con el sistema inmunitario y en órganos hematopoyéticos13.
Con esta revisión pretendemos mostrar los aspectos fundamentales del SEC en relación con los mecanismos de su síntesis y degradación, su vinculación con el sobrepeso y la obesidad, así como con otros factores de riesgo cardiometabólico, y señalar los beneficios esperados con la inhibición de este sistema.
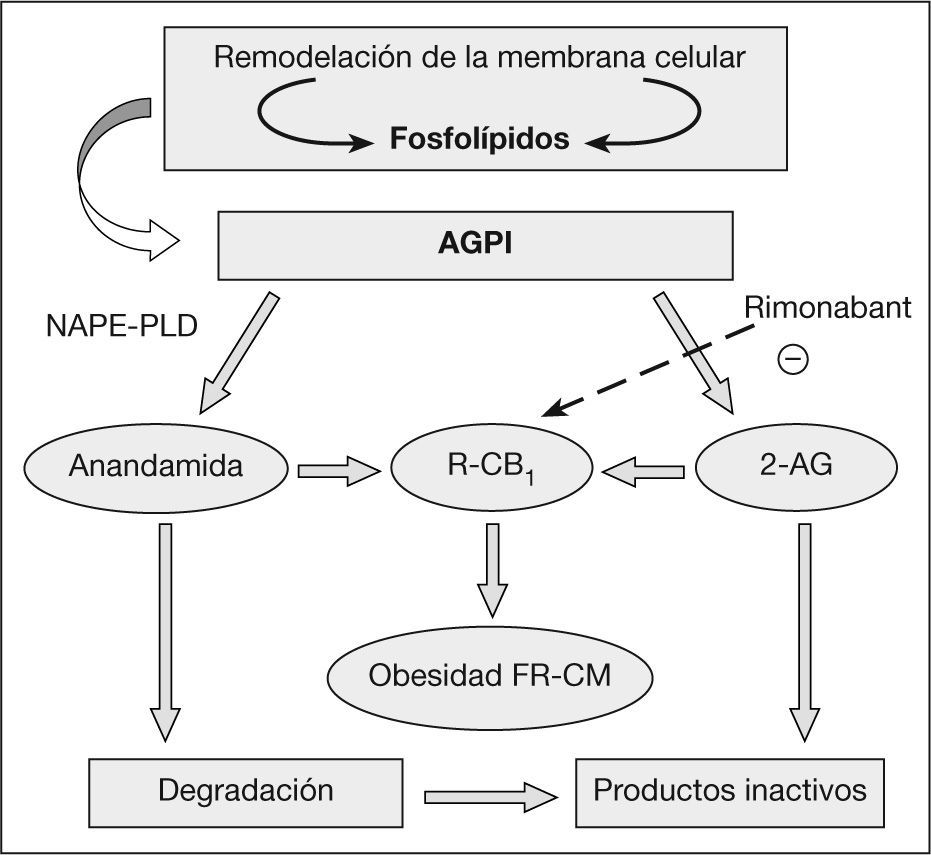
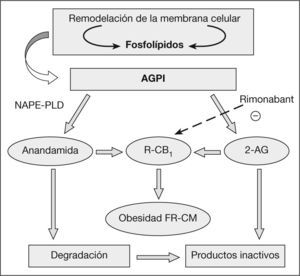
Síntesis y degradación de los endocannabinoidesTodos los EC derivan de los ácidos grasos (AG) poliinsaturados de cadena larga, específicamente del ácido araquidónico. La anandamida y el 2-AG se sintetizan a partir de fosfolípidos dependientes y las enzimas que catalizan su formación a partir de los precursores son la n-acilfosfatidiletanolaminafosfolipasa D y la diacilglicerol lipasa, respectivamente14,15. Tanto la anandamida, como el 2-AG se hidrolizan rápidamente por una amidohidrolasa de ácido graso y por la monoacilglicerol lipasa, respectivamente, a componentes inactivos para los RCB16,17 (fig. 1).
Sistema endocannabinoide: formación e inactivación. 2-AG: araquidonil glicerol; AGPI: ácidos grasos poliinsaturados; DAG-L: diacilglicerol lipasa; FAAH: amidohidrolasa de ácidos grasos; FR-CM: factores de riesgo cardiometabólico; MAG-L: monoacilglicerolipasa; NAPE-PLD: acilfosfatidiletanolamina-fosfolipasa D; R-CB1: receptor cannabinoide.
En las neuronas, después de sintetizarse, los EC se difunden de forma retrógrada a través de la sinapsis a la membrana neuronal presináptica, donde activan los receptores CB1 con la consiguiente nivelación de neurotransmisores en la sinapsis, lo cual caracteriza el proceso conocido como neurotransmisión retrógrada.
Los EC no están confinados al sistema nervioso central, de manera que en otros tejidos se sintetizan en respuesta ante estímulos fisiológicos y patológicos, actúan como mediadores locales en muchos tejidos y se producen a demanda para restaurar los valores y la función de otros mediadores, incluidos los neurotransmisores excitatorios e inhibitorios18.
El SEC está involucrado en la conducta alimentaría, en la antinocicepción, en la regulación de la memoria reciente, en el control del movimiento y en la neuroprotección19. También presenta efecto antiproliferativo, modulación de la secreción hormonal e interviene en la respuesta inmunitaria e inflamatoria.
Papel del sistema endocannabinoide en la regulación de la ingesta de alimentosEl hipotálamo es el área cerebral que controla la ingestión de alimentos por medio de una serie de neuronas que proveen valores altos de adaptabilidad de la conducta alimentaria ante estímulos endógenos y exógenos20. El SEC interviene en los mecanismos centrales que modulan la ingestión de alimentos, efecto que logra mediante la regulación de la expresión y/o acción de varios mediadores hipotalámicos anorécticos y orexigénicos. El efecto neto de los cannabinoides es el aumento de la ingesta.
Los EC y los receptores CB1 están presentes en las áreas del hipotálamo involucradas en la ingestión de alimentos que son capaces de interactuar con señales de origen periférico. El receptor CB1 se colocaliza con el mediador anoréctico conocido como hormona liberadora de corticotropina en el núcleo paraventricular y con el mediador orexigénico conocido como hormona concentradora de melanina en la región hipotalámica lateral. La estimulación de los receptores CB1 causa sensibilización de los receptores orexin 1, lo cual incrementa el apetito inducido por sustancias endógenas estimulantes del apetito u orexinas21.
Los receptores CB1 parecen inhibir los episodios anorécticos determinados por la activación de los receptores de la melanocortin 4. La inyección de anandamida dentro de la región ventromedial del hipotálamo en ratas provoca hiperfagia por vía CB1 dependiente22.
La leptina y la adiponectina son adipocinas secretadas por los adipocitos, que al igual que la grelina, una hormona secretada en el aparato gastrointestinal, pueden actuar directamente en las neuronas hipotalámicas. La inyección intravenosa de la leptina origina una disminución de la liberación de EC hipotalámicos19. Un tono EC aumentado se ha asociado también con incremento de los valores de grelina en sangre después de la deprivación de la ingesta de alimentos y puede modular algunos de los efectos orexigénicos de este péptido. El efecto orexigénico de la grelina puede revertirse mediante la administración de dosis sistémicas pequeñas del antagonista del RCB CB123.
Otro mecanismo por el cual el SEC actúa para promover la ingestión de alimentos es a través del nervio vago, que conecta el aparato gastrointestinal con la médula y núcleos cerebrales, involucrados en el control de la saciedad. Las propiedades orexigénicas de los EC se revierten por el bloqueo del receptor CB1 y por destrucción de los nervios sensitivos vagales que también median la saciedad inducida por colecistocininas, de manera que una actividad endocabinoide reducida puede mediar en la inducción de la saciedad por colecistocininas24.
Efectos periféricos dependientes de la activación de los receptores CB1En el momento actual, se considera que el SEC ejerce su acción periférica a través del receptor CB1, efecto que provoca una modulación en el metabolismo del tejido adiposo, en la homeostasis de glucosa y en la recaptación de glucosa por el músculo esquelético25.
Cuando se estimulan los receptores CB1, se incrementa la expresión de lipoproteína lipasa en los adipocitos, lo cual estimula la lipogenia y reduce la expresión y la secreción de adiponectina18. La adiponectina es una proteína circulante específica del tejido adiposo, que desempeña un papel regulador en el metabolismo graso y de la glucosa, al incrementar la sensibilidad a la insulina, disminuir la producción hepática de glucosa y regular el metabolismo de los ácidos grasos libres por supresión de la lipogenia26,27.
En el estudio realizado por Ravinet-Triliou et al28, en ratas sometidas a dietas inductoras de obesidad, el bloqueo del receptor CB1 se asoció con reducción de la ingestión de alimentos y con disminución sostenida de peso corporal.
Los pacientes obesos con resistencia a la insulina o con diabetes mellitus tipo 2 presentan valores plasmáticos reducidos de adiponectina y el bloqueo del receptor CB1 incrementa su expresión y secreción por el adipocito29,30.
Sobreactividad del sistema endocannabinoideEl SEC normalmente se comporta de forma silente y se activa de forma transitoria cuando es necesario, pero en modelos animales con obesidad genética o inducidas por dietas se puede mostrar crónicamente activado, con valores hipotalámicos altos de 2-AG31.
Cuando modelos de ratones ob/ob con comportamiento hiperfágico son tratados con leptina, los valores hipotalámicos de 2-AG son similares a los controles delgados y la concentración de anandamida puede declinar hasta valores indetectables, lo cual sugiere una regulación negativa de los EC por la leptina e indica que esta sustancia y los EC desempeñan un papel crucial en la modulación de la homeostasis de energía y del peso corporal28.
La evidencia disponible hasta el momento apoya la hipótesis de que el SEC está sobreactivado en los individuos obesos. Los adipocitos de animales obesos tienen una expresión mayor de receptores CB1 que los delgados5.
En humanos, la hiperactividad sostenida del SEC, limitado a los tejidos que controlan el equilibrio de energía, puede contribuir al desarrollo de obesidad y se considera que los valores circulantes de anandamida y 2-AG están incrementados (35-52%) en mujeres obesas posmenopáusicas de origen caucásico, comparado con mujeres delgadas, de manera que la sobreactividad del SEC se considera la causa y no la consecuencia de la obesidad, ya sea subcutánea o visceral32,33.
La causa de desregulación del SEC podría ser el incremento de suplemento de precursores para la biosíntesis de EC y el incremento de la actividad de enzimas involucradas en su síntesis, así como una disminución en su degradación34.
Recientemente se ha identificado la variante genética de la enzima FAAH 385 A/A, la cual puede predecir la sustitución de treonina por prolina (P 129T), con lo que se reduce la actividad enzimática de la enzima que conduce a una inactivación menor de anandamida35.
En pacientes prediabéticos, con diabetes mellitus tipo 2 y obesos, la concentración de EC en la grasa visceral y plasma fue superior al compararla con los controles, lo cual ocasiona una desregulación de la célula β con hiperinsulinemia permanente. Los valores elevados de EC en las células β producen hipertrofia de los adipocitos e hiperactividad de los EC en estas células, con incrementos subsecuentes en los valores de lípidos, disminución de adiponectina y aparición de las consecuencias metabólicas derivadas de estas perturbaciones36.
Antagonistas de los receptores CB1: datos preclínicos y clínicosEn 1964, Gaoni et al3 identificaron el compuesto activo de la marihuana, el δ9-tetrahidrocannabinol, pero fue en 1988, después del descubrimiento de su receptor en el cerebro de ratas37, cuando se inició el estudio de su fisiología. Posteriormente, se describieron y se clonaron los RCB38,39 y se avanzó en el conocimiento de los agonistas endógenos1,40, de los antagonistas sintéticos del receptor CB141 y su posible utilización con fines terapéuticos, así como de la posibilidad de modulación en las enzimas que participan en el metabolismo y la señalización de este novedoso sistema42–44.
En 1994, Rinaldi-Carmona et al41 de los laboratorios Sanofi indicaron que el rimonabant, el primer antagonista (bloqueador) específico de los receptores CB1 podría utilizarse como tratamiento antiobesidad, lo cual se probó inicialmente en modelos de animales. De acuerdo con la evidencia de diferentes líneas de experimentación, se ha confirmado que la administración, tanto aguda como crónica, de rimonabant reduce la ingesta de alimentos y el peso corporal.
En animales de laboratorio, mediante la administración intraperitoneal o intragástrica de dosis de 1–10mg/kg/día, durante 10 semanas, rimonabant indujo una reducción marcada en la ingesta diaria de alimentos en ratas normales y obesas, asociados con una reducción inmediata y significativa en el peso corporal45.
En diferentes ensayos clínicos en humanos, se ha tratado de demostrar la importancia del rimonabant en el tratamiento de la obesidad y de los factores de riesgo cardiometabólico46.
López Jaramillo et al47 plantean una asociación importante entre el SEC, la obesidad abdominal y el síndrome metabólico y señalan las ventajas de los antagonistas de los RCB1.
En un ensayo clínico de fase 2, realizado a doble ciego y controlado con placebo, el efecto de rimonabant en dosis de 5–20mg/día se estudió en pacientes con índice de masa corporal entre 30 y 40kg/m2. El promedio de reducción de peso después de un período de 4 meses fue de 4,4kg (20mg) y de 1,1kg en el grupo placebo48.
En ensayos clínicos de fase III, hay 4 estudios, denominados Río-Europa, Río-Lípidos, Río-Norteamérica y Río-Diabetes y que colectivamente se han denominados como programa-RIO49–52. Se trata de estudios multicéntricos aleatorizados, a doble ciego y controlados con placebo. El estudio incluyó a 6.627 pacientes adultos de ambos sexos, con comorbilidad asociada a la obesidad, como diabetes mellitus, hipertensión arterial y dislipoproteinemia. En el brazo de diabetes mellitus, 20mg de rimonabant provocó una caída del 0,7% de la hemoglobina glucosilada, comparado con placebo. En la rama de lípidos, la insulina plasmática en ayunas, la insulinemia y el grado de glucosa plasmática después de una carga oral de 75g de glucosa disminuyeron de forma significativa en el grupo asignado a 20mg de rimonabant, lo cual se asoció también a un incremento del 46% de la adiponectina, así como una disminución significativa de la leptina, de la proteína C reactiva y una reducción modesta de la presión arterial (−2,1/1,7mmHg).
En una revisión reciente de Cochrane53 de los estudios del programa RIO, se informa de una disminución del peso corporal de 4,64kg y de la circunferencia abdominal de 3,84cm en el grupo tratado con rimonabant frente a placebo y, además, señalan una disminución significativa de los triglicéridos e incremento del colesterol unido a lipoproteínas de alta densidad frente a placebo. Los efectos adversos del fármaco (2,3-5,2%) incluyen trastornos psiquiátricas con ansiedad y depresión, así como la presencia de episodios gastrointestinales, que en ocasiones obligan a interrumpir el medicamento.
Conclusiones y perspectivas futurasSe concluye que el sobrepeso y la obesidad, sobre todo abdominal, se acompaña con frecuencia de diversos factores de riesgo cardiometabólico. El tejido adiposo secreta una variedad de factores o adipocinas que contribuyen a la resistencia a la insulina, a la disfunción endotelial y a la aterogenia. La obesidad abdominal coexiste de manera frecuente con intolerancia a la glucosa, dislipemia e hipertensión arterial. La presencia de este agrupamiento de factores de riesgo se pueden asociar con un incremento de la morbilidad y la mortalidad cardiovasculares. Recientemente se ha documentado que la obesidad y sus complicaciones están asociadas con una hiperactividad del SEC en el ámbito central y periférico. El rimonabant, el primer representante de los antagonistas de los receptores CB1, ha demostrado cambios favorables en los valores de lípidos plasmáticos, en la mejoría del control glucémico en pacientes prediabéticos y con diabetes mellitus tipo 2, así como una reducción importante del peso y de la circunferencia abdominal. Sin embargo, resulta conveniente señalar que debido a la presentación de casos con depresión con tratamiento con rimonabant, se necesitan nuevos estudios de seguimiento más prolongados que confirmen tanto los efectos favorables, como los adversos del fármaco, antes de que pueda establecerse como tratamiento habitual de la obesidad y de la comorbilidad asociada, cuestión que ya ha indicado la Food and Drug Administration.