Estudio prospectivo, abierto, de pacientes con el virus de la inmunodeficiencia humana (VIH) con dislipemia asociada al tratamiento antirretroviral (TAR) para analizar la eficacia y la seguridad de la ezetimiba junto a dosis bajas de atorvastatina en pacientes que no alcanzan el objetivo de colesterol unido a lipoproteínas de baja densidad (cLDL) con atorvastatina. Se analizaron las modificaciones en el perfil lipídico, riesgo cardiovascular (RCV) a 10 años (ecuación de Framingham), parámetros inmunovirológicos y concentraciones de creatincinasa y transaminasa glutámico pirúvica a las 24 semanas de añadir ezetimiba al tratamiento. Se incluyeron a 27 pacientes, 13 (48%) alcanzaron el objetivo de cLDL y hubo una reducción del colesterol total, cLDL y del porcentaje de pacientes con un RCV a 10 años > 10%. El recuento de linfocitos CD4 aumentó y todos mantuvieron la carga viral del VIH indetectable. No se observaron efectos adversos. El uso de ezetimiba junto a dosis bajas de atorvastatina es eficaz y seguro para el tratamiento de la hipercolesterolemia asociada al TAR.
Prospective, open-label study of HIV-patients with HAART-related dyslipidaemia to analyse the efficacy and safety of ezetimibe plus low-dose atorvastatin in HIV-patients on HAART who do not reach LDL-C goals with atorvastatin. Changes in plasma levels of lipids, cardiovascular risk (CVR) at 10 years (Frahmingam equation), immunovirological parameters, CK and ALT levels were analysed. Twenty seven patients were included, thirteen (48%) achieved LDL-C goals, and a reduction was observed in total cholesterol, LDL-C, and the percentage of patients with a 10 year CVR > 10%. Mean CD4 cells count increased, and all patients maintained undetectable HIV viral load. No adverse events were observed. Adding ezetimibe to low-dose atorvastatin is safe and effective for HAART-related hypercholesterolaemia.
Los pacientes con infección por el virus de la inmunodeficiencia humana (VIH) tienen un riesgo cardiovascular (RCV) elevado, que en parte se debe a la alta prevalencia de hiperlipemia asociada al uso del tratamiento antirretroviral de gran actividad (TARGA)1–4. Se ha demostrado la eficacia y la seguridad de ciertas estatinas para el tratamiento de la hipercolesterolemia en pacientes con infección por el VIH4–7, y actualmente en esta población se recomiendan la pravastatina, la fluvastatina y la atorvastatina8,9. La ezetimiba es el primer inhibidor selectivo de la absorción del colesterol en el ámbito intestinal10,11, con lo que se consiguen reducciones del 20% en las concentraciones del colesterol de las lipoproteínas de baja densidad (cLDL) y hasta del 50% cuando se asocia con alguna de las estatinas. Además, la ezetimiba tiene un buen perfil de tolerancia y no interacciona con la vía metabólica del citocromo CYP 3A410–19. Sin embargo, en pocos estudios se han evaluado su eficacia y seguridad en pacientes con infección por el VIH y la capacidad de esta intervención para alcanzar los objetivos lipidicos específicos de cada paciente20–23; además, en ninguno se ha analizado el impacto de esta estrategia en el RCV de estos individuos. Se llevó a cabo un análisis prospectivo de la eficacia y la seguridad de ezetimiba junto a dosis bajas de atorvastatina en pacientes con el VIH en TARGA con hipercolesterolemia no controlada con atorvastatina en monoterapia y se evaluó el impacto de esta combinación en el RCV.
Pacientes y métodosDiseño del estudio e individuos participantesSe llevó a cabo un estudio piloto prospectivo, abierto y de un solo brazo con 24 semanas de seguimiento. Los participantes fueron pacientes con infección por el VIH con hipercolesterolemia tratada con dieta y ejercicio más atorvastatina (10 mg/día) durante al menos los 6 meses previos, sin alcanzar el objetivo de cLDL (National Cholesterol Education Program/ Adult Treatment Panel III [NCEP/ATP III]). Todos los pacientes tenían que mantener un regimen estable de TARGA y carga viral del VIH < 50 copias/ml durante al menos los 3 meses previos a la inclusión en el estudio. No se incluyó a ningún paciente con concentraciones de trigliceridos por encima de 400 mg/dl al no poder estimar el cLDL mediante la fórmula de Friedewald. Tampoco se incluyeron individuos en tratamiento con fibratos, hepatopatía grave activa, mujeres embarazadas o en período de lactancia, o que hubieran utilizado previamente ezetimiba.
Seguimiento y evaluaciónSe analizaron las modificaciones en el perfil lipídico. Se determinaron específicamente las concentraciones de colesterol total, cLDL, colesterol unido a lipoproteínas de alta densidad (cHDL) y de trigliceridos en el momento basal, a las 12 y 24 semanas. El cLDL se calculó por la fórmula de Friedewald et al24. Tambien se determinaron la carga viral del VIH, el recuento de linfocitos CD4 y parámetros bioquímicos y hematológicos habituales, con especial atención a las concentraciones de alanino aminotransferasa (ALT) y aspartato aminotransferasa (AST), gamma glutamiltranspeptidasa (GGT) y creatincinasa (CK). Se recogieron también todas las manifestaciones neuromusculares atribuibles al tratamiento farmacológico hipolipemiante. Además, se evaluó la evolución del RCV durante el período del estudio, y se calculó el RCV a 10 años según la ecuación de Framingham. También se analizaron las concentraciones de cLDL y el RCV a 10 años en el momento del inicio de atorvastatina en monoterapia. Los pacientes que modificaron el régimen de TARGA o la medicación hipolipemiante se retiraron del estudio.
Objetivos del estudioEl objetivo primario fue el porcentaje de individuos que alcanzaron el objetivo de cLDL (NCEP/ATP III) a las 24 semanas. Se evaluaron los cambios en los parámetros lipídicos y no lipídicos durante el seguimiento y se calculó el porcentaje de cambio a las 24 semanas respecto a los valores basales. También se contrastaron las concentraciones de cLDL y el RCV a 10 años en la entrada en el estudio con estos valores en el momento de inicio de atorvastatina en monoterapia. La seguridad se evaluó a partir de la determinación del porcentaje de pacientes que suspendieron la ezetimiba por intolerancia y el porcentaje de pacientes con un incremento ≥ grado 2 de transaminasas o CK.
ÉticaEl Comité Ético y de Investigación del Hospital Virgen de la Victoria (Málaga) aprobó el estudio. A todos los pacientes se les informó de la naturaleza del estudio y todos dieron su consentimiento para participar.
Análisis estadísticoLos datos de cada paciente se introdujeron en una base de datos para su análisis estadístico posterior. Las variables continuas se expresan como medias (rango intercuartil) y las variables categóricas como número de casos (porcentaje). Para el contraste de las variables continuas, se utilizó el test de la t de Student o el test de Mann–Whitney para las variables que no seguían una distribución normal. El análisis del grado de asociación de las variables categóricas se hizo con el test de la χ2 y la corrección de Yates o con el test exacto de Fisher. Los datos se analizaron con el programa estadístico SPSS, versión 10.0 (SPSS software, Chicago, IL).
ResultadosSe incluyeron en el estudio 27 pacientes, con un tiempo medio de tratamiento con atorvastatina de 12,2 (7,7-16,6) meses. En la tabla 1 se muestran las principales características basales de los pacientes.
Características basales de los 27 pacientes
| Edad (años) | 52 (44,5-59,8) |
| Sexo masculino | 23 (85,2) |
| IMC (kg/m2) | 26,0 (24,0-27,1) |
| Recuento de CD4 (células/μl) | 423 (367–532) |
| Carga viral del VIH < 50 copias/ml | 27 (100) |
| TAR | 27 (100) |
| Tiempo con atorvastatina (meses) | 12,2 (7,7-16,6) |
| Factores de riesgo cardiovascular | |
| Hipertensión arterial | 17 (62,9) |
| Tabaco | 12 (44,4) |
| Historia familiar de CI | 8 (29,6) |
| Diabetes mellitus tipo 2 | 2 (7,4) |
| RCV a 10 años (%) | 14,7 (6–22) |
| Pacientes en cada rango de objetivo de cLDL | |
| < 160 mg/dl | 6 (22,2) |
| < 130 mg/dl | 9 (33,3) |
| < 100 mg/dl | 12 (44,4) |
CI: cardiopatía isquémica; cLDL: colesterol unido a lipoproteínas de baja densidad; IMC: índice de masa corporal; RCV: riesgo cardiovascular; TAR: tratamiento antirretroviral; VIH: virus de la inmunodeficiencia humana.
Las variables cuantitativas se expresan en media (rango intercuartílico) y las variables cualitativas como número de casos (porcentaje).
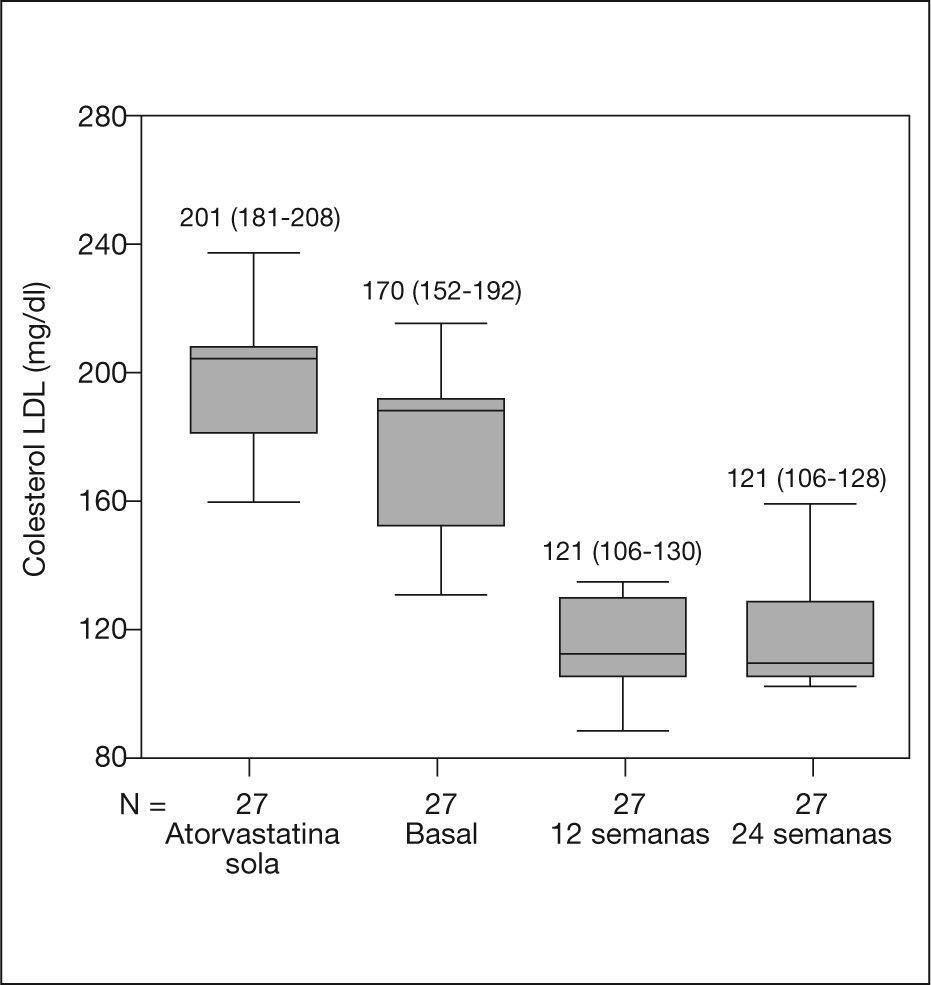
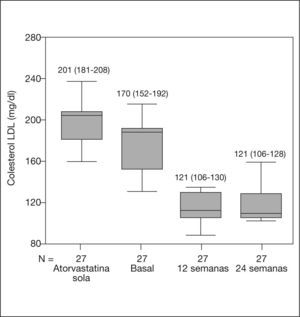
A la semana 24, 13 (48,1%) pacientes alcanzaron el objetivo de cLDL en función del RCV a 10 años. Se observó una reducción significativa en todos los pacientes entre el momento basal y la semana 24 en los valores de colesterol total (258 frente a 204 mg/dl; -20,9%; p < 0,0001) y cLDL (170 frente a 121 mg/dl; -29%; p < 0,0001). Las concentraciones de cHDL y triglicéridos no se modificaron (52 frente a 51 mg/dl; -2%; p = 0,3, y 186 frente a 169 mg/ dl; -9,1%; p = 0,5, respectivamente). En la figura 1 se muestra la evolución del cLDL desde el inicio del tratamiento con atorvastatina sola hasta el final del estudio. La reducción en el cLDL fue también significativa entre el comienzo de la estatina y la introducción de la ezetimiba (201 frente a 170 mg/dl; -15,4%; p < 0,0001), aunque la reducción fue más marcada tras añadir ezetimiba (descenso medio: -49 [IC del 95%, -60 a −38] frente a −30 [IC del 95%, -42 a −18 mg/dl]; p < 0,0001).
El porcentaje de pacientes con RCV a 10 años > 10% disminuyó a las 24 semanas (66,6 a 51,8%; p < 0,001), pero no lo hizo con atorvastatina en monoterapia (66,6 a 66,6%; no significativo).
El recuento medio de linfocitos CD4 aumentó (423 frente a 559 células/μl; p < 0,0001) y todos los pacientes mantuvieron una carga viral indetectable a las 24 semanas.
La tolerabilidad de 10 mg de atorvastatina más 10 mg de ezetimiba fue excelente en todos los casos, sin retiradas por toxicidad y sin incremento de transaminasas o CK por encima o igual a grado 2. No hubo retiradas en el estudio.
DiscusiónEn este estudio prospectivo, casi la mitad de los pacientes alcanzó el objetivo de cLDL según la NCEP/ATP III tras añadir ezetimiba a atorvastatina. Además, se observó un descenso significativo en el porcentaje de pacientes con un RCV elevado. La hiperlipemia es uno de los factores de RCV más frecuentes en los pacientes con infección por el VIH1–4. El tratamiento de esta complicación en esta población es, por tanto, de gran interés, no sólo para reducir su RCV, sino también para reducir la mortalidad cardiovascular25. El tratamiento hipolipemiante con estatinas puede alcanzar los objetivos terapéuticos en un 50-80% de la población general, en función de los objetivos de la NCEP/ATP III26. Aunque la atorvastatina a dosis bajas es uno de los pocos hipolipemiantes recomendados en pacientes con el VIH, la respuesta terapéutica con esta estatina, como con otras recomendadas, es a menudo insuficiente6,7. Además, en estos pacientes son frecuentes las interacciones farmacológicas, de tal forma que aumentar la dosis de estatinas o fibratos puede mejorar el perfil lipídico, pero también puede aumentar el riesgo de toxicidad27–30. Para evitar este riesgo -y teniendo en cuenta que la ezetimiba inhibe la absorción selectiva del colesterol intestinal, potencia el efecto hipolipemiante de las estatinas hasta en un 25%15–19 y no presenta interacciones farmacológicas con los antirretrovirales10-, nos planteamos añadir ezetimiba en lugar de aumentar la dosis de atorvastatina. Nuestros resultados coinciden con otros estudios que han analizado la eficacia de ezetimiba en pacientes no infectados por el VIH15–19. Coll et al20 observaron una eficacia similar de ezetimiba (10 mg/día) en monoterapia y de fluvastatina (80 mg/ día) en pacientes con el VIH; no evaluaron cuántos pacientes alcanzaron los objetivos de la NCEP/ATP III, ni dieron datos respecto al control inmunovirológico. En otro estudio21 en el que se incluyeron 19 pacientes con el VIH en tratamiento con pravastatina con pobre respuesta terapéutica, se produjo un descenso significativo de las concentraciones de colesterol total y cLDL al añadir ezetimiba, en el que un 61,5% de los individuos alcanzó el objetivo del estudio a 24 semanas (cLDL < 130 mg/dl). Una limitación del estudio fue que se consideró el mismo objetivo de cLDL para todos los pacientes y no un objetivo específico para cada individuo en función de su RCV. Sin embargo, nosotros sí calculamos el objetivo específico de cLDL para cada paciente y en casi la mitad era de < 100 mg/dl. Más recientemente, se han publicado otros 2 estudios en los que se analiza la eficacia de ezetimiba en una población infectada por el VIH22,23. Uno de estos estudios22 tiene serias limitaciones por el escaso tamaño de la muestra y por ser retrospectivo. Por último, Bennet et al23 observaron que la ezetimiba era segura y eficaz en pacientes con el VIH asociada a dosis máximas toleradas de tratamiento hipolipemiante. Este estudio estaba también limitado por su naturaleza retrospectiva, la heterogeneidad de la muestra (ya que incluía a pacientes con diferentes estatinas, fibratos, niacina y aceite de salmón) y también consideró el mismo objetivo de cLDL para todos los pacientes.
Nuestro estudio aporta nuevos datos a lo previamente publicado. Hasta la fecha, éste es el primer estudio que tiene como objetivo primario el porcentaje de individuos que alcanzan el objetivo de cLDL de la NCEP/ATP III, considerando el objetivo específico para cada individuo. Hay que destacar que la reducción del cLDL tras añadir ezetimiba es superior a lo que cabría esperar10; ello se podría deber a que los pacientes incluidos en el estudio fueran muy posiblemente hiperabsorbedores de colesterol en el ámbito intestinal, lo que además explicaría que con la atorvastatina en monoterapia sólo alcanzaran una reducción del 15% de cLDL. Por otro lado, éste es también el primer estudio que muestra la reducción en el RCV como consecuencia de la mejoría del perfil lipídico, con una reducción considerable en el porcentaje de pacientes con RCV elevado a las 24 semanas de tratamiento combinado. También hemos podido observar que la adición de la ezetimiba a dosis bajas de atorvastatina intensifica la mejoría tanto del perfil lipídico, como del RCV, comparada con la estatina en monoterapia. Aunque esta última estrategia redujo el cLDL y el RCV, el tratamiento combinado mostró mejores resultados en menos de la mitad del tiempo. Además, la tolerancia fue espectacular, sin efectos adversos ni retiradas del fármaco. Finalmente, llama la atención un aumento significativo en el recuento de linfocitos CD4 en una población con TARGA estable y con buena situación inmunovirológica a la inclusión en el estudio. Una buena hipótesis para explicar este hecho es que el posible efecto antiinflamatorio de los hipolipemiantes31 podría haber favorecido la recuperación inmunológica de los individuos32; este es un tema controvertido y que, en cualquier caso, se debería más al efecto de la estatina que de la ezetimiba, con la que no se ha demostrado un efecto pleiotrópico ni antiinflamatorio paralelo a su efecto hipolipemiante33.
En resumen, en este estudio piloto, asociar ezetimiba a dosis bajas de atorvastatina es seguro y efectivo, no sólo para la hipercolesterolemia asociada al TARGA con pobre respuesta a dosis bajas de estatinas, sino también para reducir el RCV a 10 años en esta población.