Recientes evidencias clínicas y experimentales sugieren que los efectos de las estatinas se extienden más allá del descenso del colesterol de baja densidad (c-LDL) y pueden disminuir la respuesta inflamatoria que caracteriza a la aterosclerosis, al bajar la concentración de citocinas.
ObjetivoEl objetivo del estudio fue evaluar los efectos antiinflamatorios de la simvastatina midiendo marcadores inflamatorios de riesgo cardiovascular como: proteína C reactiva (PCR), factor de necrosis tumoral α (TNFα), interleucina (IL) 1, IL-6, superóxido dismutasa (SOD) y 8-isoprostano F2α, además de efectos sobre la disminución del colesterol total, del c-LDL, de los triglicéridos, sobre el colesterol de alta densidad (c-HDL), y sobre parámetros metabólicos como la glucemia y el ácido úrico.
Materiales y métodosEstudio prospectivo, observacional y analítico de una serie de casos. La población incluyó pacientes de la Policlínica Pempaire de Maracaibo y del Hospital Vargas de Caracas; un total de 21 pacientes de ambos sexos que como criterio de inclusión presentaban hipercolesterolemia.
ResultadosA las 8 semanas se observó disminución del colesterol total, LDL, TNFα, IL-6, PCR y glucemia, además de aumento de HDL y de SOD.
ConclusiónEn corto tiempo las estatinas disminuyen la inflamación gracias a la disminución del TNFα y mejoran el estado oxidativo al aumentar la SOD, lo que puede mejorar la disfunción de HDL.
Recent clinical and experimental evidences have suggested that the effect of the statins is extending beyond from diminishing the low-density (LDL) cholesterol, and they are taking action to decrease the inflammatory response (characteristic of the atherosclerosis) to lower the concentration of cytokines.
ObjectiveThe objectives of the study were to evaluate the anti inflammatory effects of simvastatin by measuring the inflammatory cardiovascular risk markers such as: C-reactive protein, tumor necrosis factor (TNF), interleukin 1 (IL-1), interleukin 6 (IL-6), superoxid dismutase (SOD) and 8-isoprostane F2α, and to evaluate its effects on the reduction of total cholesterol, cholesterol of low-density (LDL), triglycerides, high-density (HDL) cholesterol and the metabolic parameter; such as glycemia and uric acid.
Materials and methodsA prospective, observational and analytical study of a number of cases was performed. Population was 21 patients of both sexes, presented as a criterion for inclusion of hypercholesterolemia. It was included patients from the Policlinica Pempaire Maracaibo and Caracas (Hospital Vargas).
ResultsAfter 8 weeks of treatment it was noted decreasing of the total cholesterol, LDL, TNF, IL-6, PCR and glycemia, beside the increasing of the HDL and SOD.
ConclusionIn a short time the treatment with statins have decreased the inflammation, represented by the decreasing of the TNF and improving of the oxidative state increased SOD which can improve HDL dysfunction.
La aterosclerosis es una enfermedad inflamatoria crónica en la que intervienen tanto una respuesta inmune adaptativa como la respuesta inmune innata. Las células vasculares, las células endoteliales y las células musculares lisas participan en el desarrollo de la enfermedad al facilitar el reclutamiento de leucocitos, el remodelado y la perpetuación de la inflamación mediante la liberación de citocinas y quimiocinas como el factor de necrosis tumoral alfa (TNF-α), la interleucina (IL) 1-β, la IL-6, la IL-12 y la IL-8, entre otras1,2.
Las estatinas, fármacos que inhiben la síntesis del colesterol al actuar sobre la enzima 3-hidroxi-3 metilglutaril coenzima A reductasa (HMG-CoA), han demostrado efectos en la prevención de la progresión de aterosclerosis y sus secuelas. Recientes evidencias clínicas y experimentales sugieren que los efectos de las estatinas se extienden más allá de disminuir los valores del colesterol de baja densidad (c-LDL), y pueden actuar en la disminución de la respuesta inflamatoria que caracteriza la aterosclerosis3. En pacientes con enfermedad arterial coronaria conocida las estatinas reducen un 16% la mortalidad y un 25% los mayores eventos coronarios, independientemente de los niveles basales de colesterol4.
Existen cambios que aparecen poco tiempo después del inicio de la administración de los fármacos y transforman las características protrombóticas y vasoespásticas que presenta el endotelio en los estados de hipercolesterolemia. La terapia con estatinas ha demostrado que reduce significativamente los niveles de proteína C reactiva (PCR), un efecto que puede observarse incluso a las 12 semanas de su administración5.
Diversos estudios han demostrado que las estatinas bajan la concentración de citocinas al inhibir reclutamiento y la expresión de moléculas de adhesión en el endotelio, atenuando la producción de factores quimiotácticos que participan en la respuesta inflamatoria. Además de disminuir la síntesis hepática de colesterol y aumentar la expresión de receptores LDL, las estatinas pueden inhibir la síntesis de importantes intermediarios isoprenoides, tal como farnesil pirofosfato (FPP) y geranilgeranil pirofosfato (GGPP), que son necesarios para aumentar una serie de proteínas intracelulares como Ras, Rho, Rac y Rap, que activan las vías inflamatorias y son capaces de disminuir la producción de óxido nítrico6,7.
El efecto de las estatinas no solo consiste en disminuir las LDL, sino también en aumentar el colesterol de alta densidad (c-HDL). Otros efectos también discutidos son las acciones de las estatinas en la oxidación que han sido demostrados en forma experimental. Los efectos antiinflamatorios de las estatinas independientes de disminuir el colesterol son llamados efectos pleiotrópicos, y se cree que tienen un papel importante en mejorar la disfunción endotelial, atenuar el remodelado miocárdico, inhibir la inflamación y la oxidación endotelial, y estabilizar la placa aterosclerótica7.
El estudio JUPITER demostró disminución de la PCR y de la mortalidad cardiovascular en pacientes adultos sin hipercolesterolemia8.
El objetivo del estudio fue evaluar los efectos pleiotrópicos de la simvastatina midiendo determinados marcadores inflamatorios de riesgo cardiovascular, como la PCR, el TNFα, la IL-1, la IL-6, la superóxido dismutasa (SOD) y el 8-isoprostano F2α, además de efectos sobre la disminución del colesterol total, del LDL, de los triglicéridos y de las lipoproteínas de alta densidad (HDL), y parámetros metabólicos como glucemia y ácido úrico.
Materiales y métodosEstudio prospectivo, observacional y analítico de serie de casos. La población incluye pacientes de la Policlínica Pempaire de Maracaibo y del Hospital Vargas de Caracas, y se incluyeron 21 pacientes de ambos sexos, que presentaban como criterio de inclusión hipercolesterolemia (colesterol total >180mg/dl, discretamente elevado) y que no presentaran diabetes, enfermedad tiroidea, infección y enfermedad de origen inmunológico, ya que estos constituían los criterios de exclusión. Se evaluaron los pacientes en un periodo de estudio corto de tratamiento: 8 semanas después de recibir 40mg de simvastatina.
A cada paciente se le determinaron los parámetros bioquímicos: colesterol total, triglicéridos, c-HDL, LDL, glucemia, creatinina, ácido úrico, PCR, IL-1, IL-6, TNFα, SOD y 8-isoprostano F2α, antes y después del tratamiento.
A cada uno, en ayuno de 14 h, se le extrajeron 10ml de sangre periférica en 2 tubos Vacutainer con EDTA y sin EDTA; la sangre se centrifugó a 1.000g por 20 min y se separó el suero y el plasma para la determinación de colesterol total, triglicéridos, c-HDL, LDL, glucemia, creatinina, ácido úrico, PCR, empleando kits por método enzimático colorimétrico de Invelab. Se congeló suero y plasma de cada uno de los pacientes para la posterior determinación de IL-1 (valores de referencia normales en suero: 0-5,4 pg/ml), IL-6 (valores de referencia normales en plasma: 0-5,0 pg/ml), TNFα (valores de referencia normales en plasma: 0-17,3 pg/ml); estos parámetros se determinaron por el método de ELISA empleando los kits Comercial de Endogen Human. La SOD (valores de referencia normales en suero: 0,025-0,25 U/ml) y el 8-isoprostano (valores de referencia normales en plasma: 40-100 pg/ml) se determinaron por método de ELISA empleando los kits Comercial de Calbiochem, en un lector de microplacas ELISA Biotek Instruments, Inc.
Análisis estadísticoA fin de evaluar el posible efecto que pudiera tener el tratamiento sobre los diferentes parámetros bioquímicos, se evalúo la distribución de las diferencias de medias para muestras dependientes (prueba t para muestras apareadas antes-después), que permite determinar si hay diferencias estadísticamente significativas entre las variables pre y postratamiento. Se empleó el paquete estadístico SSPS versión 17.
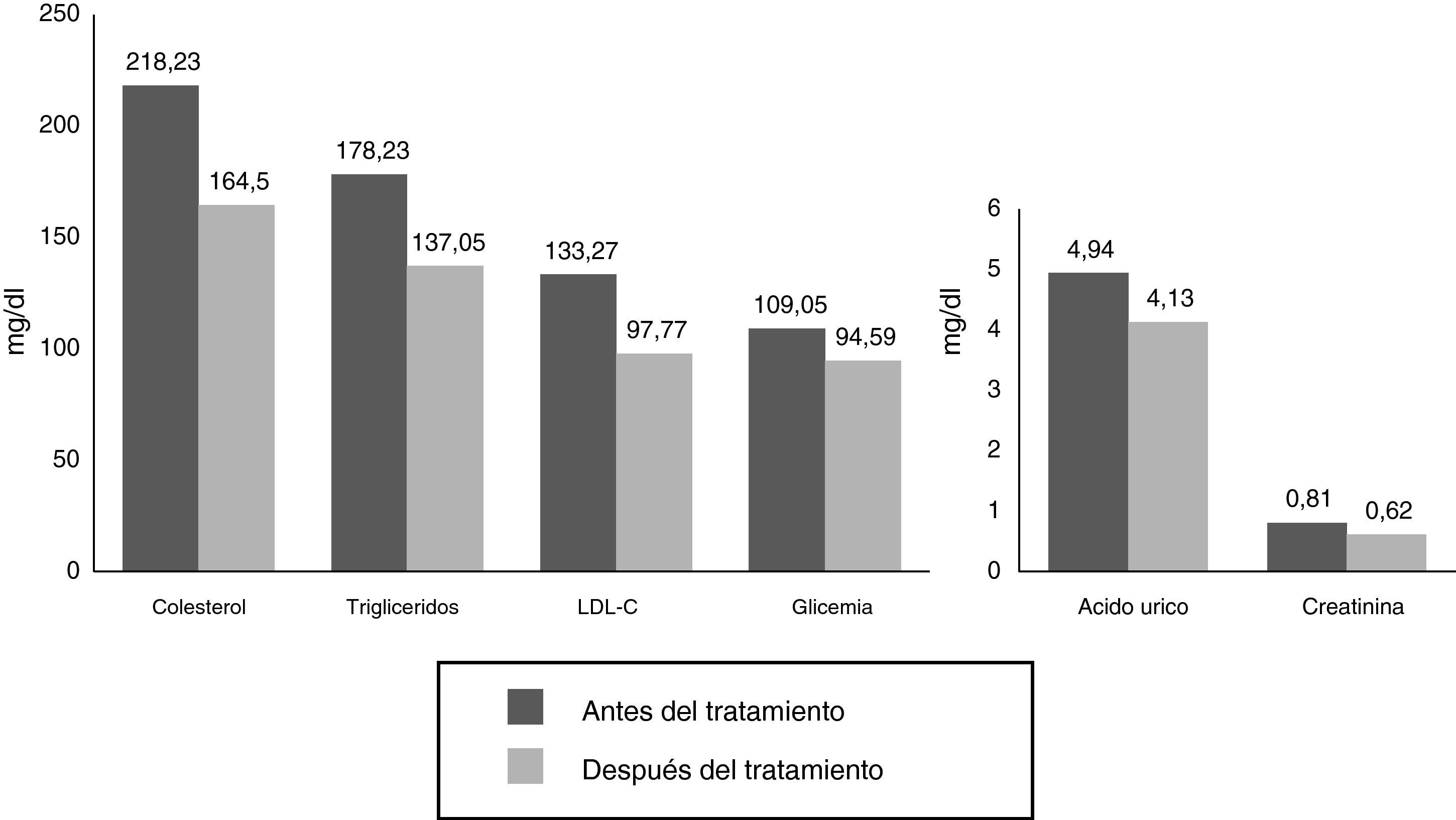
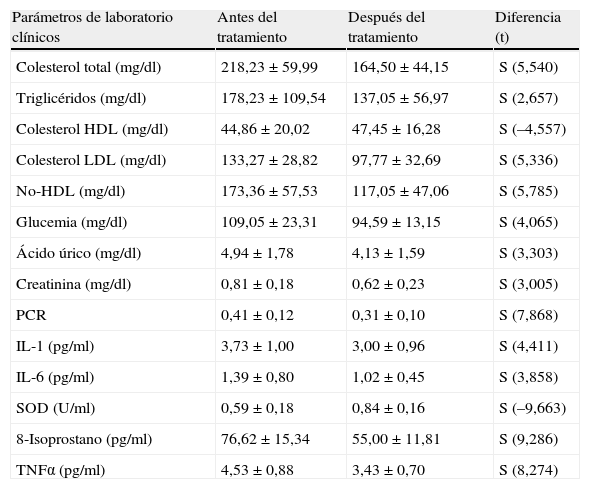
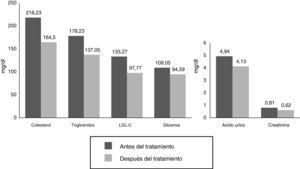
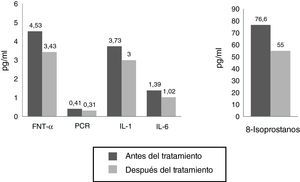
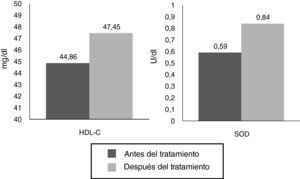
ResultadosEn la tabla 1 observamos que las variables estudiadas (colesterol total, LDL, IL-1, IL-6, 8-isoprostanos, prostaglandinas F2α [8 iso-PGF2a] y PCR) disminuyen en el periodo de 8 semanas, a excepción del HDL y la SOD, que aumentaron, tal como esperábamos. Se observaron diferencias significativas en todos los parámetros estudiados antes y después del tratamiento farmacológico en los pacientes.
Marcadores bioquímicos de laboratorio antes y después del tratamiento con simvastatina 40mg
| Parámetros de laboratorio clínicos | Antes del tratamiento | Después del tratamiento | Diferencia (t) |
| Colesterol total (mg/dl) | 218,23±59,99 | 164,50±44,15 | S (5,540) |
| Triglicéridos (mg/dl) | 178,23±109,54 | 137,05±56,97 | S (2,657) |
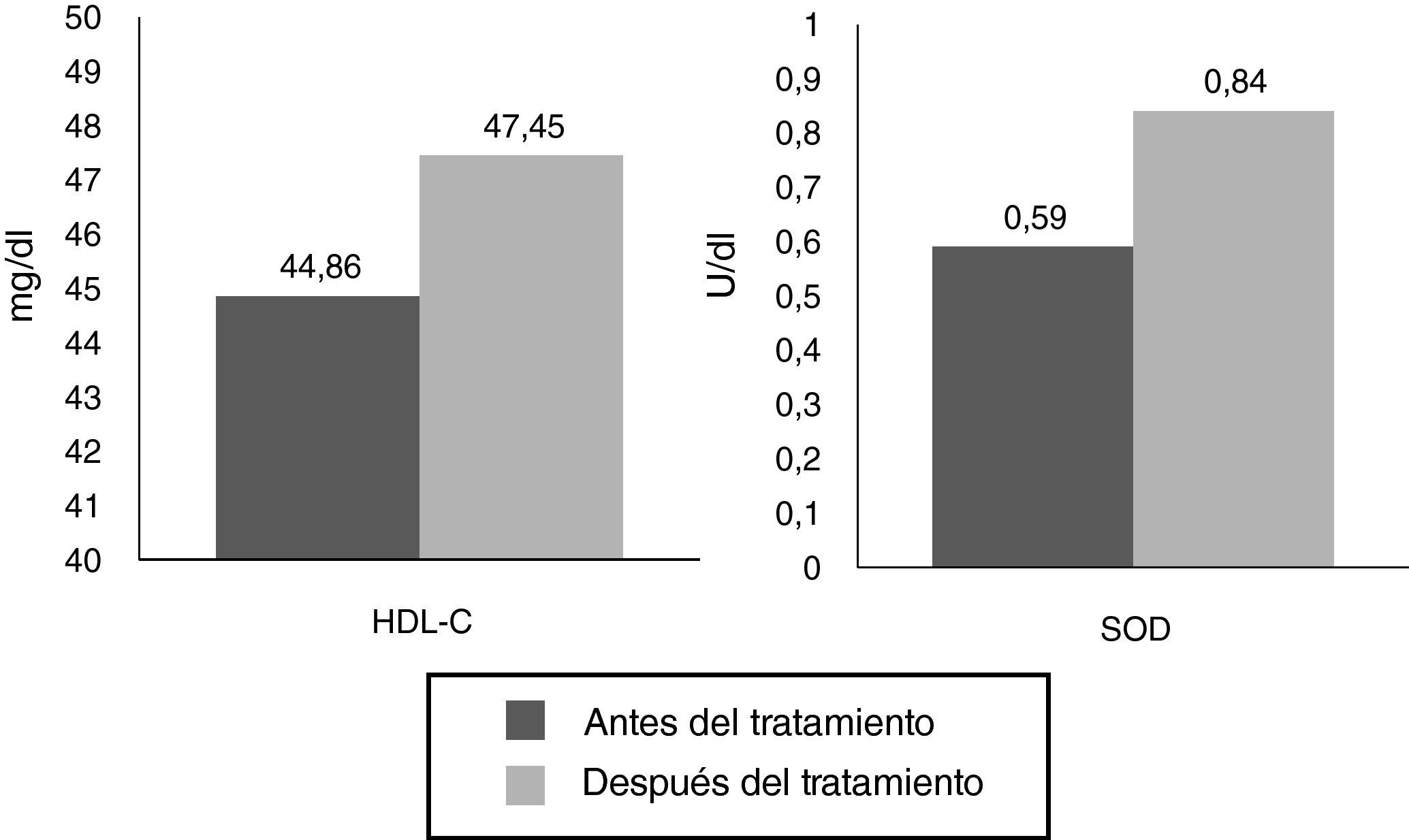
| Colesterol HDL (mg/dl) | 44,86±20,02 | 47,45±16,28 | S (–4,557) |
| Colesterol LDL (mg/dl) | 133,27±28,82 | 97,77±32,69 | S (5,336) |
| No-HDL (mg/dl) | 173,36±57,53 | 117,05±47,06 | S (5,785) |
| Glucemia (mg/dl) | 109,05±23,31 | 94,59±13,15 | S (4,065) |
| Ácido úrico (mg/dl) | 4,94±1,78 | 4,13±1,59 | S (3,303) |
| Creatinina (mg/dl) | 0,81±0,18 | 0,62±0,23 | S (3,005) |
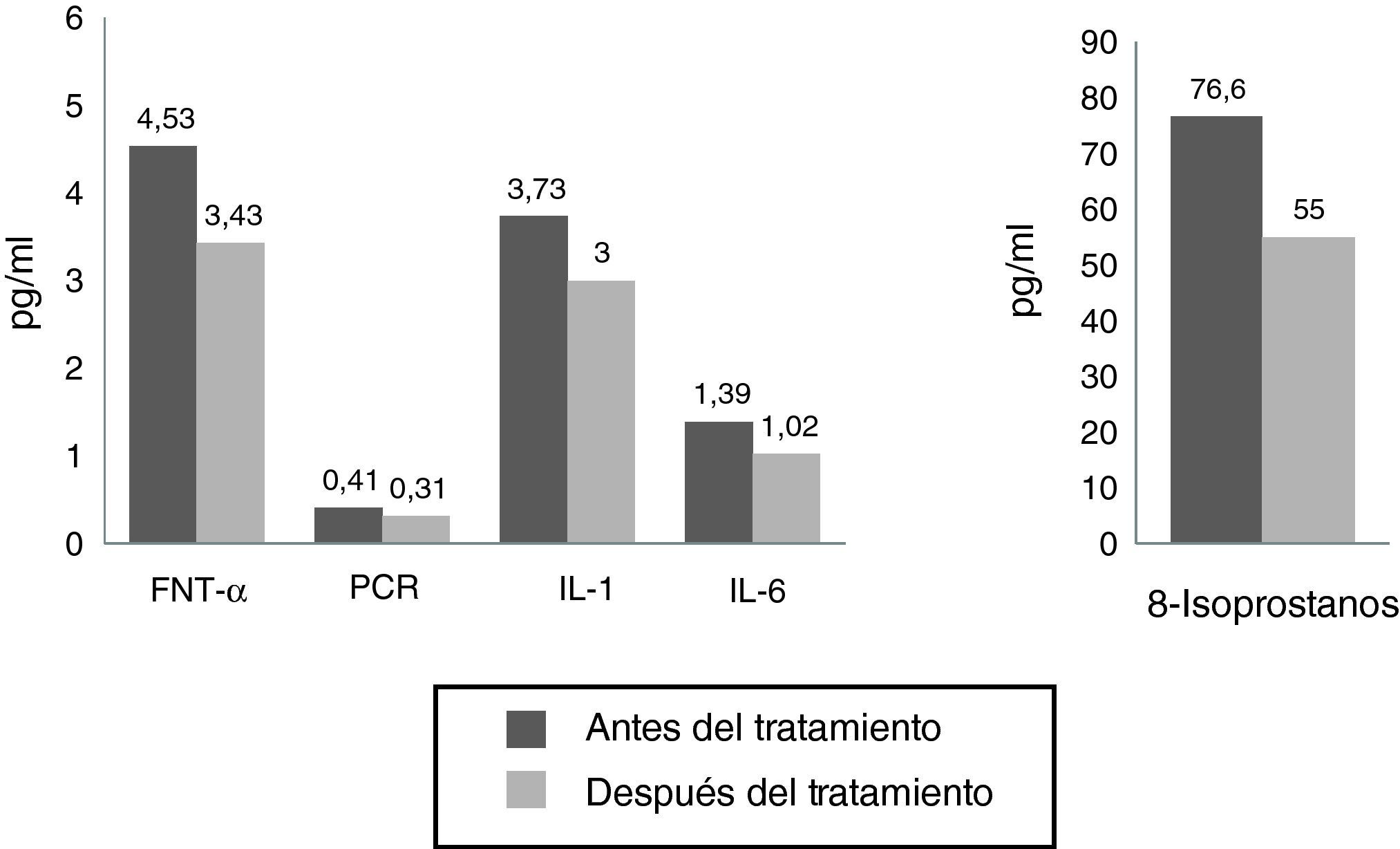
| PCR | 0,41±0,12 | 0,31±0,10 | S (7,868) |
| IL-1 (pg/ml) | 3,73±1,00 | 3,00±0,96 | S (4,411) |
| IL-6 (pg/ml) | 1,39±0,80 | 1,02±0,45 | S (3,858) |
| SOD (U/ml) | 0,59±0,18 | 0,84±0,16 | S (–9,663) |
| 8-Isoprostano (pg/ml) | 76,62±15,34 | 55,00±11,81 | S (9,286) |
| TNFα (pg/ml) | 4,53±0,88 | 3,43±0,70 | S (8,274) |
S: diferencia significativa: p<0,05.
La figura 1 demuestra la disminución significativa de LDL, colesterol total, triglicéridos, glucemia y ácido úrico. Es importante analizar lo encontrado con la glucemia en este estudio, ya que no todos los pacientes presentaban valores <100mg/dl, y aunque también presentaban glucemias en rango de prediabetes, a las 8 semanas se observó disminución de la misma. Tomando en cuenta que los últimos metaanálisis han reportado aumento de la incidencia de diabetes con estatinas9, este hallazgo podría explicarse por el tamaño de la muestra o por el corto tiempo del estudio, si se tiene en cuenta que el efecto sobre la glucemia causado por las estatinas aparece con el uso prolongado de este fármaco.
La figura 3 nos permite observar como disminuyen las variables correspondientes a la respuesta inflamatoria, como el TNFα, la IL-6 y la IL1, la PCR y los isoprostanos F2α. Aunque se esperaba una disminución más significativa de la PCR y de la IL-6, podemos observar que en forma temprana los parámetros bioquímicos que disminuyeron significativamente fueron el TNF-α (de 4,53 a 3,43; diferencia significativa 0,000 para una p<0,05) y los 8-isoprostanos F2α (de 76,67 a 54,60pg/ml, con una diferencia significativa de 0,000 para una p<0,05).
Otro resultado importante fue el aumento de HDL (de 44,86 a 47,45mg/dl), observándose diferencias significativas (p<0,05), así como el aumento observado con la SOD (de 0,59 a 0,84; diferencia significativa, p<0,05) (fig. 2).
DiscusiónEn este estudio demostramos que a las 8 semanas de la administración de simvastatina logramos disminuir la PCR y el LDL. Pero más allá de estos parámetros, observamos disminución en citocinas como el TNFα, la IL-6 y marcadores de estrés oxidativo como 8 iso-PGF2a, acompañados de un aumento de SOD y c-HDL, logrando un equilibrio de factores proaterogénicos y antiaterogénicos.
La reducción de la inflamación puede ser el mecanismo más importante de las estatinas, ya que permite alterar la biología de la placa y enlentecer la progresión de la enfermedad. La estatinas reducen las especies reactivas de oxígeno, incrementan el contenido intersticial de colágeno y promueven la madurez de células musculares lisas; en este estudio observamos disminución de 8 iso PGF2a y de IL-6 y TNFα; estas últimas citocinas están involucradas en la iniciación y la progresión de la placa aterosclerótica10.
La LDL oxidada promueve la producción del TNFα e IL-1β, que actúan sinérgicamente e la secreción de IL-6, y la activación de células musculares lisas, quienes a su vez son capaces de producir factor estimulante de colonias de los macrófagos y promover la diferenciación de monocitos dentro de la íntima vascular, lo que permite el desarrollo de la placa aterosclerótica2. El TNFα es un mediador inflamatorio que puede actuar directamente en la pared arterial y promover la formación de ateroma, progresión y complicaciones trombóticas11.
El TNFα es una citocina producida principalmente por los monocitos/macrófagos. Tiene varias actividades biológicas, que pueden causar cambios fisiológicos comúnmente en los estados de enfermedad, y pertenece a un grupo de otras citocinas que estimulan la fase aguda de la reacción inflamatoria. La liberación de TNF-α produce activación local del endotelio vascular y aumento de la permeabilidad vascular, que conduce al reclutamiento de las células inflamatorias, inmunoglobulinas y complemento, provocando la activación de los linfocitos T y B. También aumenta la activación y la adhesión plaquetaria. A finales de la década de 1980 y principios de la de 1990, las observaciones realizadas en modelos experimentales de endotoxinemia llevaron a la conclusión de que el TNF-α era un requisito previo para la inducción de muchas otras citocinas inflamatorias12.
La inyección de lipopolisacáridos en modelos experimentales con animales o en voluntarios humanos condujo a la aparición de TNF-α en el torrente sanguíneo antes de que pudiera detectarse cualquier otra citocina. Además, los experimentos realizados con anti-TNF-anticuerpos indicó que, con el bloqueo de TNFα, la endotoxina bacteriana o inducida por los modelos de choque llevaba a una disminución dramática de los niveles de otras citocinas medidas en la sangre, pero además se demostró también que la expresión de citocinas proinflamatorias está significativamente disminuida en ratones apoE-/-, deficientes en TNF, en comparación con ratones apoE-/-, aunque hay que tomar en cuenta que no está totalmente abolida13,14.
Uno de los grandes aportes de nuestro trabajo es la disminución del TNFα, ya que hoy sabemos que las vías inflamatorias se encuentran activadas en forma constante en las enfermedades cardiovasculares y metabólicas, como la diabetes y la obesidad, y vemos que el TNFα participa perpetuando esta respuesta e involucrándose en alterar vías metabólicas como la de la insulina, en inducir disfunción del adipocito y en actuar sobre la disfunción endotelial; entonces todos los tratamientos farmacológicos que disminuyan el TNFα tienen beneficios en este tipo de enfermedades. Las estatinas son capaces de disminuir este factor, que constituye también un elemento común en la activación de otras citocinas y el aumento del estrés oxidativo15.
Las estatinas disminuyen el TNFα y la IL6, inhibidores naturales de la óxido nítrico sintetasa y que son capaces de bloquear el receptor de insulina; una perfusión de TNFα en animales causa disminución de la glucosa a las 18h. La disminución observada de IL-6 junto con TNFα participa en mejorar el metabolismo de la glucosa y la sensibilidad de la insulina en los tejidos16.
También observamos una disminución importante de la IL-6 por acción de las estatinas. Jougasaki et al17 ya habían demostrado que las estatinas bloqueaban los efectos de la IL-6 en las células endoteliales aórticas porque previenen la inducción de proteína quimiotáctica 1 de los monocitos. En el estudio PRIME la IL-6, a diferencia de la PCR y del fibrinógeno, fue relacionada como predictor independiente de muerte súbita en pacientes europeos asintomáticos que ya tenían un evento coronario en un periodo de seguimiento de 10 años18.
La disminución de la IL-6 constituye un marcador de inflamación temprano, ya que una reducción en sus niveles explica la reducción de la PCR, puesto que la IL-6 es el primer inductor de síntesis de PCR en el hígado3.
Los efectos de las estatinas en forma independiente a la disminución del c-LDL son debatidos en la actualidad19.
En cuanto a la disminución de 8-isoprostano F2α y el aumento de SOD, previamente estudios publicados en pacientes con angina inestable20 habían demostrado un aumento significativo de los valores de SOD y una disminución de 8-isoprostano F2α después de ser tratados con estatinas en un período de 3 meses, al ser comparados con grupo placebo. En nuestro estudio ya encontramos modificación de estos parámetros a las 8 semanas. Aunque se ha postulado que las estatinas aumentan la Apo A1 en la HDL, el balance entre elementos prooxidantes y antioxidantes puede favorecer el ambiente que permite mantener la funcionalidad de la HDL, que, como es sabido, puede ser disfuncional cuando hay aumento de la oxidación, ya que los fosfolípidos de su membrana —al igual que las enzimas paraoxonasa 1— se saturan y comienza a aumentar la peroxidación lipídica, que en algunas oportunidades es un factor que sirve como quimiotáctico de monocitos21 (HDL proinflamatoria). Estudios experimentales han demostrado que la simvastatina disminuye el índice quimiotáctico de los monocitos y mejora las propiedades antiinflamotorias de la HDL22, a la vez que también mejora la actividad de las PON123.
Los efectos de las estatinas pueden constituir un mecanismo importante en la estabilización de la placa, derivado de los efectos antiinflamatorios, antitrombóticos y antioxidantes; el sinergismo de estos efectos puede acompañar la temprana reducción del riesgo cardiovascular y constituir el efecto que va más allá de la reducción del c-LDL24. Otra situación importante en la que pueden ser beneficiosos los efectos tempranos de la acción de la estatinas es la fase temprana del infarto del miocardio, en la que se observa aumento de la PCR, lo que refleja mayor oxidación e inflamación, sobre todo debido a los procesos de isquemia y de reperfusión25.
A los laboratorios Dollder Venezuela, Diffucap y Chemobras (Brasil) por la colaboración en la realización de este estudio.