El sistema renina-angiotensina participa en el desarrollo del síndrome metabólico. El presente trabajo tiene como objetivo evaluar el papel que juega la angiotensina ii en las alteraciones metabólicas y vasculares asociadas a esta patología en un modelo de obesidad inducida por la dieta.
MétodosEl estudio se llevó a cabo en ratas Sprague Dawley divididas en tres grupos: 1) ratas alimentadas con dieta estándar utilizadas como grupo control; 2) ratas alimentadas con una dieta con alto contenido en grasas (SBP) (33,5% del contenido calórico), y 3) ratas en las mismas condiciones que el grupo 2 a las que se les administró un antagonista de receptores AT1 de angiotensina ii (candesartan) (2mg/kg/día). El periodo de evolución fue de 7 semanas. Se evaluó el peso corporal, el tejido adiposo blanco y marrón, las concentraciones plasmáticas y los niveles proteicos en tejido adiposo blanco de leptina y adiponectina, así como el metabolismo glucídico y lipídico.
ResultadosLas ratas alimentadas con dieta grasa experimentaron un aumento del peso corporal así como de tejido adiposo epididimal y lumbar. El candesartan atenuó todos estos valores. La alteración del balance leptina/adiponectina, así como el aumento en la expresión proteica de estas adipocinas, se normalizaron tras el tratamiento con candesartan, que también mejoró la sensibilidad a la insulina y el perfil lipídico.
ConclusiónLa corrección del balance leptina/adiponectina podría ser uno de los mecanismos a través de los cuales el candesartan ejerce su efecto protector en ratas alimentadas con dieta grasa.
The renin angiotensin system has been shown to participate in the development of metabolic syndrome. The aim of this study was to determine whether the angiotensin ii type 1 receptor blocker, candesartan, exerts a protective effect against metabolic and vascular abnormalities in rats fed a high fat diet (HFD).
MethodsSprague Dawley rats (n=30) were divided into three groups: 1) rats fed a standard diet for 7weeks, used as a control group; 2) rats fed a HFD (33.5% fat) for 7weeks; and 3) rats fed a HFD (33.5% fat) treated with candesartan (2mg/kg/day) for 7weeks. Body weight, white and brown adipose tissue weight, plasma concentrations and protein expression of leptin and adiponectin in white adipose tissue, glucose and lipid metabolism were investigated.
ResultsHFD rats showed increased body, epididymal and lumbar adipose tissue weights. Candesartan attenuated all of these parameters. The leptin/adiponectin ratio of plasma concentrations and protein expression in lumbar adipose tissue increased in HDF rats, and were normalized by candesartan. Candesartan also improved insulin sensitivity and lipid profile.
ConclusionCorrection of the leptin-adiponectin imbalance may be an important mechanism participating in the protective effect of candesartan in HDF rats.
El tejido adiposo es un importante órgano metabólico y endocrino que secreta numerosos factores denominados colectivamente adipocinas, tales como la leptina, la adiponectina, la resistina, la visfatina, etc. Cambios en la producción de algunas adipocinas como la leptina se asocian con alteraciones del metabolismo glucídico y lipídico, así como con alteraciones del sistema cardiovascular1. La leptina está implicada principalmente en la regulación de la ingesta y en el gasto energético a través de su receptor hipotalámico, activando la síntesis de péptidos anorexigénicos y aumentando la lipólisis.
En alteraciones metabólicas como la obesidad, la elevación de los niveles de leptina no es suficiente para prevenir la alteración del balance energético, por lo que se ha sugerido la existencia de resistencia hipotalámica asociada en esta patología1. La adiponectina, cuyos niveles disminuyen con la obesidad, se encuentra relacionada con el metabolismo de la glucosa y mejora la sensibilidad a la insulina2 disminuyendo la producción hepática de glucosa. Además posee un efecto antiinflamatorio3 y antiaterogénico4 a través de mecanismos relacionados con la disminución en la expresión de moléculas de adhesión, el bloqueo de la activación y migración de las células de músculo liso vascular, y el bloqueo en la expresión de receptores de LDL en macrófagos evitando la formación de células espumosas. Asimismo, la adiponectina se encuentra relacionada con el metabolismo de los ácidos grasos aumentando la β-oxidación en el músculo. La alteración del balance leptina-adiponectina se ha propuesto como un nexo de unión entre las alteraciones metabólicas y la disfunción vascular asociada a la obesidad en sujetos con síndrome metabólico y diabetes tipo 25.
El tejido adiposo es capaz de sintetizar diversos componentes del sistema renina-angiotensina6–12 capaces de modificar su estructura y metabolismo. Éstos podrían participar de forma autocrina, paracrina y/o endocrina en la fisiopatología de la obesidad, constituyendo un nexo entre ésta y la enfermedad cardiovascular. En concreto, la angiotensina ii induce mecanismos inflamatorios y un aumento del estrés oxidativo13,14 en el tejido adiposo que pueden favorecer el desarrollo de la enfermedad cardiovascular y de sus patologías asociadas como la hipertensión y la diabetes mellitus tipo 215. Estos efectos, mediados por receptores AT1 localizados en la membrana del adipocito, pueden ser directos o mediados por la acción de otras adipocinas16. La angiotensina ii influye también en la regulación del metabolismo glucídico y lipídico. Se ha demostrado que el bloqueo de receptores AT1 reduce los niveles de glucosa y mejora la sensibilidad a la insulina en ratones diabéticos mediante un aumento en la captación de glucosa por parte del tejido adiposo, una reducción del tamaño del adipocito y un aumento en la expresión del receptor activado por proliferadores peroxisómicos gamma (PPAR-γ)17. Asimismo, la sobreexpresión de angiotensinógeno por parte del tejido adiposo en animales transgénicos, así como la administración de angiotensina ii en ratones, contribuyen a la disminución de los niveles de colesterol HDL mediante mecanismos que parecen estar relacionados con la translocación del receptor SR-BI desde espacios intracelulares a la membrana plasmática en tejido adiposo18.
Según lo descrito, parece evidente que la angiotensina ii podría jugar un papel importante en la fisiopatología de la obesidad, por ello el objetivo del presente trabajo fue estudiar el efecto del tratamiento con el antagonista de los receptores AT1 de la angiotensina ii, el candesartan, sobre las alteraciones metabólicas asociadas a la obesidad inducida por dieta. Además, teniendo en cuenta que la leptina y la adiponectina son piezas clave en la homeostasis glucídica y lipídica, otro de los objetivos del estudio fue determinar si las modificaciones en el balance de estas adipocinas podrían estar relacionadas con el posible efecto protector del antagonista de los receptores AT1.
Material y métodosEl estudio se llevó a cabo en ratas Sprague Dawley macho (n=30; 200g; Harlan Ibérica S.L., Barcelona, España). Los animales se dividieron en tres grupos: 1) ratas alimentadas con dieta estándar durante 7 semanas que se utilizaron como grupo control; 2) ratas alimentadas con una dieta con alto contenido en grasas (33,5% del contenido calórico; Harlan Teklad #TD.03307, WI, EE.UU.) durante 7 semanas, y 3) ratas alimentadas con la dieta con alto contenido en grasa tratadas con candesartan (2mg/kg/día) durante el mismo periodo. La dosis de fármaco empleada se obtuvo en estudios piloto, eligiéndose aquella dosis que no modificase los niveles de presión arterial sistólica (PAS). Los animales se pesaron una vez a la semana. La ingesta de agua y comida también se valoró a lo largo del experimento. Tras el sacrificio del animal, el tejido adiposo blanco epididimal y lumbar, el tejido adiposo marrón interescapular y el corazón se pesaron, se congelaron y se almacenaron a –80°C.
El protocolo experimental se llevó a cabo según las recomendaciones del comité de uso y manipulación animal de la Universidad Complutense de Madrid según las guías de la Unión Europea.
Medida de la presión arterialLa presión arterial se midió de manera indirecta mediante pletismografía en la arteria caudal (Narco Bio-Systems, Houston, Texas, EE.UU.).
Parámetros metabólicos, citocinas y adipocinas plasmáticasLas concentraciones plasmáticas de colesterol, lipoproteínas de alto peso molecular (HDL), triglicéridos, glucosa, insulina, leptina, adiponectina, TNF-α, IL-1β e IL6 se valoraron mediante kits comerciales (R&D Systems, Inc., Minneapolis, EE.UU.), basados en una técnica cuantitativa de ensayo inmunoenzimático. La sensibilidad a la insulina se evaluó al final del periodo experimental mediante el cálculo del índice HOMA, que indica el grado de resistencia a la insulina y viene determinado por la fórmula:
Expresión proteica de adipocinasSe valoró la expresión proteica de adipocinas como, la adiponectina y la leptina (Chemicon Internacional Inc., CA, EE.UU.), mediante técnicas de Western Blot en tejido adiposo lumbar según la metodología previamente descrita19.
Análisis estadísticoTodos los resultados se expresaron como la media±error estándar de la media (EEM). La comparación estadística de los resultados se realizó mediante un análisis de la varianza de una vía, seguido de una comparación múltiple de medias (test de Newman-Keuls) cuando se encontraron diferencias. La hipótesis nula fue rechazada cuando el valor de p era menor que 0,05. La elaboración de todas las pruebas estadísticas se realizó con el apoyo informático del paquete estadístico GRAPHPAD (GraphPad Software Inc., CA, EE.UU.).
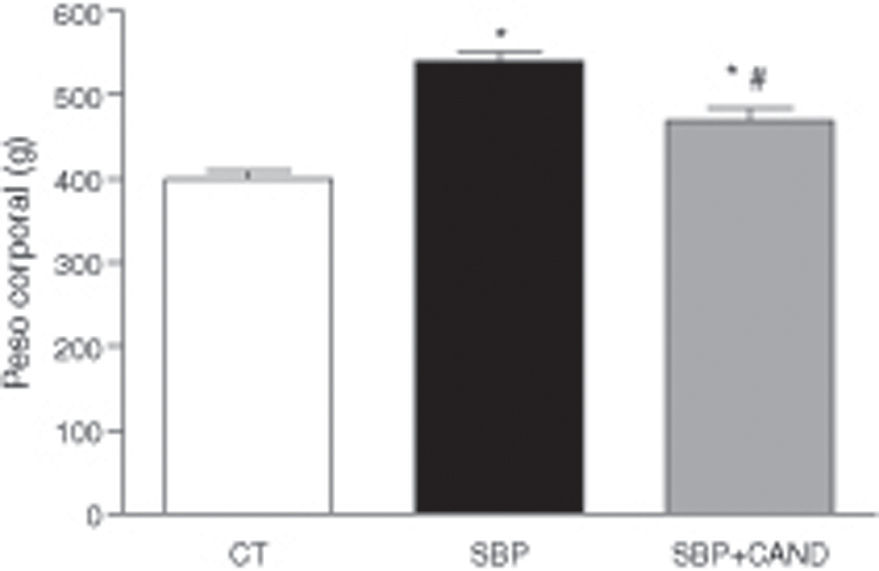
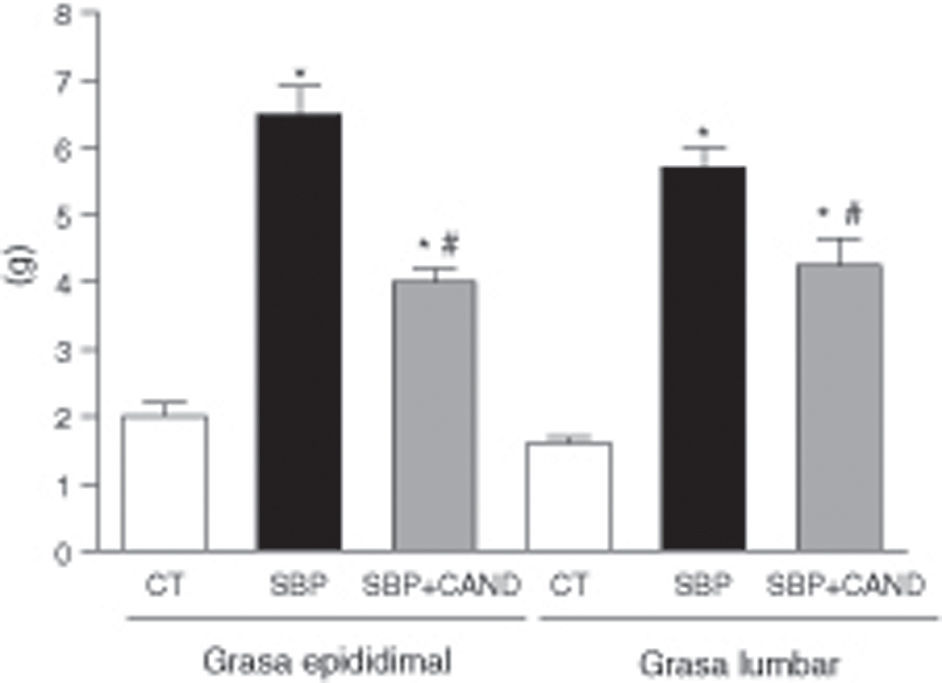
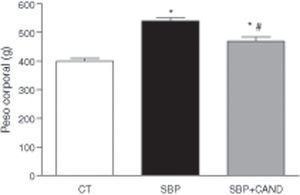
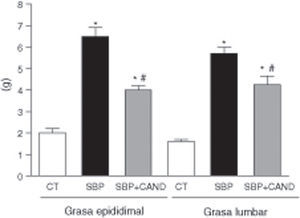
ResultadosLa administración de una dieta con alto contenido en grasa aumentó significativamente el peso corporal, llegando a alcanzar un incremento del 29% con respecto al grupo control al final del periodo experimental (fig. 1). El tejido adiposo epididimal y lumbar aumentó significativamente en los animales con sobrepeso con respecto al grupo control (p<0,05) (fig. 2), sin embargo el tejido adiposo marrón subescapular fue similar entre ambos grupos (0,11±0,01 vs. 0,15±0,01g). La ingesta de alimento fue significativamente menor en las ratas con dieta hipercalórica con respecto a las ratas control (p<0,05).
Peso de la grasa epididimal y lumbar de ratas alimentadas con una dieta estándar (CT), con una dieta con alto contenido en grasa sin tratamiento (SBP) y ratas con dieta grasa y tratamiento con candesartan (2mg/kg/día) (SBP+CAND). Cada columna representa la media±error estándar. *p<0,05 vs. CT; #p<0,05 vs. SBP.
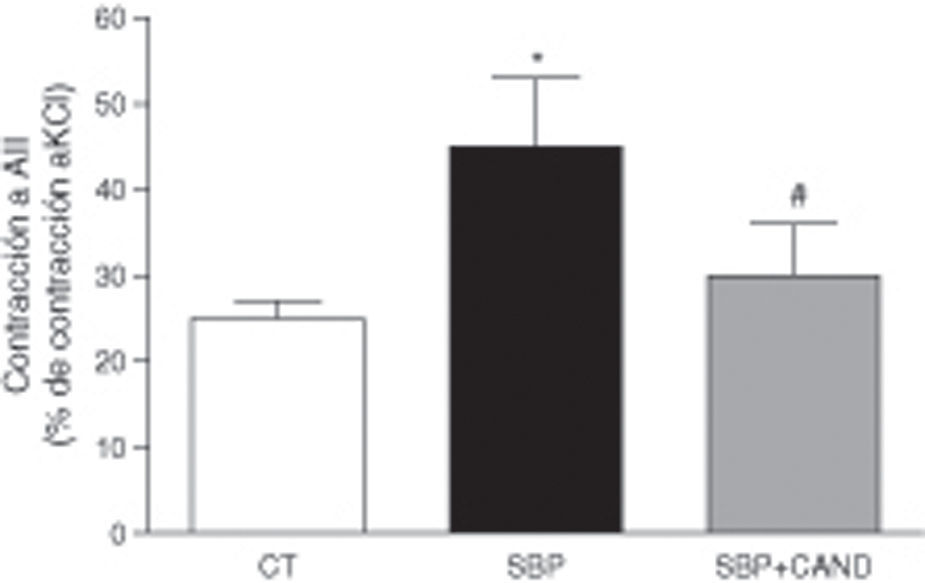
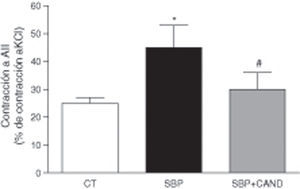
La respuesta vasoconstrictora a la angiotensina ii en anillos de aorta fue superior en los animales con sobrepeso con respecto a las ratas control (p<0,05) (fig. 3), sugiriendo un aumento de receptores AT1 de angiotensina ii a nivel vascular.
Respuesta vasoconstrictora a angiotensina ii (AII) en anillos de aorta de ratas alimentadas con una dieta estándar (CT), con una dieta con alto contenido en grasa sin tratamiento (SBP) y ratas con dieta grasa y tratamiento con candesartan (2mg/kg/día) (SBP+CAND). Cada columna representa la media±error estándar. *p<0,05 vs. CT; #p<0,05 vs. SBP.
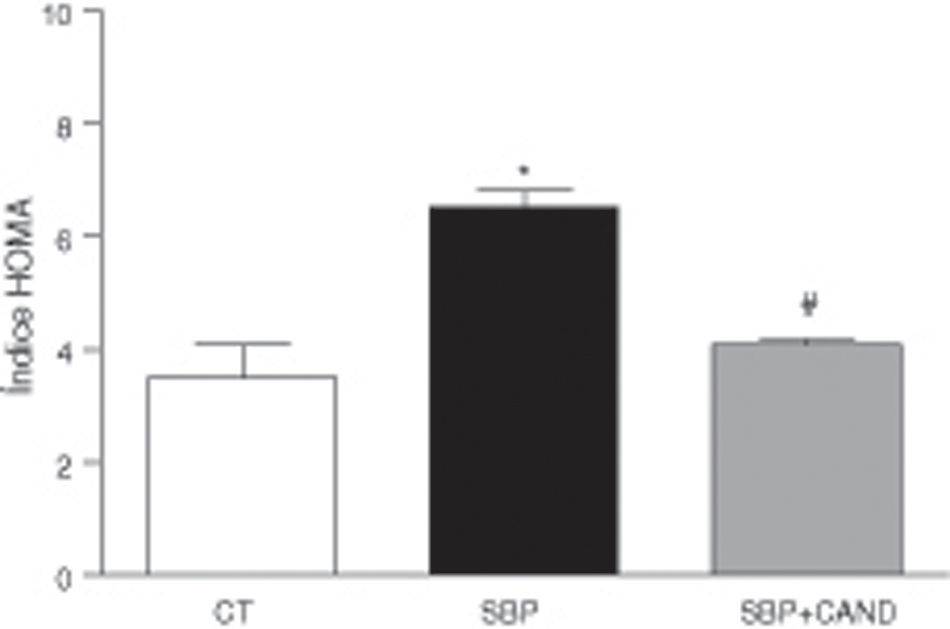
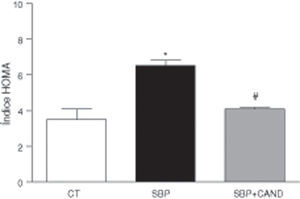
Los niveles plasmáticos de glucosa (108±2 vs. 87,15±4mg/dl) e insulina (1,4±0,05 vs. 0,71±0,2μg/dl) fueron mayores (p<0,05) en ratas con sobrepeso en comparación con las ratas control. Las ratas con sobrepeso presentaban resistencia a la insulina, ya que el índice HOMA fue superior en estos animales (fig. 4). Los niveles plasmáticos de colesterol total fueron mayores en ratas alimentadas con una dieta hipercalórica con respecto a los animales alimentados con una dieta estándar (59,35±4,3 vs. 51±0,02mg/dl; p<0,05). Los niveles plasmáticos de lipoproteínas de alta densidad y de triglicéridos no se vieron modificados en estas condiciones experimentales.
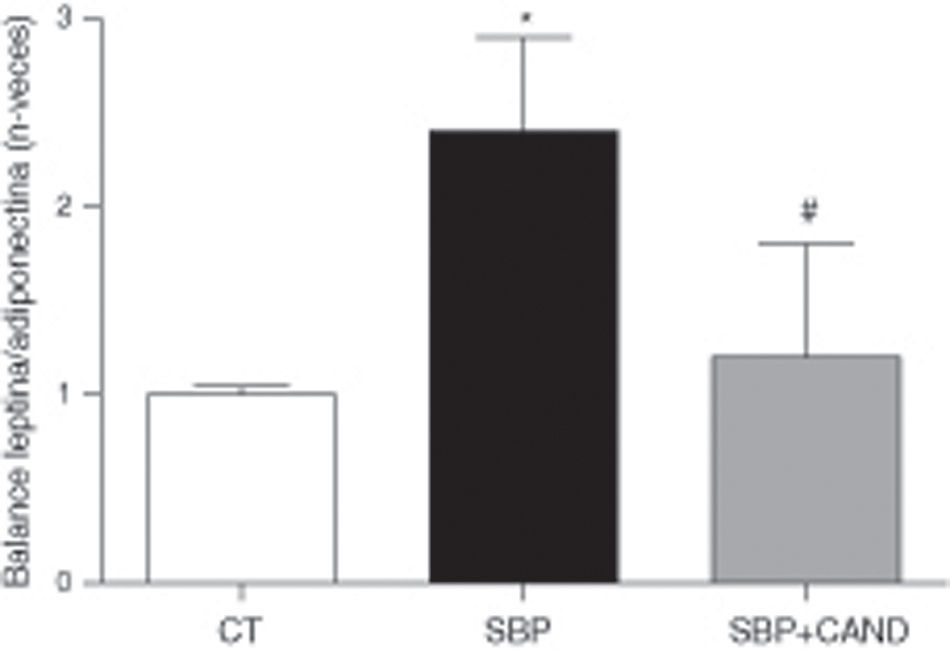
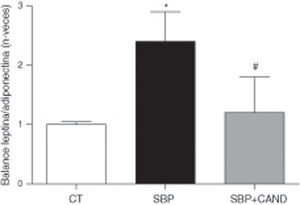
La administración de la dieta con alto contenido en grasa no modificó los niveles plasmáticos de adiponectina cuando se compararon con animales a los que se les administró dieta estándar (986±46 vs. 845±38 ng/ml, respectivamente). Sin embargo, los niveles plasmáticos de leptina sí se encontraban aumentados en ratas con sobrepeso con respecto a los animales control (26,15±3,5 vs. 7,25±0,8 ng/ml; p<0,05). El cálculo del balance leptina/adiponectina aumentó por lo tanto en situación de sobrepeso con respeto a los animales control (0,025±0,003 vs. 0,009±0,002; p<0,05). La expresión proteica de estas adipocinas en tejido adiposo lumbar mostró una reducción de los niveles de adiponectina (0,66±0,05 vs. 1±0,01; p<0,05) en ratas con sobrepeso con respecto a los animales control y un aumento en los niveles de expresión proteica de leptina (1,6±0,1 vs. 1±0,05; p<0,05). Por lo tanto, el balance leptina/adiponectina fue muy superior en los animales con sobrepeso con respecto a los animales control (p<0,05) (fig. 5).
Balance leptina/adiponectina de ratas alimentadas con una dieta estándar (CT), con una dieta con alto contenido en grasa sin tratamiento (SBP) y ratas con dieta grasa y tratamiento con candesartan (2mg/kg/día) (SBP+CAND). Cada columna representa la media±error estándar. *p<0,05 vs. CT; #p<0,05 vs. SBP.
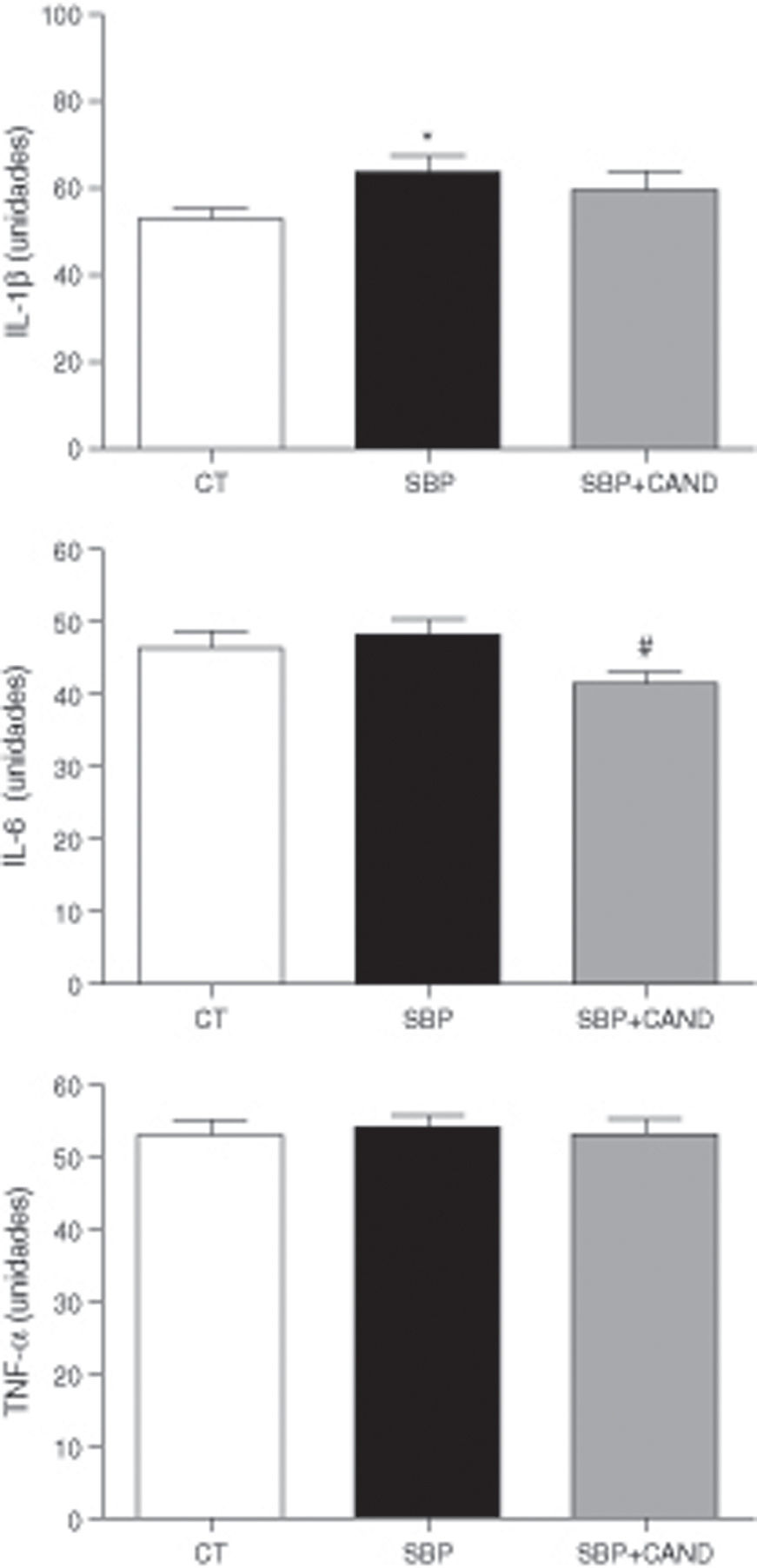
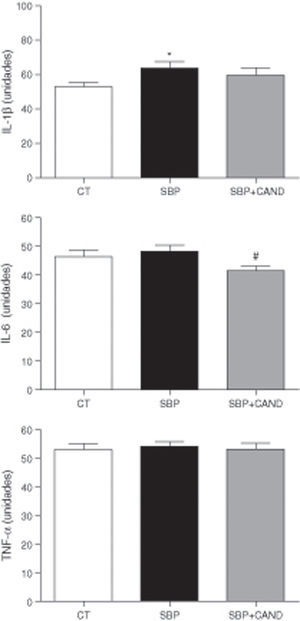
Se valoraron los niveles plasmáticos de citocinas proinflamatorias como la IL-1β, la IL-6 y el TNF-α, siendo la primera la única que se encontraba aumentada en animales con sobrepeso (fig. 6).
Niveles plasmáticos de interleucina 1beta (IL-1β), interleucina 6 (IL6) y factor de necrosis tumoral alfa (TNF-α) de ratas alimentadas con una dieta estándar (CT), con una dieta con alto contenido en grasa sin tratamiento (SBP) y ratas con dieta grasa y tratamiento con candesartan (2mg/kg/día) (SBP+CAND). Cada columna representa la media±error estándar. *p<0.05 vs. CT; #p<0,05 vs. SBP.
El tratamiento con el antagonista de receptores AT1 para angiotensina ii no modificó la ingesta de alimento, sin embargo redujo el peso corporal de manera significativa en animales a los que se les administró una dieta hipercalórica con respecto a los animales sin tratamiento (fig. 1). Asimismo, el candesartan redujo significativamente el tejido adiposo epididimal y lumbar en estos animales (fig. 2) y aumentó de manera significativa el tejido adiposo marrón subescapular (0,20±0,03g; p<0,05).
La respuesta vasoconstrictora a la angiotensina ii se normalizó en ratas tratadas con candesartan (fig. 3), confirmó el bloqueo de los receptores AT1 de angiotensina ii.
Los niveles plasmáticos de glucosa (90,7±1,5mg/dl) e insulina (0,71±0,3μg/dl) se redujeron significativamente (p<0,05) con respecto a los animales con sobrepeso sin tratamiento. La resistencia a la insulina mejoró en los animales tratados, como reveló la reducción del índice HOMA (fig. 4). Los niveles plasmáticos de colesterol total se redujeron significativamente tras la administración de candesartan (50,65±0,8mg/dl; p<0,05), sin variar los de lipoproteínas de alta densidad y triglicéridos.
Los niveles plasmáticos de adiponectina aumentaron en los animales tratados con candesartan (1.315±85 ng/ml); sin embargo, los niveles de leptina no se modificaron con respecto a las ratas con sobrepeso con tratamiento (25,5±1,2 ng/ml). El balance leptina/adiponectina, por lo tanto, se redujo en los animales tratados con el antagonista de los receptores AT1 (0,018±0,002). Las expresiones proteicas de adiponectina (0,93±0,03) y leptina (0,73±0,41) se normalizaron en los animales tratados con candesartan con respecto a las ratas con sobrepeso.
El candesartan redujo significativamente los niveles plasmáticos de IL-6 y mostró una clara tendencia a la reducción de los niveles de IL-1β, sin embargo no tuvo ningún efecto sobre los niveles de TNF-α (fig. 6).
DiscusiónEl estudio llevado a cabo demuestra que el tratamiento con candesartan reduce la ganancia de peso corporal debida al consumo de una dieta con alto contenido en grasa, la resistencia a la insulina, mejora el perfil lipídico y produce una mejora en la alteración del balance leptina/adiponectina presente en animales con sobrepeso, reflejando la importancia de la angiotensina ii en las alteraciones metabólicas y hormonales asociadas con la obesidad.
El candesartan mejoró la sensibilidad a la insulina en ratas alimentadas con una dieta hipercalórica, como demuestra la reducción de la concentración plasmática de glucosa e insulina, así como del índice HOMA. Numerosos estudios han demostrado que la angiotensina ii participa en los mecanismos que conducen a la resistencia a la insulina20,21 y que la administración de un IECA o ARA-II es capaz de mejorar esta alteración22,23. En cuanto a los mecanismos mencionados, parece que la angiotensina ii aumenta el número de adipocitos grandes y resistentes a la insulina, disminuyendo el número de los adipocitos pequeños sensibles a insulina, favoreciendo por lo tanto el depósito ectópico de lípidos24. Asimismo, estudios in vitro han demostrado que la angiotensina ii es capaz de inducir la transformación de células precursoras en adipocitos maduros participando de manera directa en la acumulación de tejido adiposo25. Por lo tanto, la reducción en el peso corporal tras la administración de candesartan parece ser consecuencia de una disminución de tejido adiposo blanco y no de una reducción de la ingesta. El conjunto de estos resultados pone de manifiesto el importante papel que juega la angiotensina ii en la adipogénesis.
El aumento de los niveles de adiponectina y la disminución de los de leptina, con la consiguiente disminución del balance leptina/adiponectina, podrían estar relacionados con el efecto del candesartan sobre el tejido adiposo blanco y la resistencia a la insulina. La disminución de leptina favorece la mejora de la resistencia a la insulina26. El exceso de leptina producido en la obesidad debido al aumento de tejido adiposo no tiene como consecuencia un aumento del gasto energético. La resistencia a la leptina en individuos obesos parece estar relacionada con limitaciones en el sistema transportador de leptina y la inhibición de rutas de señalización a nivel hipotalámico27. La adiponectina se induce durante la diferenciación de los adipocitos y actúa también como un potenciador de la sensibilidad a la insulina, a la vez que posee efecto antiinflamatorio28. Este efecto queda de manifiesto con la reducción en los niveles de citocinas inflamatorias como la IL-6. Teniendo en cuenta los efectos metabólicos y antiinflamatorios de la adiponectina, podríamos decir que esta hormona no sólo contribuye a la pérdida de peso corporal, sino que también juega un papel importante en la modulación del sistema cardiovascular.
En situaciones de resistencia a la insulina/hiperinsulinemia se estimula la síntesis hepática de proteínas VLDL, principales transportadoras de triglicéridos29. En nuestro estudio la administración de candesartan mejoró el perfil lipídico de los animales sometidos a la dieta con alto contenido en grasa, disminuyendo los valores de colesterol total y triglicéridos. Por lo tanto, cabe pensar que la angiotensina ii podría estimular la producción de triglicéridos a nivel hepático. Esta mejora del perfil lipídico estaría directamente relacionada con la disminución de resistencia a la insulina observada en los animales tratados. Existen diversos estudios que señalan a los ácidos grasos libres como uno de los factores causantes de esta patología por su capacidad para inducir la fosforilación de insulin receptor substrate-1 (IRS1), inhibiendo la ruta de señalización de la insulina e impidiendo la captación de glucosa30.
La mejora del perfil lipídico asociada a la administración de un antagonista de los receptores de angiotensina ii se debe a diferentes mecanismos. Existen estudios que sugieren que algunos antagonistas son capaces de actuar como agonistas de PPAR-γ, modulando la expresión de genes diana implicados en el metabolismo lipídico31. Asimismo, diferentes estudios experimentales in vitro han demostrado la capacidad de la AII para estimular la lipogénesis en adipocitos32,33 y la colesterogénesis en macrófagos34.
El aumento de la respuesta vasoconstrictora a la angiotensina que se observa asociado a la obesidad sugiere un aumento de los receptores AT1 a nivel vascular, indicando un aumento de actividad del sistema renina-angiotensina-aldosterona que se asocia a la obesidad inducida por la dieta. Finalmente, el estudio mostró que la administración de una dieta hipercalórica no afectó a la presión arterial sistólica. Por lo tanto, los efectos metabólicos y hormonales observados tras la administración de candesartan son independientes de cualquier acción antihipertensiva del fármaco.
En resumen, el candesartan reduce el peso corporal así como el de tejido adiposo blanco, mejora el metabolismo glucídico y la función vascular en la aorta. Según los resultados obtenidos en nuestro estudio, parece que la corrección del balance leptina/adiponectina podría ser uno de los mecanismos implicados en el efecto protector del candesartan en la obesidad inducida por la dieta.
Este trabajo ha sido realizado con la financiación de la Comisión Interministerial de Ciencia y Tecnología de España (SAF2007-61595), Fondo de Investigaciones Sanitarias (FIS PI 060133) y Red Cardiovascular del Fondo de Investigaciones Sanitarias (RD06/0014/0007), así como gracias a una beca concedida por Almirall Prodesfarma durante el congreso anual de la Sociedad Española de Arteriosclerosis.