Los pacientes con diabetes mellitus tipo 2 (DM2) tienen un alto o muy alto riesgo cardiovascular. Las guías de práctica clínica se centran en la necesidad de alcanzar un control glucémico óptimo, sin olvidar que las estrategias de abordaje terapéutico multifactorial han demostrado importantes beneficios cardiovasculares en estos pacientes.
Los inhibidores del cotransportador sodio-glucosa 2 (SGLT-2) son un nuevo grupo de fármacos de administración por vía oral en el tratamiento de la DM2 que actúan inhibiendo la reabsorción de glucosa en el túbulo proximal renal con el consiguiente efecto glucosúrico y disminución de la glucemia plasmática. La dapagliflozina, inhibidor de SGLT-2 comercializado en Europa y Australia, ha demostrado conseguir reducciones de hemoglobina glucosilada similares a otros antidiabéticos orales, así como efectos beneficiosos en las principales comorbilidades asociadas a la DM2. Por ello, hemos considerado de interés revisar la eficacia clínica de este nuevo hipoglucemiante oral en el control glucémico y riesgo de hipoglicemias, así como su impacto en el peso corporal, la presión arterial, el perfil lipídico y la función renal.
Patients with type 2 diabetes mellitus (T2DM) have a high or very high cardiovascular risk. The clinical practice guidelines focus on the need to achieve optimal glycemic control, and strategies for a multifactorial therapeutic approach have shown significant cardiovascular benefits in these patients.
Inhibitors of sodium-glucose co-transporter 2 (SGLT-2) are a new class of orally administered drugs in the treatment of T2DM, which act by inhibiting reabsorption of glucose in the renal proximal tubule with consequent glycosuric effect and lowering of blood glucose. Dapagliflozin, SGLT-2 inhibitor marketed in Europe and Australia, has been shown to achieve glycosylated hemoglobin reductions similar to other oral agents, as well as beneficial effects on major comorbidities associated with T2DM. Therefore, it is considered of interest to review the clinical efficacy of this new oral hypoglycemic on glycemic control, risk of hypoglycemia, and its impact on body weight, blood pressure, lipid profile and renal function.
La diabetes mellitus tipo 2 (DM2) ha adquirido en la última década unas dimensiones epidémicas muy vinculadas a la obesidad, al incremento del sedentarismo y a una excesiva ingesta calórica, todo ello unido al progresivo envejecimiento poblacional. Además, se estima que la prevalencia de diabetes a nivel mundial se incrementará un 72% entre los años 2010 y 20301. Este hecho tiene una gran trascendencia si tenemos en cuenta las frecuentes complicaciones micro y macrovasculares de la enfermedad, que tienen un efecto devastador en la calidad de vida de los pacientes con DM2. Así, por ejemplo, según el United Kingdom Prospective Diabetes Study (UKPDS)2, el 50% de los pacientes afectados de DM2 presentan complicaciones en el momento del diagnóstico.
De acuerdo con el estudio Di@betes3, la prevalencia de DM2 en nuestro país es del 13,8% y en prácticamente la mitad de los casos no está diagnosticada. Asimismo, no debemos olvidar las dificultades para alcanzar un control metabólico óptimo en estos pacientes, fruto, en líneas generales, de la adscripción terapéutica deficiente y/o de la eficacia insuficiente de las terapias farmacológicas disponibles. Según datos recientes, solo un 55% de los pacientes con DM2 consiguen unos niveles de hemoglobina glucosilada (HbA1c) inferiores al 7%4. Estudios previos demuestran que un descenso del 1% en la concentración de HbA1c se asocia a una reducción aproximada del 35% en el riesgo de desarrollar complicaciones microangiopáticas5,6. Por otra parte, la hiperglucemia mantenida contribuye a la resistencia a la insulina y al deterioro funcional de la célula betapancreática7,8, y en definitiva, a la progresión de la DM2.
El riesgo cardiovascular de los pacientes con DM2 está fuertemente modulado por el sexo, la duración de la enfermedad, la presencia de aterosclerosis subclínica y los factores de riesgo concomitantes9. En un estudio de control glucémico y factores de riesgo cardiovascular realizado en atención primaria con 286.791 pacientes afectados de DM2, solo el 13 y el 12% de los pacientes en prevención primaria y secundaria de la enfermedad cardiovascular, respectivamente, alcanzó de forma conjunta los objetivos terapéuticos de HbA1c, presión arterial y colesterol de las lipoproteínas de baja densidad (LDL)4. Si bien las guías de práctica clínica se centran en la necesidad de alcanzar un buen control glucémico, quisiéramos destacar en este punto que el abordaje terapéutico conjunto de los principales factores de riesgo cardiovascular ha demostrado, tanto a medio como a largo plazo, una significativa e importante disminución del riesgo cardiovascular global de estos pacientes10,11.
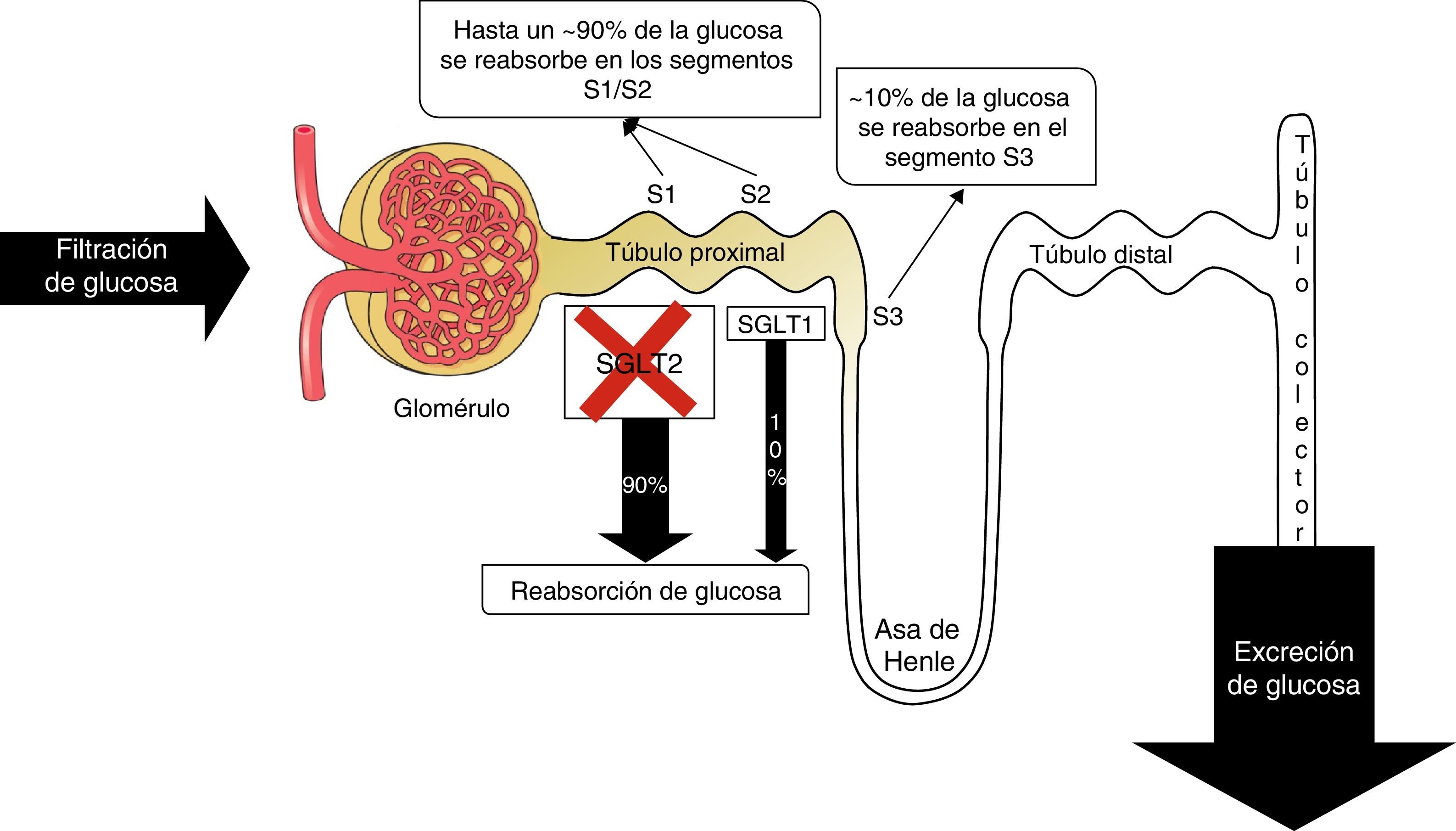
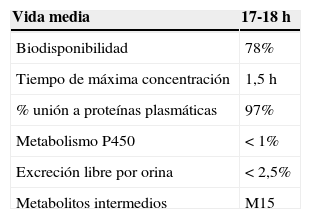
Recientemente, ha aparecido una nueva clase de fármacos hipoglucemiantes que inhibe de forma competitiva, selectiva y reversible el cotransportador sodio-glucosa 2 (SGLT-2) en el túbulo renal proximal y disminuye la glucemia en los pacientes con DM2 al reducir la reabsorción renal de glucosa, con el consiguiente incremento de su excreción urinaria12 (fig. 1). La dapagliflozina, un inhibidor de SGLT-2, cuyas principales características farmacocinéticas y farmacodinámicas se exponen en la tabla 1, ha sido aprobada recientemente por la Food and Drug Administration (FDA) y por la European Medicines Agency (EMA) para el tratamiento de la DM2, y comercializada en Australia y Europa13–15. Su efecto glucosúrico es dependiente de la dosis y persiste después de 14 días de una única dosis14. Se ha señalado una conservación del efecto glucosúrico después de 2 años de tratamiento16 y ejerce un impacto adicional en las comorbilidades asociadas a la DM2. Conscientes que tanto desde la atención primaria como la especializada debemos intensificar nuestros esfuerzos para alcanzar los objetivos terapéuticos en los pacientes con DM2 y reducir su riesgo cardiovascular global, hemos considerado de interés revisar la experiencia clínica con la dapagliflozina en el control glucémico de la DM2, la aparición de hipoglucemias, sus efectos en parámetros antropométricos, perfil lipídico, presión arterial y funcionalismo renal, así como los estudios clínicos disponibles con objetivos cardiovasculares. No abordaremos aspectos relacionados con el perfil de seguridad del fármaco, por lo que remitimos al lector a otros artículos de revisión17–19.
Reducción de la hemoglobina glucosiladaLa dapagliflozina ha demostrado reducir la HbA1c tanto en monoterapia como junto a otros antidiabéticos orales o insulina16,18,20–23 (tabla 2). Su mecanismo de acción, independiente de la secreción de insulina por la célula betapancreática, plantea la posibilidad de garantizar su eficacia clínica independientemente de la utilización en terapias combinadas con otros fármacos y que esta se mantenga a lo largo del tiempo. A grandes rasgos, se ha objetivado una reducción de la HbA1c similar a otros hipoglucemiantes orales. Los estudios con 10mg/día de dapagliflozina en monoterapia en pacientes con DM2 durante 24 semanas mostraron una reducción significativa de la HbA1c del 0,89% frente al 0,26% con placebo en pacientes con HbA1c basal entre el 7 y el 8%17. Cuando se añadió dapagliflozina a pacientes tratados con metformina con niveles de HbA1c ≥ 7% y ≤ 10%, la reducción media de la HbA1c fue dependiente de la dosis, siendo del 0,67% con 2,5mg, el 0,70% con 5mg y el 0,84% con 10mg de dapagliflozina comparado con el 0,3% obtenido con placebo24. En el estudio de extensión a 102 semanas se mantuvieron las mismas reducciones25.
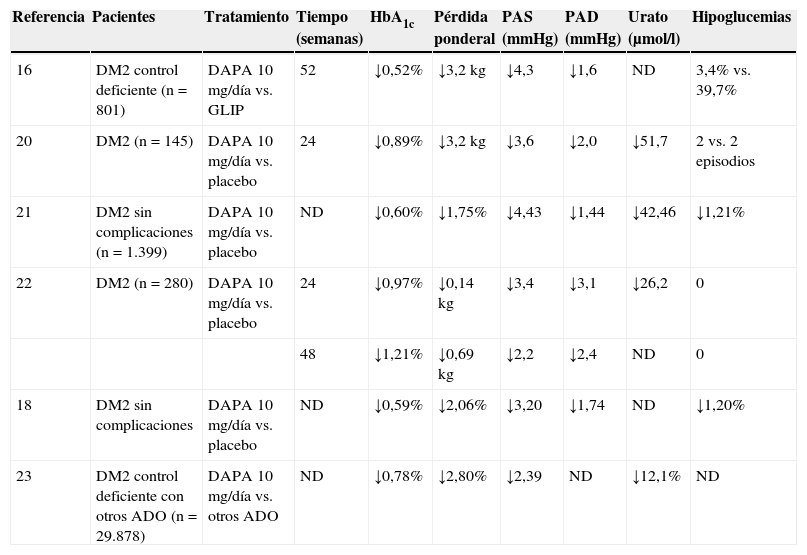
Resumen de los principales estudios clínicos con dapagliflozina
| Referencia | Pacientes | Tratamiento | Tiempo (semanas) | HbA1c | Pérdida ponderal | PAS (mmHg) | PAD (mmHg) | Urato (μmol/l) | Hipoglucemias |
|---|---|---|---|---|---|---|---|---|---|
| 16 | DM2 control deficiente (n = 801) | DAPA 10mg/día vs. GLIP | 52 | ↓0,52% | ↓3,2kg | ↓4,3 | ↓1,6 | ND | 3,4% vs. 39,7% |
| 20 | DM2 (n = 145) | DAPA 10mg/día vs. placebo | 24 | ↓0,89% | ↓3,2kg | ↓3,6 | ↓2,0 | ↓51,7 | 2 vs. 2 episodios |
| 21 | DM2 sin complicaciones (n = 1.399) | DAPA 10mg/día vs. placebo | ND | ↓0,60% | ↓1,75% | ↓4,43 | ↓1,44 | ↓42,46 | ↓1,21% |
| 22 | DM2 (n = 280) | DAPA 10mg/día vs. placebo | 24 | ↓0,97% | ↓0,14kg | ↓3,4 | ↓3,1 | ↓26,2 | 0 |
| 48 | ↓1,21% | ↓0,69kg | ↓2,2 | ↓2,4 | ND | 0 | |||
| 18 | DM2 sin complicaciones | DAPA 10mg/día vs. placebo | ND | ↓0,59% | ↓2,06% | ↓3,20 | ↓1,74 | ND | ↓1,20% |
| 23 | DM2 control deficiente con otros ADO (n = 29.878) | DAPA 10mg/día vs. otros ADO | ND | ↓0,78% | ↓2,80% | ↓2,39 | ND | ↓12,1% | ND |
ADO: antidiabético oral; DAPA: dapagliflozina; DM2: diabetes mellitus tipo 2; GLIP: glipizida; ND: no disponible; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
En los estudios comparativos con otros antidiabéticos orales, la eficacia en el control glucémico con dapagliflozina resultó en general similar a glipizida e inhibidores de la dipeptidil peptidasa iv (DPP-4) e inferior respecto a los análogos de GLP116,26.
HipoglucemiasLas hipoglucemias secundarias al tratamiento deben ser valoradas no solo en el contexto del perfil de seguridad de un fármaco hipoglucemiante, sino también como un factor asociado al incremento del riesgo de episodios cardiovasculares, hospitalización por cualquier causa y mortalidad global27,28.
Los estudios con dapagliflozina han confirmado que la probabilidad de hipoglucemias es similar o inferior a la de otros antidiabéticos orales, siendo esta del 6,81% frente al 7,23% con los inhibidores de DPP-4 o del 31,83% .con los análogos de GLP-126. Varios estudios han referido una tasa de hipoglucemias de 1,20:1 para la dapagliflozina vs. placebo18,21. Cuando se comparó con otros antidiabéticos orales la tasa fue de 0,49:1, corroborando una menor incidencia de hipoglucemias respecto a otros antidiabéticos orales16,26 (tabla 2).
La administración de dapagliflozina en pacientes con DM2 inhibe la reabsorción renal de glucosa en el tubo proximal entre un 20 y un 44%29. Asimismo, el umbral de excreción de glucosa, que en condiciones normales se sitúa en torno a 180mg/dl, se reduce hasta los 70-90mg/dl en dosis terapéuticas. Sin embargo, las glucemias de los pacientes con DM2 no se reducen hasta estos niveles debido a que la inhibición del transportador es parcial. Se ha sugerido un posible aumento compensatorio de la actividad de otros transportadores que participan pero en menor cuantía porcentual en la reabsorción de glucosa. Por otra parte, datos recientes apuntan que la glucosuria inducida por la inhibición de SGLT-2 se asocia a una mayor sensibilidad a la insulina a nivel muscular, y paradójicamente a un «inexplicable», por el momento, aumento de la producción endógena de glucosa junto a un incremento de la concentración en ayunas de glucagón30. Todo ello comporta una reducción moderada de la glucemia plasmática con un bajo riesgo de hipoglucemias.
Peso corporalEl 85% de los pacientes con DM2 presentan sobrepeso/obesidad31. Según datos nacionales, el 50% de los pacientes con un diagnóstico de diabetes tienen un índice de masa corporal superior a 30kg/m2 y cerca del 60% presenta obesidad abdominal valorada según el índice cintura/cadera3. La grasa abdominal se asocia a resistencia a la insulina, hiperinsulinemia y a dislipidemia aterogénica. En estos pacientes es difícil conseguir una reducción ponderal, por lo que cualquier antidiabético oral que facilite el control del peso corporal es bienvenido.
La glucosuria constante y mantenida a lo largo del tiempo producida por este grupo farmacológico se ha asociado a una perdida calórica por vía renal de aproximadamente 280kcal/día, hallazgo que se podría relacionar con una pérdida moderada e involuntaria de peso. Los estudios clínicos con dapagliflozina han conseguido reducciones del 1 al 3% de peso corporal, ya sea en monoterapia o en combinación16,18,20-23 (tabla 2). Esta pérdida ponderal es debida a una disminución de la masa grasa constatada por cambios de absorción dual de rayos X y, principalmente, a expensas del tejido adiposo visceral y subcutáneo medido mediante resonancia magnética32. Estos efectos se mantienen después de 2 años de tratamiento con dapagliflozina sin afectar a los marcadores de recambio o densidad mineral ósea en pacientes con DM2 no controlados adecuadamente con metformina33. De acuerdo con esta falta de efecto en la densidad mineral ósea, recientemente se ha comunicado que la dapagliflozina no se asocia a un aumento del riesgo de fracturas34.
Presión arterialLa diuresis osmótica secundaria al aumento de la concentración de glucosa en orina permite explicar el efecto diurético de estos fármacos. Fruto de esta pérdida de volemia, diferentes estudios con dapagliflozina han demostrado reducciones en la presión arterial sistólica de 2 a 4,5mmHg y en la presión arterial diastólica de 1 a 3mmHg16,18,20–23 (tabla 2). Los estudios de intervención en pacientes con DM2 han demostrado que la reducción de la presión arterial se acompaña de un descenso del 27% en el riesgo de infarto de miocardio mortal y no mortal35. A pesar de los modestos pero significativos descensos de la presión arterial registrados en los estudios clínicos con dapagliflozina, no debemos olvidar que una reducción de 5mmHg en la presión arterial sistólica se asocia a una reducción del riesgo relativo de episodios cardiovasculares graves del 14,2% (intervalo de confianza del 95%, del 8,6% al 19,5%) y del 12,1% (del 2,9% al 20,4%) según el filtrado glomerular sea normal o disminuido, respectivamente36.
Perfil lipídicoEl patrón lipídico característico de la DM2 consiste en un aumento moderado de la concentración de triglicéridos, descenso de la concentración del colesterol de las lipoproteínas de alta densidad (HDL) y aumento de partículas LDL pequeñas y densas37. Estas alteraciones lipídicas, también conocidas como dislipidemia aterogénica, suelen preceder al diagnóstico de la diabetes en muchos casos, especialmente en los sujetos con obesidad central y resistencia a la insulina. El predominio de partículas LDL pequeñas y densas, también denominado patrón B, se asocia con la trigliceridemia basal, de forma que en la mayor parte de pacientes con DM2 y trigliceridemia superior a 150mg/dl predominan las partículas LDL correspondientes al fenotipo B38.
Los estudios con dapagliflozina han mostrado un efecto beneficioso en el colesterol HDL, tanto en monoterapia como en terapia combinada. Un estudio con una muestra de 30.000 pacientes en Estados Unidos reveló un aumento del 6,32% del colesterol HDL frente a un grupo control tratado con otros antidiabéticos orales23. Sin embargo, la dapagliflozina no parece tener efectos significativos en las concentraciones de colesterol LDL y triglicéridos16,24,39. Resultados similares se han observado en terapias combinadas junto a otros antidiabéticos orales, indicando un papel independiente a estos fármacos. Hacen falta estudios clínicos que evalúen la posible repercusión de estos cambios lipídicos en el desarrollo de complicaciones cardiovasculares a largo plazo.
Función renalSe han descrito leves descensos del filtrado glomerular estimado en los estudios clínicos con dapagliflozina que aparecen al iniciar el tratamiento con un gradual retorno a los valores basales en la semana 24, permaneciendo la función renal estable a lo largo de 102 semanas19. No se han documentado aumentos en la excreción urinaria de albúmina16,20,24,40,41.
Por lo que hace referencia a los niveles de ácido úrico, conocido factor de riesgo cardiovascular42,43, los estudios con dapagliflozina han demostrado importantes descensos del ácido úrico sérico, con una reducción media de 41,50μmol/l20-23 (tabla 2).
Impacto cardiovascularSe han llevado a cabo estudios a corto y medio plazo para determinar los posibles beneficios cardiovasculares de la dapagliflozina en pacientes con DM2. Un reciente metaanálisis sobre los episodios cardiovasculares en 6.300 pacientes tratados con dapagliflozina de 14 ensayos clínicos reveló una odds ratio de 0,73 (IC del 95%, 0,46-1,16) comparado con el grupo control18, pero los datos no son concluyentes. Estudios independientes de la FDA y la EMA mostraron un resultado parecido (OR: 0,82, IC del 95%, 0,58-1,15)44.
En un estudio de simulación a 20 años, la adición de dapagliflozina a las opciones terapéuticas disponibles en la actualidad mostró un reducción relativa en la incidencia de infarto de miocardio, ictus, mortalidad cardiovascular y por cualquier causa del 13,8, el 9,1, el 9,6 y el 5%, respectivamente23.
Aunque todos estos hallazgos parecen descartar que el tratamiento con dapagliflozina se acompañe de un incremento del riesgo cardiovascular, habrá que esperar a abril de 2019, momento de finalización y análisis de resultados de un estudio prospectivo con objetivos cardiovasculares, el Multicenter Trial to Evaluate the Effect of Dapagliflozin on the Incidence of Cardiovascular Events (DECLARE-TIMI58).
ConclusionesLa DM2 se acompaña de un elevado riesgo vascular y los estudios de los principales factores de riesgo en esta población específica ponen de manifiesto que estamos lejos de alcanzar los estándares de control glucémico, ponderal, lipídico y de presión arterial. La dapagliflozina, inhibidor de SGLT-2 con un mecanismo de acción independiente de la insulina, ofrece una buena eficacia clínica sobre la base de las reducciones en HbA1c conseguidas en diferentes escenarios clínicos, y con una baja propensión intrínseca para causar hipoglucemia. Además, facilita la pérdida de peso en los pacientes con DM2 mediante la inducción de una glucosuria controlada, y se acompaña de un discreto descenso de la presión arterial, moderado incremento HDL e importantes reducciones de ácido úrico.
Así pues, este fármaco contribuye al control glucémico y facilita el control de las principales comorbilidades asociadas a la DM2 como la obesidad, la hipertensión arterial leve y el síndrome de HDL bajo. Sus posibles beneficios sobre el riesgo cardiovascular a largo plazo están siendo valorados en un ensayo clínico aleatorizado que finalizará en 2019.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.