Introducción: El diagnóstico del tumor en peritoneo se asocia a mal pronóstico. El manejo establecido es quimioterapia, con resultados limitados. Es necesario ensayar otras opciones: la cirugía citorreductora (CRS) combinada con quimioterapia intraperitoneal con hipertermia (HIPEC) es una opción que mejora la supervivencia. El propósito de este estudio es evaluar la factibilidad y la seguridad de la CRS más HIPEC para la carcinomatosis peritoneal (CP) en el Instituto Nacional de Cancerología de México.
Métodos: Se diseñó un estudio piloto para pacientes con CP para tratarlos con HIPEC después de CRS para evaluar seguridad y factibilidad en un centro de referencia.
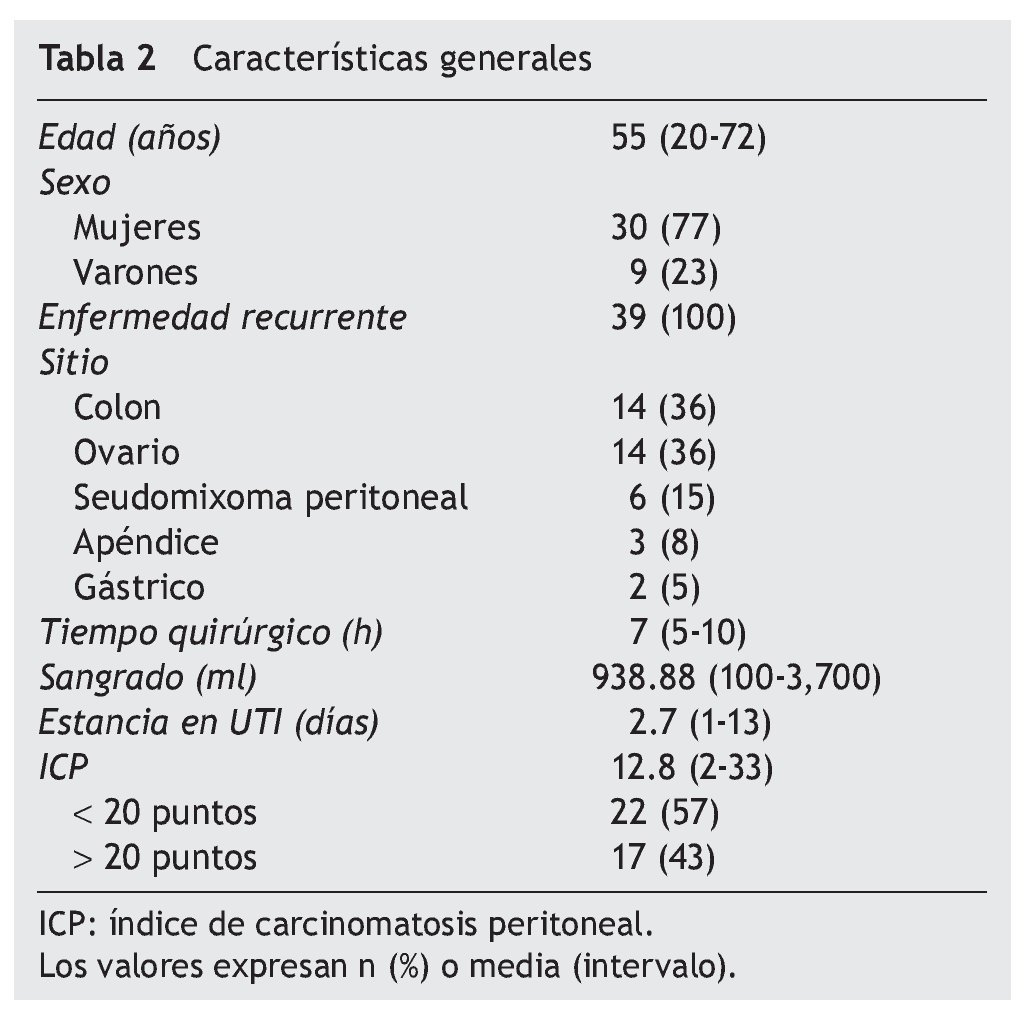
Resultados: Se trató a 39 pacientes de 55.4 (49-67) años de edad promedio. Después de CRS óptima, recibieron HIPEC con cisplatino 25 mg/m2/l y mitomicina C 3.3 mg/m2/l. Hubo complicaciones mayores en el 53% de los casos, sin mortalidad operatoria. El tiempo quirúrgico fue 7.06 (5-9) h. La mediana de sangrado fue 939 (100-3,700) ml. Ameritaron estancia en UCI 2.7 días. La sobrevida media fue de 28 meses, mayor entre los pacientes con índice de carcinomatosis < 20 puntos (32 meses) y menor con un índice > 21 (21 meses).
Conclusiones: Se ha demostrado que una adecuada selección de pacientes y un procedimiento uniforme y ordenado de CRS más HIPEC son un procedimiento factible y de beneficio para los pacientes. El procedimiento es de baja mortalidad y de alta morbilidad, pero mejor que solo terapia sistémica.
Background: The diagnosis of peritoneal carcinomatosis is associated a poor prognosis. The standard treatment is chemotherapy, with limited results. Other options need to be explored, and cytoreductive surgery (CRS) combined with hyperthermic intraperitoneal chemotherapy (HIPEC) maybe improve the results. This study evaluated safety and feasibility of CRS with HIPEC for peritoneal metastasis at the National Cancer Institute, Mexico.
Methods: In a pilot study of patients with peritoneal carcinomatosis (PC) treated with HIPEC after optimal CRS, a review was performed to evaluate safety and feasibility in a reference center.
Results: Thirty-nine patients were treated. The mean age was 55.4 years. After aggressive CRS, HIPEC was performed with cisplatin 25mg/m2/L and mitomycin C 3.3 mg/m2/L Major postoperative complications developed in 53%. No operative mortality occurred. The mean time of the surgical procedure was 7.06 hours (5-9 hours). The median of blood loss was 939 ml (100-3700 ml). The mean ICU stay was 2.7 days. The median survival was 28 months, with 32 months in patients with <20 points on the peritoneal cancer index, and 21 months for patients with index >21.
Conclusions: The results underline the safety and efficacy of CRS and HIPEC for PC. It is feasible and beneficial for patients in the National Cancer Institute, Mexico. The procedure has a low mortality rate and high morbidity, but is better than systemic therapy only.
Introducción
El diagnóstico del tumor en peritoneo se asocia con mal pronóstico, ya que es un signo de estadio avanzado, progresión de la enfermedad o recurrencia de numerosas enfermedades gastrointestinales o ginecológicas. La supervivencia media reportada es de 5.2 meses para cáncer colorrectal avanzado y 3.1 meses para el cáncer gástrico1. El 60% de los casos de cáncer colorrectal en etapas Dukes C tendrán enfermedad recurrente2, y la carcinomatosis peritoneal como único sitio representa un 25-35% de las recurrencias y es la causa más común de muerte, a pesar de que se ha demostrado que la carcinomatosis peritoneal no es necesariamente una condición terminal sin opciones de cura3.
El manejo establecido es quimioterapia sistémica paliativa, y se reserva la intervención quirúrgica solo con fines de paliación en casos de obstrucción y/o sangrado y no con fines de citorreducción de la enfermedad para mejor control y/o tratamiento con fines curativos4; solo en la patología oncológica ovárica la cirugía citorreductora tiene un papel determinante y pronóstico, y forma parte del tratamiento estándar5.
La cirugía citorreductora (CRS) más quimioterapia intraperitoneal con hipertermia (HIPEC) fue descrita en 1985 por Sugarbaker et al, que la propusieron como una opción innovadora para pacientes seleccionados con carcinomatosis peritoneal de origen colorrectal6,7. Se ha demostrado que los procedimientos con enfermedad residual tratada solo con cirugía son la causa de recurrencia en la mayoría de los pacientes, la eficacia del procedimiento llamado CRS con peritonectomía y quimioterapia intraperitoneal con hipertermia se ha probado en diferentes estudios clínicos, y se han establecido centros de tratamiento en diferentes países del mundo, entre ellos México, Italia, Países Bajos, Estados Unidos y Japón4,5,8.
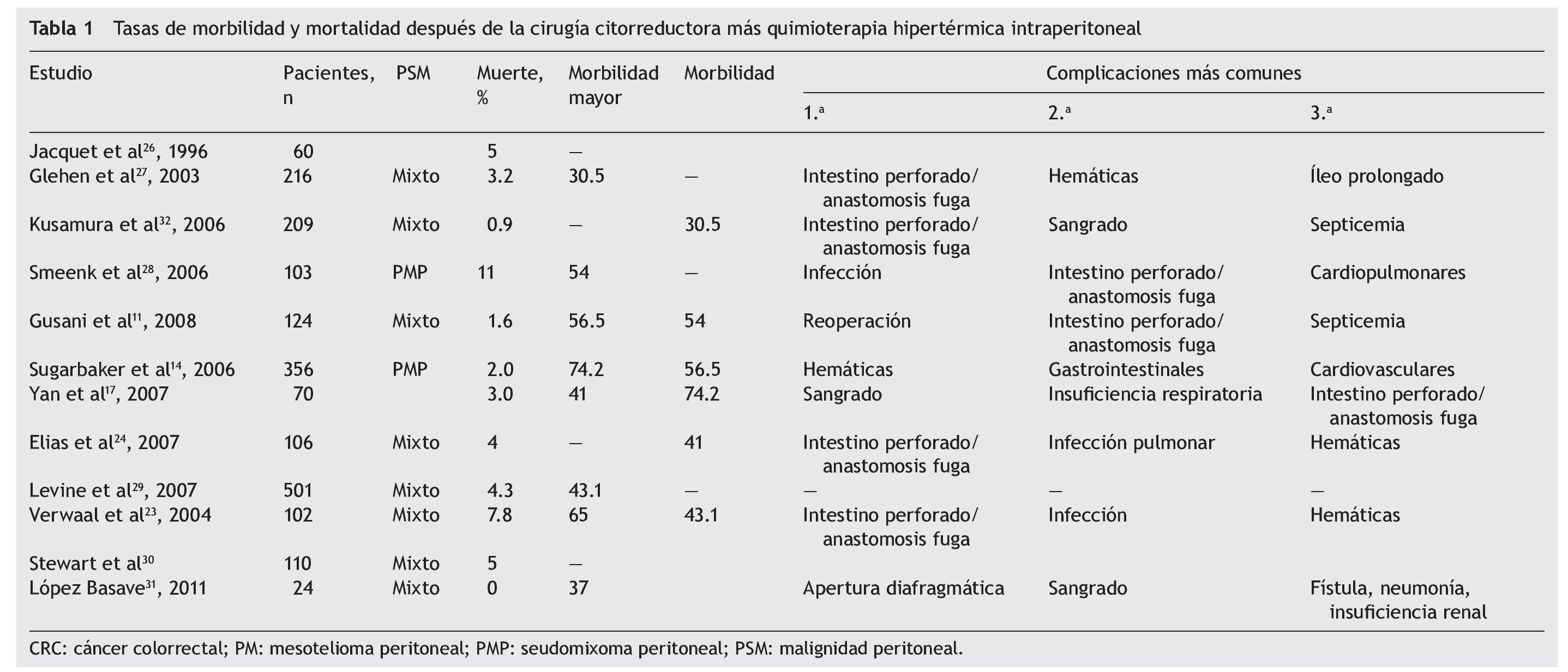
No obstante, la técnica no se ha popularizado en todo el mundo debido a que es un procedimiento complejo con resecciones extensas, multiviscerales, frecuentemente con más de dos anastomosis, quimioterapia en altas concentraciones, tiempos quirúrgicos muy largos, en ocasiones 10-14 h, y que la hipertermia acentúa los desequilibrios hidroelectrolíticos, lo que condiciona elevadas tasas de morbilidad y mortalidad (tabla 1)9,10. Las concentraciones intraperitoneales frente a las concentraciones plasmáticas de los diferentes agentes de quimioterapia varían de 18 a 20 veces. Se reporta una mayor concentración intraperitoneal. En algunos casos, desde 120-1,000 veces mayor para taxanos y paclitaxel respectivamente, debido a la baja absorción a través del peritoneo11, a lo que se agregan los efectos citotóxicos directos y sinérgicos de la hipertermia, como desnaturalización proteica, inducción de la apoptosis e inhibición de la angiogénesis12-14.
Material y métodos
Se incluyó a los pacientes con carcinomatosis peritoneal (CP) que cumplían los criterios señalados dentro del protocolo y aprobados por los comités científico y de bioética de la institución, previa firma de consentimiento informado, en el periodo comprendido de enero de 2007 a enero de 2012. Los criterios de inclusión de los pacientes fueron los siguientes:
1. Diagnóstico de carcinomatosis, clínico radiológico o patológico.
2. Edad de 18 a 75 años.
3. Sin enfermedades concomitantes respiratoria, hepática, hemática o renal.
4. ECOG 0-2.
5. Ausencia de enfermedad hepática o extraabdominal.
6. Enfermedad potencialmente resecable por tomografía preoperatoria.
7. Índice de carcinomatosis peritoneal (ICP) < 20 puntos.
Cirugía citorreductora
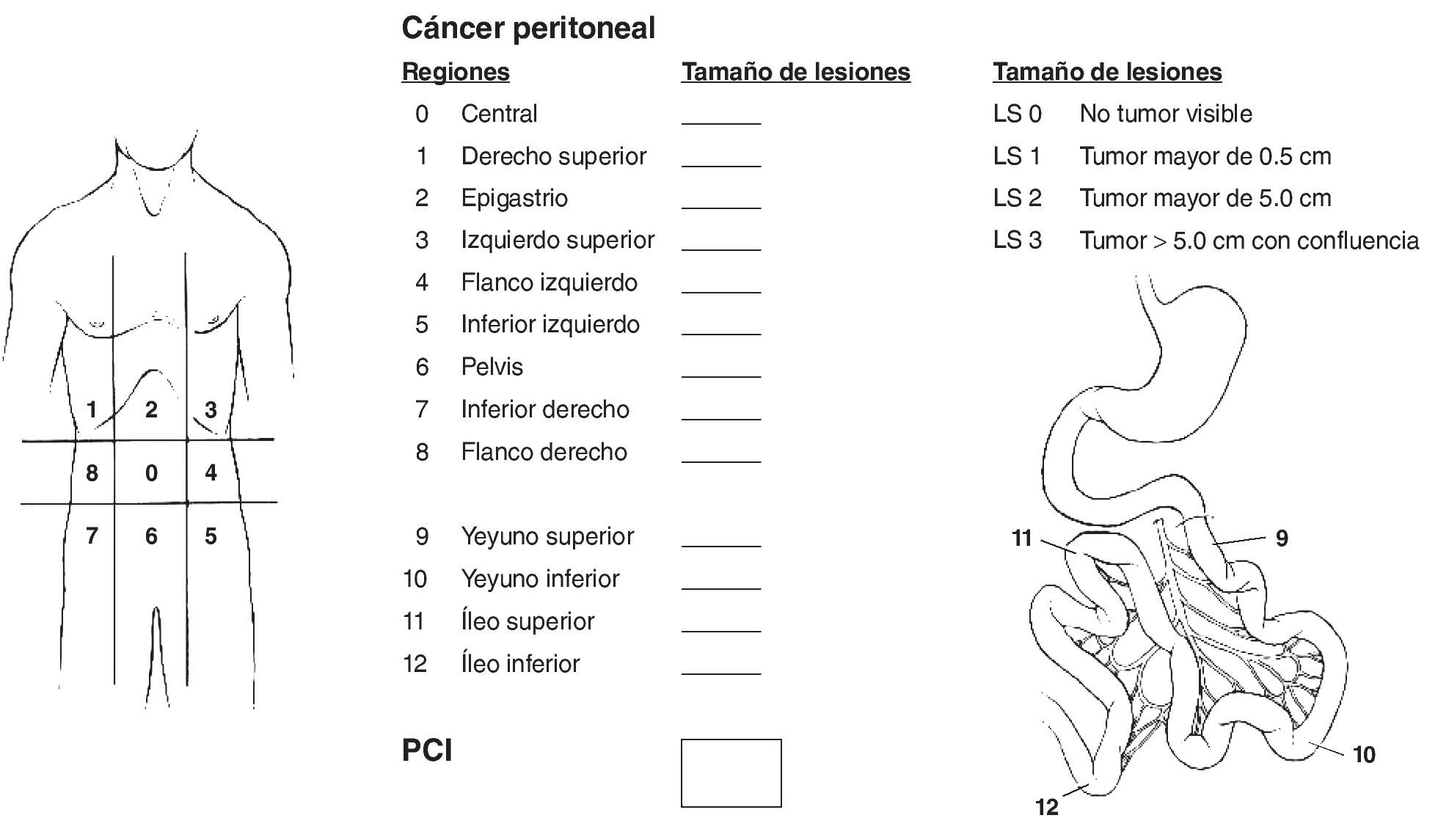
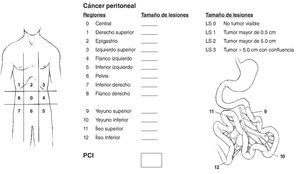
Una vez intervenido el paciente, se evalúa la extensión de la enfermedad en la cavidad abdominopelviana y se calcula el ICP (figura 1) descrito por Sugarbaker; obtenido este índice (que va de 0 a 39 puntos), se emite la puntuación final.
Figura 1 Índice de carcinomatosis peritoneal. Se atribuye una puntuación según el tamaño del implante, y al final se suma; el más alto es de 39 puntos y el máximo permitido es de 20 para una citorreducción óptima.
Si el paciente tiene 20 puntos o menos, puede continuarse el plan de lograr una citorreducción óptima (ausencia de tumor visible), con uno o más de los siguientes procedimientos:
• Omentectomía extensa o mayor, peritonectomía parietal derecha + resección de colon derecho.
• Peritonectomía pelviana + resección de colon sigmoides + histerectomía con o sin ooforectomía.
• Omentectomía extensa y disección del ligamento hepático + antrectomía + colecistectomía.
• Peritonectomía de cuadrante superior derecho + cápsula de Glisson.
• Peritonectomía de cuadrante superior derecho y esplenectomía.
• Otra resección intestinal y/o resección de masa abdominal.
La enfermedad residual se cuantifica intraoperatoriamente usando la siguiente clasificación: CCR-0, sin tumor visible; CCR-1, nódulos tumorales < 2.5 mm; CCR-2, nódulos residuales > 2.5 mm y < 2.5 cm; CCR-3, nódulos > 2.5 cm. Las puntuaciones CCR-O y CCR-1 son las situaciones ideales en las que es posible administrar la quimioterapia intraperitoneal con hipertermia.
Después de CRS, se colocan cuatro catéteres (eferentes), además de un termómetro a cada cuadrante y un quinto termómetro a nivel esofágico, así como un quinto catéter a nivel central en el abdomen. Las técnicas más empleadas fueron la de coliseo (38 casos) y la técnica cerrada (1 caso).
Los agentes de quimioterapia empleados en el procedimiento de HIPEC fueron en nuestro estudio: cisplatino 25 mg/m2/l y mitomicina C 3.3 mg/m2/l administrados durante 90 min a 40.5 (40-43)°C en promedio. Se fraccionó la quimioterapia para su administración; el 50% de la dosis se administró en los primeros 30 min, el siguiente 25% en los 30 min posteriores y el 25% restante en los últimos 30 min.
Se revisaron y analizaron las características clínicas de los pacientes sometidos al procedimiento mediante las siguientes variables: edad, sexo, histología, sangrado, ingreso a unidad de cuidados intensivos, complicaciones y estado actual.
Análisis estadístico
Se emplearon variables continuas expresadas como media (intervalo) y variables categóricas como frecuencia y porcentajes.
Resultados
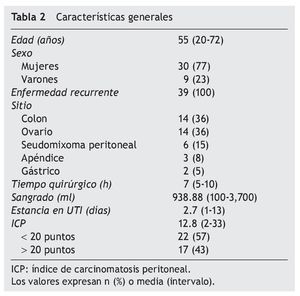
De enero de 2007 a enero de 2012, se sometieron al procedimiento 39 pacientes (30 mujeres y 9 varones) con histologías de cáncer colorrectal (n = 14), de ovario (n = 14), seudomixoma peritoneal (n = 6), de apéndice (n = 3) y carcinomatosis por cáncer gástrico (n = 2). La mediana de edad encontrada fue de 55.4 años. El tiempo del procedimiento quirúrgico fue una media de 7.06 (5-10) h. El promedio de sangrado fue 938.88 (100-3,700) ml (tabla 2).
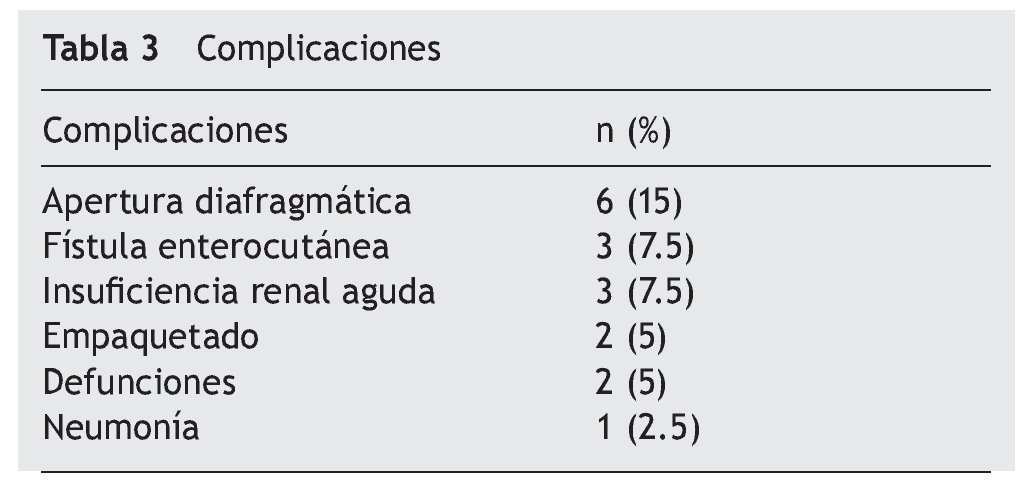
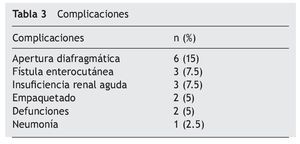
El 67% de los casos (26/39) ingresaron a la unidad de terapia intensiva (UTI). De los 39 pacientes, 19 sufrieron complicaciones, principalmente apertura diafragmática (6 casos), fístula enterocutánea (3 casos) e insuficiencia renal (3 casos) (tabla 3). Ocurrieron 2 defunciones, una por sangrado y una por tromboembolia pulmonar.
La supervivencia global fue de 28 meses; la de los pacientes con menos de 20 puntos fue 32 meses y la de aquellos con más de 20 puntos, 21 meses. El promedio del periodo libre de enfermedad fue de 10 meses.
En el seguimiento en enero de 2012, el 49% (19 casos) estaban vivos y sin evidencia de enfermedad, 13 casos (33%) se encontraban con actividad tumoral; 4 casos (10%), perdidos sin actividad tumoral en su última visita, y 3 pacientes (8%) habían muerto sin actividad tumoral.
Discusión
En los tumores de origen intraabdominal, la CP se considera la principal causa de muerte, con opciones de tratamientos solo paliativos a pesar de que se ha demostrado que no es siempre una condición terminal sin opción de tratamiento o cura3,6. La innovación descrita por Sugarbaker para el tratamiento de esta entidad ha mejorado en los últimos años no solo la calidad de vida, sino la supervivencia de los pacientes. Sus requerimientos son un personal altamente especializado, infraestructura y apoyo tecnológico para disminuir la morbilidad, factores que han influido en todo el mundo en el poco interés en aprender y realizar dicho abordaje6,7.
En nuestra serie, la morbilidad fue del 43% y la mortalidad, el 5%; se ha descrito que ambas son directamente proporcionales a la experiencia que tenga el grupo quirúrgico, y en algunas series se ha reportado que 130 es el número de procedimientos que es necesario realizar para considerarse expertos en citorreducción + HIPEC. La literatura señala una morbilidad entre el 31 y el 65% y una mortalidad de 0 al 11% e incluso el 19%8-12 (tabla 3).
En nuestra serie se reporta una morbilidad elevada respecto a otras series1,2,13-16, que puede estar condicionada en parte por intervenirse a pacientes con ICP > 20 puntos, lo que a su vez requiere resecciones más amplias y, por lo tanto, conllevan más tiempo quirúrgico, sangrado, estancia en UTI, resecciones multiviscerales y anastomosis.
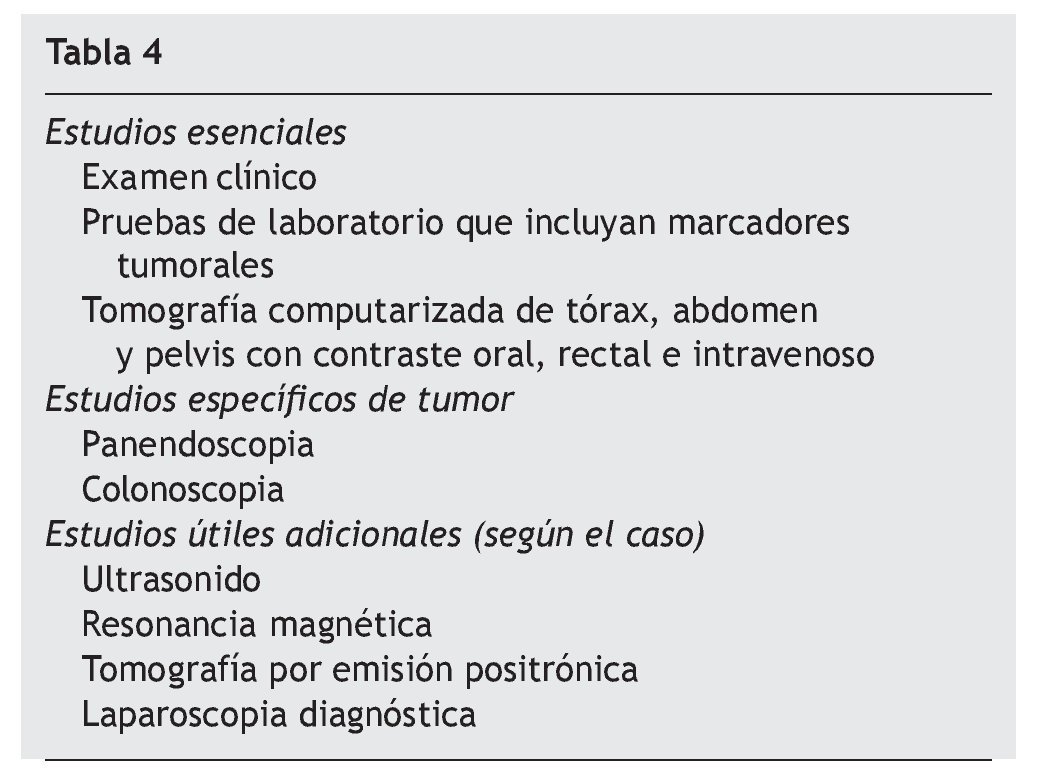
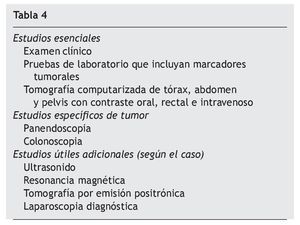
Asimismo la identificación de factores de riesgo de incremento de la morbilidad es también crucial para mejorar los resultados. Yan et al, en el consenso del manejo de las enfermedades de la superficie peritoneal de 200817, y Deraco et al para el manejo de mesotelioma en 200818 actualizaron lo previamente publicado por Sugarbaker et al en 2003 y coincidieron en lo estricto de los criterios de selección como requisitos indispensables para mejorar los resultados y la superviviencia; establecieron los estudios esenciales, específicos y adicionales para cada tumor, así como las limitantes y contraindicaciones del procedimiento (tabla 4), debido a que antes de 2008 no se tenía estandarizado aún que solo los pacientes con ICP < 20 puntos son los que más se benefician de recibir HIPEC, salvo los pacientes con seudomixoma peritoneal, los únicos a los que no se aplica dicha medida.
En nuestro estudio19, se debe destacar que 17 pacientes (44%) tuvieron un ICP > 20, 6 de ellos presentaban seudomixoma peritoneal y solo se incluyó inicialmente a 11 pacientes con otras enfermedades e ICP > 20.
Los tratamientos convencionales de soporte médico, cirugía paliativa y quimioterapia sistémica no son suficiente manejo para un grupo de pacientes con carcinomatosis, y por ello Pestieau y Sugarbaker propusieron en 1982 los procedimientos llamados peritonectomías y CRS con el fin de eliminar la enfermedad macroscópica y tratar con quimioterapia intraperitoneal la enfermedad residual microscópica20.
Finalmente, los efectos sinérgicos de la hipertermia21,22 más la quimioterapia, en este caso mitomicina C y cisplatino, representan la razón de este abordaje. Está demostrado el beneficio en la sobrevida de pacientes muy seleccionados con CP7,11,14. Verwaal et al23 en 2003 realizaron el primer estudio aleatorizado de comparación en carcinomatosis de cáncer colorrectal, y se reportó una sobrevida media de 23 meses con CRS e HIPEC frente a 12.6 meses en pacientes tratados con quimioterapia sistémica con fluorouracilo/leucovorina. Elias et al24, en un estudio retrospectivo de 2009, reportaron 23.9 meses para el manejo sistémico frente a 62.7 meses con la CRS más HIPEC. En nuestro estudio se reportan 28 meses de sobrevida global, pero se debe notar que esta sobrevida se ve afectada por afecciones de mal pronóstico como el cáncer gástrico, del que se incluyeron 2 casos, y a la vez se beneficia con enfermedades de mejor pronóstico, como el seudomixoma y el cáncer de apéndice. Consideramos que, a pesar de la complejidad del procedimiento y la alta morbilidad, el beneficio recibido es superior que con la mejor terapia sistémica en cualquiera de las enfermedades incluidas, como demostraron Franko et al25, con sobrevida de 34.7 meses para la CRS más HIPEC frente a 16.8 en el grupo de quimioterapia sistémica con agentes biológicos26-32.
Conclusiones
Nuestro estudio demuestra que una adecuada selección de pacientes y un procedimiento uniforme y ordenado de CRS más HIPEC hacen factible el procedimiento y resulta de beneficio para los pacientes. El procedimiento es de baja mortalidad y alta morbilidad. Los resultados obtenidos con este tratamiento demuestran que se puede lograr una mejora en la sobrevida, mayor que la alcanzada aun con los mejores manejos con quimioterapia sistémica, según lo reportado en la literatura. Al superar la curva de aprendizaje del procedimiento, se espera reducir la morbilidad y lograr una mayor supervivencia.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Recibido el 1 de mayo de 2014;
aceptado el 1 de julio de 2014
* Autor para correspondencia:
Av. San Fernando # 22, Col. Sección XVI,
México DF, C.P. 14050 México,
Teléfono (015255) 56 28 04 00, Ext. 120, Fax (015255) 56 28 04 64.
Correo electrónico:lobohnoe@gmail.com (H.N. López Basave).